基因过表达是将目的基因的编码区克隆到相应的工具病毒载体上,导入细胞使基因实现大量转录和翻译,从而实现目的基因的过表达。此外,还可选择报告基因进行目的基因表达的追踪。
腺相关病毒(Adeno-associated Virus,AAV)属于细小病毒科(parvoviridae),病毒颗粒无包膜,结构为直径约20 nm的正二十面体,是迄今发现的一类结构最简单且无法自主复制的线性单链DNA病毒,对分裂细胞和非分裂细胞均具有感染力。通过人工进化的方法对AAV衣壳蛋白Cap基因进行定向突变改造,可以筛选到具有高转导效率和不同感染特性的AAV载体,极大增加了AAV的应用潜力。研究中采用的重组腺相关病毒(Recombination adeno-associated virus,rAAV)载体是在非致病的野生型AAV的基础上改造的基因表达载体,具有种类多样、免疫原性低、安全性高、宿主范围广、扩散能力强、体内表达外源基因时间长等特点,已被广泛的应用在动物水平的基因表达、基因操作和基因治疗。
表1靶向不同的器官及组织推荐使用对应AAV血清型、启动子及注射方式
| 类别 | 感染部位 | 注射方式 | 启动子 | 血清型 |
| CNS(部分脑区,经验值) | VHPC | 脑立体定位注射 | 广谱启动子 | 2、5、8、9 |
| NAC | 脑立体定位注射 | 广谱启动子 | 2、5、8、9 | |
| DG | 脑立体定位注射 | 广谱启动子 | 2、5、8、9 | |
| VTA | 脑立体定位注射 | 广谱启动子 | 2、5、8、9 | |
| 全脑 | 侧脑室小脑延髓池 | 广谱启动子 | 9、phpeb | |
| 尾静脉,颈静脉/颈动脉 | 广谱启动子 | phpeb | ||
| 眼球后静脉 | 广谱启动子 | 9、phpeb | ||
| 脊髓 | 鞘内注射 | CMV | 9 | |
| PNS | 眼睛 | 玻璃体腔注射/视网膜下腔注射/晶状体 | CAG,视网膜特异性启动子rpe65 | 2、anc80L65(视网膜),shH10(视网膜穆勒细胞) |
| 肺 | 鼻吸/气管注射 | CMV、CAG | 6.2、6 | |
| 胰腺 | 腹腔注射 | CAG | 8、pan | |
| 肾脏 | 尾静脉/肾动脉、肾静脉和左髂脉、腹主动脉 | CMV | 2、9 | |
| 肾盂原位注射 | ||||
| 肠道 | 肠系膜上动脉注射灌肠 | CAG | 8、9和10 | |
| 骨髓 | 骨髓腔 | 9 | ||
| 心脏 | 尾静脉/颈静脉注射 | cTNT | 9 | |
| 心内腔注射心肌内定点注射 | CMV、cTNT | 9 | ||
| 脾脏 | 静脉注射 | 6 | ||
| 卵巢 | 腹腔注射 | CMV、CAG | 2 | |
| 睾丸 | 上后肢注射/睾丸注射 | CMV、CAG | 2 | |
| 骨骼肌 | 静脉注射 | 8、9 | ||
| 胫骨前(tibialis anterior ) | CMV | 8、9 | ||
| 肌肉注射(后肢的股四头肌,腓肠肌和胫骨颅骨肌) | 1、6 | |||
| 骨骼肌 | 静脉注射 | CAG,骨骼特异性启动子Col2.3,Sp7 | 8 | |
| 肝脏 | 尾静脉注射 | TTR,TBG,EF1a | 8 | |
| 肝内注射 | ||||
| 腹腔注射 | ||||
| 脂肪 | 尾静脉 | 脂肪特异性启动子FABP4(aP2) | 8、9 | |
| 内脏脂肪-腹腔内注射 | CMV | 8、9 | ||
| 皮下脂肪-皮下注射 | CMV | 8、9 | ||
| 耳 | 耳朵/圆窗膜round window membrane (RWM) | CMV、CAG | anc80L65、ie、8 | |
| 血管 | 腹主动脉局部感染 | CMV | 1、5 | |
| 滑膜关节 | 关节 | 5 | ||
| 平滑肌 | 尾静脉/气管 | SM22a | 1、2 |
rAAV所包含的DNA一般是用外源基因表达元件替换AAV的编码基因,仅保留了病毒复制和包装所需的ITR序列。通过反式补偿Rep基因、Cap基因和辅助病毒功能因子包装产生携带外源DNA的rAAV。AAV的总包装容量是4.7 kb,目的基因长度要求不超过3.5 kb。
慢病毒是逆转录病毒科的一个属,属于单链RNA病毒,是在人类免疫缺陷I型病毒(HIV-1)的基础上发展起来的病毒载体,能够有效感染分裂细胞和非分裂细胞,整合到宿主基因组上实现长期稳定表达。慢病毒载体的载量为6-6.5kb左右(还取决于载体本身是否有其他抗性基因或报告基因)。一般而言插入的片段如果在5kb以下产生的病毒滴度比较高,当插入的片段大于6kb的时候得到的病毒滴度往往不高。如果除去一般携带的抗性基因和报告基因,则往往只余下3kb左右的容量供目的片段的插入。我司通过载体改造去除一些不必要基因,在一些特殊情况下,可以最大插入7kb的基因片段。

图1. 5种血清型AAV载体不同注射量基因表达效果
颈静脉注射cTnT启动表达eGFP的5种血清型AAV载体,4周后心脏冰冻切片荧光检测显示AAV9 1×1011vg病毒量时eGFP在心肌细胞表达最强。
参考文献:
Prasad KM, Xu Y, Yang Z, et al. Gene Ther. 2011.
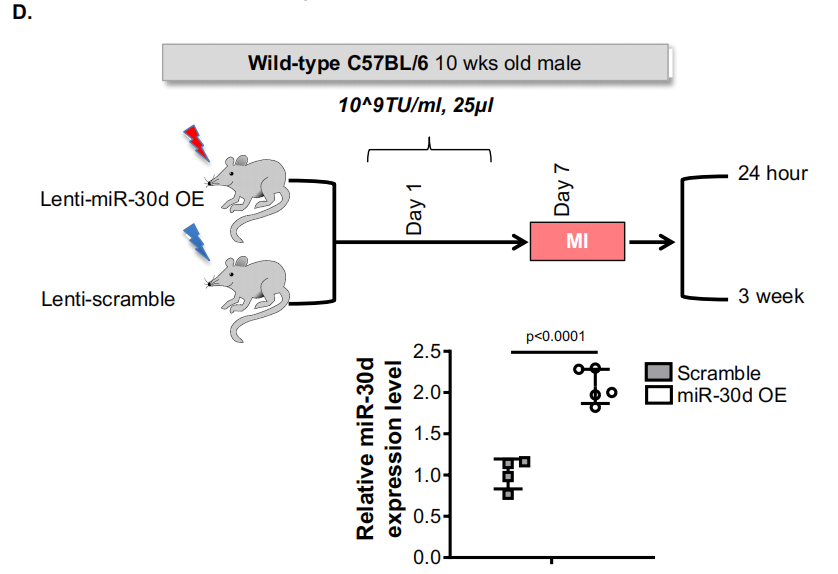
图2. miR-30d表达水平
在MI(心肌梗死)手术前1周的开胸手术中单点心肌注射25μL过表达miR-30d慢病毒,结果显示术后三周心脏中miR-30d水平增加2倍。
Li J, Salvador AM, Li G, et al. Circ Res. 2021.
CRISPR/Cas9系统是目前被广泛运用的基因编辑系统,其原理是由CRISPR转录产生的sgRNA介导Cas9核酸酶靶向目标序列,对序列进行切割。Cas9的核酸酶剪切活性取决于两个结构域:RuvC和HNH。当这两个结构域同时处于失活状态时,Cas9将不具有核酸酶活性,成为dCas9(dead Cas9)。CRISPR-dCas9系统即是dCas9与转录激活因子(如VP64、VPR、SAM或SunTag)或转录抑制因子(如KRAB)融合后,结合sgRNA能促进或抑制目的基因的表达。

图1 CRISPR-dCas9系统调控内源基因(Gilbert et al., Cell, 2013)
应用
CRISPR-dCas9转录激活:可实现目的基因在内源环境中过表达、诱导iPSC、激活沉默基因、遗传缺陷补偿等;
CRISPR-dCas9转录抑制:可实现抑制目的基因表达、分析代谢途径、敲低特定基因转录量以研究基因功能、可与CRISPR/Cas9 Gene Knockout或RNAi技术联合作用等。
信息订阅
我们将及时向您推送最新产品资讯

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK