阿尔茨海默病(Alzheimer's disease, AD)是最常见的神经退行性疾病,也是痴呆的主要形式。临床上,AD表现为认知能力下降,最初表现为轻度认知性痴呆,最终发展为严重的智力缺陷和无法应付日常生活。
神经病理学上,AD大脑表现出淀粉样蛋白‐β(Amyloid β, Aβ)的沉积,作为细胞外斑块和神经元内神经纤维缠结(Neurofibrillary tangles, NFT),由过度磷酸化的微管相关Tau蛋白组成。
1.AD转基因模型
转基因模型是对现有的基因构成进行基因修饰或改变目标基因在正常染色体上的位置。为了解AD发病机制,已经开发了各种加速积累Aβ和Tau缠结的转基因小鼠模型,如APP23、TgCRND8、TgCRND8、APPPS1等多种不同品系。
● 实例
利用原核显微注射技术,将分别编码人APPSwe和tauP301L (4R/0N)的两个独立转基因构建体共注射到来源于PS1M146V敲入纯合子小鼠的单细胞胚胎中。注射有APP和tau基因的胚胎转移至受体鼠体内,由此得到的新生小鼠后代进行基因分型以鉴定3×Tg-AD小鼠。免疫印迹结果显示转基因小鼠大脑中APP和Tau蛋白表达水平升高。
图1 三转基因(3×Tg-AD)小鼠模型的构建及鉴定
【参考文献】
Oddo S, Caccamo A, Shepherd JD, et al. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Abeta and synaptic dysfunction. Neuron. 2003 Jul 31;39(3):409-21.
2. AAV诱导的AD模型(我司开发)
通过不同的给药途径,将AAV介导基因进行表达从而构建AD模型。
● 实例一
通过脑立体定位注射腺相关病毒载体来在小鼠海马区表达蛋白tau或淀粉样前体蛋白制作AAV-AD模型。12周后对小鼠大脑进行分析,APP.SLA在CA和皮质的锥体神经元中有明显的表达,抗体6E10显示APP代谢物在神经细胞内大量积聚。免疫印迹结果显示海马区蛋白提取物APP.SLA或Tau.P301L的相对水平分别比内源性小鼠APP或Tau.P301L高约两倍。脑内注射AAV-APP.SLA 6个月后出现淀粉样斑块,在淀粉样斑块周围的营养不良的轴突中也有磷酸化的tau。
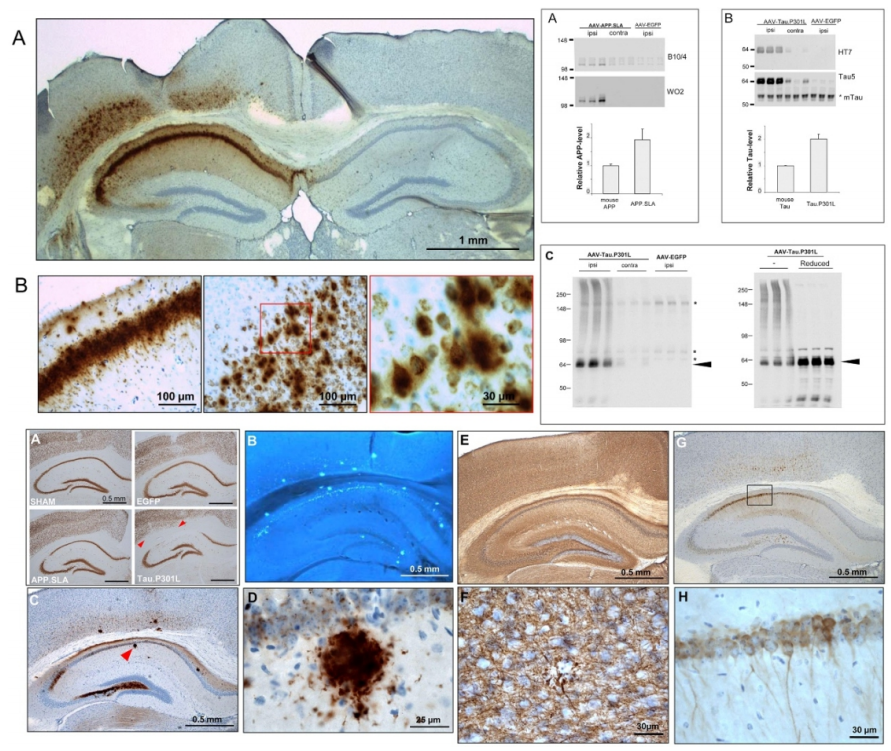
图2 脑立体定位注射腺相关病毒载体构建AD模型及鉴定
【参考文献】
Jaworski T, Dewachter I, Lechat B, et al. AAV-tau mediates pyramidal neurodegeneration by cell-cycle re-entry without neurofibrillary tangle formation in wild-type mice. PLoS One. 2009 Oct 1;4(10):e7280.
● 实例二
小鼠进行脑立体定位注射AAV-TauP301L 6个月后,进行行为学检测(探索能力、焦虑、学习和记忆)和脑部病理检测。结果显示,在矿场实验(Open-field assay, OFA)中,AAV1-TauP301L小鼠表现出多动、探索矿场中间区域的减少趋势,这是典型的焦虑增加的特征;在高架十字迷宫(Elevated plus maze, EPM)实验中,AAV1-TauP301L小鼠表现出异常的探索行为和去抑制行为;在场景条件性恐惧实验中也表现出缺陷,在将场景或听觉线索联系起来的能力上存在明显的记忆障碍。
图3 小鼠AD造模后行为学检测及脑部病理检测
【参考文献】
Cook C, Kang SS, Carlomagno Y, et al. Tau deposition drives neuropathological, inflammatory and behavioral abnormalities independently of neuronal loss in a novel mouse model. Hum Mol Genet. 2015 Nov 1;24(21):6198-212.
利用AAV病毒能够在短时间内诱导生成大量的AD动物模型,弥补了转基因动物模型获取周期长、数量少、价格昂贵的缺点。AAV病毒能够在不同的核团中特异性表达,对于研究AD临床症状背后的环路机制具有重要作用。并且通过调整病毒的用量,能够诱导动物产生由轻到重的神经退行性病变的表型。
|
产品编号 |
产品名称 |
血清型 |
|
GT-0221 |
rAAV-SYN-tau (p301L) |
AAV9 |
|
GT-0222 |
rAAV-SYN-APPs1-L |
AAV9 |
|
GT-0223 |
rAAV-SYN-PS1-M146L |
AAV9 |
|
GT-0224 |
rAAV-SYN-APPs1a-L-A |
AAV9 |
|
AAV-AD模型检测 |
实验项目 |
实验内容 |
|
行为学检测 |
旷场实验 |
检验动物的自主运动能力 |
|
Y迷宫 |
检测动物探索新环境的特性 |
|
|
明暗场实验 |
记录动物的运动活性 |
|
|
T迷宫 |
检测动物空间学习、工作记忆、交替行为 |
|
|
组织染色 |
银染 |
检测运动神经元的凋亡 |
|
免疫组化 |
特异性目的蛋白在细胞内的含量及定位 |
信息订阅
我们将及时向您推送最新产品资讯

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK