AAV基因治疗制品检测分析平台
本平台专注于重组腺相关病毒(AAV)基因治疗药物的全方位质量控制,提供从早期研发、IND申报到商业化生产的全生命周期合规检测服务。可提供定制化的方法开发及质量控制服务,包括鉴别、结构分析、生物学活性、含量、纯度、杂质、安全性和一般理化特性等维度的一系列分析方法,可为基因治疗产品各项检测快速开展精准分析。
| 类别 | 检测项目 | 检测方法 | 方法描述 | 送检要求 |
检测周期
(工作日)
|
交付物 |
| 鉴别 |
衣壳蛋白
血清型
|
WB | 可选择特定血清型抗体或抗多种血清型抗体 | 提供基因组滴度或者预计滴度范围,单次AAV总量≥8E+10vg,体积≥15μL,提供血清型 | 7 | 检测报告 |
|
衣壳蛋白
分子量
|
SDS-PAGE | 银染 | 提供基因组滴度或者预计滴度范围,单次AAV总量≥8E+10vg,体积≥15μL,提供血清型 | 7 | 检测报告 | |
|
结构分析
(委外)
|
粒径大小及分布 | DLS | N/A | 单次体积≥30μL | 7 | 检测报告 |
|
衣壳蛋白分子量
(还原)
|
LC-MS | N/A | 1E+13vg/mL,200μL | 10 | 检测报告 | |
|
肽图覆盖率
(PM)
|
LC-MS | N/A | 单次体积≥400μL(滴度1E+13vg/mL) | 20 | 检测报告 | |
| SDS-PAGE切胶回收,胶内酶解肽图覆盖率 | LC-MS | N/A | 单次体积≥400μL (滴度1E+13vg/mL) | 20 | 检测报告 | |
| N/C端序列 | LC-MS | N/A | 单次体积≥400μL (滴度1E+13vg/mL) | 10 | 检测报告 | |
|
翻译后修饰
(PTM)
|
LC-MS | N/A | 单次体积≥200μL (滴度1E+13vg/mL) | 20 | 检测报告 | |
| 热稳定性 | DSF | N/A | 单次体积≥50μL (滴度1E+13vg/mL) | 10 | 检测报告 | |
| 含量 | 基因组滴度 | qPCR | 染料法 | 提供引物序列及标曲,单次样品量:中间过程样品100~500μL,成品≥10μL,其他类型样品体积协商提供;如需筛选引物和制备标准曲线,另行商议 | 7(不含引物筛选合成和标曲制备) | 检测报告 |
| ddPCR | 探针法 | 提供预计滴度范围、引物探针序列,单次样品量:中间过程样品100~500μL,成品≥10μL,其他类型样品体积协商提供 | 7(不含引物探针筛选合成和标曲制备) | 检测报告 | ||
| 病毒衣壳滴度 | ELISA | N/A | 提供血清型,单次体积≥15μL | 7(试剂盒采购到位后) | 检测报告 | |
| 感染滴度 | AAV TCID50(荧光) | 采用梯度稀释AAV感染细胞并通过荧光检测 | 提供基因组滴度或者预计滴度范围,提供荧光类型,单次体积≥15μL;无菌分装 | 15 | 检测报告 | |
| AAV TCID50(qPCR,引物名称) | 采用梯度稀释AAV感染细胞并通过qPCR进行检测 | 提供基因组滴度或者预计滴度范围,提供引物序列及标曲,单次体积≥15μL;无菌分装;如需筛选引物和制备标准曲线,另行商议 | 15(不含引物探针筛选合成和标曲制备) | 检测报告 | ||
| 总蛋白含量 | BCA | N/A | AAV滴度不小于5E+13vg/mL,单次体积≥50μL,滴度较高样品可根据稀释至5E+13vg/mL滴度的稀释倍数降低送样量 | 7 | 检测报告 | |
| MicroBCA | N/A | AAV滴度不小于3E+12vg/mL,单次体积≥300μL,滴度较高样品可根据稀释至3E+12vg/mL滴度的稀释倍数降低送样量 | 7 | 检测报告 | ||
|
生物学
活性
|
效价 | 细胞培养+荧光素酶法 | AAV感染细胞后通过荧光素酶检测试剂盒测定荧光素酶表达情况 | 单次AAV量≥5E+10vg,目的基因滴度不低于5E+10vg/mL;无菌分装,提供血清型 | 15 | 检测报告 |
| 细胞培养+WB | AAV感染细胞后通过WB测定目的蛋白表达情况 | 单次AAV量≥1.8E+12 vg,目的基因滴度不低于4E+12vg/mL;无菌分装,提供血清型 | 15 | 检测报告 | ||
| 细胞培养+ELISA | AAV感染细胞后通过ELISA测定目的蛋白表达情况 | 单次AAV量≥1.8E+12 vg,目的基因滴度不低于4E+12vg/mL;无菌分装,提供血清型 | 15 | 检测报告 | ||
| 细胞培养+RT-PCR | AAV感染细胞后通过RT-PCR检测目的基因mRNA表达情况 | 单次AAV量≥1.8E+12 vg,目的基因滴度不低于4E+12vg/mL;无菌分装,提供血清型 | 15 | 检测报告 | ||
| 纯度 | 空壳率 | AUC | 沉降速率分析方法(AUC-SV) | 单次AAV体积≥1mL,OD230≥0.9,可根据OD230等比换算送样体积 | 10 | 检测报告 |
| TEM | 磷钨酸负染 | 体积>20μL,滴度不低于8E+12vg/mL | 10 | 检测报告 | ||
|
衣壳蛋白比例
及纯度
|
CE-SDS | 衣壳蛋白还原后,P503染色,荧光检测 | 单次AAV体积≥20μL,滴度≥1E+13vg/μL,提供样品buffer信息 | 10 | 检测报告 | |
| 病毒单体纯度 | SEC-HPLC | 根据病毒单体及其他组分尺寸差异分离样品 | 单次AAV量≥1.5E+11vg,滴度≥1.5E+12 vg/mL | 7 | 检测报告 | |
| 杂质 |
Sf9宿主细胞
DNA残留
|
qPCR | N/A | 单次样品体积≥10μL,提供AAV滴度 | 7 | 检测报告 |
|
杆状病毒
DNA残留
|
qPCR | N/A | 单次样品体积≥10μL,提供AAV滴度 | 7 | 检测报告 | |
| HEK293宿主细胞DNA残留 | qPCR | N/A | 单次样品体积≥10μL,提供AAV滴度 | 7 | 检测报告 | |
|
DNA残留片段
大小分布
|
ddPCR | N/A | 单次样品体积≥10μL,提供AAV滴度 | 7 | 检测报告 | |
|
Sf9宿主细胞
蛋白残留
|
ELISA | N/A | 单次样品体积≥100μL | 7 | 检测报告 | |
|
杆状病毒蛋白
残留(GP64)
|
ELISA | 检测GP64蛋白含量 | 单次样品体积≥100μL | 7 | 检测报告 | |
|
HEK293宿主
细胞蛋白残留
|
ELISA | N/A | 单次样品体积≥100μL | 7 | 检测报告 | |
|
感染性杆状
病毒残留
|
蚀斑法/TCID50 | N/A | 蚀斑法单次用量样品体积≥6mL,TCID50单次样品体积≥1.5mL | 30/15 | 检测报告 | |
| 弹状病毒残留 | qPCR | N/A | 细胞:单次≥1E+6细胞,病毒:单次样品体积≥100μL | 7 | 检测报告 | |
| 亲和配基残留 | ELISA | N/A | 单次样品体积≥100μL,提供配基类型 | 7 | 检测报告 | |
| 核酸酶残留 | ELISA | N/A | 单次样品体积≥100μL | 7 | 检测报告 | |
| 吐温20残留 | HPLC |
外标法,
CAD检测器
|
单次样品体积≥50μL | 7 | 检测报告 | |
| 安全性 | 内毒素 | 凝胶法 | N/A | 单次样品体积≥12μL | 7 | 检测报告 |
| 动态浊度法 | N/A | 单次样品体积≥12μL | 7 | 检测报告 | ||
|
复制型
腺相关病毒
|
细胞培养法 | AAV感染细胞后通过qPCR进行检测 | 单次样品体积≥100μL,提供病毒滴度 | 30 | 检测报告 | |
|
一般理化 特性 |
外观 | 目视法 | N/A | 单次样品体积≥200μL | 3 | 检测报告 |
| pH值 | 电位法 | N/A | 单次样品体积≥200μL | 3 | 检测报告 | |
| 渗透压 | 冰点法 | N/A | 单次样品体积≥250μL | 3 | 检测报告 | |
| 可见异物 | 目视法 | N/A | 单次样品体积≥200μL | 3 | 检测报告 | |
| 不溶性微粒 | 光阻法 | N/A | 单次样品体积≥200μL | 3 | 检测报告 | |
|
辅料含量
(泊洛沙姆188)
|
HPLC |
外标法,
CAD检测器
|
单次样品体积≥50μL | 7 | 检测报告 |
案例一、AAV基因组滴度测定——qPCR法
qPCR为AAV基因组滴度测定较常使用的一种检测手段,其检测结果的稳定性尤为关键。
我司优势:流程化的引物探针设计及筛选;规范化的标准曲线制备流程,批次间稳定;数据重复性好。
AAV基因组滴度测定
|
检测引物:ITR |
|||||||||
|
日期 |
实验人员 |
重复数 |
病毒滴度(vg/mL) |
平均值 |
CV |
平均值 |
CV |
平均值 |
CV |
|
Day 1 |
A |
1 |
9.14E+11 |
9.56E+11 |
8% |
9.69E+11 |
6% |
9.34E+11 |
8% |
|
2 |
1.04E+12 |
||||||||
|
3 |
9.12E+11 |
||||||||
|
B |
1 |
9.39E+11 |
9.81E+11 |
4% |
|||||
|
2 |
9.87E+11 |
||||||||
|
3 |
1.02E+12 |
||||||||
|
Day 2 |
B |
1 |
9.78E+11 |
9.28E+11 |
5% |
9.07E+11 |
5% |
||
|
2 |
9.29E+11 |
||||||||
|
3 |
8.77E+11 |
||||||||
|
C |
1 |
8.83E+11 |
8.87E+11 |
3% |
|||||
|
2 |
8.64E+11 |
||||||||
|
3 |
9.13E+11 |
||||||||
|
Day 3 |
B |
1 |
7.43E+11 |
8.60E+11 |
13% |
9.26E+11 |
13% |
||
|
2 |
9.69E+11 |
||||||||
|
3 |
8.69E+11 |
||||||||
|
A |
1 |
1.01E+12 |
9.91E+11 |
9% |
|||||
|
2 |
8.91E+11 |
||||||||
|
3 |
1.07E+12 |
||||||||
CV:Coefficient of Variation,变异系数
ITR引物:三名检测人员对同一样品连续三天进行三重复检测,同一天单人三重复间,同一天两人六重复间和三天三人十八重复间的CV均<15%。
案例二、AAV基因组滴度检测——ddPCR法
ddPCR技术,是一种qPCR技术的升级技术,同样是利用染料法或Taqman探针法进行的荧光检测,不同的是ddPCR是终点检测荧光信号,qPCR是实时检测荧光信号。
与qPCR相比,ddPCR存在以下特点:
● 绝对定量,不依赖Ct值, 无需标准曲线;
● 超高灵敏度,适用于稀有序列及稀有突变的检测;
● 精准的定量结果和极佳的重复性;
● 适用复杂样品检测,不易受PCR抑制物影响;
● 兼容染料法和探针法,同时满足科学研究和临床检测要求。
|
样品编号 |
实验人员 |
重复数 |
平均值 |
CV |
平均值 |
CV |
|
AAV-1 |
A |
1 |
8.30E+12 |
2.8% |
8.48E+12 |
4.0% |
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
8.89E+12 |
0.9% |
|||
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
8.24E+12 |
1.5% |
|||
|
2 |
||||||
|
3 |
||||||
|
AAV-2 |
A |
1 |
1.14E+13 |
1.9% |
1.13E+13 |
6.2% |
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
1.20E+13 |
2.6% |
|||
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
1.05E+13 |
3.6% |
|||
|
2 |
||||||
|
3 |
||||||
|
AAV-3 |
A |
1 |
2.76E+13 |
2.9% |
2.81E+13 |
6.8% |
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
3.04E+13 |
1.9% |
|||
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
2.63E+13 |
2.0% |
|||
|
2 |
||||||
|
3 |
||||||
|
AAV-4 |
A |
1 |
9.40E+12 |
0.5% |
9.47E+12 |
5.5% |
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
1.01E+13 |
1.8% |
|||
|
2 |
||||||
|
3 |
||||||
|
B |
1 |
8.94E+12 |
3.6% |
|||
|
2 |
||||||
|
3 |
两名实验人员在不同天对四个样品各进行九次检测;同⼀实验人员同天三重复,三名实验人员九次重复之间CV均在10%以内;重复性及中间精密度较好。
案例三、AAV感染滴度(TCID50)
目前AAV采用TCID50法进行感染性滴度的检测,但该方法面临的挑战是精密度差、变异系数大,大多数发表文章的结果RSD值>70%。其中辅助病毒wtAd5的批次稳定性、感染细胞类型如HelaRC32、培养时间、qPCR引物反应体系、实验人员的熟练程度、实验室环境等都会影响结果。
本公司开发了一种以质粒辅助代替wtAd5病毒辅助的方法,增加了安全性和稳定性。
AAV感染滴度(TCID50)测定
|
实验人员 |
实验时间 |
滴度(IU/ml) |
滴度平均值(IU/ml) |
CV |
滴度平均值(IU/ml) |
CV |
|
实验人员1 |
Day 1 |
1.03E+11 |
8.38E+10 |
24.1% |
9.95E+10 |
33.6% |
|
6.31E+10 |
||||||
|
8.48E+10 |
||||||
|
Day 2 |
6.31E+10 |
1.01E+11 |
36.1% |
|||
|
1.05E+11 |
||||||
|
1.36E+11 |
||||||
|
Day 3 |
6.17E+10 |
6.55E+10 |
8.3% |
|||
|
6.31E+10 |
||||||
|
7.17E+10 |
||||||
|
实验人员2 |
Day 1 |
1.38E+11 |
1.23E+11 |
37.4% |
||
|
1.60E+11 |
||||||
|
7.17E+10 |
||||||
|
Day 2 |
1.03E+11 |
8.70E+10 |
17.3% |
|||
|
8.41E+10 |
||||||
|
7.36E+10 |
||||||
|
Day 3 |
1.22E+11 |
1.36E+11 |
9.2% |
|||
|
1.44E+11 |
||||||
|
1.44E+11 |
由两名实验人员对同一样品在不同天共进行三次独立重复实验,每次测定3个样品,共18组数据,平均感染滴度为9.95E+10 IU/ml,CV整体控制在40%以内。
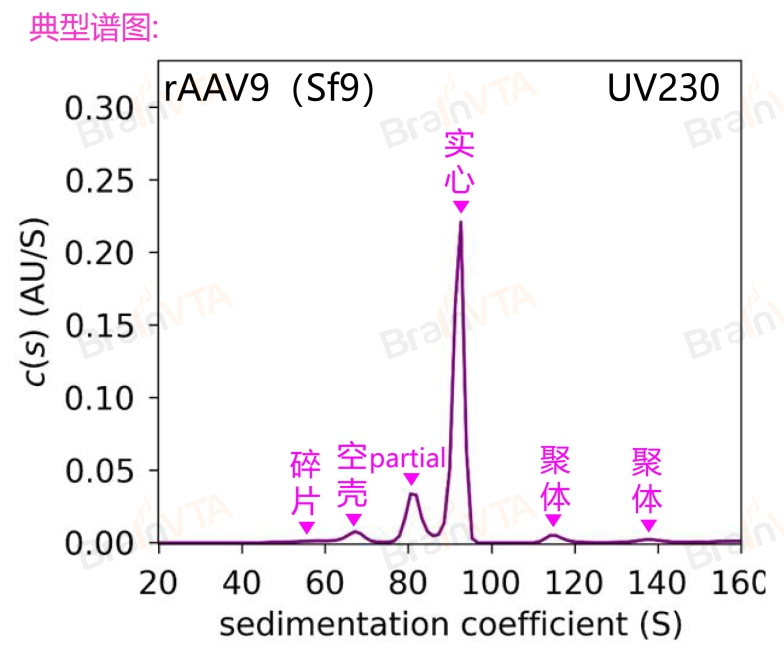
案例四、AAV空壳率检测(AUC)
分析型超速离心技术(AUC,Analytical Ultracentrifugation)将离心机与光学检测模块相结合,利用离心作用使颗粒沉降,并实时监测沉降过程的变化。通过分析物质的沉降系数、质量和密度等参数,AUC能够将不同沉降系数的样品依次沉降至样品池底部。在这一过程中,系统会扫描并记录样品的分布状态,从而通过时间变化的分析,获取各组分的沉降特性和相对比例。基于full capsid与其他病毒颗粒沉降系数的差异,AUC能够精确测定重组腺病毒样颗粒(rAAV)中不同类型衣壳颗粒的沉降系数及其相对比例,同时也可用于检测中间产物、病毒载体碎片、基因组片段及病毒聚集体。目前,AUC已成为评估AAV空壳率的“金标准”,在业内得到了广泛认可。
案例五、TEM检测
透射电子显微镜法(Transmission Electron Microscopy, TEM):透射电子显微镜使用加速电子束为光源,穿透待检样品,电子与样品中的原子发生碰撞、散射,因散射角不同,形成明暗不同的影像,影像经放大和聚焦,获得纳米级分辨率的图像。负染色技术能通过染色液,增加电子散射能力,使背景呈现为黑色,样品呈现为亮色,形成负反差。在rAAV样品的电镜检测中,实心病毒的衣壳中封装DNA,阻止染色液进入,在图像上呈现为明亮的实心圆点,空壳病毒的衣壳内侵入染色液,在图像上呈现为中心黑暗的圆环,从而在形态上得到直观区分。

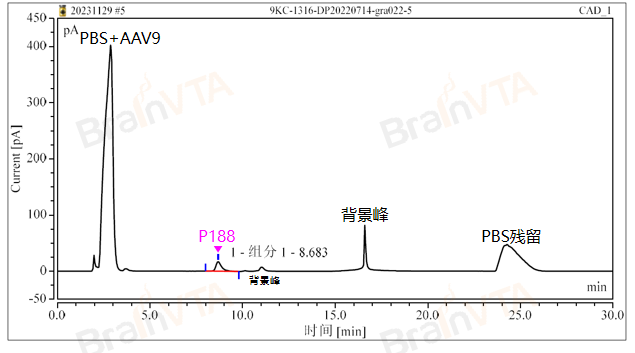
案例六、HPLC检测
高效液相色谱(HPLC,High-Performance Liquid Chromatography)是一种先进的分离分析技术,利用不同化合物在固定相和流动相中的分配行为差异,通过柱子的分离作用实现样品的分离和分析,广泛应用于化学、制药、食品、环境和生物科学等领域。
当样品与流动相一同进入色谱柱后,样品中的不同成分与固定相之间的相互作用会导致它们在柱中的迁移速度不同。这样,样品中的成分在柱中被分离开来。分离后的成分在检测器中被测量,并生成相应的色谱图,图中每个峰代表不同的化合物。
P188含量检测:
P188(泊洛沙姆188)是一种非离子表面活性剂,通常作为AAV制剂中的一种添加剂,避免聚体的产生,以保证长期低温保存和运输的稳定性。
信息订阅
我们将及时向您推送最新产品资讯

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK