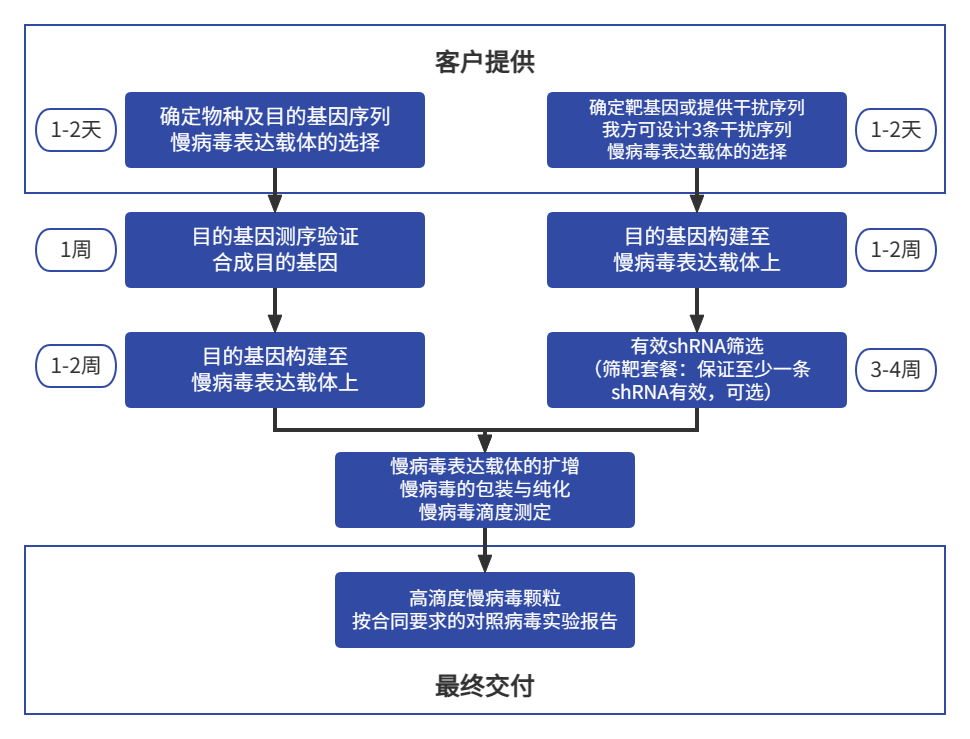
慢病毒载体(Lentiviral vectors, LVs)是在人免疫缺陷病毒(HIV-1病毒)基础上改造而成的病毒载体系统,它能高效的将目的基因(或RNAi)导入动物和人的原代细胞或细胞系,对分裂细胞和非分裂细胞均具有感染能力。慢病毒载体基因组是单股正链RNA,其基因组进入细胞后,在细胞浆中被其自身携带的反转录酶反转为DNA,形成DNA整合前复合体,进入细胞核后,DNA整合到细胞基因组中。整合后的DNA转录成mRNA,回到细胞浆中,表达目的基因或片段。
慢病毒载体介导的基因表达或RNAi干扰作用持续且稳定,其目的基因整合到宿主细胞基因组中,并随细胞基因组的分裂而分裂。另外,慢病毒载体能有效感染并整合到非分裂细胞中。以上特性使慢病毒载体与其它病毒载体相比(如不整合的腺病毒载体、整合率低的腺相关病毒载体、只整合分裂细胞的传统逆转录病毒载体),有鲜明的特色。大量文献研究表明,慢病毒载体介导的目的基因长期表达的组织或细胞包括脑、肝脏、肌肉、视网膜、造血干细胞、骨髓间充质干细胞、巨噬细胞等
慢病毒表达载体删除了HIV病毒绝大多数基因,仅保留了HIV病毒的LTR序列,包装信号,Rev应答元件等。因此免疫原性低,在注射部位无细胞免疫反应,体液免疫反应也较低,不影响病毒载体的第2次注射。
慢病毒包装系统主要有慢病毒表达载体和包装载体及包膜载体构成,一般由三个(二代系统)或者四个质粒(三代系统)构成,包装病毒所用细胞一般为293系列的细胞,其主要过程是将组成慢病毒系统的质粒共转染293细胞,48-72h后收集细胞培养基上清,经过浓缩纯化后得到慢病毒粒子。
枢密科技慢病毒载体是在国际通用的第三代载体系统为基础,通过一定改建构成四质粒体系。其中转移载体(transfer vector)包含转移目的基因的慢病毒骨架及其包装产生相应基因组RNA的所有顺式作用元件,可以单一或多重组合的稳定或条件诱导下表达转移基因或shRNA;另外,通过三个辅助质粒提供病毒包装所需的反式作用因子,同时采用“自我灭活”修饰,阻止子代病毒自我复制和转移,从而确保产生的慢病毒具备良好的生物安全性。
1、对分裂期细胞和非分裂期细胞均有感染作用
2、操作方便,安全性高
3、表达稳定高效
4、实验周期短
5、多种载体可选
● 将目的基因/RNAi基因转入难以转染的细胞,比如神经元细胞、干细胞或其它原代细胞
● 将目的基因/RNAi基因转入动物组织,以期获得长期表达
● 构建稳定表达目的蛋白/RNAi的细胞系,再用ex vivo的方法导入动物体内
● 基因治疗
● 转基因动物
● 基因敲除
● 药物研究:构建表达受体蛋白的细胞系,研究药物的作用
● 快速建立生产目的蛋白的细胞系,非常有前途的真核细胞表达方法
一、慢病毒载体在神经科学领域的应用
1. 慢病毒搭载shRNA感染神经元
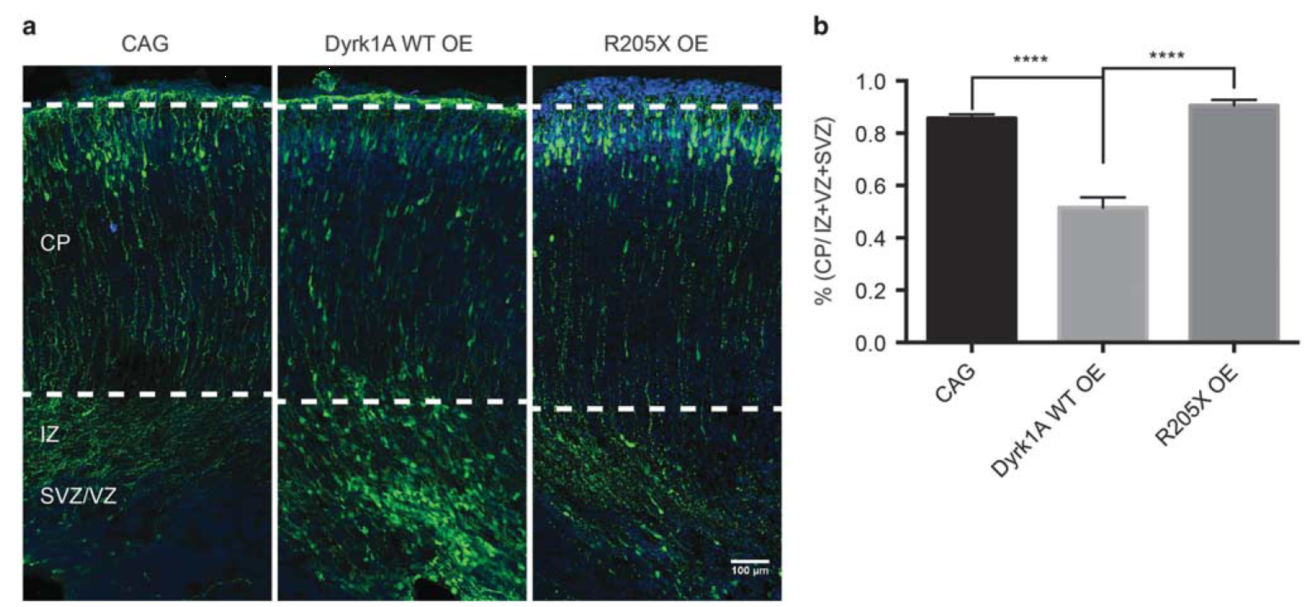
慢病毒载体搭载的Dyrk1α段发卡RNA(shRNA)干扰新生小鼠皮层的发育和神经元的迁移。(Dang, T , et al. Molecular Psychiatry . 2017)
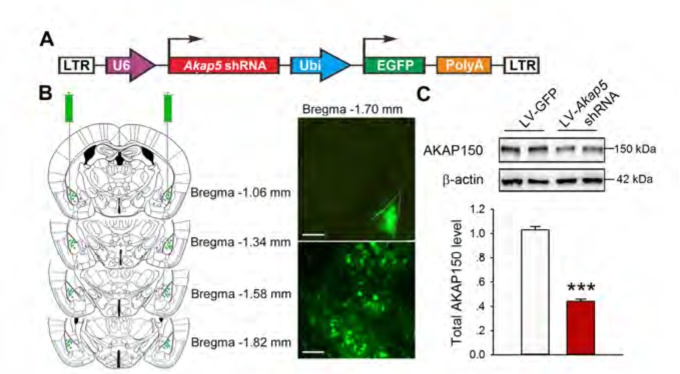
慢病毒搭载shRNA后干扰小鼠杏仁核内Akap5的表达,下调小鼠脑内BLA中Akap5的含量,可有效缓解小鼠出现慢性束缚造成的焦虑/抑郁样行为。(Zhou et al., Biol Psychiatry. 2019)
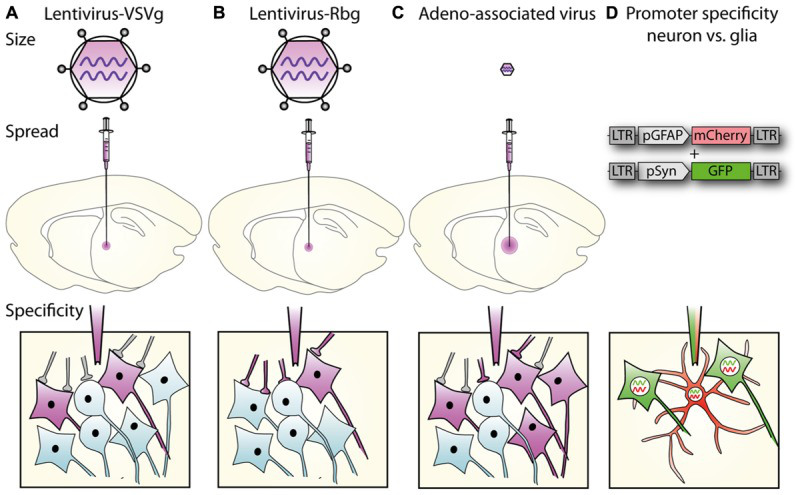
2. 慢病毒标记CNS细胞
不同包膜的慢病毒载体携带特异启动子标记特定细胞类群。(Parr-Brownlie, Louise C. , et al. Frontiers in Molecular Neuroscience, 2015)
3. 钙成像
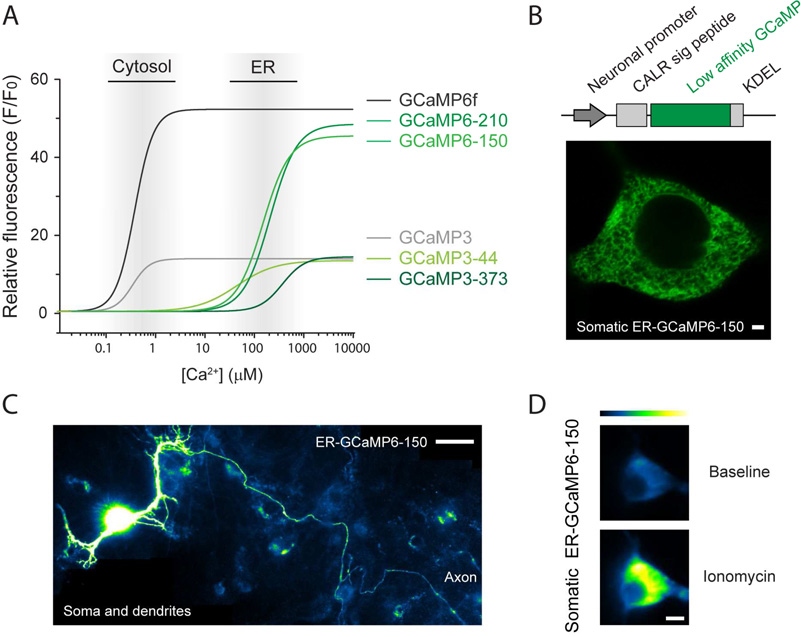
Lenti-ER-GCaMP6超敏内质网ER Ca2+指示剂,清楚显示了胞体延申至树突及整个轴突网络。(De Juan-Sanz J , Holt G T , Schreiter E R , et al. Neuron, 2017.)
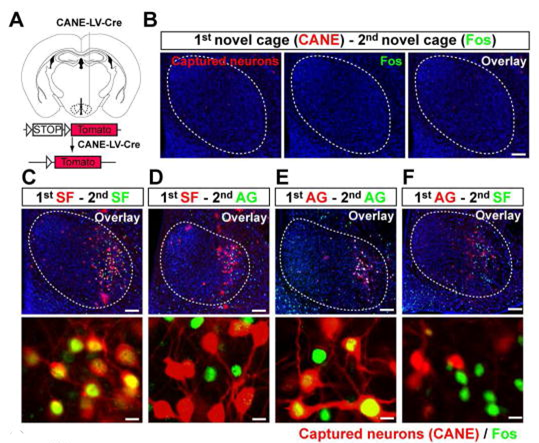
4. 慢病毒(LV)结合狂犬病毒(RV)操控活性依赖的神经元
Lenti-hSyn-Cre用EnvA蛋白包装,获得CANE-LV-Cre选择性感染Fos+神经元。(Sakurai K , Zhao S , Takatoh J , et al. Neuron, 2016)
5. 慢病毒介导基因沉默研究中间神经元电偶联
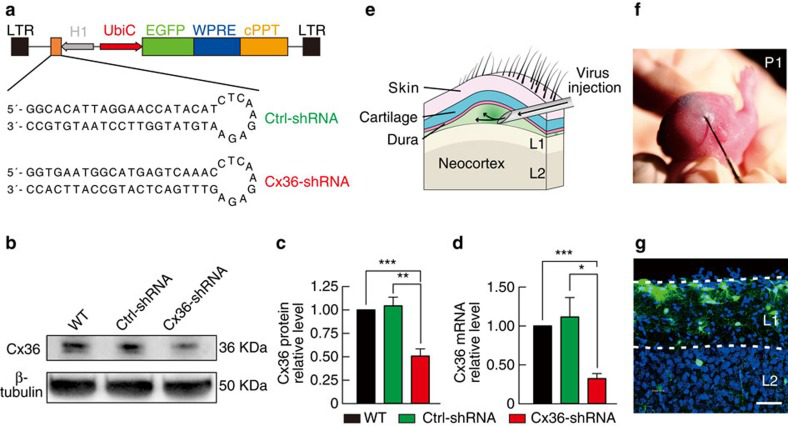
诱导型慢病毒shRNA有效介导Conne-xin 36敲减。将病毒注射到新生P1小鼠的硬脑膜和皮质层的间隙(e.f),P15小鼠中观察到GFP+主要分布在L1,在深层的分布较少。(Yao X H , Wang M , He X N , et al., Nature Communications, 2016)
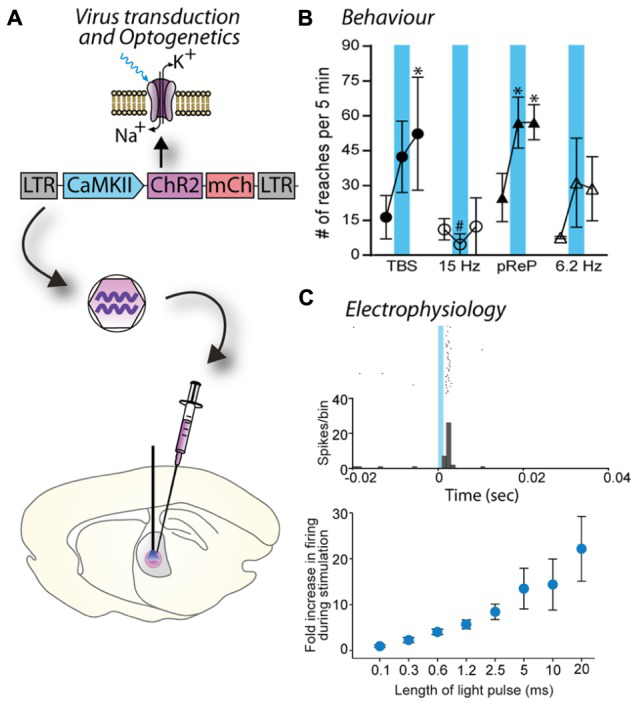
6. 慢病毒在光遗传学中的应用
慢病毒表达光敏感离子通道蛋白(ChR2)的神经元经蓝光刺激后细胞行为的改变。(LC Parr-Brownlie et al., Front. Mol.Neurosci,2015)
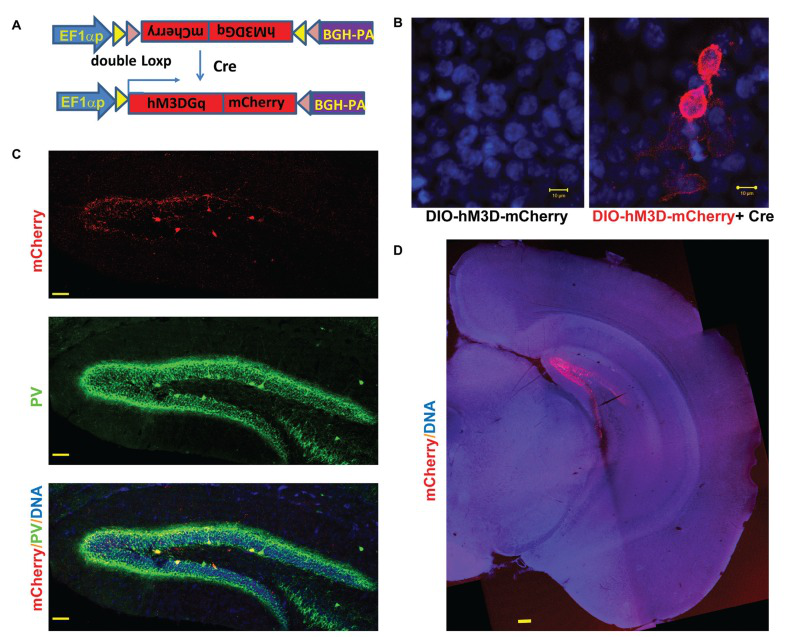
7. 慢病毒的药理学应用
LV-hM3Dq研究PV中间神经元。DREADDr e c e p t o r h M 3 D q 在PV(Parvalbumin,Green)阳性中间神经元内表达。在小鼠海马注射 LVhEF1α-DIO-hM3D-GqmCherry,两周后在脑片中观察到海马hM3D-Gq(Red) 和PV (Green)的表达。( Zou et al. Curr MolMed. 2016)
二、慢病毒载体在其他领域的应用
1. 慢病毒CRISPR成像
LV-dCas9 和LV-sgRNA用于哺乳动物细胞基因组位点成像。(Baohui Chen et al., Cell, 2013)
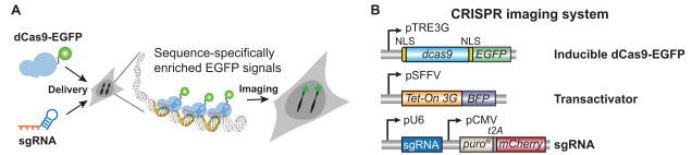
2. 慢病毒介导的造血干细胞治疗X连锁严重免疫缺陷疾病(SCID-X1)
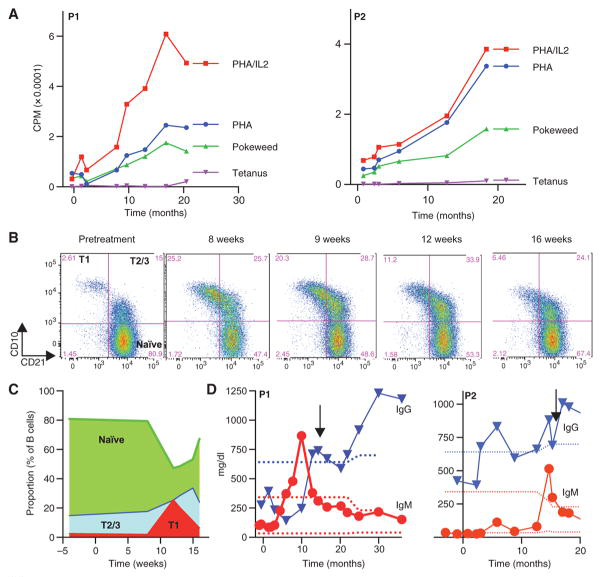
接受SIN-LV治疗后,SCID-X1病人T细胞和B细胞的功能改善。密码子优化的 Self-inactivating element LV,即SIN-LV(Cl20-i4-Ef1a-hγcOPT) 转导CD34+ HSC后回输给病人。上图显示病人的CD3T 细胞能够响应药物刺激增殖(A),治疗后的12-16周,病人出现 T1B cells(CD10++CD21lo)向T2/3 B cells+hi (CD10++CD21lo)的转变,免疫细胞类群构成多样性增加。(De Ravin et al.,Sci Transl Med, 2016)
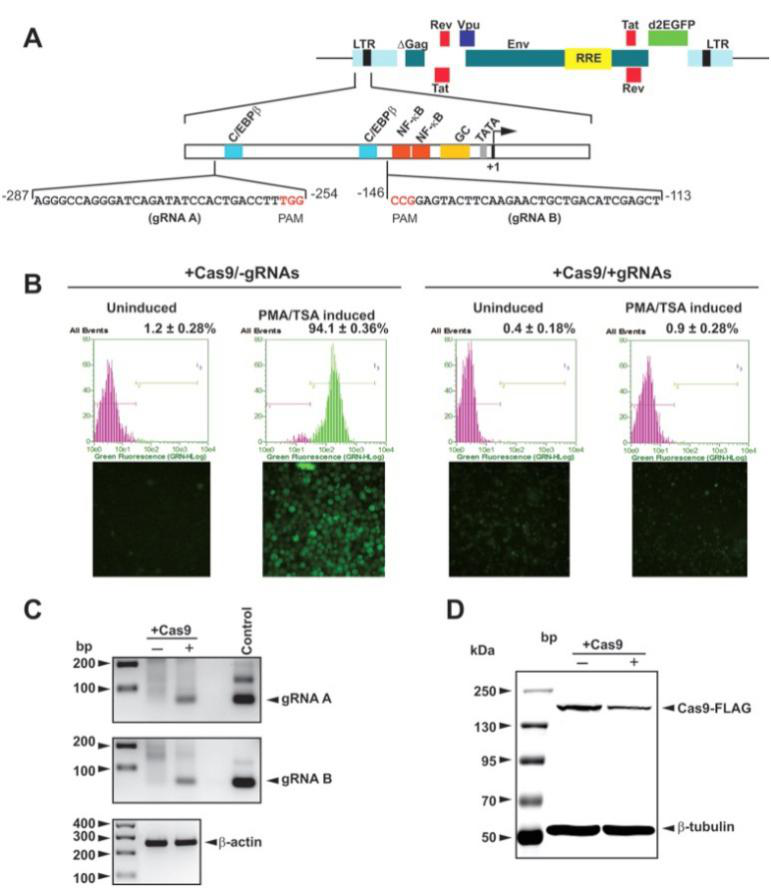
3. LV- CRISPR/Cas9清除人T细胞基因组中的HIV-1
设计针对HIV LTR的gRNA序列(Top),LV介导Cas9/gRNA投递抑制人T细胞感染HIV(Bott-om)。(Rafal Kaminski et al., Sci Rep, 2016)
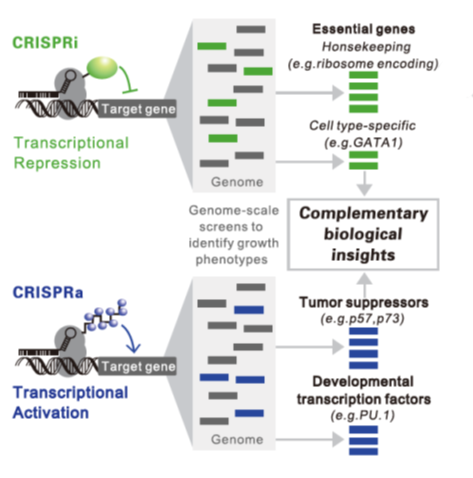
4. LV-CRISPRa/i介导转录激活和抑制
LV-CRISPRi/a研究基因剂量控制基因功能。(Luke A. Gilbert etal., Cell, 2014)
1. Dang T, Duan W Y, Yu B, et al. Autism-associated Dyrk1a truncation mutants impair neuronal dendritic and spine growth and interfere with postnatal cortical development[J]. Molecular Psychiatry, 2017.
2. Cetin, A. and E.M. Callaway, Optical control of retrogradely infected neurons using drug-regulated "TLoop" lentiviral vectors. J Neurophysiol, 2014. 111(10): p. 2150-9.
3. Wei, Y., et al., Lentiviral vectors enveloped with rabies virus glycoprotein can be used as a novel retrograde tracer to assess nerve recovery in rat sciatic nerve injury models. Cell Tissue Res, 2014. 355(2): p. 255-66.
4. Parr-Brownlie, L.C., et al., Lentiviral vectors as tools to understand central nervous system biology in mammalian model organisms. Front Mol Neurosci, 2015. 8: p. 14.
5. Parr-Brownlie, Louise C., et al. "Lentiviral vectors as tools to understand central nervous system biology in mammalian model organisms." Frontiers in Molecular Neuroscience. 8(2015).
6. De Juan-Sanz J , Holt G T , Schreiter E R , et al. Axonal Endoplasmic Reticulum Ca 2+, Content Controls Release Probability in CNS Nerve Terminals[J]. Neuron, 2017, 93(4):867-881.e6.
7. Sakurai K , Zhao S , Takatoh J , et al. Capturing and Manipulating Activated Neuronal Ensembles with CANE Delineates a Hypothalamic Social-Fear Circuit[J]. Neuron, 2016:S0896627316307164.
8. Yao X H , Wang M , He X N , et al. Electrical coupling regulates layer 1 interneuron microcircuit formation in the neocortex[J]. Nature Communications, 2016, 7:12229.
9. Zou D , Chen L , Deng D , et al. DREADD in Parvalbumin Interneurons of the Dentate Gyrus Modulates Anxiety, Social Interaction and Memory Extinction[J]. Current Molecular Medicine, 2016, 16(1):91-102.
10. Chen B , Gilbert L , Cimini B , et al. Dynamic Imaging of Genomic Loci in Living Human Cells by an Optimized CRISPR/Cas System[J]. Cell, 2013, 155(7):1479-1491.
11. De Ravin S S , Wu X , Moir S , et al. Lentiviral hematopoietic stem cell gene therapy for X-linked severe combined immunodeficiency[J]. Science Translational Medicine, 2016, 8(335):335ra57-335ra57.
12. Kaminski R , Chen Y , Fischer T , et al. Elimination of HIV-1 Genomes from Human T-lymphoid Cells by CRISPR/Cas9 Gene Editing[J]. Scientific Reports, 2016, 6:22555.
13. Genome-Scale CRISPR-Mediated Control of Gene Repression and Activation[J]. Cell, 2014, 159(3):647-661.
14. Zhou, H. Y., J. G. He, Z. L. Hu, S. G. Xue, J. F. Xu, Q. Q. Cui, S. Q. Gao, B. Zhou, P. F. Wu, L. H. Long, F. Wang and J. G. Chen 2019. A-Kinase Anchoring Protein 150 and Protein Kinase A Complex in the Basolateral Amygdala Contributes to Depressive-like Behaviors Induced by Chronic Restraint Stress. Biol Psychiatry 86: 131-142. doi: 10.1016/j.biopsych.2019.03.967
信息订阅
我们将及时向您推送最新产品资讯

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK