枢密科技已建立睡眠研究相关的技术服务平台,可提供以下服务内容:
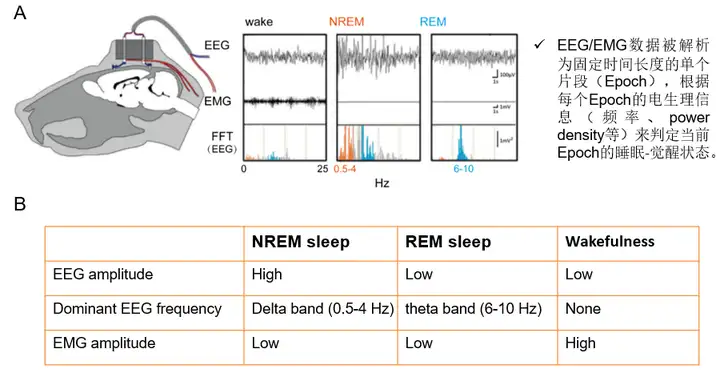
脑电(Electroencephalogram, EEG)和肌电(Eectromyography, EMG)是目前睡眠领域用来评估睡眠-觉醒行为的金标准。1929年德国精神科医生Hans Berger发现,在人头皮上记录的脑电信号呈正弦波发放,其频率与受试者的清醒程度密切相关,极大促进了人类和动物睡眠-觉醒相关的神经电生理研究的发展。EEG记录的是皮层神经元同步化活动形成的突触后电位总和,EMG记录的是多个肌细胞或者肌肉组织同步化活动产生的生物电信号变化总和。通过对获得的EEG数据进行傅里叶转换,可以将睡眠-觉醒时相分为非快动眼睡眠(NREM)、快动眼睡眠(REM)以及觉醒(Wake)三个时期。NREM睡眠以低频、高辐的0.5-4 Hz同步化δ波为主,EMG静止或有轻度活动;REM睡眠以高频、低辐的6-10 Hz去同步化θ波为主,EMG完全静止并伴有随机的眼球运动以及生动梦境的产生;觉醒期以高频、低辐的去同步化EEG为主,EMG剧烈活动。根据NREM、REM以及Wake时长、片段数以及三种时相转换的频率可以评价睡眠稳定性,同样地依据NREM和REM睡眠阶段的power density可以评价睡眠质量。
图1:啮齿类动物NREM、REM以及Wake三种时相EEG/EMG的特点
图片改编自:OishiY, et al. J Vis Exp. 2016
利用EEG/EMG睡眠记录和解析系统不仅可以开展睡眠相关药物的药效评价、同时还能够用于抗癫痫药物、麻醉类药物以及精神类药物的药效研究。通过与化学遗传学、光遗传学、钙信号记录、在体多通道记录等实验技术联用,可以解析中枢核团调控睡眠-觉醒、癫痫、麻醉以及认知等生理性行为的神经环路机制。
采用一系列人工方法限制动物的正常睡眠,以模拟睡眠障碍的状态,从而建立睡眠剥夺模型。利用该模型探索睡眠丧失或者限制对生物体生理机能、基因表达、免疫代谢、应激反应以及学习记忆等多方面的影响,有助于深化对睡眠生理学、睡眠障碍成因以及睡眠障碍与其它神经系统疾病共病机制的理解。目前动物实验常用的睡眠剥夺模型主要有:
1、水平台睡眠剥夺法。这一方法的特性在于利用实验动物畏水、避水以及在水中无法自然入睡的特性,从而达到REM睡眠剥夺的目的。具体的实验操作为:在盛满水的实验装置中放置2-3个直径3 cm的不锈钢圆台,动物可以在此平台站立并进行正常的NREM睡眠。当小鼠进入REM睡眠后,骨骼肌张力丧失使得动物头、面部接触水面甚至掉入水中进而惊醒。畏水的天性促使小鼠再次爬上平台,从而重复上述行为达到REM睡眠剥夺的目的。为了解决REM睡眠剥夺过程中社交隔离的问题,后续又开发了多平台睡眠剥夺法从而能够同时进行多只动物REM睡眠剥夺实验。水平台睡眠剥夺法的优点在于操作简单、设备造价低廉,适应于各种实验条件的课题组,能够有效的模拟动物REM睡眠剥夺的状态。缺点在于动物重复多次的掉入水中以及时刻保持警觉状态,会加剧动物的压力应激反应以及焦虑情绪。
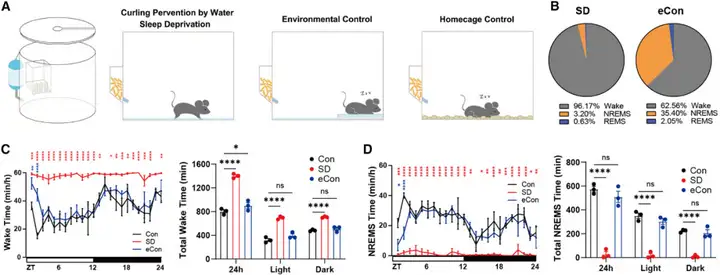
2、CPW睡眠剥夺法。北京生命科学研究所高级研究员张二荃课题组在水平台睡眠剥夺法的基础上,创新设计了名为“curling prevention by water”的睡眠剥夺范式。其原理是将动物置于有一层浅水层(水深大约8毫米)的实验笼中,水深仅达到动物的脚踝,当动物以蜷缩的姿势入睡时,小鼠的口鼻会接触到水进而迅速被唤醒。这一创新的实验范式不仅能够达到剥夺REM睡眠(83%)和NREM睡眠(95%)的目的,而且不会诱发动物过度应激或者损害代谢平衡。
图2:小鼠“curling prevention by water”睡眠剥夺行为学范式
图源:Sang D, et al. Cell. 2023
3、强迫运动睡眠剥夺法。这一造模方法的原理是通过自动化的动力装置迫使大鼠不停的运动,从而达到全睡眠剥夺的目的。将EEG/EMG睡眠监测系统整合到自动装置中可以实现更为精准的睡眠剥夺。这一方法的优点是简单易行且睡眠剥夺效果显著、睡眠剥夺的时间和强度易于控制,无须实验人员随时观察实验情况,减轻了实验人员工作强度;由于该方法不涉及物理接触或水的不适刺激,因此可以减少动物的压力和应激反应。缺点在于长时间运动可能导致动物疲劳从而干扰睡眠剥夺的实验结果。目前主要有水平转盘睡眠剥夺法和旋转圆筒睡眠剥夺法。
4、剥夺杆睡眠剥夺法。为了消除过度运动对睡眠剥夺效果的影响,实验人员开发了剥夺杆睡眠剥夺法。具体的操作为:将动物置于一个配备有剥夺杆的装置内,该剥夺杆能够周期性、随机性的在笼子底部转动,自动化设备可以控制剥夺杆的旋转速度和方向,从而达到全睡眠剥夺的目的。这一方法因其高效性和可靠性,已逐渐成为睡眠剥夺实验最为常用的方法之一。
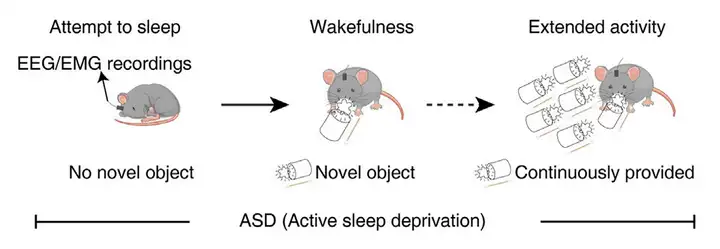
5、轻柔刺激法。这一方法在短期睡眠剥夺实验中应用较多,原理是实验人员通过观察或者结合EEG/EMG睡眠记录在动物即将入睡时给予外部干预(如:毛刷轻触动物的背部或四肢、敲击或轻晃记录笼、或者轻微的噪音刺激等),使动物无法入睡;或者通过引入新物体和新奇环境鼓励动物自发探索,从而达到全睡眠剥夺的效果。这一方法不会引起动物的应激反应,也能避免过度运动,但耗费人力。例如中国科学技术大学副教授晋艳课题组采用主动睡眠剥夺(active sleep deprivation, ASD)的方法,通过不断为小鼠提供新物体使其维持清醒状态之后进行疼痛测试,发现ASD导致机械痛和热痛敏化、炎症痛不易恢复。
图3:小鼠“active sleep deprivation”睡眠剥夺行为学范式
图源:Lou Q, et al. Curr Biol. 2024
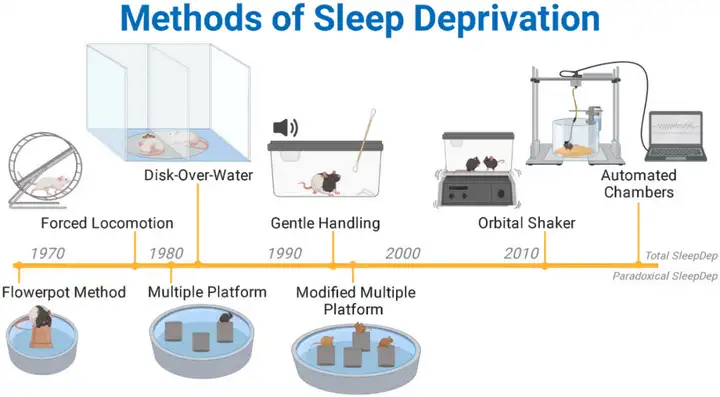
除此之外,还可以采用“Orbital Shaker”定轨摇床、“Disk-Over-Water”水转盘以及药物刺激等实验方法进行睡眠剥夺。经过半个世纪的发展,研究人员已经开发出多种行为学方法来有效的减少、限制或者剥夺啮齿类动物的睡眠。方法学的进步最大限度地减轻了实验动物的应激反应并减少了潜在的干扰因素,保证了睡眠剥夺效果的可靠性和稳定性。
图4:实验性睡眠剥夺方法学发展年表
图源:Wright CJ, et al. Neurobiol Stress. 2023
2005年美国哈佛大学医学院Clifford Saper教授创新性地提出睡眠-觉醒的双稳态触发器模型(flip-flop model)。该模型认为,睡眠和觉醒分别由促睡眠神经环路和促觉醒神经环路控制,两者相互作用、相互拮抗,共同调节睡眠和觉醒时相转换。近些年,随着神经科学研究的新技术,包括光遗传学、化学遗传学、基因编辑、神经通路示踪技术、高分辨率/高通量光学成像技术、多通道电生理记录、高时空分辨率脑功能成像等的推广和普及,鉴定了脑内诸多调控睡眠-觉醒的关键脑区和核团神经元,丰富了睡眠-觉醒的中枢环路调控学说。
接下来将以2018年第三军医大学胡志安教授课题组在《Science》杂志发表的题为“The paraventricular thalamus is a critical thalamic area for wakefulness”的文献作为示例,讲解如何鉴定并解析脑内参与调控睡眠-觉醒的核团及神经环路。
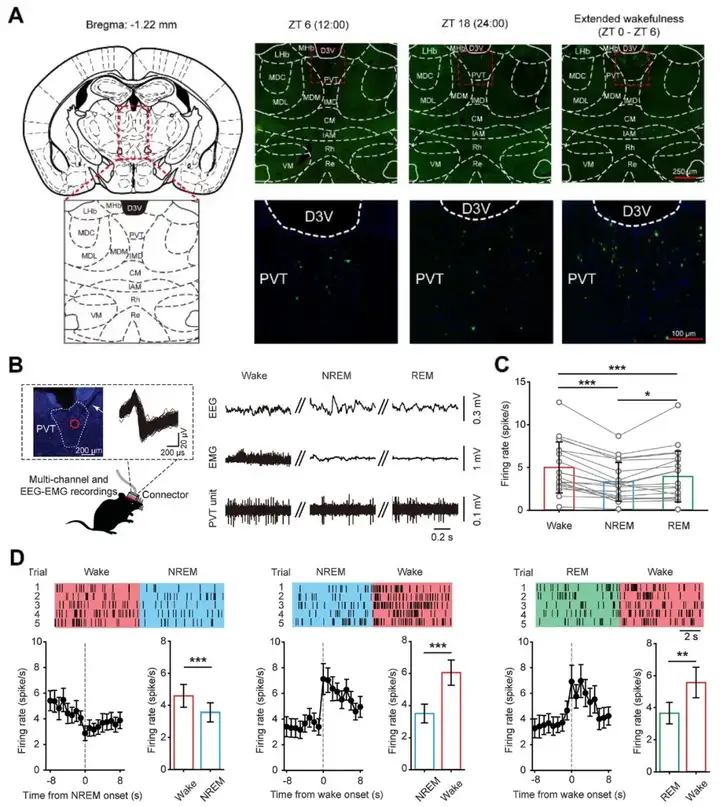
1)筛选并鉴定脑内参与睡眠-觉醒调控的脑区。临床报告表明,卒中所致的丘脑受损可引起病人出现严重的嗜睡甚至昏迷,但丘脑中包含三十余个核团,究竟是哪个核团对觉醒维持起关键作用?作者利用丰富新奇环境睡眠剥夺行为学范式结合即刻早期基因编码蛋白c-Fos(反映神经元兴奋性的蛋白)染色发现,丘脑中缝核PVT脑区在觉醒以及延长觉醒状态下,c-Fos表达水平显著升高。同时在体多通道电生理记录也发现,PVT脑区神经元在觉醒状态下放电频率最高且PVT神经元放电频率在由觉醒向睡眠转换过程中逐渐下降。表明通过睡眠剥夺、c-Fos染色以及在体多通道电生理记录等方法,作者在PVT脑区鉴定了一群在觉醒期活跃的神经元。
图5:PVT脑区神经元活性与觉醒状态密切相关
图源:Ren S, et al. Science. 2018
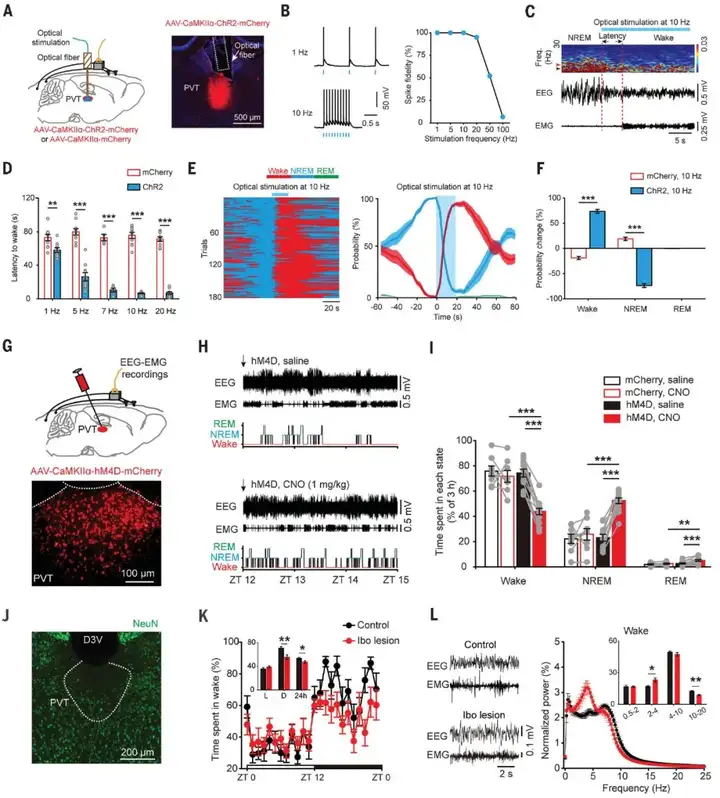
2)操控神经元活性调控睡眠-觉醒行为。基于上述策略筛选并鉴定出睡眠-觉醒相关神经元后,可以利用化学遗传学、光遗传学、基因编辑以及病理损毁等方法特异性操控神经元活性,从而调控睡眠-觉醒生理性行为。结合这篇文章,作者分别用光遗传激活、白喉毒素(DTA)损毁以及化学遗传学抑制PVT谷氨酸能神经元发现,这类神经元促进并维持觉醒。
图6:PVT谷氨酸能神经元活性促进并维持觉醒
图源:Ren S, et al. Science. 2018
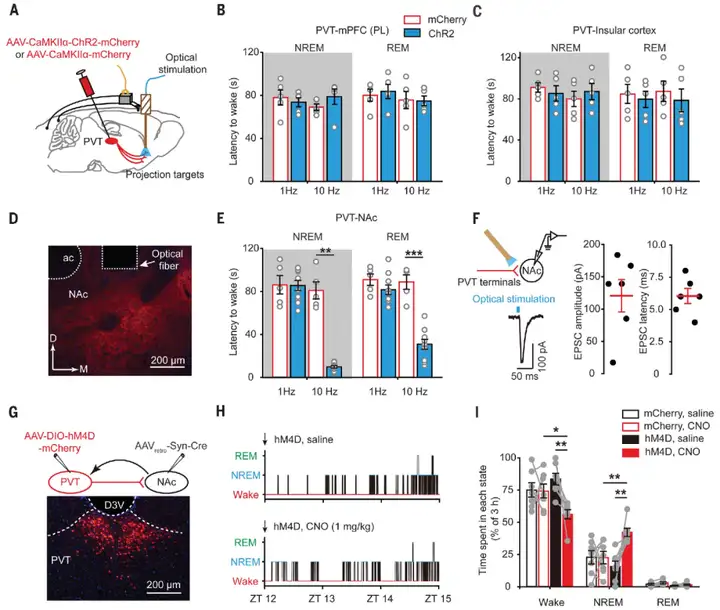
3)解析特定神经元调控睡眠-觉醒行为的神经环路。为了解析脑区神经元调控睡眠-觉醒行为的上、下游环路,可以利用顺行环路示踪、狂犬病毒(RV)介导的逆行跨单突触示踪筛选并鉴定与特定神经元存在突触联系的上、下游核团,之后结合光遗传和化学遗传学手段验证上、下游环路的生理性功能。这篇文章中,利用AAV-CaMKIIα-ChR2-mCherry介导的顺行环路示踪技术,作者发现PVT谷氨酸能神经元投射到多个皮层及皮层下脑区,如前额叶皮层(prefrontal cortex, PFC)、岛叶皮层(insular cortex, INS)以及伏隔核(nucleus accumbens, NAc)等,而只有激活PVTGlu-NAc通路才能够诱发快速的睡眠→觉醒转换并调控觉醒。
图7:PVTGlu-NAc通路调控觉醒行为
图源:Ren S, et al. Science. 2018
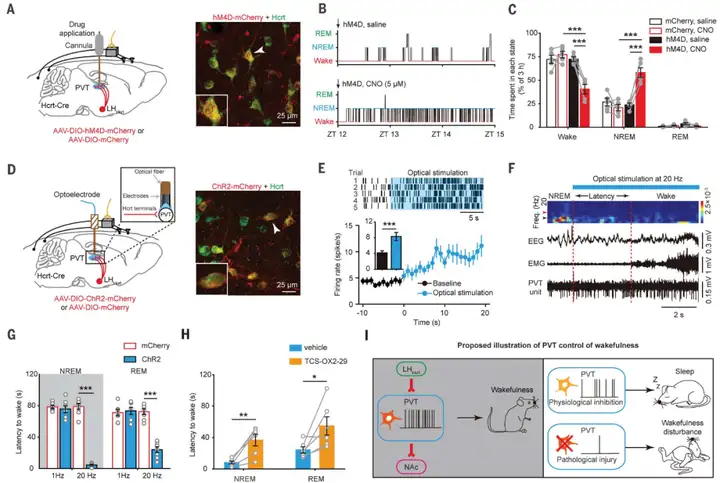
同时,作者采用基于RV狂犬病毒的逆行跨单突触示踪技术,在vGlut2-Cre小鼠中研究PVT谷氨酸能神经元上游输入核团的分布发现,PVT谷氨酸能神经元接受大量来自外侧下丘脑(LH)食欲素肽能神经元(hypocretin, Hcrt)的输入。为了从功能学角度验证LHHcrt→PVT环路在觉醒调控中的作用,作者在Hcrt-Cre小鼠中采用化学遗传学方法抑制LHHcrt→PVT环路发现,PVT核团内给予CNO显著降低觉醒量。之后作者在Hcrt-Cre小鼠PVT脑区埋置光电极,光遗传学激活LHHcrt→PVT环路发现,激活PVT内Hcrt神经元末梢显著增加PVT神经元放电频率,并诱发睡眠向觉醒的转换。这一效应能够被Hcrt受体阻断剂TCS-OX2-29部分阻断。上述结果表明,PVT的觉醒调控功能受到外侧下丘脑食欲素肽能神经元的调节。
图8:LHHcrt-PVT通路调控觉醒行为
图源:Ren S, et al. Science. 2018
依据筛选并鉴定脑内参与睡眠-觉醒调控的脑区→操控神经元活性调控睡眠-觉醒行为→解析特定神经元调控睡眠-觉醒行为的神经环路的研究策略,作者发现PVT核团是生物体觉醒维持的关键脑区,PVTGlu-NAc通路是促进并维持觉醒状态的关键环路,同时PVT谷氨酸能神经元维持觉醒的效应受到上游LH食欲素肽能神经元的精确调控。这一研究策略不仅适用于睡眠-觉醒的环路研究,也适用于包括疼痛、焦虑抑郁、运动等多种生理性行为中枢核团的机制研究。
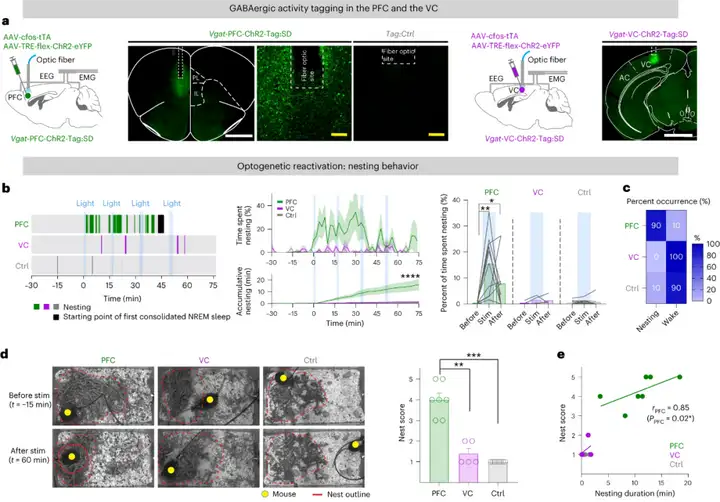
除此之外,结合c-Fos-tTA Tet-off标记策略以及TRAP2(targeted recombination in active populations, TRAP,活性类群靶向重组)标记策略可以标记并调控在睡眠剥夺前后活化的脑区神经元,进而研究这类神经元在睡眠-觉醒、负性情绪、体温调节等生理性行为中的作用。以2023年伦敦帝国理工学院William Wisden教授在《Nature Neuroscience》上发表的题为“Somatostatin neurons in prefrontal cortex initiate sleep-preparatory behavior and sleep via the preoptic and lateral hypothalamus”的文献为例,作者在Vgat-Cre小鼠前额叶皮层PFC注射AAV-c-Fos-tTA和AAV-TRE-flex-ChR2-eYFP病毒,标记在睡眠剥夺期间活化的GABA能神经元,之后光遗传激活这类GABA能神经元能够促进小鼠的筑巢行为。依据这一标记策略可以实现睡眠-觉醒相关神经元的精确标记,进而调控这类神经元在生理性行为中的作用。
图9:激活睡眠剥夺期活化的PFC GABA能神经元促进筑巢行为
图源:Tossell K, et al. Nat Neurosci. 2023
睡眠障碍(也称为睡眠行为障碍)与老年神经系统退行性疾病(帕金森病、阿尔茨海默病、多系统萎缩等)、慢性疼痛、心血管疾病、焦虑抑郁等精神类疾病高度相关。睡眠障碍是疾病症状的一部分,同时睡眠障碍会加速神经系统疾病的进展。临床上的焦虑、抑郁、精神病样的症状和失眠症状之间有着千丝万缕的联系,抑郁症患者会出现睡眠障碍,同时睡眠障碍又是抑郁症的重要危险因素。研究显示,失眠患者发展为抑郁症的风险是正常人的2倍以上,睡眠障碍出现在30%-80%的精神分裂症患者中,是患者最常见的症状之一。临床研究发现,高达88%的慢性疼痛患者患有睡眠障碍,而至少有50%的睡眠障碍患者同时经受慢性疼痛的折磨,两者相互影响并形成恶性循环。长期以来人们对上述疾病与睡眠障碍共病的发病机制知之甚少,临床上也没有有效治疗这些疾病与睡眠障碍共病的药物及疗法。因此,研究睡眠障碍共病的中枢神经机制具有重要的临床价值和科学意义。接下来,以2023年徐州医科大学曹君利教授/安述明教授研究团队在《Nature Communication》上发表的题为“A common neuronal ensemble in nucleus accumbens regulates pain-like behaviour and sleep”的文章作为示例,解析慢性疼痛-睡眠障碍共病的研究策略。
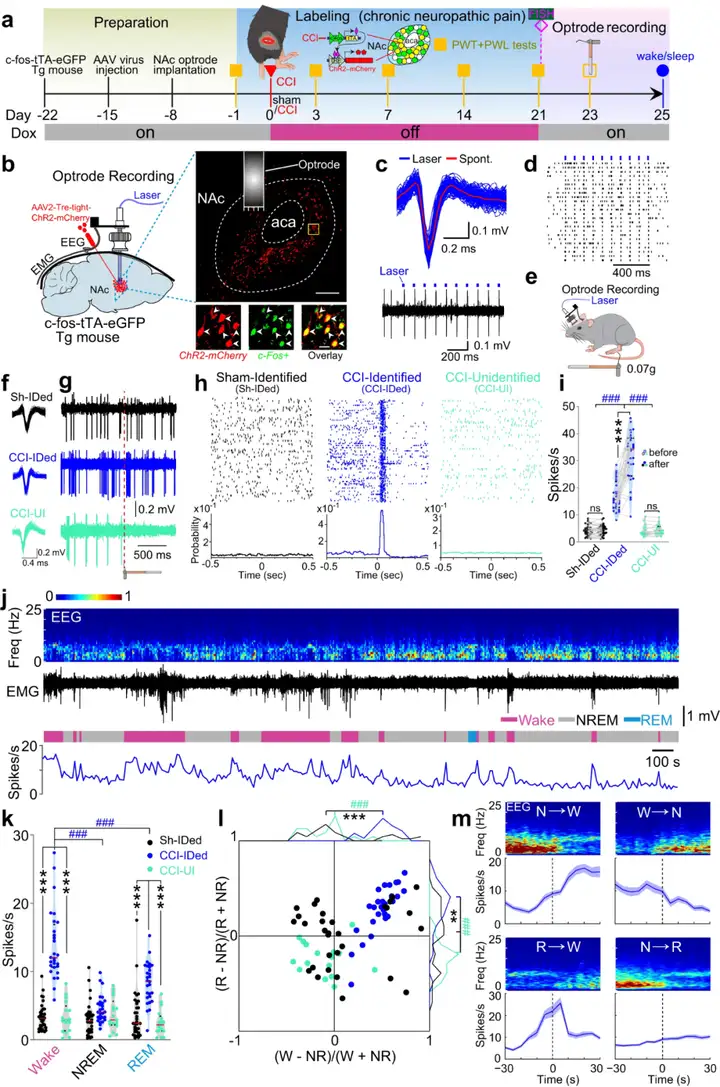
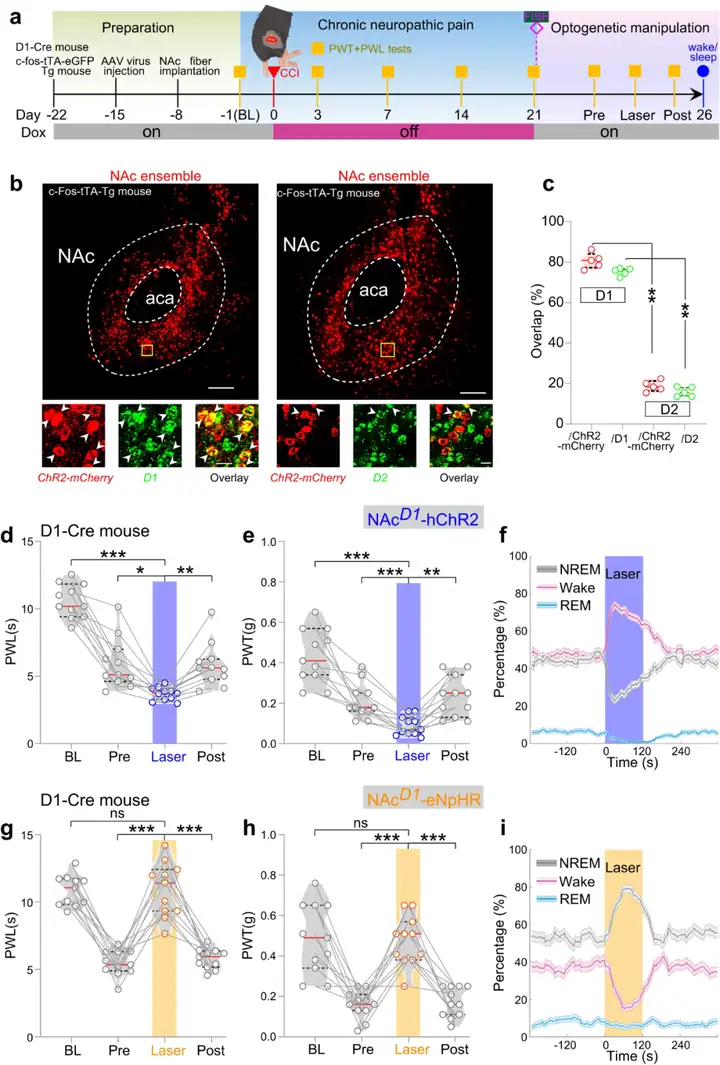
1)标记并操控慢性疼痛-睡眠障碍共病神经元。伏隔核(NAc)不仅是脑内调节奖赏、动机以及学习记忆等行为的重要核团,在疼痛以及睡眠-觉醒调控过程中也发挥重要作用。因此,作者利用c-Fos-tTA小鼠和Tet-off标记策略,标记在坐骨神经压迫(chronic constriction injury model, CCI)这一神经病理性疼痛模型中激活的NAc神经元。具体的实验操作为:将AAV2-TRE-tight-ChR2-mCherry单侧注射到c-Fos-tTA小鼠的NAc脑区,两周以后构建CCI模型,CCI术后0-21天期间终止多西环素喂养,从而标记在CCI病理进程中活化的NAc神经元(激活的神经元中表达ChR2-mCherry)。应用光电极记录这群神经元的放电活动发现,慢性疼痛激活的NAc神经元类群在给予非伤害性刺激和觉醒时放电频率显著增加,而非慢性疼痛激活的NAc神经元放电频率无显著变化。以上结果表明,慢性疼痛激活的NAc神经元类群可能能够同时调节疼痛和睡眠-觉醒行为。
图10:NAc中存在同时参与疼痛以及睡眠-觉醒调节的神经元集群
图源:Sun H, et al. Nat Commun. 2023
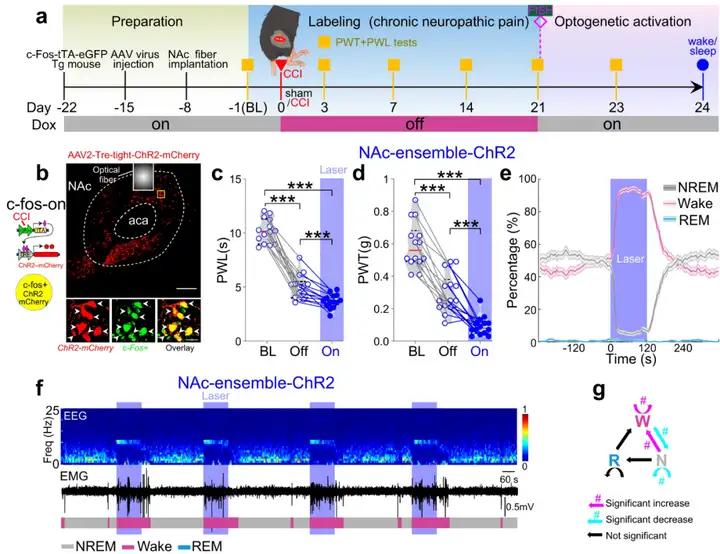
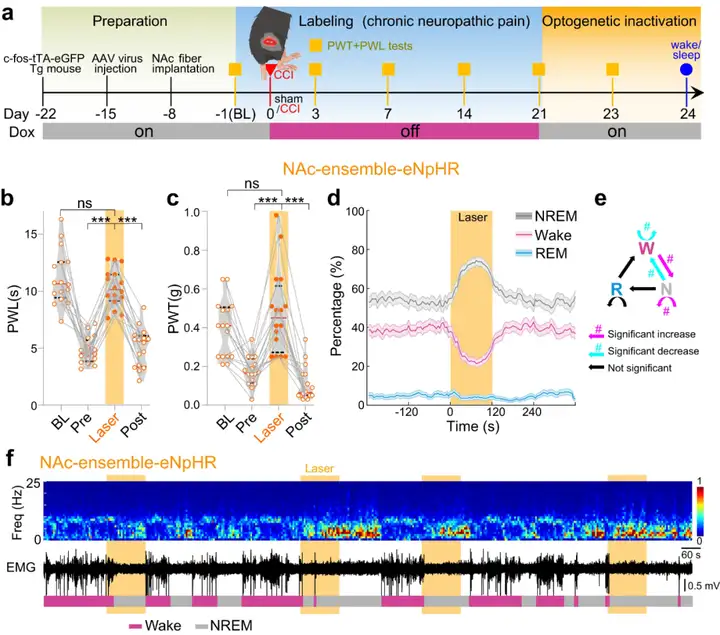
为了进一步验证慢性疼痛激活的NAc神经元对疼痛以及睡眠-觉醒行为的调节作用,作者依据同一策略激活NAc脑区慢性疼痛阳性神经元。结果发现,激活该类神经元加剧CCI小鼠的疼痛表型,减少CCI小鼠的NREM睡眠、促进觉醒。同时,c-Fos-tTA小鼠NAc脑区注射AAV2-TRE-tight-eNpHR-mCherry抑制慢性疼痛阳性神经元发现,光遗传抑制这类神经元缓解CCI小鼠的疼痛表型,增加NREM睡眠、抑制觉醒。以上结果表明,慢性疼痛激活的NAc神经元类群不仅参与处理疼痛感知还调控睡眠-觉醒行为。
图11:激活NAc慢性疼痛阳性神经元加剧疼痛表型、抑制NREM睡眠
图源:Sun H, et al. Nat Commun. 2023
图12:抑制NAc慢性疼痛阳性神经元缓解疼痛表型、促进NREM睡眠
图源:Sun H, et al. Nat Commun. 2023
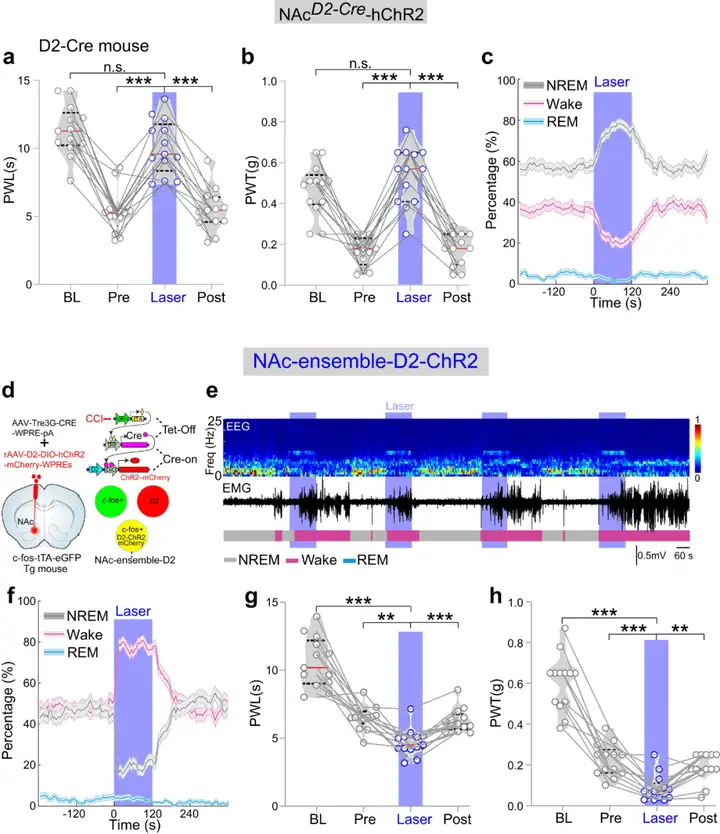
2)鉴定并操控慢性疼痛和睡眠障碍共病特定神经元。为了鉴定NAc脑区慢性疼痛阳性神经元是何种具体的神经元类型,作者利用荧光原位杂交(FISH)染色发现,CCI诱导的NAc脑区神经元大部分表达多巴胺D1受体(80.73%),而只有少部分的NAc脑区神经元表达多巴胺D2受体。光遗传激活NAc-D1神经元加剧CCI小鼠的疼痛表型、促进觉醒,而抑制NAc-D1神经元缓解CCI小鼠的疼痛表型、促进睡眠。但有意思的是,激活NAc-D2神经元缓解疼痛、促进睡眠,而激活CCI诱导的NAc-D2神经元却能加剧CCI小鼠的疼痛表型、促进觉醒。上述结果表明,NAc脑区D1和D2神经元均参与调节慢性疼痛和睡眠障碍共病,而D1神经元占主导地位。
图13:激活/抑制NAc-D1神经元调节慢性疼痛和睡眠-觉醒行为
图源:Sun H, et al. Nat Commun. 2023
图14:激活NAc-D2神经元或者CCI诱导的D2神经元调节慢性疼痛和睡眠-觉醒行为
图源:Sun H, et al. Nat Commun. 2023
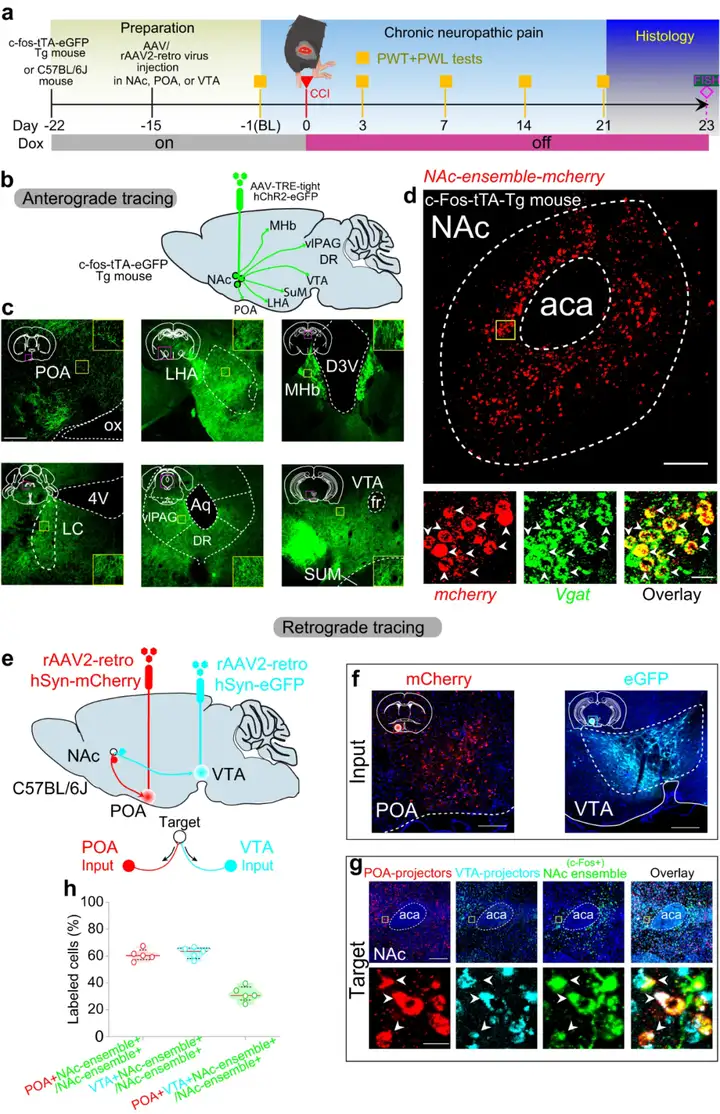
3)解析慢性疼痛和睡眠障碍共病神经元的环路机制。顺行示踪结果表明,NAc脑区慢性疼痛阳性神经元投射到包括腹外侧导水管周围灰质vlPAG、下丘脑外侧区LHA、中缝背核DR、下丘脑视前区POA以及腹侧被盖区VTA等多个核团,其中POA和VTA是脑内调节睡眠与疼痛的关键脑区。此外,逆行示踪结果表明,NAc脑区31.86%的慢性疼痛阳性神经元同时投射到POA和VTA这两个核团。因此,作者着重关注NAc-POA和NAc-VTA神经环路对疼痛以及睡眠-觉醒行为的影响。
图15:NAc脑区慢性疼痛阳性神经元的下游环路
图源:Sun H, et al. Nat Commun. 2023
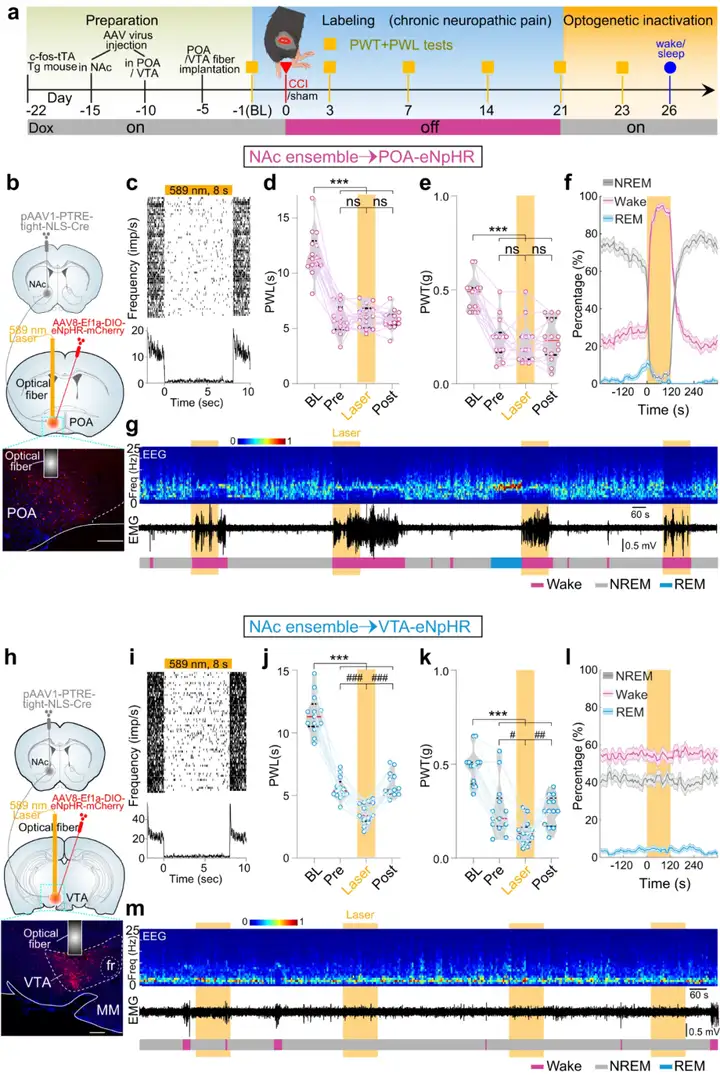
为了选择性激活NAc-POA和NAc-VTA这两条神经环路,作者将顺行跨突触病毒pAAV1-PTRE-tight-NLS-Cre注射到c-Fos-tTA小鼠的NAc脑区,一周后将AAV8-Ef1a-DIO-eNpHR-mCherry注射到POA或VTA中,使得eNpHR-mCherry在NAc脑区慢性疼痛阳性神经元支配的POA或VTA神经元中选择性表达。结果表明,抑制NAc-POA通路促进觉醒、不影响疼痛表型,抑制NAc-VTA通路加剧疼痛表型、不影响睡眠-觉醒行为。
综上,伏隔核NAc中存在同时编码伤害性感受和调控睡眠-觉醒行为的神经元类群,这一神经元类群通过POA及VTA这两条不同的通路分别调控睡眠-觉醒和疼痛样行为实现其双重功能。
图16:抑制NAc-POA/VTA神经环路调节疼痛和睡眠-觉醒行为
图源:Sun H, et al. Nat Commun. 2023
除了慢性疼痛,睡眠障碍还会增加心血管疾病、脑卒中、高血压、代谢性疾病以及痴呆等的风险,同时也会造成焦虑、抑郁、记忆力衰退、免疫力低下等严重问题。例如2024年吉林大学赵华教授、陆军军医大学胡志安教授和任栓成副教授团队在《Current Biology》在线发表的题为“A potentiation of REM sleep-active neurons in the lateral habenula may be responsible for the sleep disturbance in depression”的文献发现,在慢性束缚应激(CRS)诱导的抑郁模型小鼠中REM睡眠增多,同时外侧缰核(lateral habenula, LHb)中REM睡眠阳性的神经元数量及其放电频率均增加。抑制CRS小鼠LHb的REM睡眠阳性神经元不仅减少了REM睡眠的增加,还明显改善了小鼠抑郁样行为。该研究不仅发现LHb中REM阳性神经元调控正常小鼠的REM睡眠,其活性增强在抑郁所致睡眠障碍的产生中也扮演重要角色。
此外,睡眠障碍也可能引起但不限于感染、慢性炎症、中枢神经系统代谢清除紊乱、氧化应激等多种健康问题。例如2024年北京生命科学研究所高级研究员张二荃课题组在《Cell》上发表题为“Prolonged sleep deprivation induces a cytokine-storm-like syndrome in mammals”的文章发现,长时间的睡眠剥夺,小鼠表现出严重的全身性炎症甚至过早死亡。睡眠剥夺期间小鼠全身性炎症表现为细胞因子风暴样症状,伴有多器官功能障碍综合征(MODS),多种促炎细胞因子上调以及循环中性粒细胞积累。这些免疫反应的后果是由前列腺素D2(PGD2)通过ATP结合盒(ABC)亚家族C4转运蛋白(ABCC4)穿过脑血屏障(BBB)的外排增强引起的。该研究揭示了中枢神经系统中PGD2与睡眠相关的变化会对周围免疫系统产生深远的病理影响。
因此,解析睡眠障碍共病的中枢神经机制不仅有助于理解上述疾病与睡眠障碍共病的发病机制,也有利于临床上这类疾病与睡眠障碍共病的诊疗以及药物分子靶点的筛选,也为破解睡眠剥夺引起机体健康问题的机制以及睡眠如何与其他生物过程相互作用提供理论基础。睡眠障碍的发病机制与干预技术研究是中国脑科学计划的组成部分,以最行之有效的方式改善人们的睡眠状况,提高生命质量是睡眠研究者的毕生追求。
信息订阅
我们将及时向您推送最新产品资讯

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK