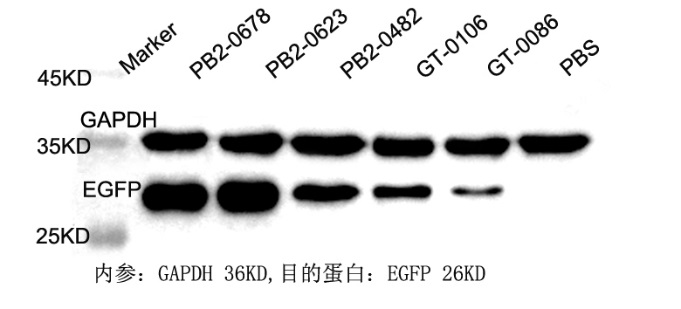
实验原理
蛋白质印迹法(免疫印迹试验)即Western Blot是分子生物学、生物化学和免疫遗传学中常用的一种实验方法,是一种能对蛋白进行定性和半定量分析的方法。其基本原理是通过特异性抗体对凝胶电泳分离的细胞或生物组织样品中的蛋白条带进行着色,通过分析着色的位置和着色深度获得特定蛋白质在所分析的细胞或组织中的表达情况。
该技术与Southern或Northern杂交方法类似,但采用的是SDS-PAGE凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
实验流程
应用
1)定性检测:目的蛋白有无、分子量大小、蛋白修饰
2)半定量检测:目的蛋白表达差异
客户提供:
1)样本分组、编号及背景资料,是否有其他要求说明
2)抗体信息(厂商、货号等);如无抗体可经双方协商后由公司代购
公司提供:
1)原始数据
2)详尽实验报告及结果分析
案例
实验原理
ELISA是酶联接免疫吸附剂测定( Enzyme-Linked Immunosorbnent Assay )的简称。它是继免疫荧光和放射免疫技术之后发展起来的一种免疫酶技术。该技术以免疫学反应为基础,通过将已知的抗原或抗体吸附在固相载体表面,使酶标记的抗原抗体反应在固相表面进行。ELISA技术将抗原、抗体的特异性反应与酶对底物的高效催化作用相结合,具有快速、灵敏、简便、载体易于标准化等优点。在实际应用中,通过不同的设计,具体的方法步骤可有多种, 常见的有直接法(A)、间接法(B)、双抗体夹心法(sandwitich,C)以及间接夹心法(D)等。比较常用的是ELISA双抗体夹心法及ELISA间接法。
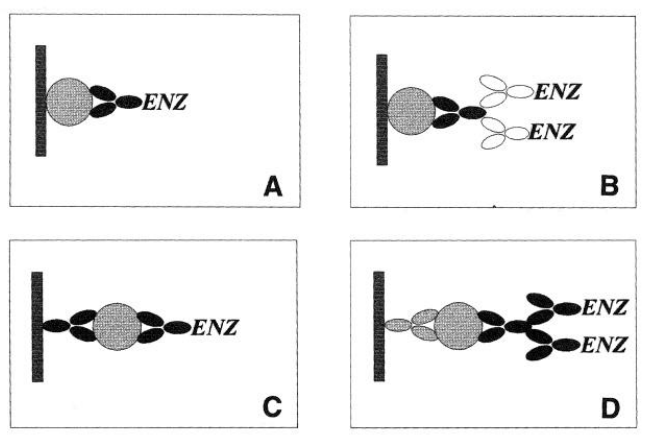
图1.ELISA不同实验方法示意图
实验流程
以双抗体夹心法为例:
应用:生物样本中抗体或抗原性物质的定性定量;
客户提供:
1)样本分组、编号及背景资料,是否有其他要求说明
2)试剂盒信息(厂商、货号等);如无试剂盒可经双方协商后由公司代购
公司提供:
1)原始数据
2)详尽实验报告及结果分析
实验原理
免疫沉淀(Immunoprecipitation,IP)最早作为传统亲和柱色谱的改进方法而开发,是用于抗原检测和纯化的最广泛使用的方法之一。IP的原理非常简单:针对特定靶蛋白的抗体(单克隆或多克隆)与样品中的该靶标(例如细胞裂解液)形成免疫复合物。然后将免疫复合物捕获或沉淀在固定有抗体结合蛋白(例如蛋白A或G)的珠状支持物上,然后将未沉淀在珠子上的其他蛋白洗掉。最后,将免疫复合物从支持物上洗脱下来,并通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析,并常通过蛋白质印迹分析(Western blot)检测以验证抗原。
免疫共沉淀(Co-IP)是IP的一种扩展,它是基于IP反应捕获和纯化主要靶标(即抗原),为捕获样品溶液中与靶标分子具有天然相互作用潜力的其他大分子而开发的一种技术。该技术常用于测定两种目标蛋白质是否在体内结合,也可用于确定一种特定蛋白质的新的作用搭档,已成为研究蛋白质相互作用的经典方法。因此,一个实验被称为IP或Co-IP取决于实验的重点是主要目标(抗原)还是二级目标(与抗原互作的蛋白)。
虽然IP/Co-IP方法在非变性条件实验条件下进行,蛋白质之间的天然相互作用得以最大程度地保留,可以比较真实的反映蛋白质之间的相互作用,但无法确定蛋白质之间的相互作用是直接还是间接的。免疫共沉淀与质谱结合不仅能验证已知蛋白的相互作用,还可以鉴定与目标蛋白互作的未知蛋白,实现对免疫共沉淀结果的进一步确证。
实验流程
应用
1. 特异性纯化靶蛋白
2. 鉴定与靶蛋白相互作用的蛋白质分子,如细胞内转录因子结合互作、各种通路及代谢中蛋白与蛋白互作;
3. 确定两种目标蛋白质是否在体内结合
客户提供:
1)样本分组、编号及背景资料,是否有其他要求说明
2)新鲜蛋白样品、细胞(3-4 E+7)、组织(>0.3-0.5ug)
3)IP、Co-IP级别抗体 (>30ug)及目的蛋白信息
4)产物WB检测的抗体(5-10ug)
5) 阳性对照
公司提供:
1. 所有实验结果图及原始图片
2. 完整实验报告
实验原理
Pull-down技术基本原理与IP/Co-IP相似,利用固相化的、已标记的饵蛋白或标签蛋白(生物素-、polyHis-或GST-)从细胞裂解液中钓出与之相互作用的蛋白。通过Pull down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,一般用于体外转录或翻译体系,如酵母双杂交系统中检测蛋白质之间的相互作用,但未必能真实的反应体内蛋白质之间的相互作用,因为在体内它们不一定空间上有碰到,所以并不意味着在生理条件下一定结合。
以谷胱甘肽-S-转移酶(GST)标签蛋白为例,pull down技术的应用流程如下:1)利用基因重组技术将GST与“诱饵”蛋白构建成融合蛋白后表达纯化;2)利用GST蛋白可以和谷胱甘肽(GSH)相互作用的原理,将纯化的融合蛋白流经固定有谷胱甘肽(GSH)的色谱柱,使诱饵蛋白固定化在色谱柱上;3)将未知蛋白混合液流经上述色谱柱,此时,与“诱饵”蛋白相互作用的蛋白被吸附, 其余“杂质”则随洗脱液流出;4)洗脱色谱柱吸附的蛋白-蛋白互作复合物,经SDS-PAGE、Western blot等进行互作蛋白分析。
应用
1. 证明两种已知蛋白间可能存在的相互作用
2. 寻找与已知蛋白发生相互作用的未知分子
客户提供:
1. 靶蛋白序列;
2. 生物样本;
公司提供:
1. 原始数据、结果图片;
2. 标准实验报告;
3. 含有目的基因的质粒及测序报告。
实验原理
真核生物的基因组DNA以染色质的形式存在。因此,研究蛋白质与DNA在染色质环境下的相互作用是阐明真核生物基因表达机制的基本途径。染色质免疫沉淀技术(Chromatin immunoprecipitation assay, ChIP)是目前唯一研究体内DNA与蛋白质相互作用的方法。它的基本原理是在活细胞状态下固定蛋白质 DNA 复合物,并将其随机切断为一定长度范围内的染色质小片段,然后通过免疫学方法沉淀此复合体,特异性地富集目的蛋白结合的 DNA 片段,通过对目的片断的纯化与检测,从而获得蛋白质与 DNA 相互作用的信息。
近年来,这种技术得到不断的发展和完善,目前不仅可用于检测体内转录因子与DNA的动态作用,还可用来研究组蛋白的各种共价修饰与基因表达的关系(表观遗传学)。此外,与微阵列技术、测序技术等其他方法的结合也大大扩大了其应用范围,在基因表达调控研究中发挥越来越重要的作用。
应用
1.判断在基因组的某一特定位置组蛋白共价修饰类型,以及该共价修饰与基因表达的关系
2.检测体内反式作用因子在基因组上的结合位点、与DNA的动态作用以及功能;
客户提供:
1. IP或ChIP级抗体,抗体量>20ug;
2. 活细胞:1-2E+7;
3. 新鲜组织:组织量>0.1-0.3g;
4. 验证基因信息
公司提供:
1. WB检测抗体效价与特异性结果图;
2. 染色体断裂图;
3. 完整实验报告;
实验原理
RIP(RNA Binding Protein Immunoprecipitation Assay,RNA结合蛋白免疫沉淀)实验技术是一种研究细胞内RNA与蛋白的结合互作实验技术,在表观上研究的是转录后的调控技术。基本原理是运用靶蛋白的抗体,将蛋白与结合的RNA复合物沉淀下来,后续纯化得到RNA,用于Q-PCR检测或高通量测序分析,验证预测结合的靶标RNA或探索结合调控的标志物RNA分子。RIP可以看成是普遍使用的染色质免疫沉淀(ChIP)技术的类似应用,但由于研究对象是RNA-蛋白复合物而不是DNA-蛋白复合物,RIP实验的优化条件与ChIP实验不太相同(如复合物不需要固定,RIP反应体系中的试剂和抗体绝对不能含有RNA酶,抗体需经RIP实验验证等等)。RIP技术下游结合microarray技术被称为RIP-Chip,帮助我们更高通量地了解癌症以及其它疾病整体水平的RNA变化。
应用
1.适用于人,大鼠,小鼠等哺乳动物的研究,探讨与验证体内蛋白与RNA结合互作转录后调控研究
2.适用于各种RNA的研究,如:mRNA,LncRNA,miRNA,circle RNA等
3.适用于临床各种组织标本的探讨研究,例:癌组织与癌旁组织,通过RIP实验获取得到的样品产物RNA,高通量测序,筛选靶标分子或分子标志物。
客户提供:
1. IP或ChIP级抗体,抗体量>20ug;
2. 活细胞:1E+8;
3. 新鲜组织:组织量>1-3g;
4. 验证基因信息
公司提供:
1. WB检测抗体效价与特异性结果图;
2. 完整实验报告;
信息订阅
我们将及时向您推送最新产品资讯

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK