2025-12-25 阅读量:138
海马下托区是海马结构的主要输出区域,由下托本体(subiculum proper,Sub)和前下托(prosubiculum,PS)组成。Sub与PS在下托区内占据不同的解剖位置,并沿背腹轴具有清晰的分子边界。近年来的研究表明,下托区神经元在转录组分类、神经环路连接以及放电模式等方面表现出高度异质性。由于轴突导向分子的差异,Sub与PS分别与不同的脑区建立特异性连接:Sub接收来自远端CA1的输入,并投射至压后皮质(Rsp)、乳头体等脑区;而PS接收来自近端CA1的输入,并投射至外侧隔核等特定核团。Sub与PS的高度异质性决定了它们在多种行为中的不同功能。值得注意的是,单细胞RNA测序鉴定出一种新的下托区神经元类型,定位于Sub和PS的多形层(polymorphic layer,po)。该亚型在形态学和放电特性上均有别于Sub和PS中的锥体神经元。迄今为止,关于海马发育的研究主要集中于CA1-CA4区域,而对下托区,尤其是其神经元亚型命运决定的分子调控机制仍知之甚少。
近日,复旦大学丁玉强教授/宋宁宁副研究员团队在Journal of Advanced Research(IF=13)在线发表研究论文“Essential function of Nr4a2 in subicular development and social novelty”,系统揭示了转录因子Nr4a2在海马下托神经元命运决定和小鼠社交障碍中的关键作用。
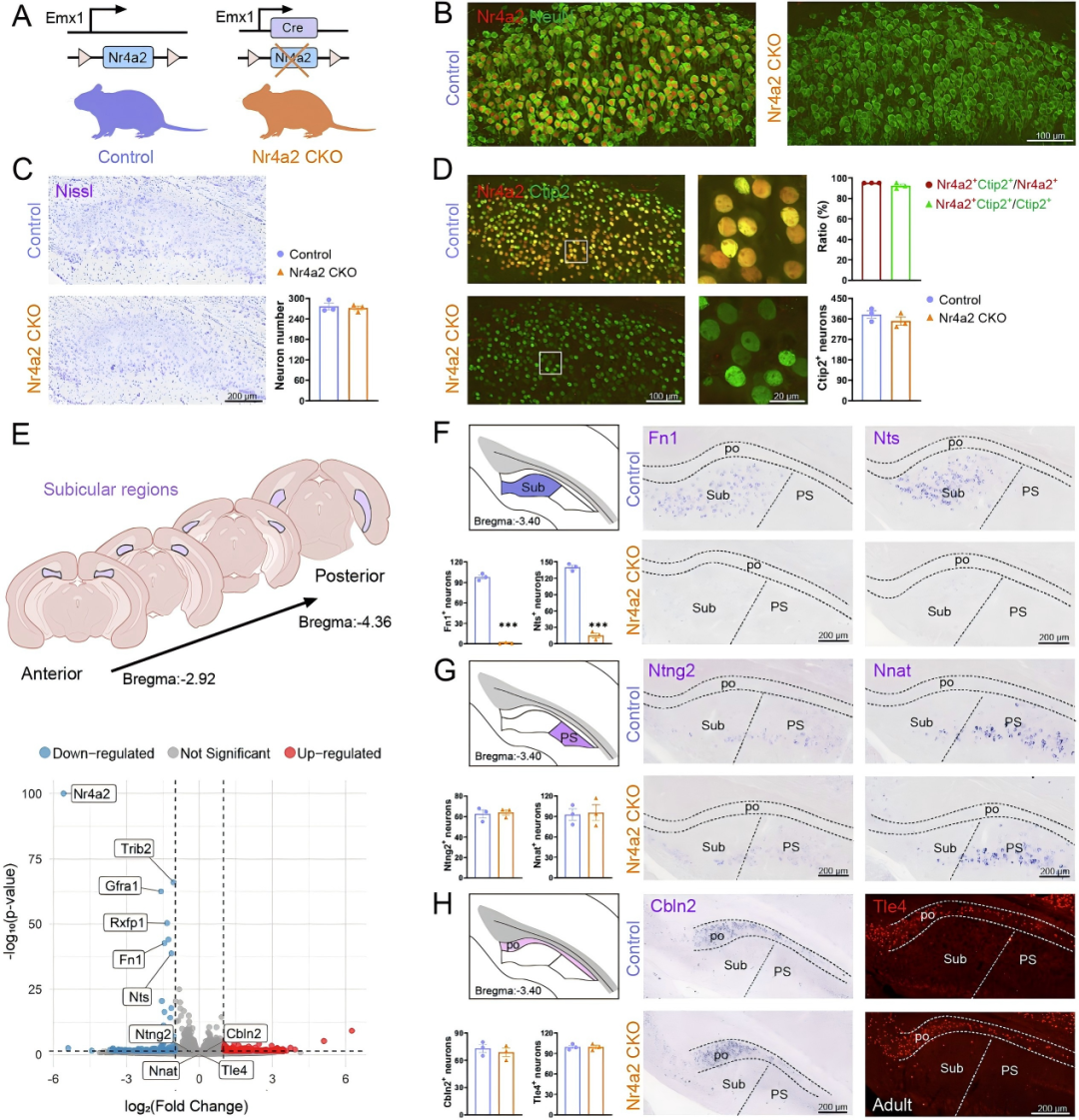
作者前期研究表明,Nr4a2在海马下托区高表达。为探究其功能,研究人员利用Emx1-Cre工具鼠介导的Cre-LoxP重组系统,构建了Nr4a2基因条件性敲除(CKO)小鼠模型,结合转录组测序技术发现:P7(出生后7天)Nr4a2缺失会导致Sub神经元的特异性基因(如Fn1、Nts)表达显著缺失,但不影响PS、po神经元特异性基因表达;后续原位杂交及免疫染色验证结果与转录组测序数据一致(成年期)。此外,在Nr4a2缺失后,下托神经元的细胞构筑不受影响,且神经元存活状态正常。综上,这些研究结果证实Nr4a2在Sub神经元分化过程中发挥特异性关键调控作用。
图1.Nr4a2对Sub神经元分子身份的建立具有重要作用。
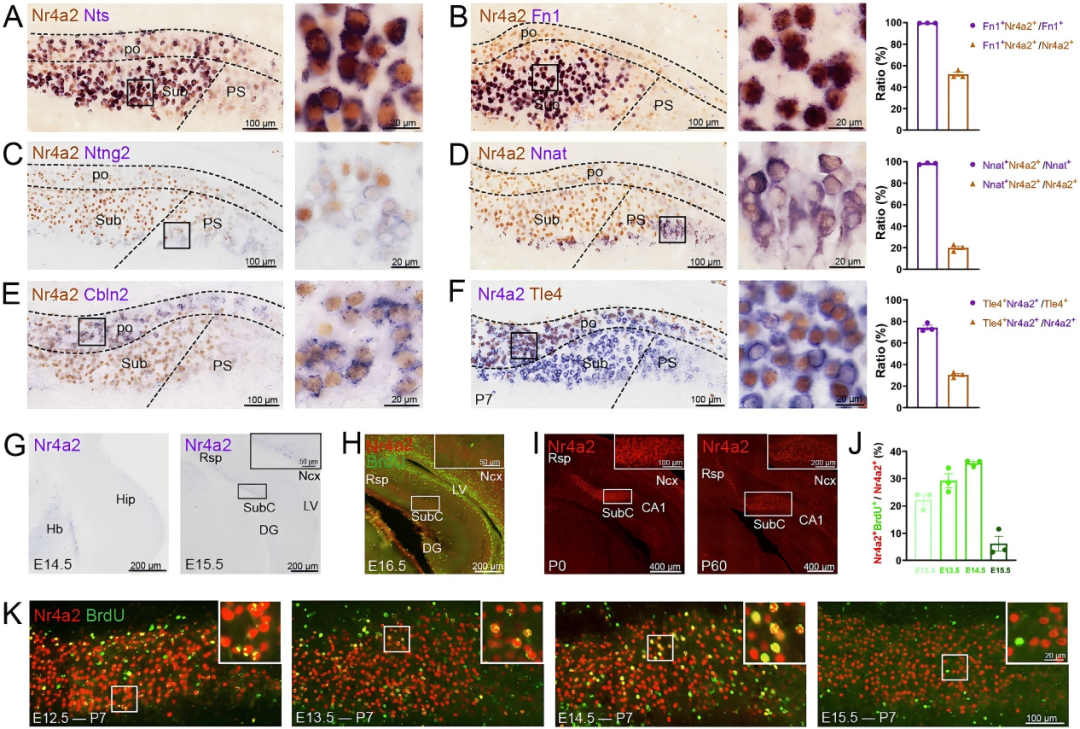
接下来,作者对Nr4a2在下托神经元中的表达定位开展了精细化分析。通过Nr4a2免疫染色与Sub、PS、po三类神经元亚型特异性分子标记(Sub神经元:Fn1、Nts;PS神经元:Ntng2、Nnat;po神经元:Cbln2、Tle4)的原位杂交联合检测,证实Nr4a2在这三类下托神经元群体中均有广泛表达。进一步通过Nr4a2与兴奋性神经元标记物(Slc17a7、Slc17a6)及抑制性神经元标记物(Gad65、Gad67)的共标记实验显示:几乎所有Nr4a2阳性神经元均表达Slc17a7和Slc17a6,且未观察到与Gad65、Gad67的共定位信号。综上表明,Nr4a2在三类下托神经元中均呈阳性表达,且这些神经元均具备兴奋性神经元属性。
从表达时序来看,Nr4a2+下托神经元的发生峰值出现在胚胎第14.5天(E14.5,神经前体细胞增殖高峰),而Nr4a2在下托区的mRNA表达始于E15.5,此后其蛋白持续高表达并维持至成年期。这一表达特征提示,Nr4a2在Sub神经元的增殖后分化阶段即启动表达,进而在其发育分化过程中发挥关键调控作用;同时,基于其成年期仍持续高表达的特性,Nr4a2可能还参与成年期Sub神经元的功能稳态维持。
图2.Nr4a2在下托三种类型的神经元中均有表达。
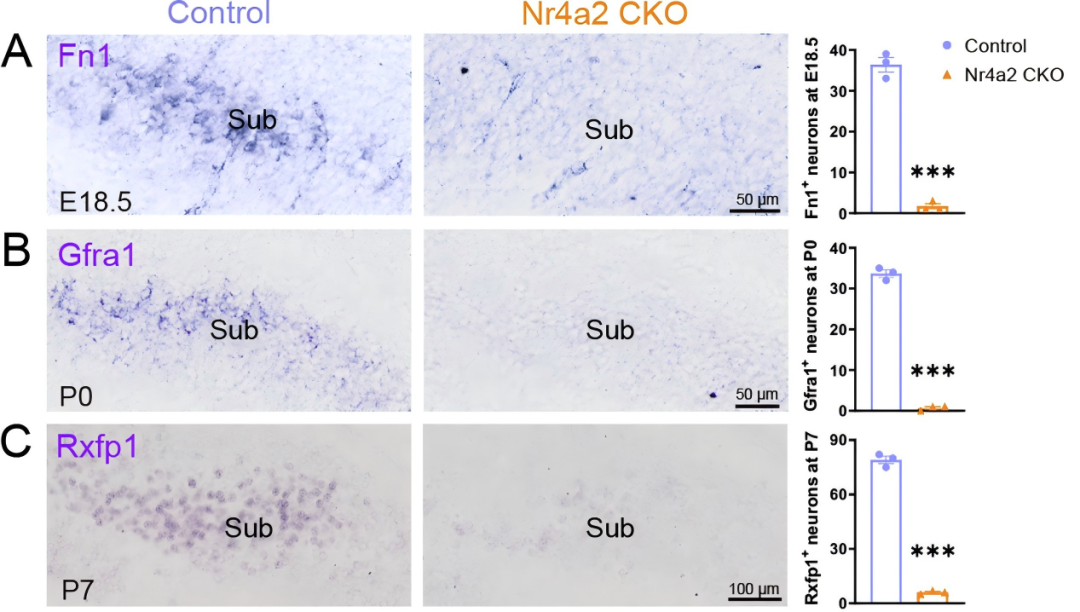
转录因子在基因表达调控中通常既参与基因表达的起始,也可在细胞成熟阶段调控基因表达的维持。作者通过对发育早期(E18.5、P0及P7)Nr4a2 CKO小鼠Sub神经元特异性基因的染色实验发现,Sub神经元特异性基因Fn1、Gfra1及Rxfp1在Nr4a2缺失后,其起始表达显著受损。上述基因在发育早期的表达缺失表明,Nr4a2对Sub神经元特异性基因的起始表达具有核心调控作用。
图3.Nr4a2是启动Sub神经元特异性基因表达所必需的。
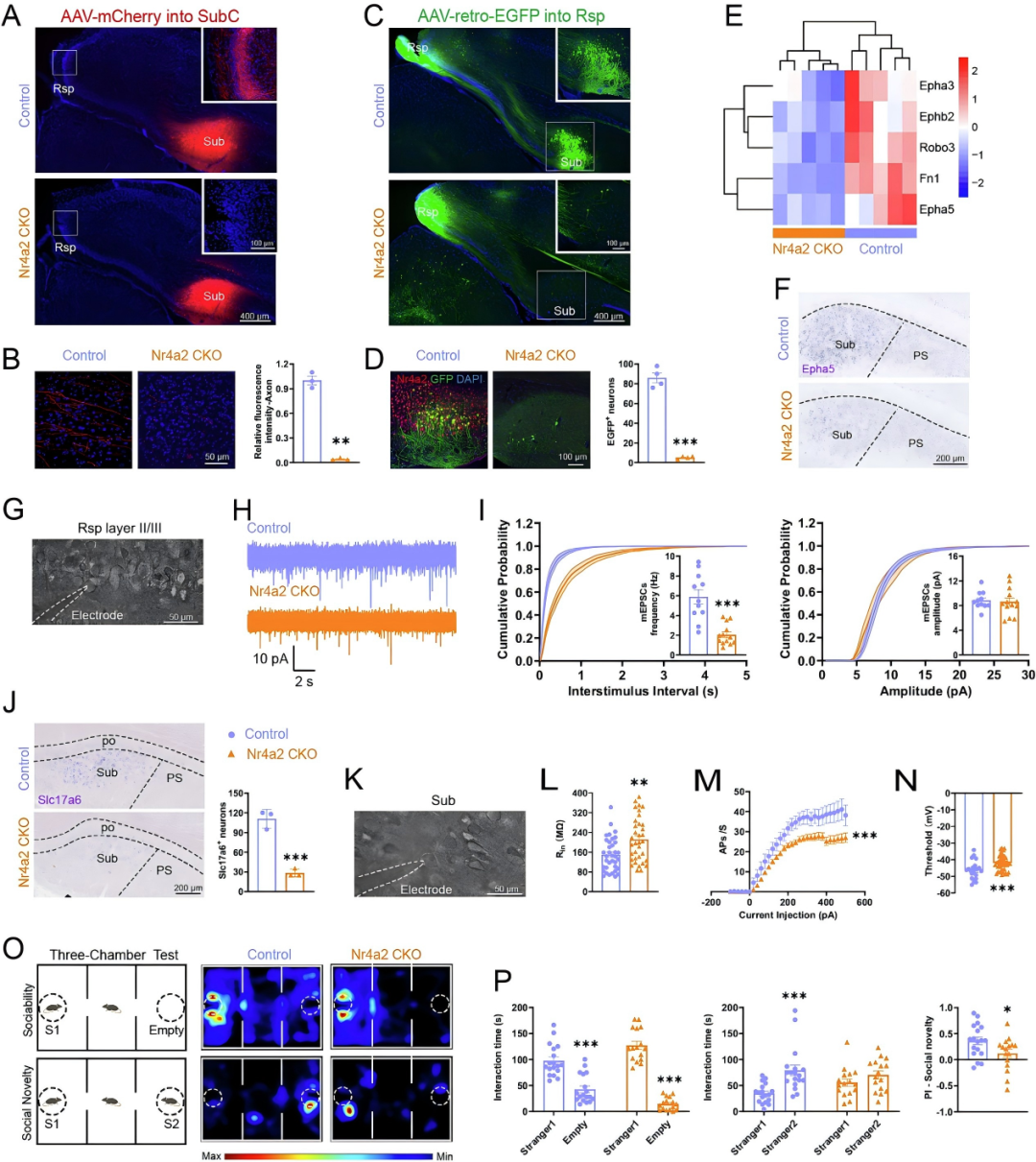
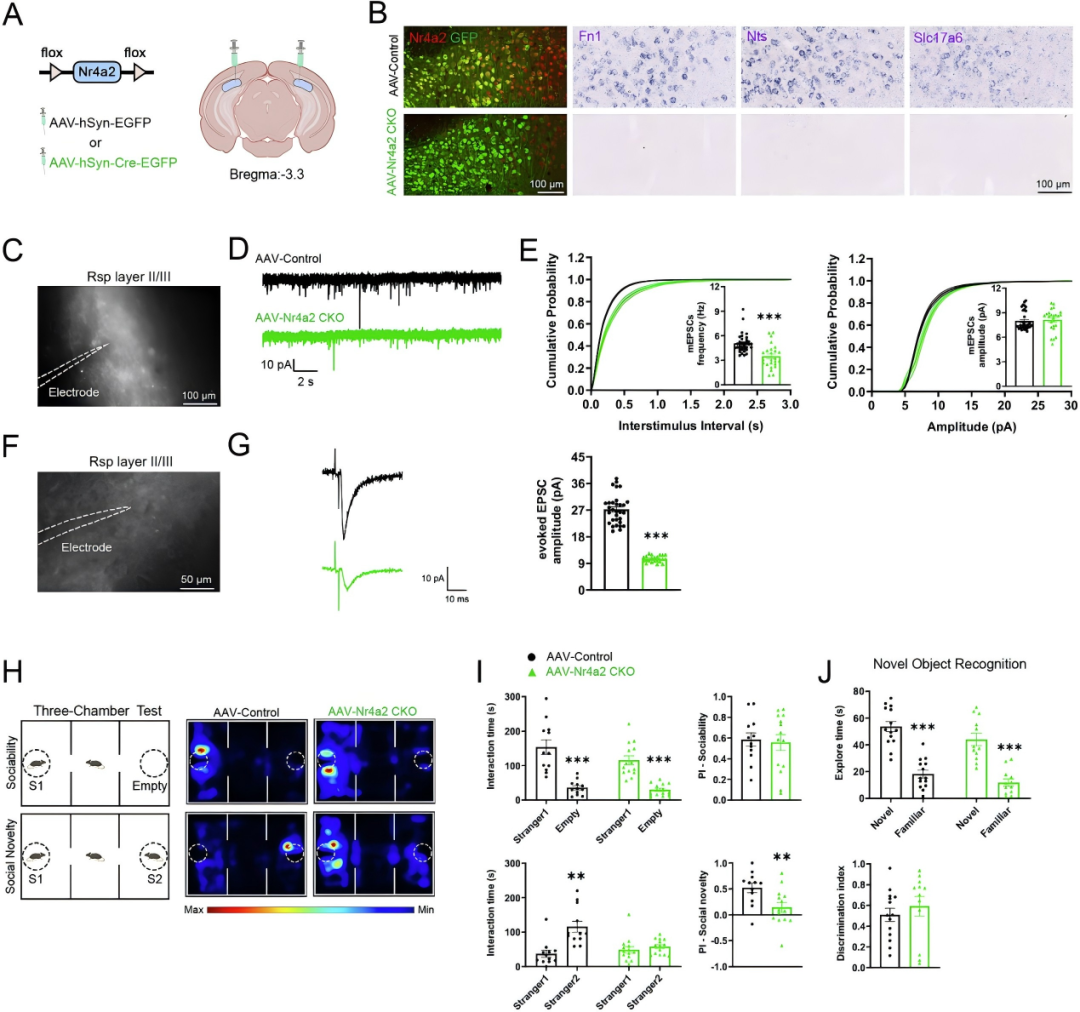
压后皮质(Rsp)与Sub之间存在高度致密的投射连接,研究发现,Nr4a2缺失会显著降低Sub-Rsp轴突投射密度,且Rsp第Ⅱ-Ⅲ层神经元的微小兴奋性突触后电流(mEPSC)频率也明显降低,表明Sub-Rsp环路的突触传递功能严重受损,进而削弱了Sub-Rsp之间的信息整合与传递,这可能是导致小鼠出现显著社交新颖性识别障碍的关键原因。
图4.Nr4a2 CKO小鼠Sub-Rsp环路受损,并伴随社交新颖性缺陷。
研究人员进一步在成年Nr4a2flox/flox(Nr4a2f/f)小鼠中,通过AAV介导的Cre重组酶特异性敲除Sub神经元中的Nr4a2。结果显示,Sub神经元特异性基因的表达显著降低,小鼠表现出社交新颖性识别异常[AAV-Nr4a2 CKO小鼠在新物体识别测试中的辨别指数(DI)与AAV对照组相当,表明其物体辨别能力正常]。对Rsp第Ⅱ-Ⅲ层神经元mEPSC的电生理记录显示,AAV-Nr4a2 CKO小鼠的mEPSC频率显著降低,提示Sub-Rsp连接存在缺陷;在光遗传学诱发EPSC记录中,光刺激Sub来源的轴突末梢后,Nr4a2缺失小鼠Rsp神经元的诱发性兴奋性突触后电流(evoked EPSC)振幅显著减小,表明Sub-Rsp的突触传递功能受损。上述结果表明成年期Sub神经元中Nr4a2的缺失可导致Sub-Rsp环路突触传递功能异常,最终引发小鼠的社交新颖性识别缺陷。
图5.成年期Sub神经元特异性Nr4a2缺失同样损害Sub神经元特异性基因表达、破坏Sub-Rsp环路功能,并最终导致社交新颖性识别缺陷。
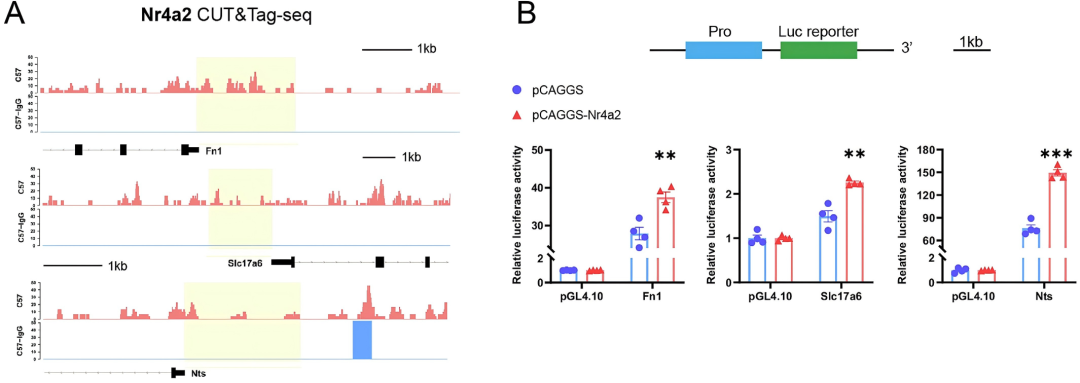
以上结果表明Nr4a2同时参与Sub区神经元身份的“建立”与功能“维持”。分子机制研究进一步显示,Nr4a2可直接结合Sub神经元特异性基因的启动子区,进而激活其表达。
图6.Nr4a2可直接结合Sub神经元特异性基因的启动子,进而激活这些基因的转录。
总结
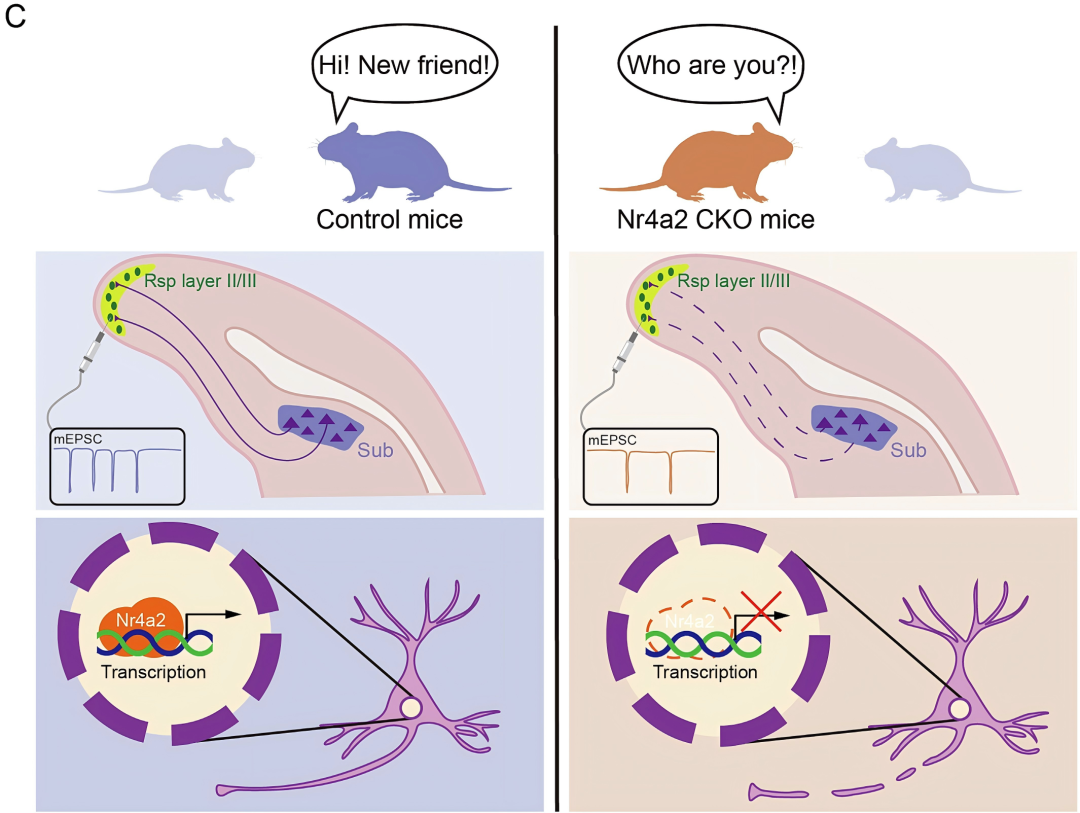
此研究系统阐明了Nr4a2在Sub神经元身份建立与功能维持中的重要作用,揭示了Sub神经元发育、相关神经环路与行为之间的内在关联。
图7.Nr4a2调控Sub神经元特化与社交新颖性的机制模式图。
作者介绍
复旦大学脑科学研究院博士研究生刘熙玥、陶赟超,以及复旦大学实验动物中心实验师章琼为共同第一作者;复旦大学实验动物中心丁玉强教授和宋宁宁副研究员为共同通讯作者。该研究得到科技部科技创新2030“脑科学与类脑研究”重大项目、国家自然科学基金、上海市自然科学基金等资助。
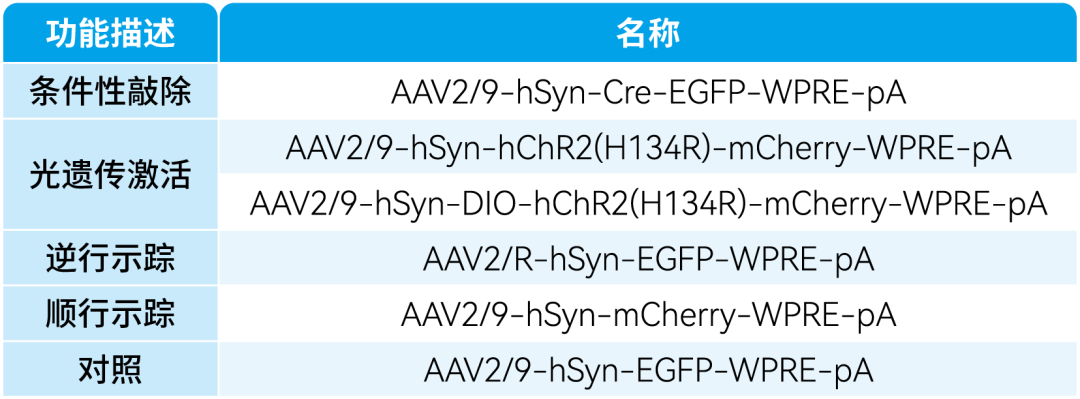
本文使用的病毒产品均来自枢密科技,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK