2025-12-01 阅读量:237
在基因治疗领域,重组腺相关病毒(rAAV)凭借其低免疫原性、低毒性、转基因表达持久且组织趋向性广泛的优势,已成为治疗神经系统、眼部、肌肉及肝脏疾病的主流载体平台。在许多中枢神经系统(CNS)相关疾病中,实现脑和/或脊髓中广泛且均匀的转导对于有效的基因治疗至关重要,尽管静脉注射具有分布广泛、无侵入性的优势,但天然AAV衣壳主要靶向肝脏,在其他器官中的转导效率有限。即便腺相关病毒9型(AAV9)因具备一定穿透血脑屏障(BBB)的能力,已被广泛应用于临床前研究和临床试验,但系统性递送时仍面临两大核心瓶颈:一是仍会受到BBB的阻碍,即使采用高全身剂量或向CNS直接注射等侵入性方式,治疗效果依然有限;二是高剂量给药常导致肝脏中病毒载量过高,可能引发与肝毒性相关的不良事件。
为解决这些问题,优化衣壳工程策略至关重要,而定向进化已成为改造AAV趋向性的核心方法,其中的关键技术肽展示,通过在VP3衣壳蛋白亚基的可变区(VR)引入随机氨基酸片段,可改变病毒颗粒的多种表面特性,进而调整其细胞趋向性。该方法区别于理性设计和机器学习,无需依赖AAV生物学先验知识与海量数据集,凭借随机多样化改造与针对性筛选,即便在作用机制未知的情况下也能显著提升载体功能。利用肽展示文库对天然AAV9衣壳进行定向进化,已成功开发出多种CNS基因递送优质变体。然而,现有策略多聚焦于单一位点的插入或替换,存在一定局限性,探索更多位点和更多类型的序列改造,可能有助于发现转导效率更高、肝脏靶向性更低的新型CNS靶向AAV。
近日,西湖大学生命科学学院的马丽佳特聘研究员团队在Molecular Therapy-Methods & Clinical Development期刊上发表了题为“Directed evolution of novel AAV variants using the MCMS library for enhanced CNS tropism and reduced liver targeting in mice”的研究成果,该研究成功开发出多衣壳突变策略(MCMS)文库,并筛选出能够高效靶向CNS的AAV变体——BRC06。研究团队聚焦于AAV9衣壳蛋白VP3的VR-VIII区域(该区域比传统改造的VR-IV更易容纳肽插入),创新性整合“随机肽插入”与“多位点肽替换”两大策略,并进一步细分为8种具体突变方案,最终构建形成序列多样性丰富的MCMS文库。通过小鼠体内定向进化筛选,团队发现核心变体BRC06表现尤为突出:在C57BL/6J小鼠中,其脑内转基因表达量比经典变体AAV.PHP.eB高1.9倍;在BALB/c小鼠中,相比AAV9脑转导效率提升1482倍,同时肝脏脱靶表达降低92倍。机制研究表明,BRC06依赖经典AAV受体(AAVR)介导细胞进入,同时需Acp2[编码溶酶体酸性磷酸酶2(ACP2)]等辅助因子促进胞内转运,进一步解释了其高效靶向特性。BRC06的发现为CNS疾病的基因治疗提供了“高效低毒”的新型载体,其跨品系兼容性也为临床转化奠定了基础。此外,MCMS文库还可广泛应用于其他组织靶向性AAV变体的筛选,为基因治疗载体的开发提供了全新技术范式。

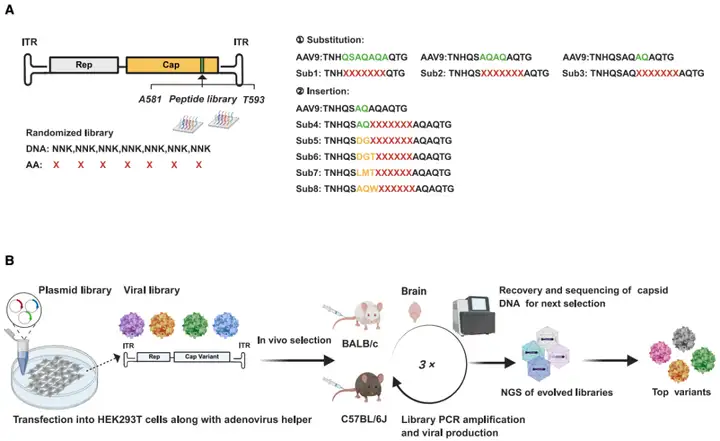
1、MCMS文库的设计与构建
为获得能更高效靶向CNS的AAV衣壳变体,研究团队以AAV9为基础,通过在VP3衣壳蛋白亚基的VR-VIII(582-592位氨基酸)区域引入突变,构建了MCMS文库,每种衣壳变体均在VR-VIII区域包含肽插入或肽替换序列,确保改造序列暴露于衣壳表面,同时扩大序列多样性。具体而言,在MCMS文库的替换策略中,用7聚体随机肽段替代AAV9原始序列中AQ(589-590位)、AQAQ(587-590位)或QSAQAQA(585-591位)残基;插入策略则是将随机序列插入VR-VIII区域,随机序列的N端侧翼残基分为两类:一类是AAV9原有的AQ(587-588位)残基,另一类是已知变体来源残基,如AAV-9P31的AQW,AAV.PHP.eB的DG和DGT,以及AAV-MG1.1的LMT,这些残基已被证实能增强AAV的转导效率。
文库构建完成后,研究人员通过3轮小鼠体内筛选进行优化:以静脉注射方式将文库病毒导入C57BL/6J和BALB/c小鼠,每轮注射后2周提取全脑DNA,利用聚合酶链式反应(PCR)回收衣壳文库序列,将扩增产物重新克隆至质粒骨架构建下一轮进化所需的AAV衣壳文库,从而逐步富集CNS靶向性优异的衣壳变体。
图1. 文库构建与衣壳进化
2、基于MCMS文库的体内进化:筛选出CNS靶向衣壳变体家族
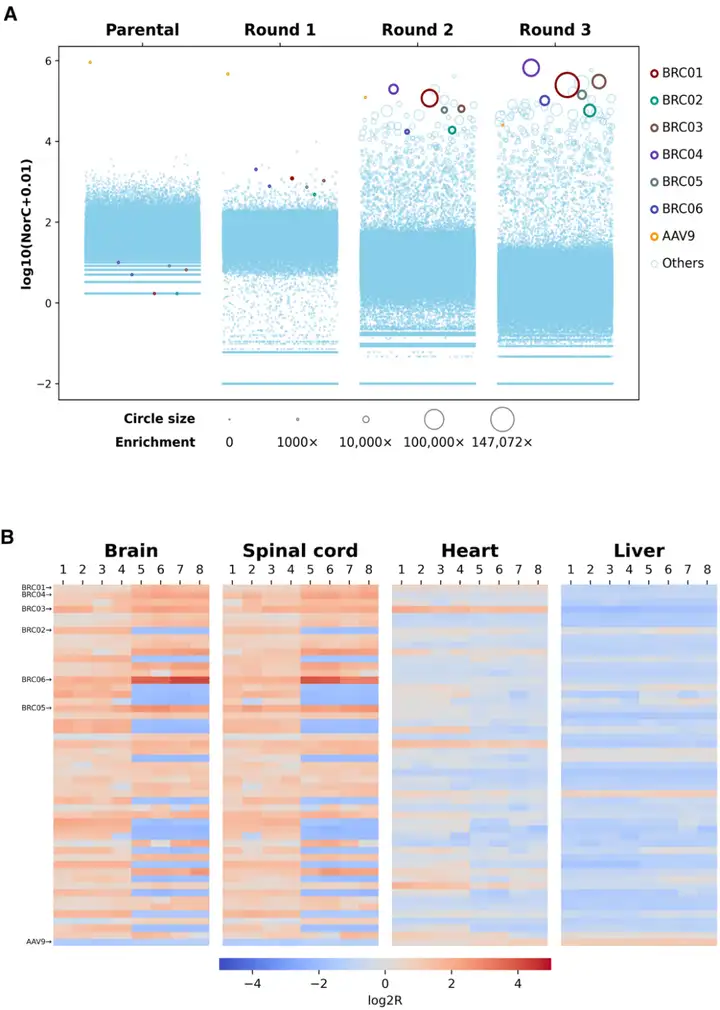
为评估MCMS文库的筛选效率,研究团队通过下一代测序(NGS)分析每轮筛选后脑组织中衣壳变体的多样性与富集情况。结果显示:第一轮筛选淘汰了约99%的衣壳变体,独特序列数量从亲本质粒文库的118,164,488个降至脑组织中的775,650个;第二轮和第三轮筛选进一步淘汰74%的剩余变体,最终保留198,931个独特序列。
为量化变体的CNS靶向能力,研究团队定义了两个关键指标:一是“富集分数”,即变体在进化后文库中的读数百分比[通过平均标准化读数计数(AvgNorC)计算]与亲本文库中的读数百分比的倍数变化,反映变体在脑组织中的相对丰度变化;二是“log2比值(log2R)”,即变体在组织中的AvgNorC与其在对应轮次质粒文库中的AvgNorC的比值,以log2尺度表示,反映其转导效率。结果显示,多个变体表现出显著的CNS富集,其中优势变体BRC01在亲本文库中的富集分数高达147,072倍。基于“高富集分数+高log2R值”的双重标准,团队最终筛选出6个靶向CNS的脑衣壳(BRC)候选变体(BRC01~BRC06),筛选流程如下:首先根据富集分数对所有变体排序,优先选择富集分数最高的BRC01;在排名前50的变体中,根据平均log2R值筛选出BRC03、BRC04、BRC05和BRC06;此外,考虑到BRC02在C57BL/6J小鼠中具有较高的log2R值,将其作为品系特异性对照,以验证筛选策略在两种小鼠品系中的有效性。
图2. 经3轮筛选后,通过NGS分析鉴定出BRC变体
3、BRC变体在C57BL/6J小鼠中表现出高CNS靶向性
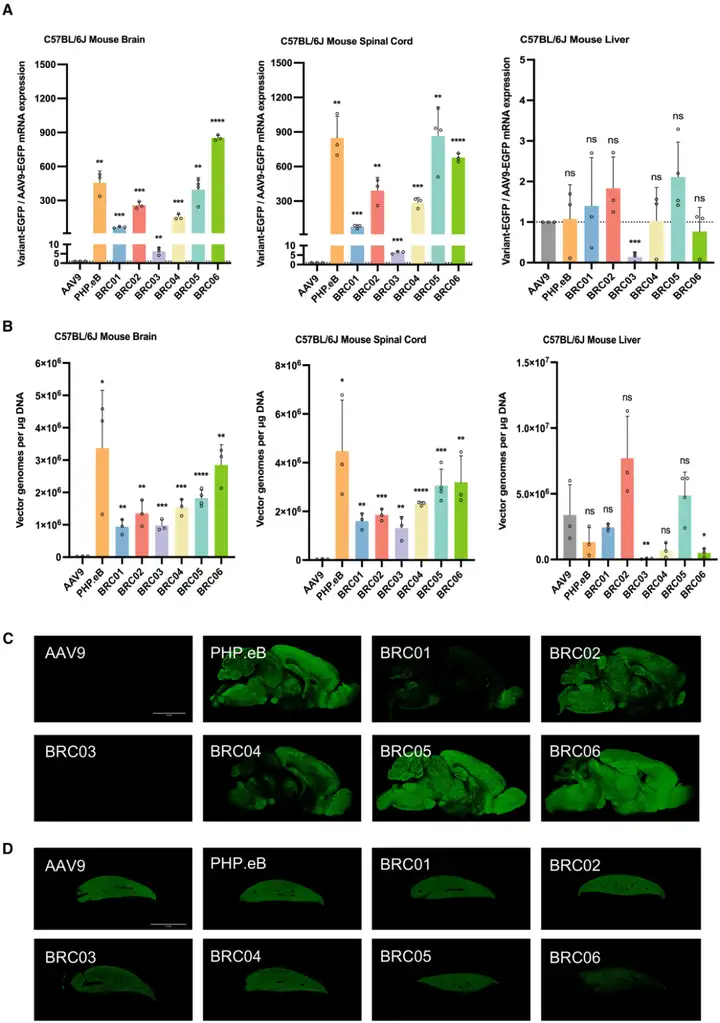
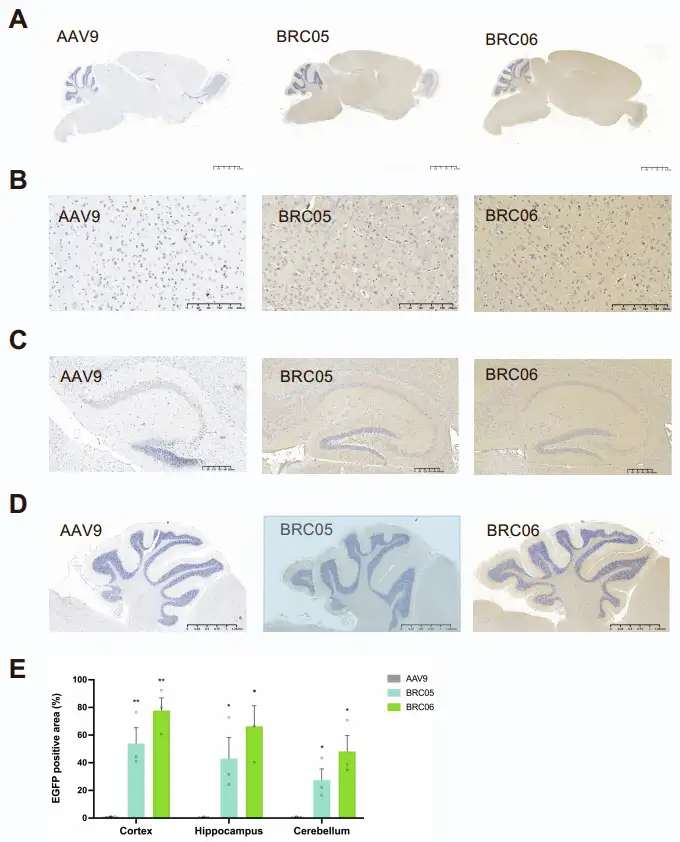
为验证BRC候选变体的CNS靶向能力,研究团队以AAV9为对照,用AAV9及BRC变体包装由广谱启动子CAG驱动的单链(ss)EGFP(增强型绿色荧光蛋白)报告载体(ssAAV-CAG-EGFP),并以5×10¹¹ vg/只的剂量静脉注射到C57BL/6J小鼠体内。3周后处死小鼠,收集组织样本,评估AAV的生物分布和转基因表达情况。
EGFP mRNA表达水平定量结果显示,所有BRC变体在CNS组织中的转导效率均显著优于AAV9:大脑中,BRC06的EGFP mRNA表达比AAV9高852倍,BRC05高397倍,二者EGFP mRNA表达水平与已报道的高效CNS靶向变体AAV.PHP.eB相当或更高;脊髓中,BRC05的mRNA表达比AAV9高865倍以上,与AAV.PHP.eB相当,其他变体的表达水平比AAV9高6-677倍不等。另外,所有BRC变体在肝脏中的mRNA表达水平均低于或与AAV9相当,表明其肝脏靶向性显著降低。
AAV的生物分布模式与mRNA表达趋势一致:与AAV9(脑内载体基因组数量<2.62×10⁴ vg/μg DNA)相比,BRC变体在小鼠大脑和脊髓中的载体基因组数量显著增加(9.38×10⁵~2.85×10⁶ vg/μg DNA)。其中,BRC06表现最优——脑内载体基因组数量达2.85×10⁶ vg/μg DNA,脊髓中达3.19×10⁶ vg/μg DNA,与AAV.PHP.eB(脑内为3.37×10⁶ vg/μg DNA)相当;而其肝脏载体基因组数量(5.08×10⁵ vg/μg DNA)比AAV.PHP.eB(1.33×10⁶ vg/μg DNA)低2.61倍,证实其在高效靶向CNS的同时,能更好地规避肝脏蓄积。
免疫荧光分析进一步验证了EGFP的表达:BRC02、BRC04、BRC05、BRC06在小鼠大脑皮层、小脑、海马体、丘脑、脑干等多个区域均表现出强且广泛的EGFP表达,与AAV.PHP.eB相当或更强;尽管BRC06在小脑中的EGFP表达略低于AAV.PHP.eB,但其转导效率仍显著高于AAV9。而在肝脏中,BRC03和BRC06的EGFP表达显著低于AAV9,进一步证实其肝脏靶向性降低。
图3. BRC变体在C57BL/6J小鼠中的个体表征
4、BRC06变体在BALB/c小鼠中表现出更优的CNS靶向性和更低的肝脏靶向性
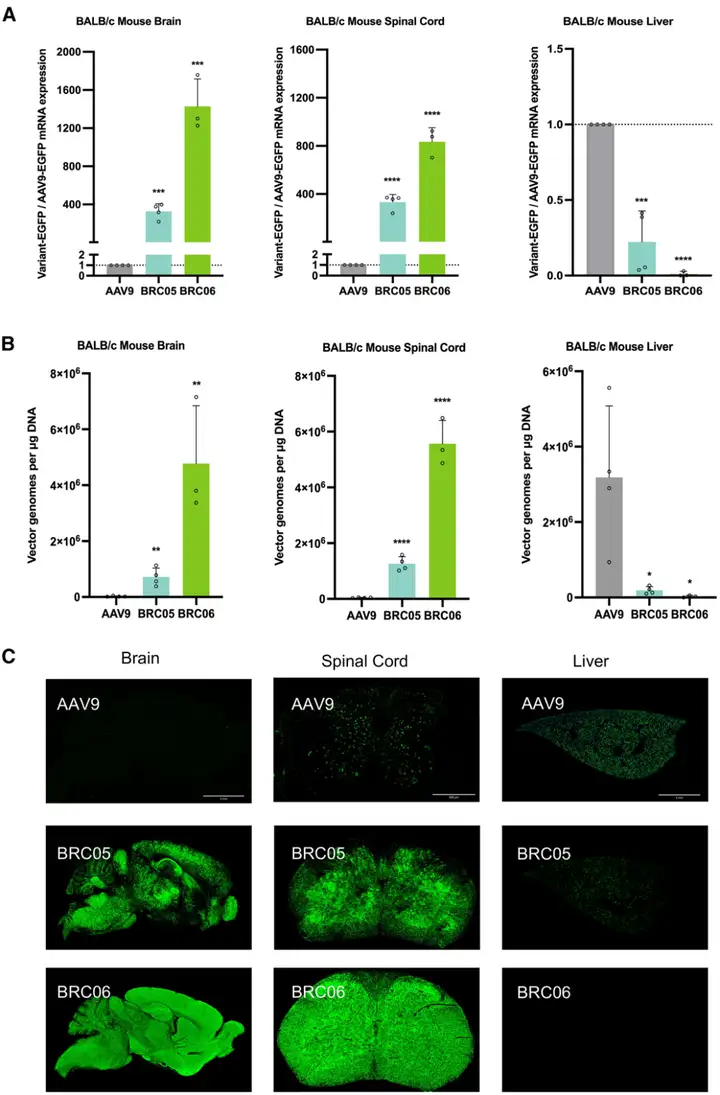
此前研究发现,CNS靶向的AAV.PHP.B变体存在品系依赖性——仅在C57BL/6J小鼠中具有高转导效率,而在BALB/c小鼠中无法达到类似效果。为验证BRC变体的跨品系适用性,研究团队首先评估了BRC02(C57BL/6J中表现出强转导能力)在BALB/c小鼠中的表现,发现其CNS转导效率显著降低,证实了品系依赖性的存在。
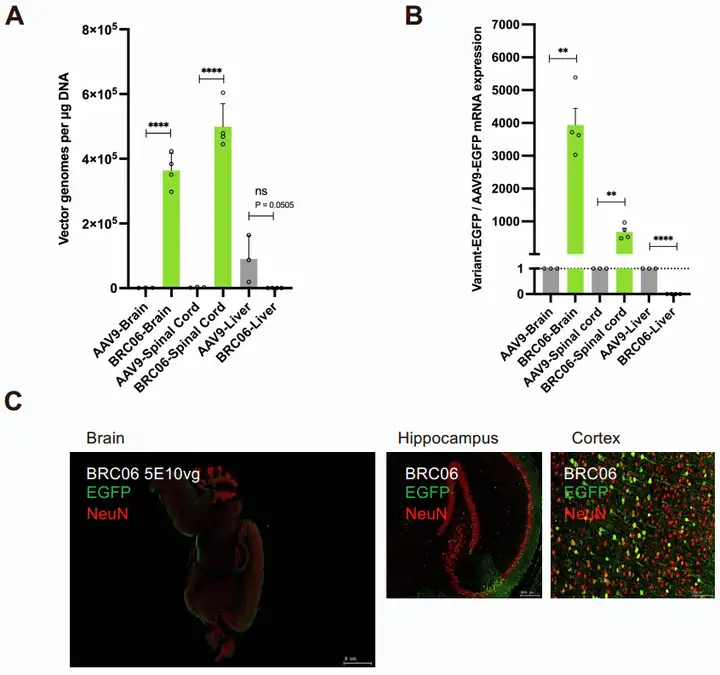
基于上述发现,团队随后选择在C57BL/6J小鼠中表现优异的BRC05和BRC06变体,在BALB/c小鼠中进行深入验证。以5×10¹¹ vg/只的剂量通过静脉注射向BALB/c小鼠递送BRC05-EGFP或BRC06-EGFP,注射3周后收集组织,评估AAV的效率、趋向性和生物分布。结果表明,BRC05和BRC06在BALB/c小鼠中的表现远超AAV9:大脑中,BRC05的EGFP mRNA表达比AAV9高328倍,BRC06高1428倍;脊髓中,BRC05高333倍,BRC06高834倍;而肝脏中,与AAV9相比,BRC05的mRNA表达降低4倍,BRC06降低92倍,展现出极强的CNS靶向与肝脏脱靶规避能力。
载体基因组分布结果进一步证实:BRC05和BRC06在小鼠大脑和脊髓中呈现显著的载体基因组富集,生物分布浓度范围为7.15×10⁵~5.57×10⁶ vg/μg DNA。其中,BRC06在大脑(4.77×10⁶ vg/μg DNA)和脊髓(5.57×10⁶ vg/μg DNA)中的载体递送效率最优,同时在肝脏中保持最低的载体基因组拷贝数(约5.59×10⁴ vg/μg DNA),优于AAV9(脑和脊髓均<4.40×10⁴ vg/μg DNA,肝内高积累)。免疫荧光与免疫组化检测也进一步验证,BRC05和BRC06在小鼠大脑、脊髓中均呈现强且广泛的EGFP表达,对大脑皮层、海马体及小脑皮层浦肯野细胞层、分子层的转导效果显著;肝脏中BRC05的EGFP表达明显降低,BRC06则几乎无表达,充分印证了BALB/c小鼠中BRC06更强的CNS趋向性和更低的肝脏靶向性。
图4. BRC05和BRC06变体在BALB/c小鼠中的表征
图5. 免疫组织化学染色评估AAV9/BRC05/BRC06-EGFP在脑内的蛋白表达
考虑到临床应用中需降低病毒剂量以减少副作用,研究团队进一步评估了低剂量(5×10¹⁰ vg/只)下BRC06在BALB/c小鼠中的表现。结果显示,小鼠无体重下降或异常死亡;注射3周后收集组织,分析载体生物分布和EGFP表达,DNA和RNA定量结果显示,在此低剂量下,BRC06仍能在CNS中保持高效的基因递送和表达,以及在肝脏中的低表达,总体优于AAV9。
图6. 低剂量注射BRC06的BALB/c小鼠表征
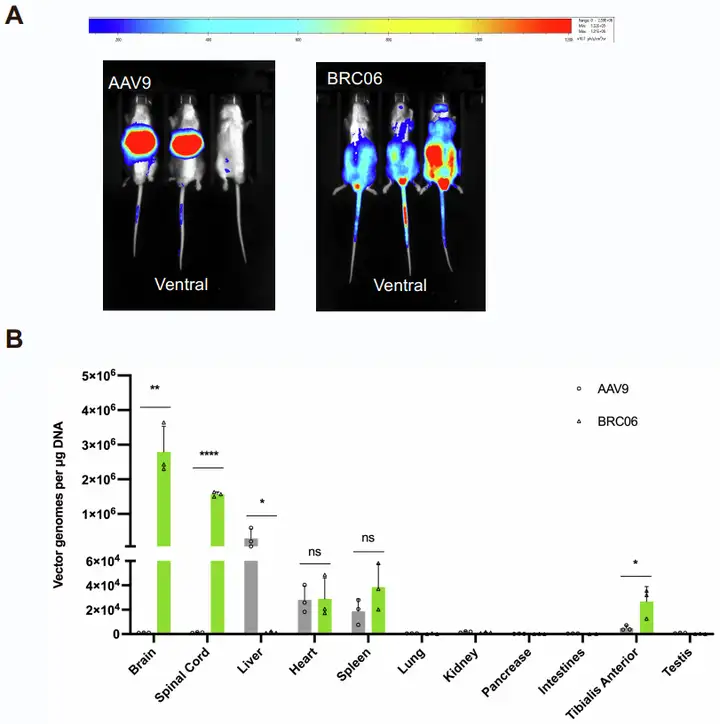
为规避EGFP过量表达可能的神经毒性并表征BRC06的体内组织分布,研究团队接下来用BRC06和AAV9衣壳包装CAG启动子驱动的荧光素酶报告基因,并以1×10¹¹ vg/只的剂量静脉注射到BALB/c小鼠体内。结果显示,该剂量下注射BRC06的小鼠无体重下降、异常死亡,1周即可观察到转基因表达。4周后的组织定量分析显示:与AAV9相比,BRC06变体的肝脏积累减少,大脑荧光表达更强;BRC06和AAV9在心脏、脾脏、肺、肾脏、肠道、胰腺和睾丸中的拷贝数无显著差异。这些结果与在C57BL/6J和BALB/c小鼠中进行的EGFP注射实验一致,进一步证实了BRC06显著的CNS靶向性和更强的组织特异性。
图7. BALB/c小鼠经系统性注射后,BRC06变体的组织分布
5、新型替换策略助力神经趋向性变体(包括BRC05和BRC06)的发现
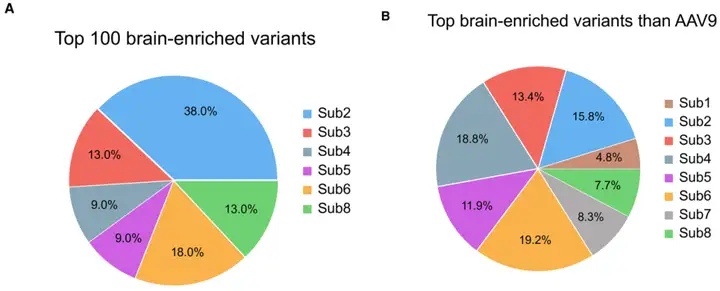
为探究哪种序列改造类型对衣壳工程改造的贡献最大,研究团队追溯了第3轮筛选中“排名前100的CNS靶向变体”及“富集超过AAV9的变体”的原始子文库来源。结果显示,不同子文库的贡献差异显著:在原始文库设计的8个子文库中,Sub2子文库(以7聚体肽替换AQAQ残基)贡献了38%的前100变体(占比最高),且产生了高效的BRC05和BRC06;其次是Sub6(18%)、Sub3(13%,产生了BRC01和BRC04)、Sub8(13%,产生了BRC03);传统7聚体插入策略(Sub4)和Sub5(产生了BRC02)各贡献9%;而Sub1和Sub7子文库未产生任何前100变体,表明其效率较低。这一结果证实,AQAQ替换策略在衣壳工程改造中的高效性,且方法学多样性对发现新型功能变体至关重要。
图8. BRC变体的来源分析
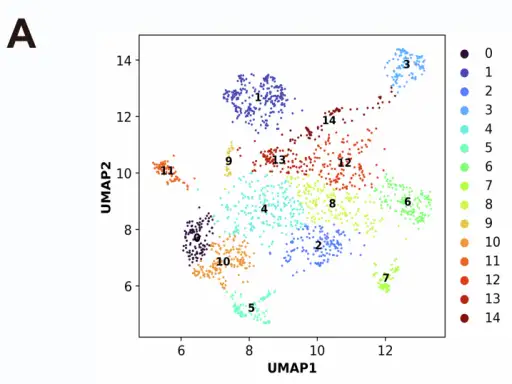
为深入了解脑富集变体的序列特征,团队将前2000个相关序列用高斯混合模型(GMM)分成15个聚类,通过独热编码找到与脑趋向性相关的基序。结果发现这些变体含2~4个氨基酸的短保守基序,部分基序和已知CNS靶向AAV(如AAV.PHP.eB)的类似;还发现特定聚类表现出共有基序,如聚类3的RLSS基序和聚类5的Nx[F/Y][N/G]I基序,提示可能存在尚未被探索的BBB相互作用机制;另有部分基序(如聚类11的FPxV基序)表现出物种限制性富集——在C57BL/6J小鼠中富集的变体未在BALB/c小鼠中富集,表明这种差异可能反映了其对宿主特异性受体或BBB穿透途径的依赖性,这也为解释AAV变体的品系依赖性提供了线索。
图9. 聚类分析揭示序列特征
6、BRC05和BRC06变体的体外表征
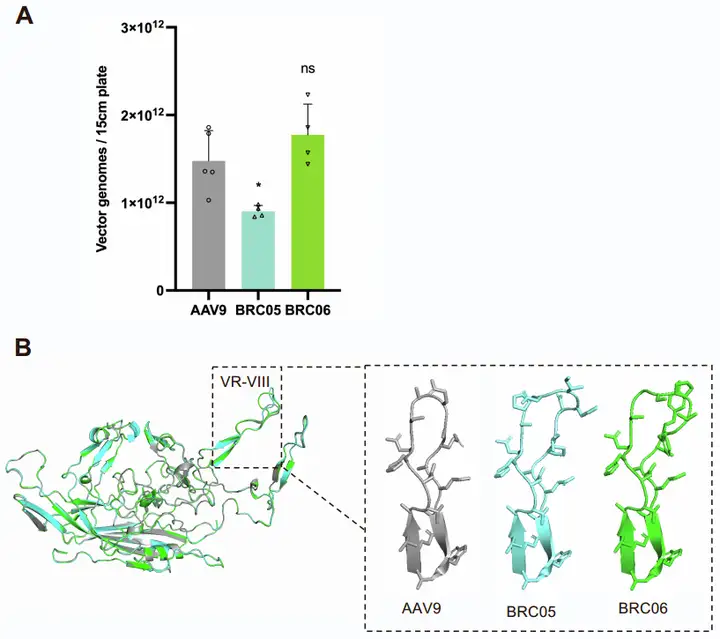
治疗性AAV的可规模化生产是其临床转化的关键前提。为评估BRC05和BRC06的转化潜力,团队通过包装编码EGFP的载体检测其滴度,结果显示二者的生产滴度与母本AAV9相当,可制造性良好。另外,通过AlphaFold2(AI蛋白质结构预测工具)预测BRC05和BRC06的衣壳结构并与AAV9对比,发现两者均出现局部构象变化,且肽插入破坏了VR-VIII区域,但未影响其核心包装效率,这种结构改变可能会影响病毒与宿主因子的相互作用。综上,BRC05和BRC06增强的CNS趋向性与良好可制造性,支持它们成为可行的基因递送候选载体。
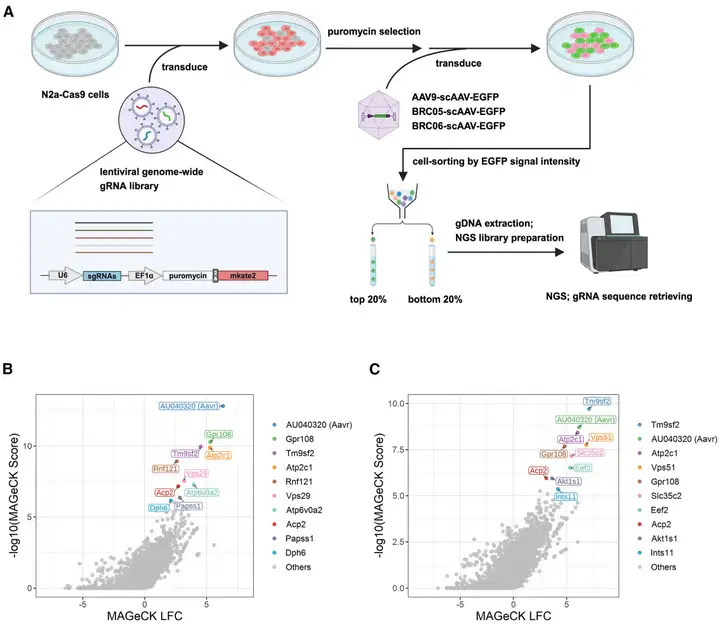
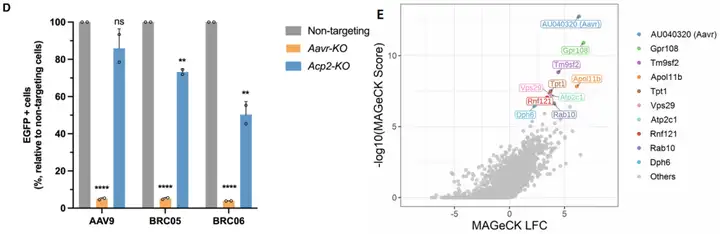
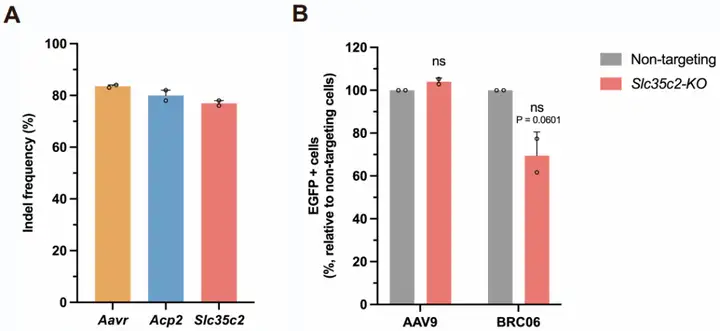
为进一步阐明BRC05和BRC06的作用机制及转化潜力,团队建立了基于流式细胞术的全基因组CRISPR敲除(KO)筛选方法以鉴定BRC转导所需的宿主因子:先用包含小鼠全基因组单向导RNA(sgRNA)文库的慢病毒(LV)库转导N2a-Cas9细胞(稳定表达Cas9蛋白的小鼠神经母细胞瘤细胞系),再用BRC05、BRC06或AAV9的自互补AAV(scAAV)转导细胞以表达EGFP,从分选的荧光强度最高的20%(EGFP高表达)和最低的20%(EGFP低表达)细胞群体中提取基因组DNA,通过NGS回收sgRNA并对比富集差异。结果筛选出促进BRC05或BRC06转导的前10个阳性调控基因,包含已知的AAV转导相关基因——如AAV进入及细胞内运输过程所必需的AU040320基因(即Aavr,编码AAVR),证实了筛选的有效性;此外,团队还发现Acp2是BRC05和BRC06转导的共同宿主因子,Slc35c2(编码高尔基体定位的GDP-岩藻糖转运蛋白)是BRC06介导转导的宿主因子。
为验证筛选出的宿主因子,研究人员用LV递两种sgRNA,在N2a-Cas9细胞中单独敲除目标基因,再用AAV9、BRC05或BRC06衣壳包装的scAAV-CAG-EGFP转导敲除细胞。结果显示:Aavr敲除显著降低所有AAV的EGFP表达;Acp2敲除也降低了BRC05和BRC06的EGFP表达,但程度弱于Aavr;Slc35c2敲除对BRC06介导的EGFP转导仅产生轻微降低作用。综上,这些筛选与验证结果表明,Aavr是必需的进入因子,而Acp2可能通过进入后的细胞内转运过程,在促进BRC05和BRC06的转导中发挥辅助作用。
图11. CRISPR筛选鉴定出介导AAV9、BRC05或BRC06感染的宿主因子
图12. CRISPR-Cas9介导的候选基因体外验证
总结
本研究展示了一种针对AAV9的定向进化方法——利用MCMS文库在啮齿动物中筛选出CNS靶向性增强且肝脏靶向性减弱的衣壳变体。该MCMS文库整合了插入、替换等创新性设计思路,经小鼠全身给药后,研究团队鉴定出一组在CNS组织中显著富集的BRC变体。其中,BRC05与BRC06成为核心候选变体,尤以BRC06表现突出——表现出最高的CNS转导效率和最低的肝脏积累。机制研究进一步揭示,BRC05和BRC06依赖经典因子Aavr介导进入细胞,同时需Acp2辅助因子促进病毒进入后的胞内转运,这为其高效靶向特性提供了分子层面解释。来源分析表明,BRC06源自团队设计的替换策略,相比VR-VIII区域的传统7聚体插入策略,该策略能产生更多CNS靶向性变体,进一步证实了MCMS文库的可行性与有效性。
尽管BRC变体已展现出良好的神经靶向潜力,但其在高等生物中的有效性与安全性仍需通过更多临床前及临床研究进一步验证。未来研究应聚焦于以下方向:优化衣壳设计以提升跨物种兼容性,在非人灵长类动物中开展变体性能评估,以及探索新型进化策略进一步提升转导特异性与效率。
服务内容
1、随机多肽展示文库成品:对文库构建过程进行多项优化测试;我司拥有多个现货AAV随机多肽展示文库,其中文库克隆正确率高、多样性高、碱基分布均匀、库容量较高。
2、文库包装体系优化服务:可改善AAV文库衣壳与基因组一致性、包装滴度低、感染活性等问题。
3、体外/体内衣壳突变体筛选服务、候选衣壳突变体体外/体内功能验证服务:我司拥有完备的动物模型平台,可根据需求提供定制化服务。
4、不同AAV血清型文库病毒开发服务
5、cGMP级别AAV病毒生产服务:我司拥有HEK293 AAV包装平台及专利核心技术One-Bac 4.0昆虫杆状病毒AAV大规模生产系统。

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK