2025-10-27 阅读量:329
在哺乳动物体内,血糖稳态维持是一个高度复杂的生理过程。当血糖下降时,机体会通过抑制胰岛素分泌、促进葡萄糖生成、减少外周利用等方式来抵御低血糖。长期以来,经典理论认为胰高血糖素、皮质酮和肾上腺素等激素是低血糖防御的“主角”。然而,这些体液因子无法完全解释低血糖状态下的代谢变化,提示背后还存在未被揭示的中枢神经调控机制。
葡萄糖是大脑能量代谢的主要底物,血糖必须保持在一个临界水平以上,以保持足够的大脑功能。在正常情况下,葡萄糖需求与机体合成及储存动员之间存在精细的稳态平衡。低血糖的发生不仅会损害机体能量代谢、认知功能及运动表现,还可能诱发眩晕、心悸、出汗、情绪不稳等一系列临床症状。持续性低血糖可通过诱导氧化应激、触发炎症反应等机制造成神经元损伤,进而进一步影响认知功能与情绪稳定性。因此,大脑进化出了一套敏感的检测机制,包含葡萄糖兴奋(glucose excited,GE)和葡萄糖抑制(glucose inhibited,GI)神经元,以确保在中枢神经系统中快速感知葡萄糖水平的变化,并对此做出响应,如促进摄食或调整机体能量代谢以避免大脑损伤。尽管葡萄糖感知神经元在大脑中的存在已被确认超过六十年,然而,如何将大脑中的葡萄糖感知信号传递至外周器官并调控葡萄糖生成这一关键问题仍未得到明确解答。
近日,中国药科大学药学院郝海平教授、谢昊教授团队在Cell Metabolism在线发表研究论文“Galnt2 neurons in the ventromedial hypothalamus counterregulate hypoglycemia via a brain-liver neurocircuit”。该研究首次揭示,大脑可通过GI神经元感知低脑糖浓度,经脑-肝神经环路精准调控肝脏葡萄糖生成,从而在低血糖状态下迅速恢复血糖水平。这一发现为理解低血糖抵抗机制提供了全新视角。

1.中枢介导血糖的“双时相”调控机制
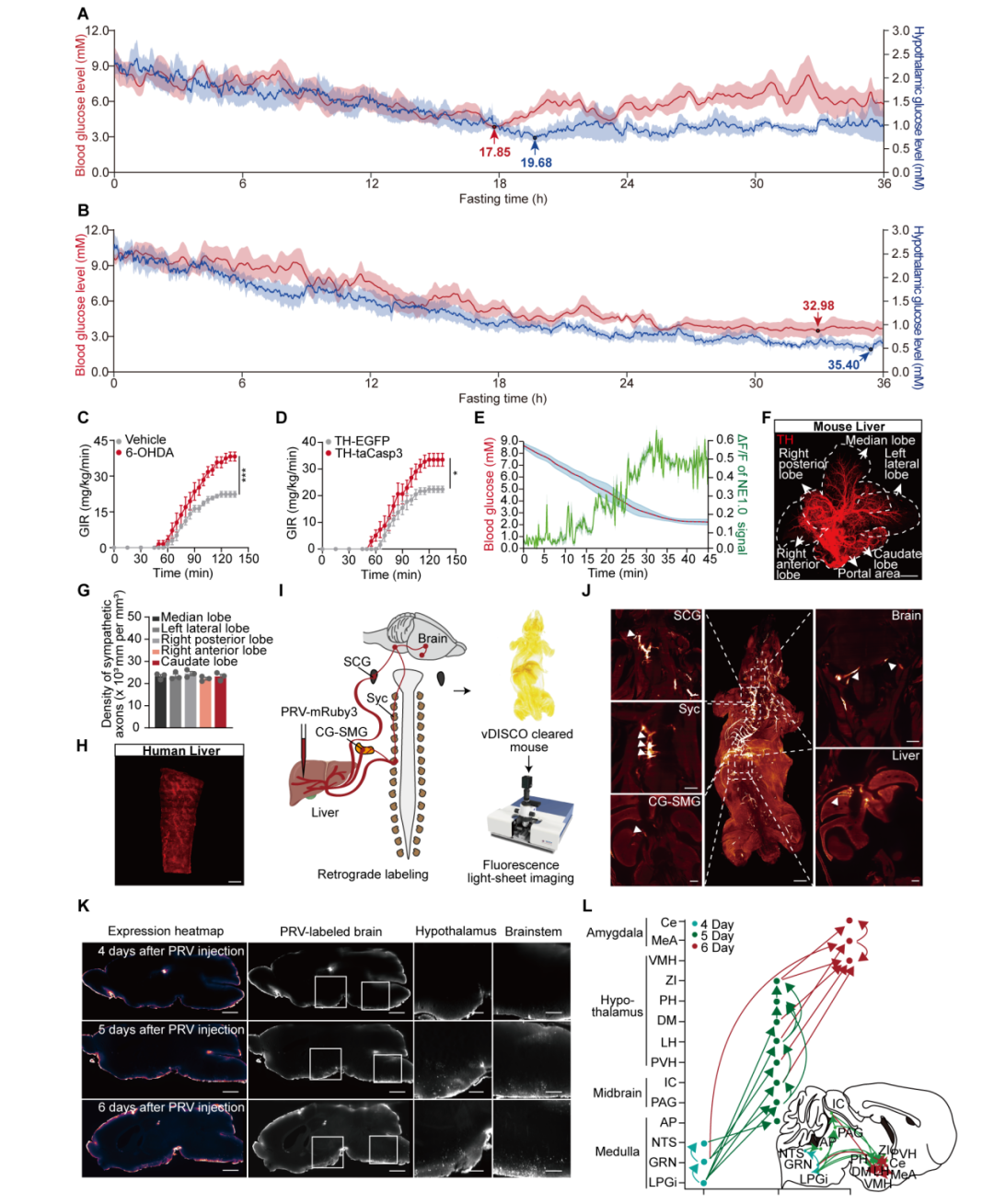
研究团队首先通过动态血糖监测与下丘脑原位葡萄糖监测技术,发现小鼠在禁食过程中血糖及下丘脑葡萄糖水平呈现双相变化模式,即前19.4小时持续下降,随后下丘脑葡萄糖稳定于约1 mM水平,而血糖则在高于最低点的范围内波动。进一步消融小鼠肝脏交感神经,可消除血糖的双相调节模式,血糖持续下降,提示肝脏交感神经在此过程中具有关键调控作用。利用逆行示踪病毒PRV(伪狂犬病毒)标记从肝脏逆行到大脑的多级环路,成功绘制出从大脑至肝脏的感染路径图谱,证实肝脏与大脑之间存在明确的结构性神经连接。
图1. 脑-肝神经环路是血糖双时相调控模式的基础
2.VMH→PVH→LPGi→肝脏是中枢驱动的低血糖抵抗环路
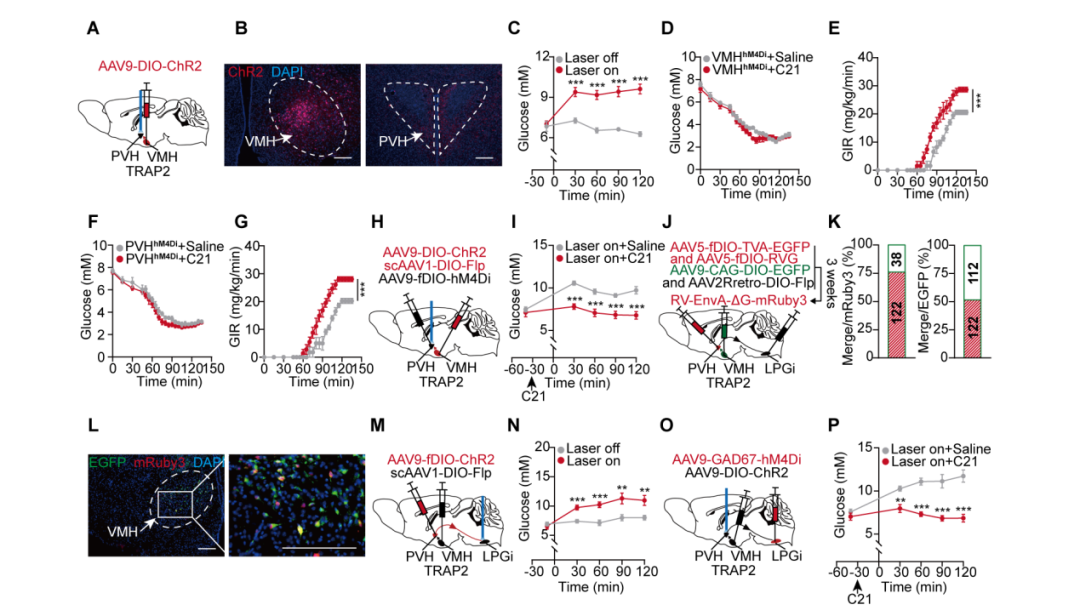
本研究揭示了一条完整的VMH(腹内侧下丘脑)→PVH(下丘脑室旁核)→LPGi(外侧旁巨细胞核)→肝脏交感神经环路在调控血糖稳态中的关键作用。通过光遗传与化学遗传学实验,证实激活TRAP2小鼠(特异性标记禁食状态下激活的神经元)中VMH神经元投射到PVH的突触末梢可显著提升血糖,而抑制PVH神经元则阻断该效应。三级环路病毒示踪技术与钙成像技术进一步揭示VMH经PVH中继脑区投射至LPGi,激活此环路可独立于激素调节,直接通过增强肝脏交感神经活性促进肝糖生成。此外,LPGi脑区GABA能(LPGiGABA)神经元通过抑制CVLM(延髓尾端腹外侧区)→RVLM(延髓头端腹外侧区)抑制性环路,增强交感输出。这些结果共同阐明了一条功能明确的脑-肝神经环路,为机体低血糖抵抗机制提供了新的神经环路基础。
图2.VMH→PVH→LPGi神经环路通过激活LPGiGABA神经元提升血糖水平
3. Galnt2是维持血糖稳态的“分子刹车”
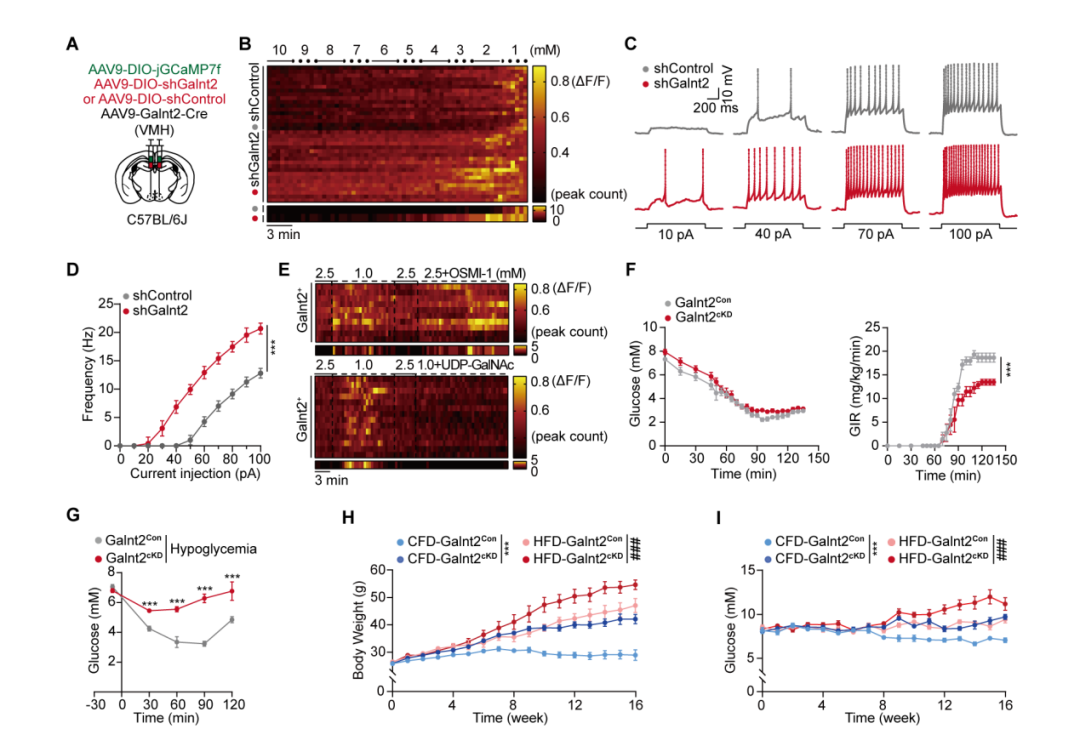
本研究揭示Galnt2(编码N-乙酰半乳糖胺转移酶2)通过调节VMH GI神经元的兴奋性,在系统性低血糖反应中发挥关键作用。研究发现,在禁食激活的VMH神经元中,Galnt2表达最为显著;该特异性神经元群体在低血糖状态下激活并强烈促进肝脏葡萄糖生成。进一步机制研究表明,Galnt2在正常或高血糖条件下作为“分子刹车”,抑制神经元异常放电;而在脑内葡萄糖浓度降至约1 mM阈值时,抑制被解除,神经元兴奋性增强,从而启动低血糖反调节反应。在体实验表明,VMH区Galnt2敲低小鼠在低血糖刺激下表现出更高的血糖水平、核心体温与自主活动能力;但在常规饮食和高脂饮食条件下,这些小鼠出现体重增加、血糖升高、脂代谢紊乱以及主动脉脂质斑块积累等代谢异常表型。综上所述,Galnt2通过精确调控VMH GI神经元对低糖信号的响应阈值,在维持机体葡萄糖稳态中扮演重要角色。
图3. Galnt2调节VMH GI神经元的低糖响应阈值及代谢稳态
结论
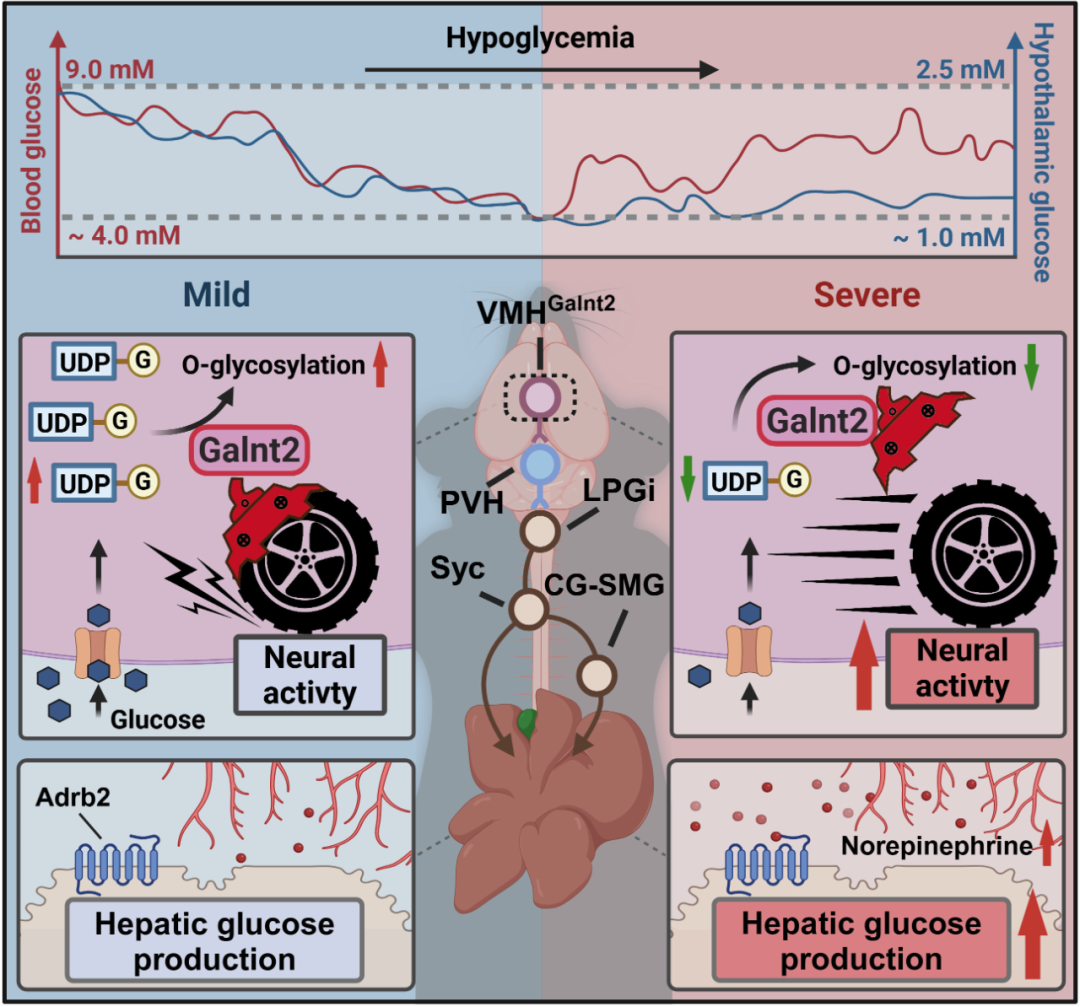
总之,本研究揭示了禁食过程中血糖及下丘脑葡萄糖水平呈现双相调节模式,并阐明在抵抗低血糖过程中存在一种阈值依赖性的中枢调控机制。具体而言,VMH中Galnt2阳性( VMHGalnt2 )神经元能够感知中枢低糖状态,进而激活VMH→PVH→LPGi→肝脏交感神经环路,驱动肝脏葡萄糖生成。该发现为以葡萄糖稳态失衡为特征的代谢性疾病提供了新的治疗思路与干预靶点。
图4. VMHGalnt2神经元检测低糖水平并通过VMH→PVH→LPGi→肝脏交感神经环路增强肝脏葡萄糖生成的机制
中国药科大学郝海平教授、谢昊教授为论文的共同通讯作者,中国药科大学博士生王俊婕、孙新沅和宫翔飞为共同第一作者。中国药科大学戴文玲副教授和洪浩教授参与了该研究的核心工作并作出了重要贡献。中国药科大学张永杰副教授、郝琨教授、周芳教授、郑啸教授、王广基院士,南通大学附属医院汤志远教授,南通大学吴小波教授,南京医科大学孙鹏副教授,东南大学附属中大医院崔莹住院医师、汤天宇副教授,北京师范大学毛兰群教授为该研究提供了重要支持与帮助。
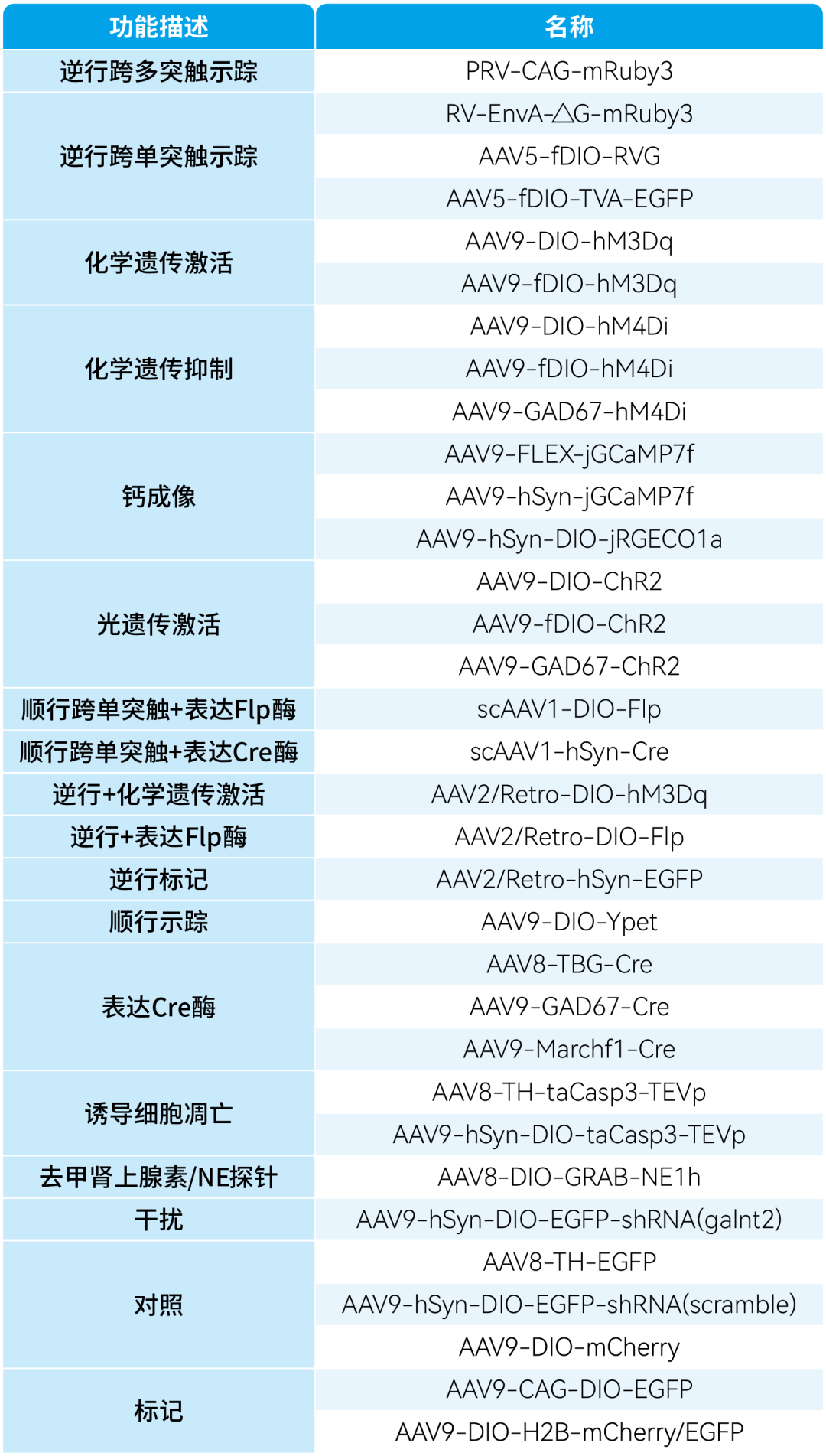
本文使用的来自枢密科技的病毒产品,列表如下:

了解产品及服务
扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK