2025-09-08 阅读量:1224
在生物医药研究与基因治疗领域,“可编程基因组插入”是一项核心技术需求。然而,长期以来,大片段DNA(如完整的治疗性基因)的精准、高效整合始终面临瓶颈,关键问题集中在传统技术对“DNA双链断裂(DSB)”的依赖上。目前主流的大片段插入方法,如基于非同源末端连接(NHEJ)的同源非依赖性靶向插入(HITI)技术、基于同源定向修复(HDR)的编辑技术,均需通过CRISPR-Cas9等核酸酶诱导DSB,再借助细胞自身修复途径实现片段整合。但DSB会引发一系列风险:包括碱基的插入/缺失(indels)、染色体片段的易位以及p53通路(调控DNA修复、细胞周期或凋亡的关键防御通路)激活;NHEJ还可能在非预期的DSB位点发生脱靶插入;而HDR不仅在非分裂细胞(如体内多种细胞类型)中效率极低,还需要制备长DNA模板,过程耗时费力。
为规避DSB依赖,研究者开发了碱基编辑、先导编辑等技术,但这类方法仅能实现核苷酸编辑、小片段插入(<50 bp)或短片段缺失(<80 bp),无法实现大片段DNA的插入或替换;近年来出现的成对引导先导编辑方法,通过使用两种具有互补逆转录模板的先导编辑引导RNA(pegRNA),实现了比传统方法更大的片段插入,但在1-5.6 kb范围内效率显著下降,无法应对更大片段。此外,天然转座子系统虽无需DSB,但插入位点半随机(如依赖TA二核苷酸);传统丝氨酸整合酶虽能位点特异性整合,却需先通过HDR在目标位置预先插入整合酶附着位点(效率低,仍有DSB风险),且部分整合酶(如phiC31)可能引发假位点间染色体重排;而整合酶/转座酶等与可编程DNA结合蛋白的融合系统,又普遍存在整合效率低、脱靶多或靶点受限的问题。
来自麻省理工学院的Jonathan S. Gootenberg教授和Omar O. Abudayyeh教授团队在Nature Biotechnology期刊发表了题为“Drag-and-drop genome insertion of large sequences without double-strand DNA cleavage using CRISPR-directed integrases”的文章,开发了一种名为“可编程位点特异性靶向元件添加(programmable addition via site-specific targeting elements,PASTE)”的新型基因组编辑技术。该技术创新性地将CRISPR-Cas9切口酶、逆转录酶(RT)与丝氨酸整合酶融合,构建出一套无需DSB即可实现大片段DNA整合的系统:通过先导编辑将整合酶的“附着位点(attB)”精准插入基因组靶标,再利用融合的丝氨酸整合酶将含互补位点(attP)的环状DNA片段高效整合。研究证实,PASTE可在3种人类细胞系、原代T细胞及非分裂原代人肝细胞中,于多个基因组位点实现长达约36 kb片段的整合;其效率与HDR、NHEJ方法相当或更高,不仅能在非分裂细胞中发挥作用,还可在体内应用,且可检测到的脱靶事件更少。此外,团队还对PASTE技术进行了一系列的优化。作为基因组编辑领域的新一代工具,PASTE为生物医学研究及治疗开发中的基因插入与标记需求开辟了多元化的应用方向。
枢密科技研发团队凭借着深厚的技术积累,已熟练掌握多种前沿基因编辑技术,可提供PASTE技术、CRISPR/Cas9基因编辑、碱基编辑(Base editor,BE)、先导编辑(Prime editor,PE)、CRISPRa/CRISPRi技术以及表观遗传编辑技术等相关服务,为您的科学研究提供强大支持!详情见文末~
1.PASTE系统的设计、构建与多轮优化
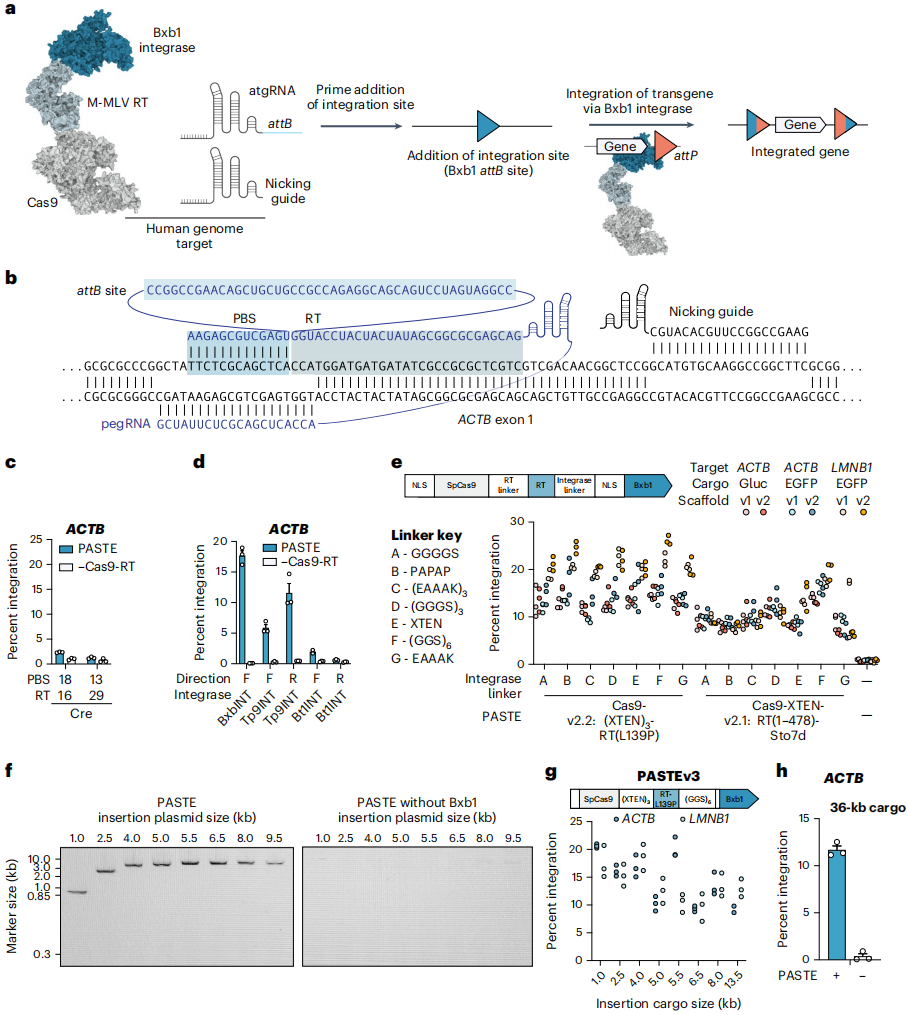
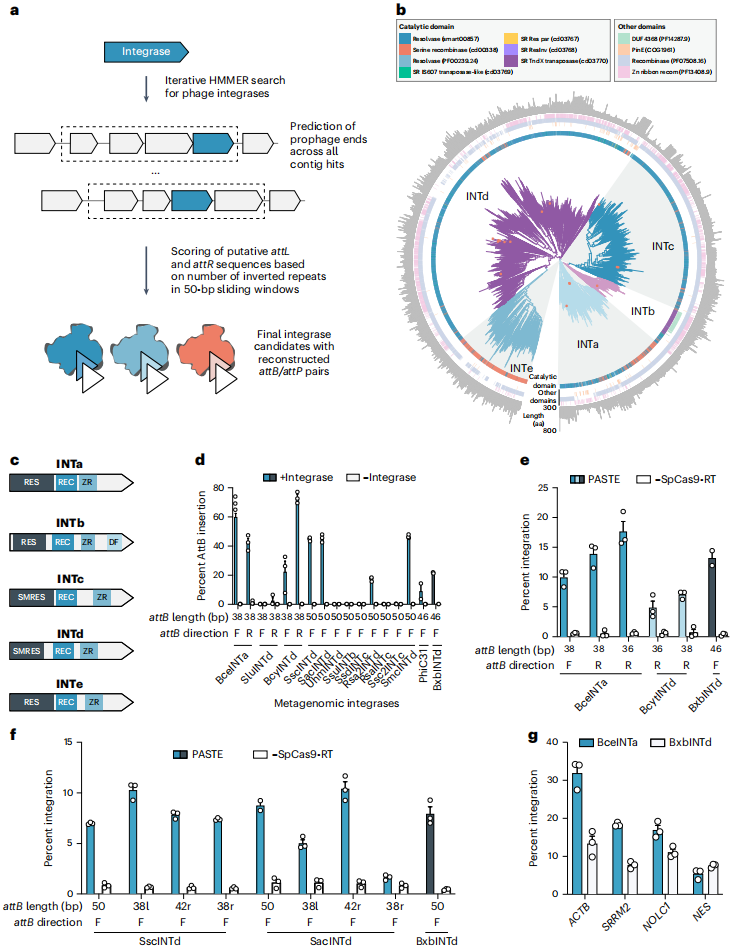
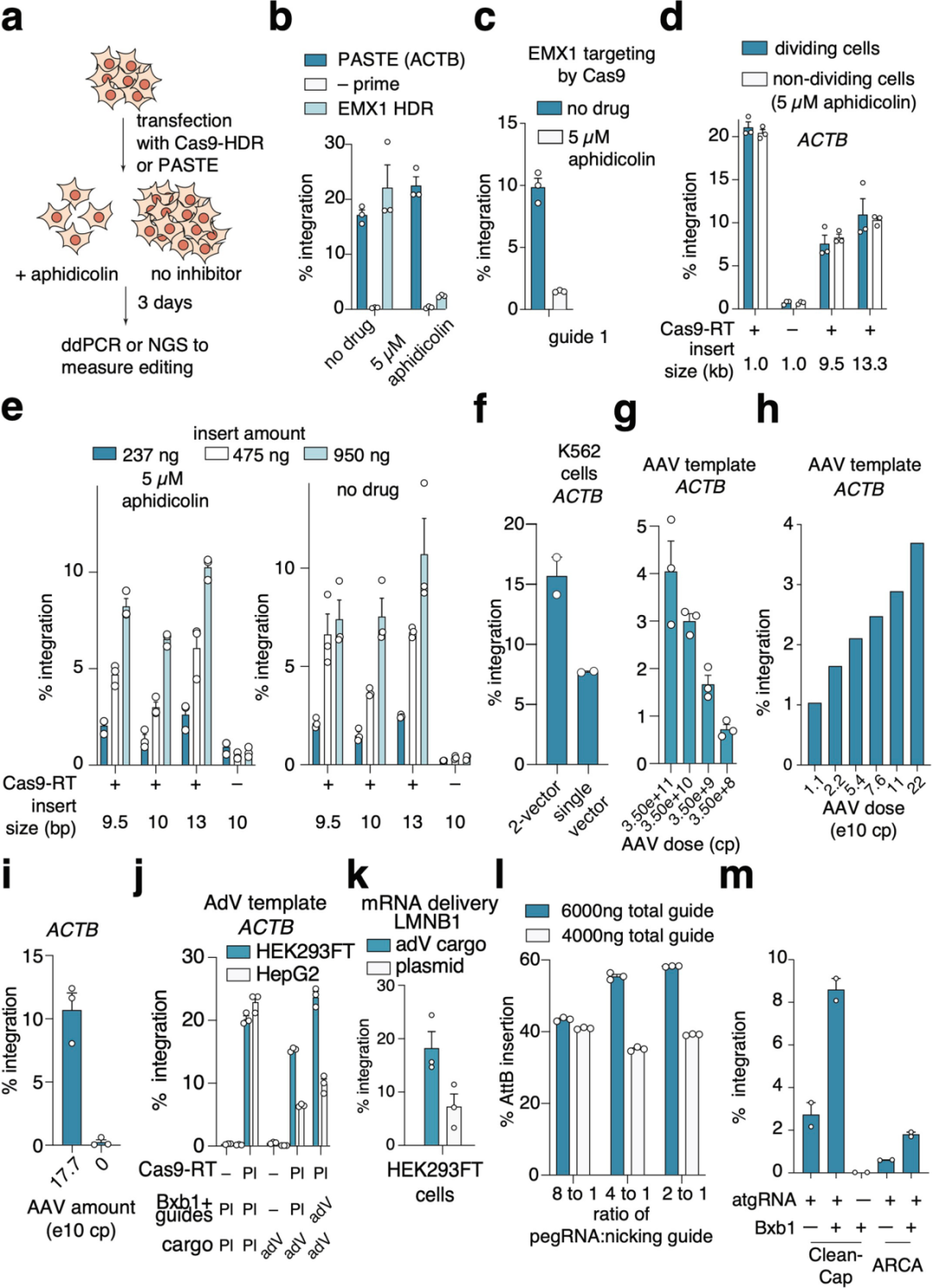
PASTE的核心设计思路是“分两步实现精准整合”:先通过先导编辑在基因组靶位点插入丝氨酸整合酶的附着位点(attB),再由整合酶将含互补位点(attP)的DNA片段整合到attB处。为实现这一过程的“单系统、高效率”,团队进行了多轮设计与优化,首先,团队验证了“先导编辑插入attB”的可行性:设计含attB序列的pegRNA(命名为atgRNA),在β-肌动蛋白(ACTB)位点成功插入长达56 bp的序列,且31 bp以下短序列插入效率更高。随后对比酪氨酸重组酶(Cre)与丝氨酸整合酶(Bxb1、TP901、phiBT1)的整合效率,发现丝氨酸整合酶效率显著更优,其中Bxb1整合酶(BxbINT)表现最佳。基于此,团队构建了初代PASTE(PASTEv1):将先导编辑载体、atgRNA、切口向导(促进链修复)、BxbINT表达载体及含GFP的969 bp微型环状DVA片段通过单次转染递送,在ACTB位点实现了约15%的GFP整合,且切口向导是最优活性的必需组件。
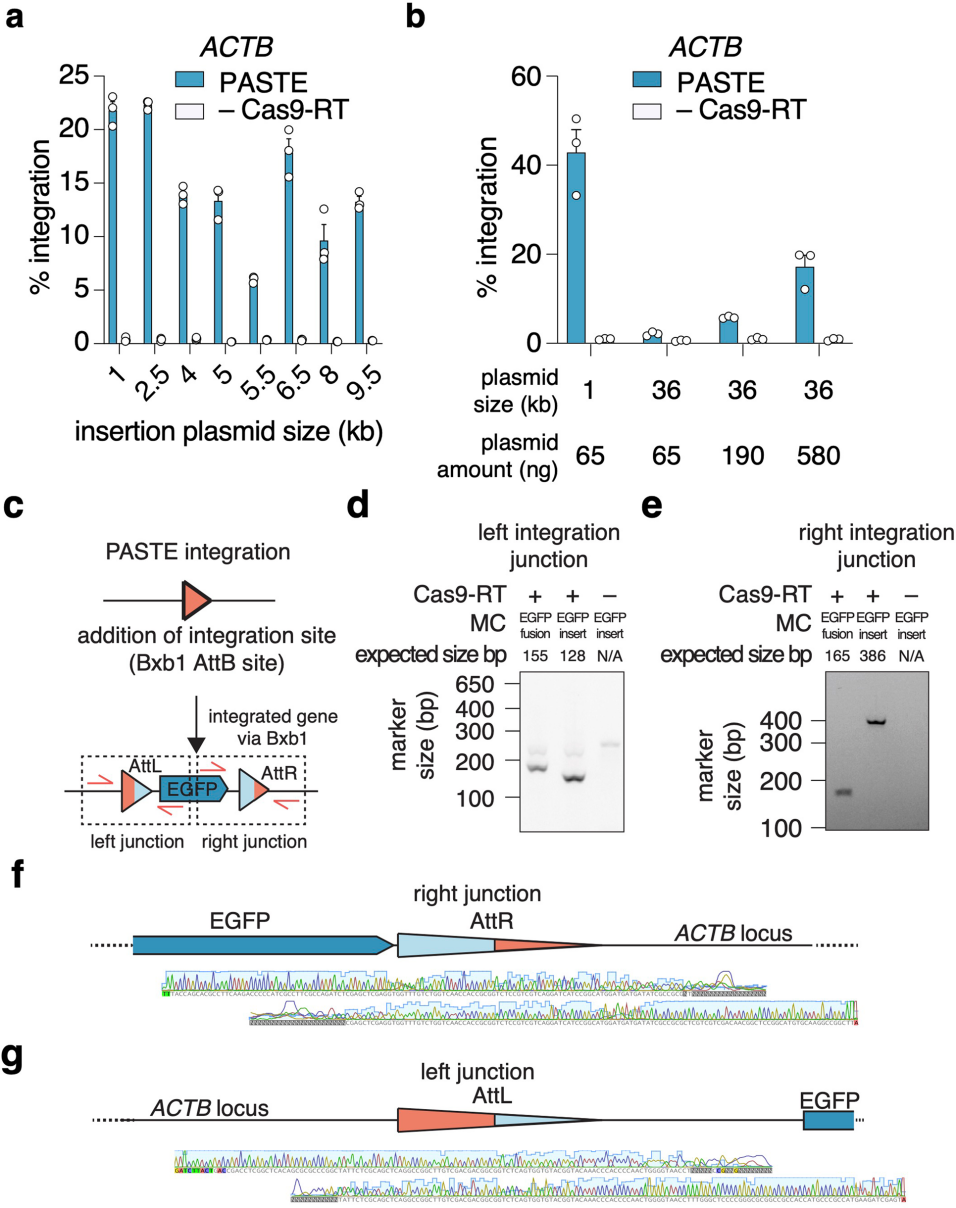
为进一步提升效率,团队开展了蛋白质与向导的工程优化:在向导层面,设计atgRNAv2支架以增强稳定性和表达效率,显著提升了attB的插入与整体整合效率;在蛋白质层面,筛选了Cas9、RT与BxbINT之间的连接子、RT突变体及结构域融合方式——例如,Cas9与RT间采用48氨基酸的XTEN连接子、RT引入L139P突变(RTL139P)等,将这些最优修饰与RT和BxbINT之间的[(GGS)6]连接子结合后,基因整合效率提升至约30%,从而构建出PASTEv2。将PASTEv2与atgRNAv2结合,得到PASTEv3,该版本可在ACTB和核纤层蛋白B1(LMNB1)位点实现长达约36 kb片段的精准整合,效率约为10%-20%,桑格测序证实其全长片段的完整插入。
图1. PASTE编辑可实现不依赖DNA修复途径的可编程基因插入
图2. PASTE载荷大小与整合连接位点的表征分析
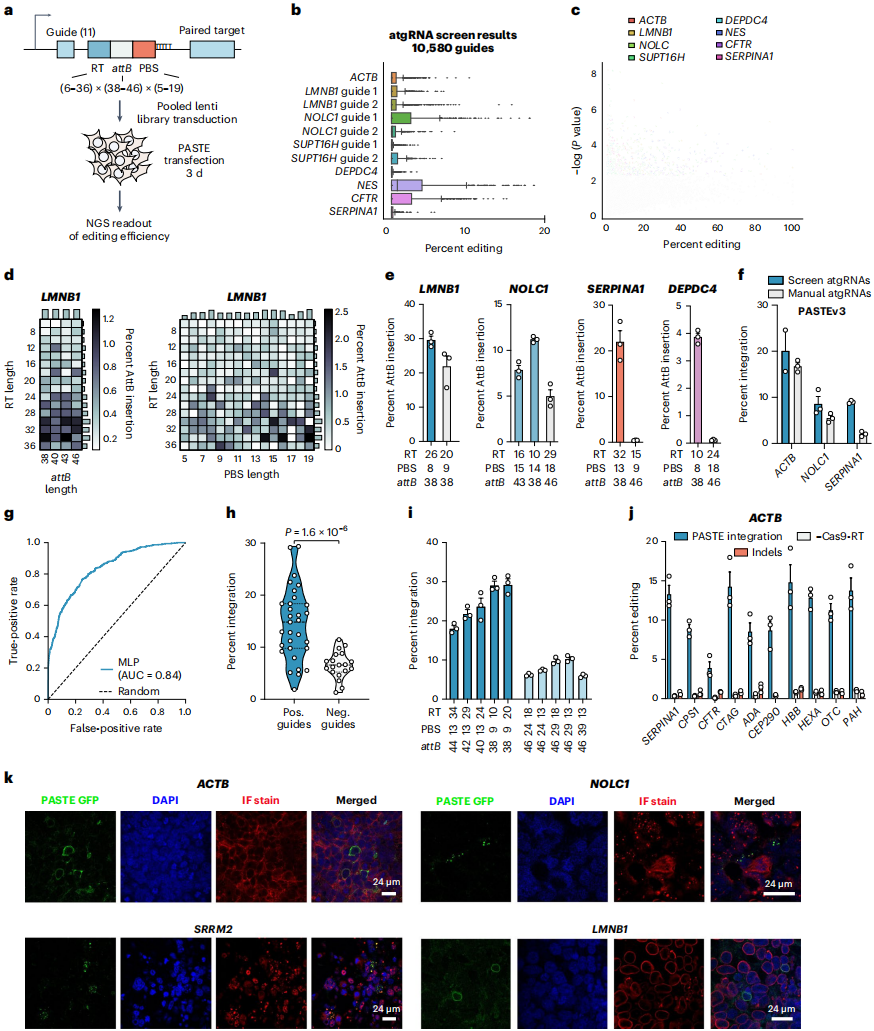
此外,团队还通过高通量筛选明确了atgRNA的设计规则:构建含10580种atgRNA的文库,覆盖8个靶基因的11个间隔序列,对每个组合评估了5-19 bp的引物结合位点(PBS)长度、6-36 bp(以2个碱基为增量)的RT长度及38、40、43、46 bp的attB长度。结果发现,attB长度、PBS/RT长度的最优组合具有“位点依赖性”(如ACTB偏好短PBS+长RT,LMNB1则偏好长PBS+短RT);在8个靶标中,长度超过20 bp的RT普遍提升attB插入率,而PBS长度在5-19 bp之间时未呈现明显规律。基于筛选数据,团队基于k-mer多层感知器(MLP)训练了一个分类器,以模拟atgRNA序列对最终attB插入编辑效率的影响。其特征优化和模型训练的准确性较高(曲线下面积(AUC)=0.84),对模型未见过的、针对LMNB1、核仁磷酸蛋白p130(NOLC1)和ACTB基因的atgRNA进行评分后发现,模型推荐的向导RNA与未推荐的向导RNA在效率上存在显著差异。团队将该预测模型作为向导设计工具,通过软件包发布,其仅需输入靶序列,即可输出按预测效率评分排序的atgRNA列表,解决了“手动设计效率低”的问题。
图3. 评估内源性基因组位点高效PASTE插入的设计规则
2.PASTE对多种片段的整合能力及精准基因标记
PASTE的核心优势之一是“片段整合的模块化”——由于无需片段质粒与基因组靶位点的同源序列,不同类型、大小的DNA片段均可通过替换含attP的载体实现整合,且能保证插入的精准性。团队首先测试了10种治疗相关性基因片段(如CEP290、HBB、PAH、SERPINA1等)的整合:这些片段大小从969 bp到4906 bp不等,整合效率介于4%-22%之间,且仅产生极少的indel,表明PASTE对“治疗性基因大小范围”的兼容性。接下来,为测试PASTE是否能实现碱基对分辨率的插入,团队利用了丝氨酸整合酶的特性——整合后会在基因组留下attL/attR残余序列。通过在微型环状片段上战略性设计attP的位置,确定了attR序列的读码框,获得了合适的蛋白质连接子(GGLSGQPPRSPSSGSSG),通过PASTEv1成功将4个基因(ACTB、SRRM2、NOLC1和LMNB1)与GFP标记融合。免疫荧光验证显示,在所有4个靶向位点,GFP均与被标记基因产物正确共定位,表明标记成功。(如图3)
3.PASTE与基于DSB的整合方法:效率及编辑纯度对比
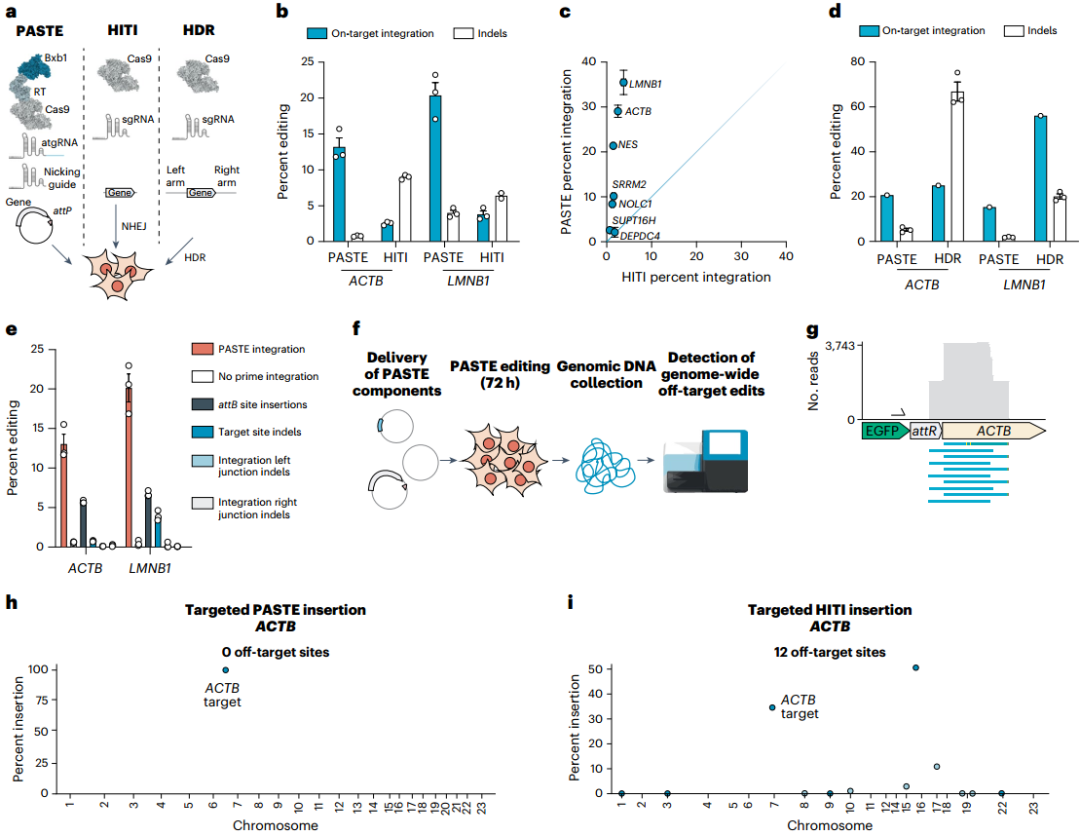
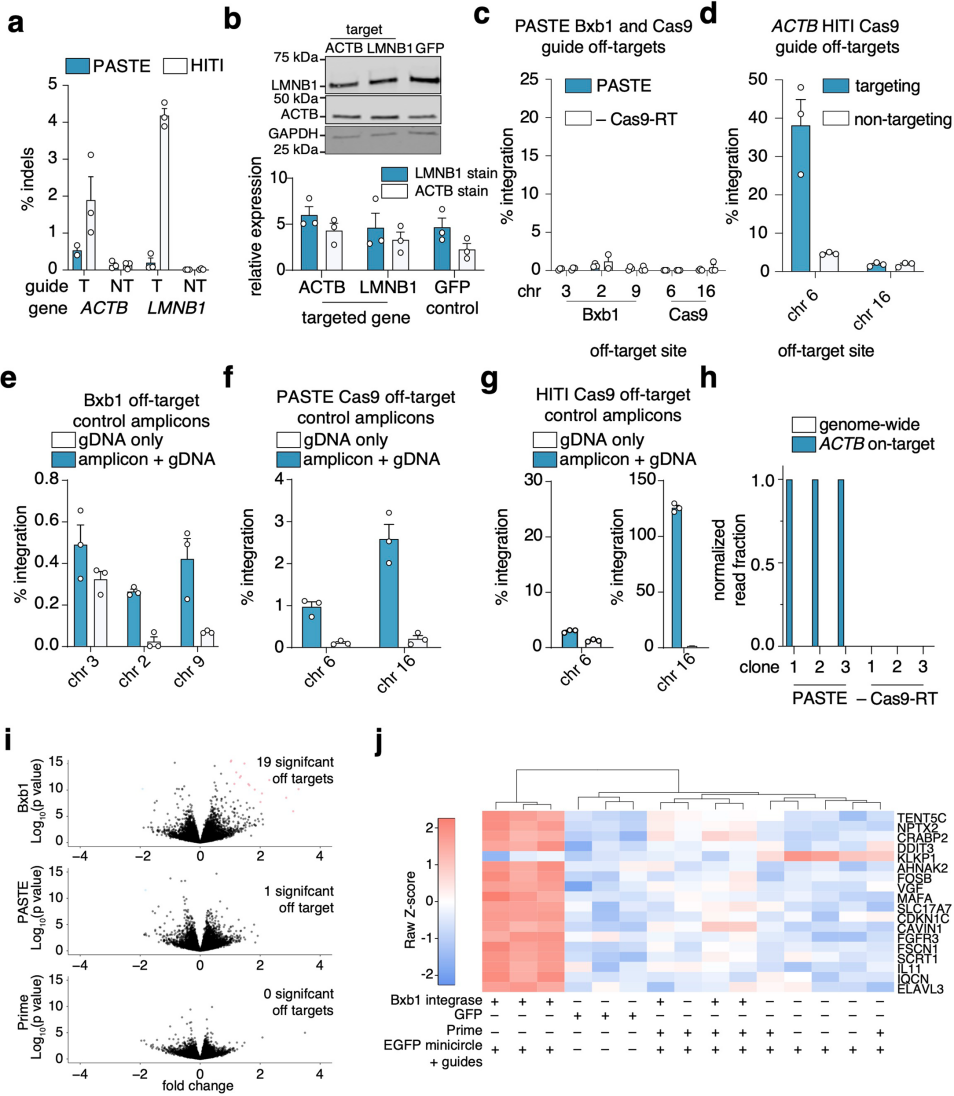
为验证PASTE的性能优势,团队将其与依赖DSB的HITI(NHEJ途径)和HDR方法在效率与编辑纯度上进行了系统对比。结果显示,PASTE的基因插入效率优于HITI,并且在人胚肾细胞(HEK293FT)和人肝癌细胞(HepG2)中,PASTEv3产生的indel显著少于HITI,表明PASTE的基因整合结果纯度较高;在7个内源性靶基因中,PASTEv3在其中6个基因的编辑效率超过HITI,仅1个基因上的效率与HITI相当;与HDR相比,PASTEv3在ACTB位点的效率与HDR相当,在LMNB1位点的效率略低,但其产生的indel显著少于HDR。为全面分析PASTE的编辑结果,团队检测了PASTEv2和PASTEv3在ACTB及LMNB1位点的所有可能的中间或替代编辑产物,包括整合接头两端是否存在残余attB位点及indel。结果显示,残余attB位点的出现概率较低,且这些残余attB位点对蛋白表达无影响。此外,整合接头处未检测到indel。综上,PASTE在基因插入效率上优于或相当于基于DSB的HITI和HDR方法,且编辑纯度更高(indel更少),整合接头处无indel形成,残余attB位点影响轻微,整体性能更优。
图4. 与其他整合方法相比,全基因组PASTE特异性和整合纯度的表征
图5. PASTE技术特异性的进一步表征及其对细胞转录组的影响分析
4.PASTE的脱靶特征及细胞安全性分析
脱靶效应是基因组编辑技术走向临床的关键障碍,团队从“整合酶脱靶”与“Cas9脱靶”两个维度,结合全基因组分析,系统评估了PASTE的特异性。首先针对“BxbINT整合酶的脱靶风险”——通过计算预测人类基因组中与BxbINT attB核心序列相似的潜在位点,并利用数字液滴聚合酶链式反应(digital droplet PCR,ddPCR)检测这些位点的整合情况,结果未发现任何脱靶整合。其次针对“Cas9切口酶的脱靶风险”——通过计算预测确定了ACTB atgRNA的2个潜在Cas9脱靶位点,发现PASTE在这些位点上无任何整合信号,而HITI在其中1个位点存在显著的脱靶活性。为进一步排除“未预测到的脱靶位点”,团队采用“插入-基因组接头测序”策略:分离PASTEv3整合组与缺失PE2(第二代先导编辑器)的阴性对照组的单细胞克隆,对这些克隆的插入-基因组接头进行深度测序。结果显示所有测序读数均精准对齐到ACTB靶位点,未发现任何全基因组范围内的脱靶插入;而相同条件下,HITI在10条染色体上鉴定出12个不同的脱靶位点,且靶向整合仅占总读数的34.8%。这些结果表明,基于线性模板(HITI技术)的整合方法存在显著脱靶活性,同时进一步凸显了将环状模板与双切口PASTE系统结合使用的技术优势。
此外,团队还通过全转录组RNA测序评估了PASTE对细胞的影响。将完整PASTEv1系统、仅含PE2的相应向导和片段、仅含BxbINT的相应向导和片段分别转染细胞,将他们与GFP对照转染组和无蛋白质表达的向导组进行比较。结果显示,当单独表达BxbINT整合酶(缺乏先导编辑)时,会产生多个显著脱靶效应;而完整的PASTE系统仅使1个基因的表达发生超过1.5倍的差异调节。此外,BxbINT过表达上调的基因包括应激反应基因(如TENT5C和DDIT3),但在PASTE系统表达中未观察到这些变化,这可能是由于BxbINT与PASTE构建体连接时的表达差异所致。(如图4和图5)
5.PASTE的功能拓展:基因替换、多重整合与治疗蛋白表达
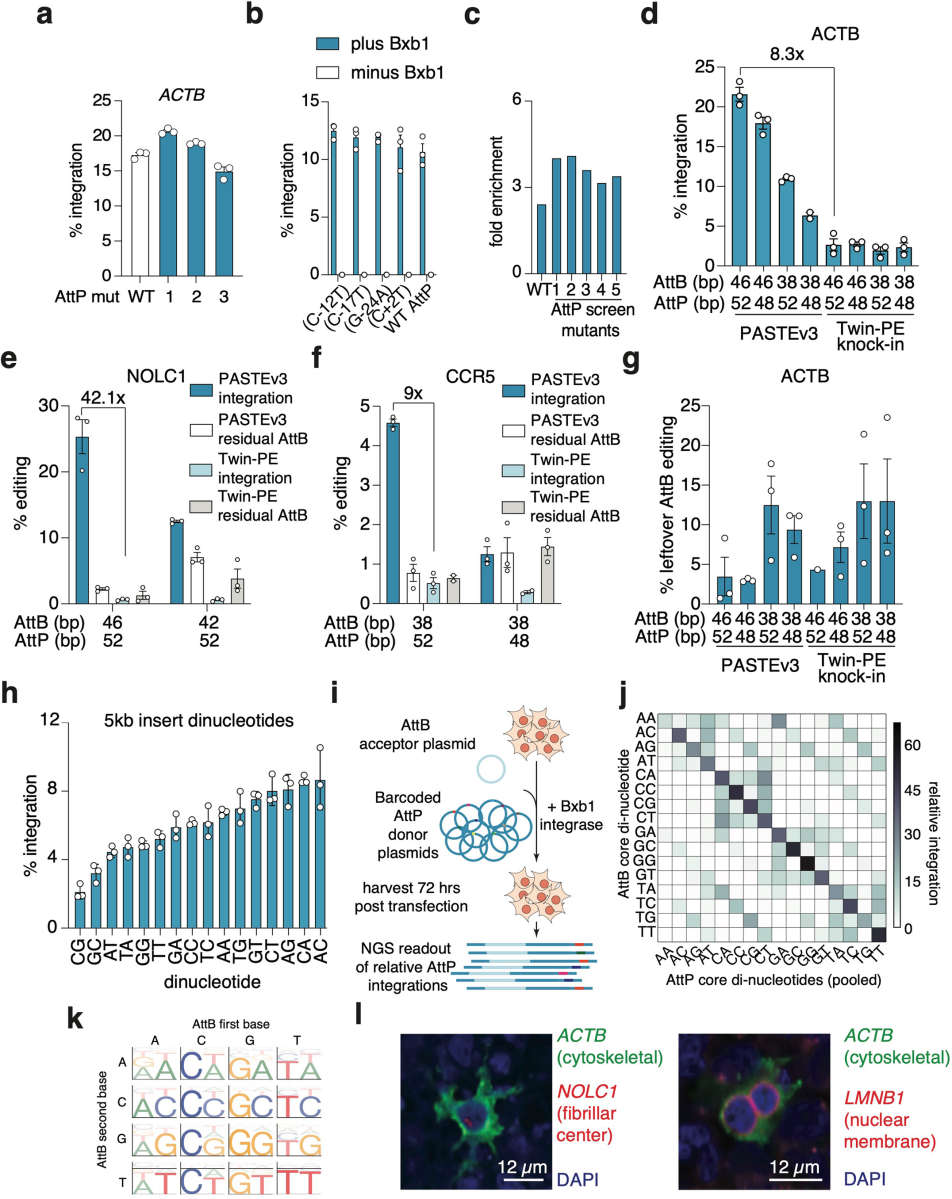
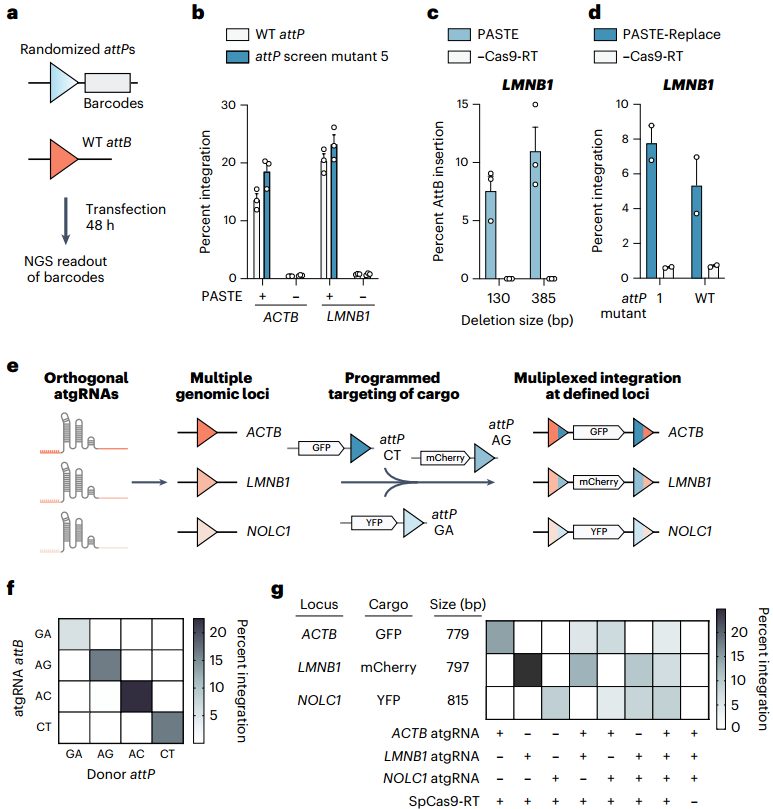
为优化PASTE效率,研究团队针对BxbINT整合酶的附着点突变体展开研究,重点改善短attB位点的低整合效率问题。通过测试已知影响BxbINT整合的attP序列,发现部分变体可显著提升整合速率;进一步通过文库筛选5775个attP单/双突变体,获得在ACTB、LMNB1位点整合活性优于野生型(WT)的attP突变体1。利用该突变体,团队开发出PASTE-Replace系统:结合转基因整合与同步片段删除功能(基于先导编辑短序列替换技术)实现靶序列替换。在LMNB1位点,团队通过成对atgRNA(含38 bp attB)及可连接至另一个附着位点的RT,以7%-10%效率完成130 bp和385 bp基因组片段替换;插入EGFP实现130 bp替换时效率约8%,且attP突变体1模板效率高于WT。该系统仅需2条含PBS和attB的atgRNA,可选择性添加RT辅助删除。表征实验显示,PASTEv3采用“单atgRNA+切口向导”或“双向导RNA”策略时,PASTE-Replace在ACTB、NOLC1、CCR5位点的EGFP插入效率分别达21%、25%、4.5%,是Twin-PE(成对向导整合酶策略)介导敲入的8.3倍、42.1倍和9倍。进一步分析表明,PASTE-Replace的效率提升并非源于attB整合效率,而是PASTEv3载体优化及更长Bxb1 attB/attP序列(更适配整合酶功能)共同作用的结果。
图6. 旨在提升编辑效率与多靶点编辑能力的attP突变体补充表征
已有研究表明,改变attB/attP匹配的中心二核苷酸序列可调控整合酶活性,为双基因插入提供正交性。据此团队推测,扩展attB/attP二核苷酸组合库,或能通过正交atgRNA组合实现PASTE的多靶点基因插入。为筛选最优二核苷酸组合,团队在ACTB位点检测了PASTE对16种attB/attP组合的GFP整合效率,发现部分组合效率高于WT GT序列,且多数效率达WT的75%以上,提示其可作为多靶点插入的正交通道。进一步探究二核苷酸相互作用特异性时,团队进行了文库实验规模化分析:为16种attP二核苷酸质粒加独特条形码构建文库,与BxbINT载体、单个attB质粒共转染后测序,测定所有组合的相对整合效率。结果显示,不同二核苷酸特异性差异显著(如GG自相互作用强、AA自偏好性低);序列图谱表明,首碱基为C或G的attP对同首碱基attB偏好性更强,首碱基为A的attP特异性则降低。基于上述数据,团队选用GA、AG、AC、CT四种二核苷酸atgRNA,在PASTEv3中检测其在ACTB位点与对应/错配attP的GFP整合效率,发现仅匹配组合可有效整合,错配组合无整合信号。随后选取CT、AG、GA三种最优组合,设计靶向ACTB(CT)、LMNB1(AG)、NOLC1(GA)的atgRNA,及含GFP(CT)、mCherry(AG)、YFP(GA)的微型环载体。共递送至细胞后通过ddPCR检测发现,PASTEv1可实现单/双/三靶点编辑,整合效率为5%-25%。
图7. 基于PASTE技术的多靶点及正交化基因插入
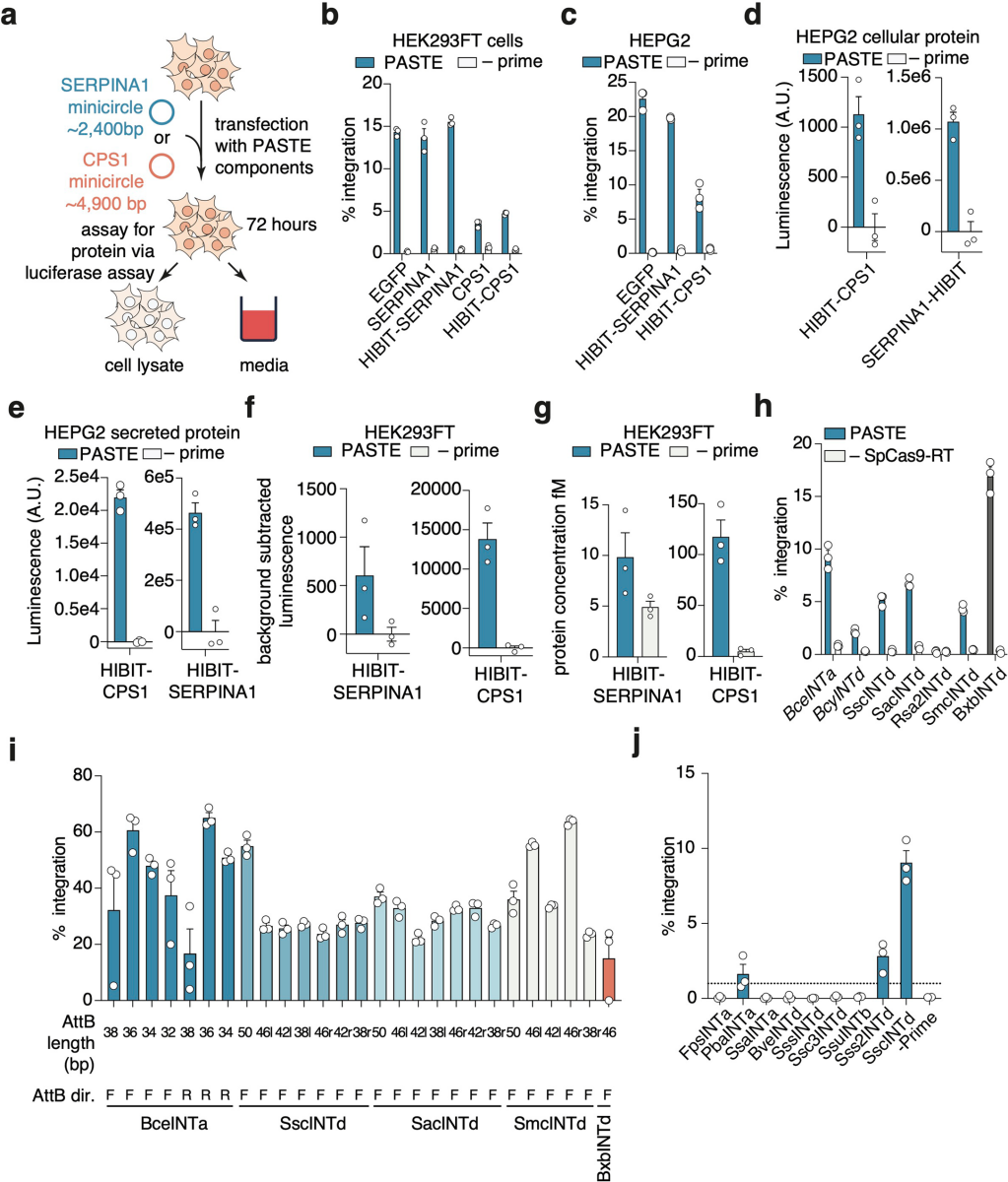
在应用验证中,团队用PASTEv1在同一细胞标记ACTB(GFP)与NOLC1(mCherry)或LMNB1(mCherry),观察到GFP与mCherry荧光无重叠,且标记基因定位与已知蛋白亚细胞位置一致;同时检测疾病相关的治疗性蛋白α-1抗胰蛋白酶(由SERPINA1编码)与氨甲酰磷酸合成酶I(由CPS1编码)的表达:将目标基因与荧光素酶亚基HiBiT融合后,转染含对应载体的PASTEv1至HEK293FT与HepG2,结果均在ACTB位点实现高效整合,且目标蛋白可高效表达、细胞内积累并分泌至培养基。这一结果证实PASTE可实现治疗性蛋白的高效表达,为单基因遗传病的治疗提供了可行方案。
图8. PASTE技术的治疗应用及整合酶的进一步表征
6.新丝氨酸整合酶挖掘与PASTE在特殊细胞及体内的应用
由于整合酶的活性直接影响PASTE效率,团队从美国国家生物技术信息中心(NCBI)、联合基因组研究所(JGI)等数据库的10 TB宏基因组数据中,筛选出25614种含催化残基的丝氨酸整合酶,通过序列分析将其分为五个不同的聚类:INTa-INTe(BxbINT为其中INTd家族成员),其中20%(5203种)来自宏基因组(含4452种人类微生物组来源)。通过报告系统筛选,发现多种整合酶在HEK293FT细胞中的活性高于BxbINT。进一步对这些整合酶的attB位点进行截短优化,发现部分整合酶的attB截短后(最短为34 bp)仍保持高活性,且许多截短体的活性高于BxbINTd。将最优的蜡样芽孢杆菌(Bacillus cereus)来源的整合酶(BceINTa)与SpCas9-MLV-RTL139P融合,构建出PASTEv4,发现该版本在多个内源性基因位点的性能优于基于BxbINTd的PASTE。
图9. 可用于PASTE可编程基因整合的噬菌体来源整合酶的发现
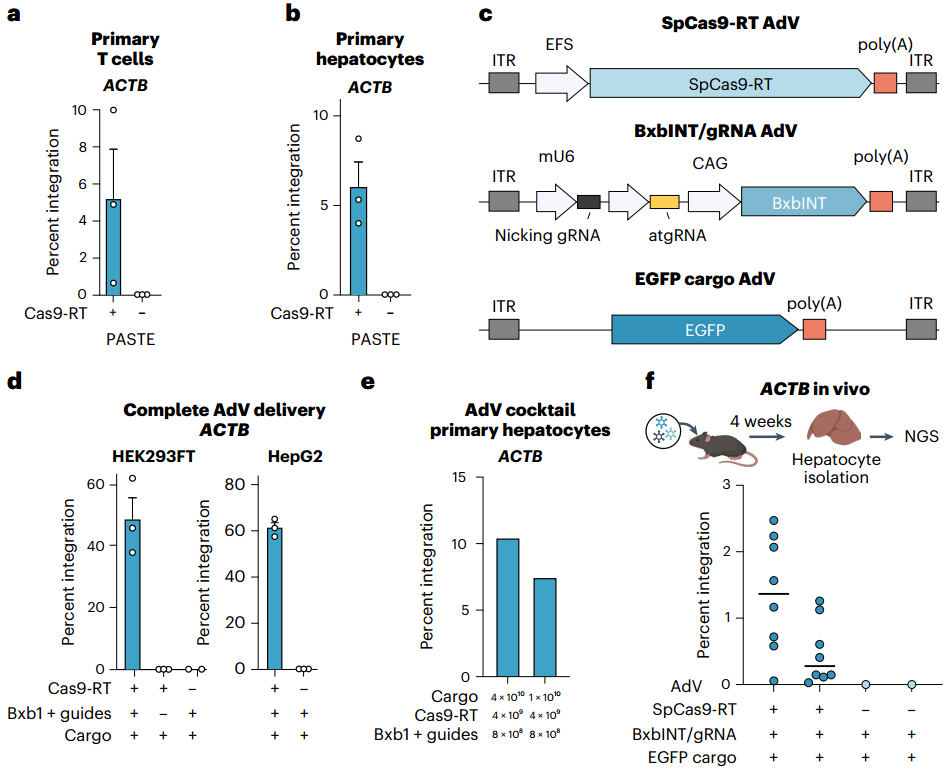
由于PASTE不依赖HDR(仅在分裂细胞活跃),团队通过阿非迪霉素处理使HEK293FT细胞停滞分裂,以测试PASTE在非分裂细胞中的活性。结果显示,PASTEv1在非分裂细胞中仍保持在ACTB位点20%以上的GFP整合效率,而HDR介导的整合则完全消失;即使插入13.3 kb的大片段,非分裂细胞中的整合效率仍大于10%,且增加DNA插入片段用量可进一步提升效率。在原代细胞中,PASTEv1在K562淋巴母细胞中的基因整合效率约为15%;在原代人T细胞中的效率约为5%;在非分裂的静息原代人肝细胞中,PASTEv1在ACTB位点的基因整合效率约为5%——这一结果打破了“大片段整合仅能在分裂细胞中进行”的限制,为体内成熟组织的基因编辑奠定基础。
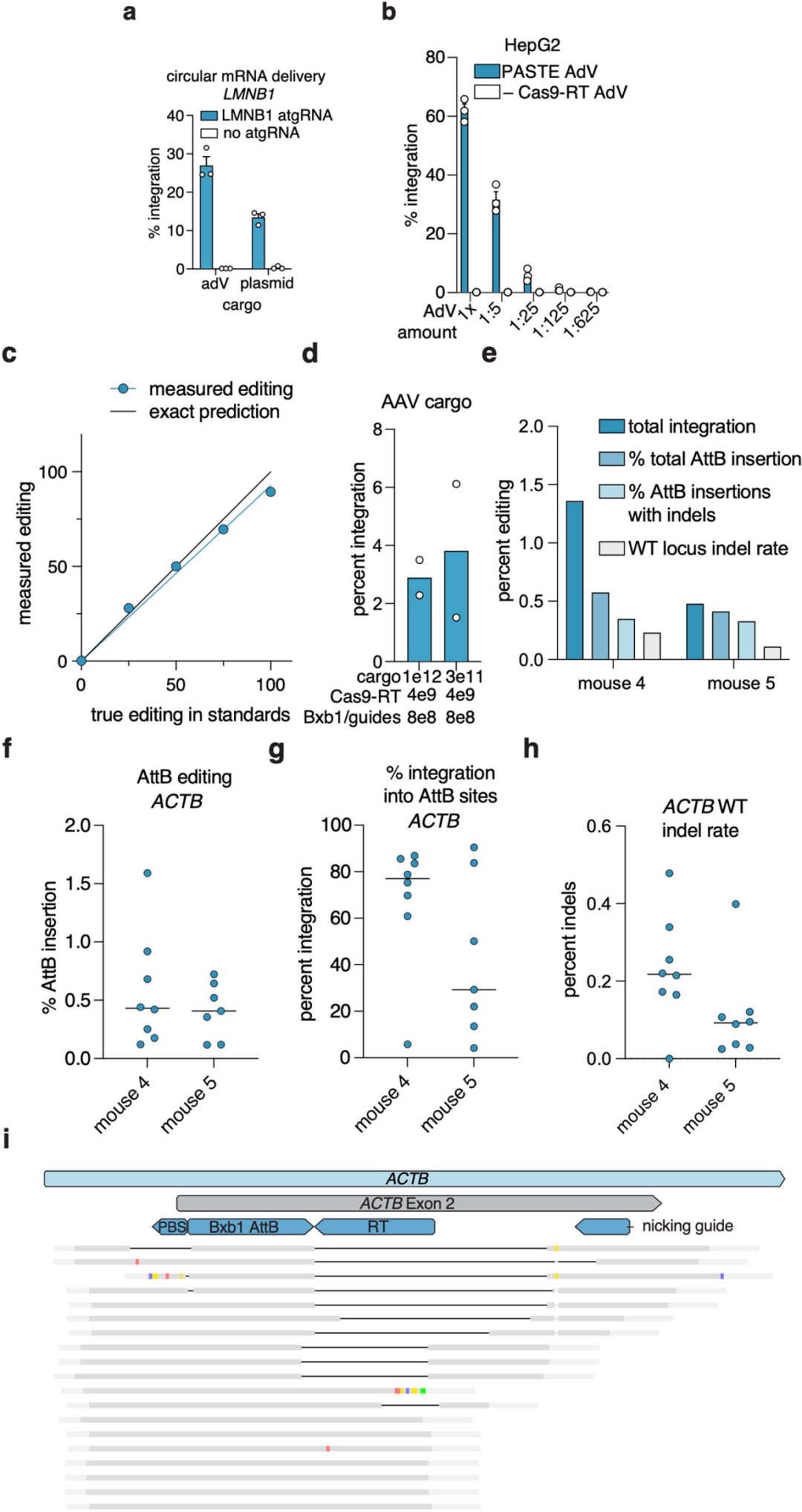
为推动PASTE的临床转化,团队测试了“病毒递送系统”的兼容性:通过腺相关病毒(AAV)递送含attP的片段时,整合效率呈剂量依赖性(4%-10%);腺病毒(AdV)递送36 kb的EGFP片段时,在HEK293FT、HepG2细胞中的效率达10%-20%。为进一步验证PASTE适用于体内递送,团队开发了PASTEv1蛋白组件的mRNA形式,及针对LMNB1靶位点的化学修饰合成atgRNA与切口向导。将这些mRNA与向导RNA进行电穿孔,同时用AdV或质粒递送模板,最终实现高达约20%的整合效率。团队推测,更持久的BxbINT表达有助于整合到基因组中新导入的attB位点,遂测试环状mRNA表达系统,发现其可将整合效率提升至约30%。为进一步优化递送策略,团队将完整PASTE系统(包括Cas9-RT融合蛋白、整合酶、引导RNA及外源片段)分别包装到三种AdV载体中(如图11c)。结果显示,在HEK293FT和HepG2细胞中,仅通过病毒递送即可实现高达约50%-60%的整合效率;在原代人肝细胞(PXB细胞)中,该系统的效率达10.5%(呈片段依赖性),使用AAV模板时整合效率可达3.8%。
为验证体内活性,团队在5.5月龄的肝脏人源化FRG小鼠(人肝细胞重建率≥70%)中,通过眶后注射三载体PASTE系统,3周后检测发现:PASTE在嵌合肝脏中的人肝细胞中可实现高达2.5%的整合效率,且在ACTB位点的indel副产物形成率仅为0.1%-0.2%。
图10. PASTE病毒模板的评估及非分裂细胞中的编辑表征
图11. PASTE与多种递送方法兼容,可以递送至原代细胞类型和体内动物模型
图12. PASTE介导的体内肝脏编辑补充表征
总结
本研究开发的PASTE技术通过理性设计Cas9、RT与整合酶连接子,构建出新型融合蛋白系统,可实现5-50%效率的精准基因组整合。该系统可在9个不同的内源性位点插入13种不同的片段(大小从779 bp到约36 kp不等),意味着可将超过99.7%的人类cDNA作为转基因插入。通过优化attB/attP序列及开发PASTEv3/v4编辑器,其效率显著优于现有先导编辑与整合酶系统,且未检测到脱靶活性。PASTE具备多基因标记、替换与递送功能,并成功在非分裂细胞(原代肝细胞、T细胞)及人源化小鼠模型中实现高效编辑。该技术为遗传病治疗提供了新范式——通过可编程方式将WT基因(如全长功能基因)插入内源性位点,可解决绝大多数潜在突变问题,有望成为一种普适性疗法。此外,PASTE在细胞治疗领域同样具有重要应用价值,其模块化设计将进一步推动基因组编辑在基础研究与临床治疗中的广泛应用。
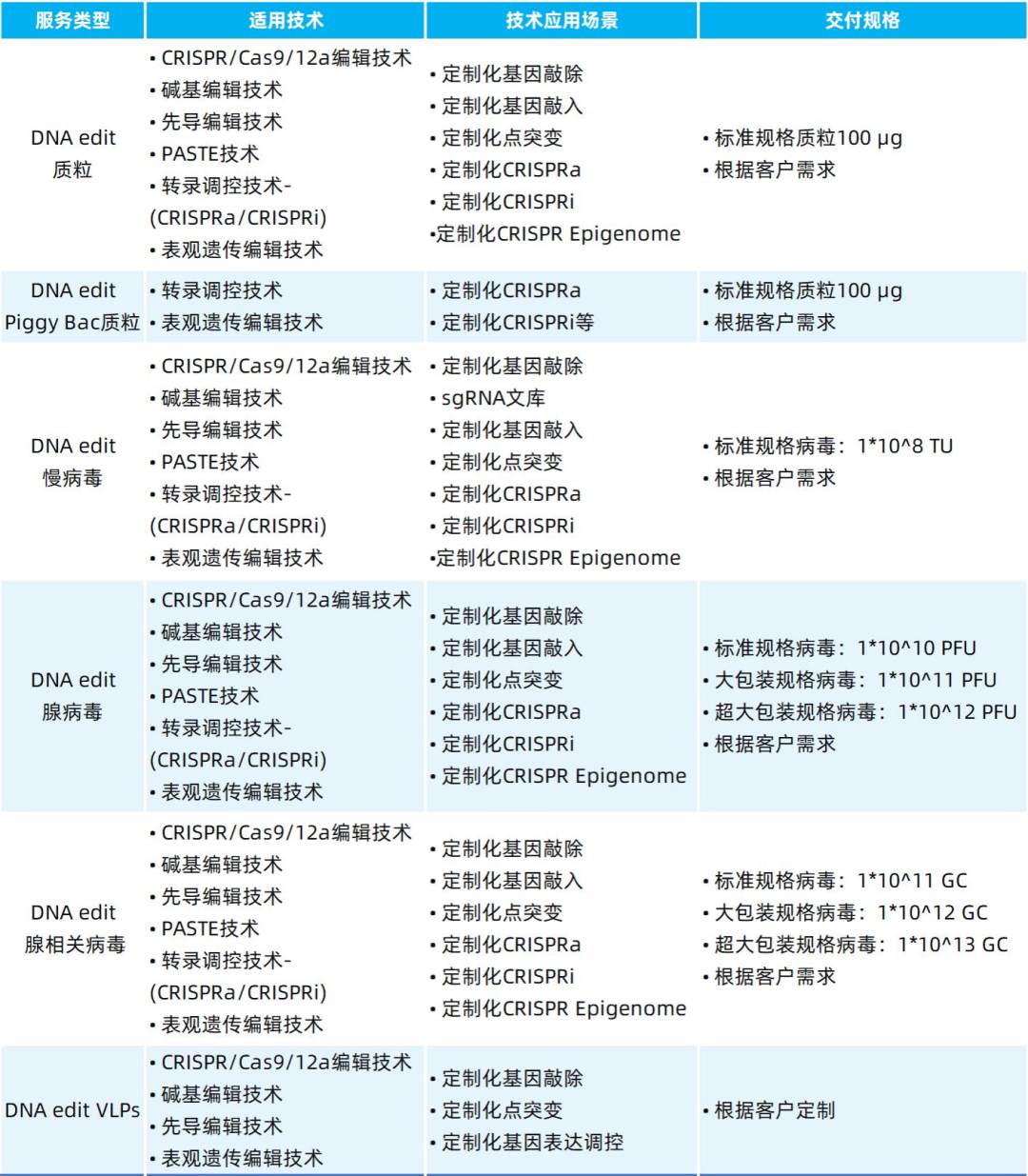
我司可提供包括PASTE技术在内的多种基因编辑递送工具,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK