2025-09-08 阅读量:1312
对处于禁食状态的动物而言,无论物种差异如何,其均需具备识别并摄入富含糖类的高热量食物的功能,以满足自身能量需求。在膳食糖类中,葡萄糖是机体的主要能量来源——尤其是脑细胞,其能量供应高度依赖葡萄糖。以人类为例,大脑重量仅占体重的约2%,却消耗了体内葡萄糖衍生能量的近20%。大脑葡萄糖浓度的急剧下降会引发严重健康问题,包括认知与反射功能受损、自主神经功能衰竭,甚至永.久性脑损伤。因此,为维持葡萄糖浓度在正常范围内(尤其是在饥饿期间),动物会通过监测胃肠道中的葡萄糖水平,并将其与其他宏量营养素(如脂质、蛋白质,或不含葡萄糖结构单元的其他碳水化合物)区分开来。事实上,胃肠道中的营养成分信息会被快速传递至大脑的特定区域,其中之一便是下丘脑弓状核中的刺鼠相关蛋白(AgRP)/神经肽Y(NPY)神经元集群。饥饿响应性AgRP/NPY神经元会被肠道中多种营养素(碳水化合物、蛋白质和脂肪)的信号所抑制,这可能是下丘脑弓状核将总热量信息整合为饥饿感的机制。值得一提的是,AgRP/NPY神经元的抑制程度与直接输注到肠道的热量值成正比,且与宏量营养素的种类无关。
天然糖类通过提供甜味和充足热量来对动物产生奖赏效应,这两种信号分别通过味觉依赖性和非味觉依赖性通路被感知。一系列开创性研究表明,肠道中存在一套专门用于检测糖类营养成分并触发动物主动获取糖类行为的系统。例如,将营养性糖类与中性风味物质共同直接输注到胃部,可诱导动物对该风味物质产生偏好,且此过程不会激活任何口腔感觉细胞。与此一致的是,味觉缺失的trpm5基因敲除(trpm5-/-)小鼠仍能对糖类的营养价值做出响应。近期研究还阐明了多巴胺奖赏系统中分别编码“营养性糖类”与“非营养性甜味剂”的独立通路。然而,目前尚不清楚是否存在一套能将D-葡萄糖与其他种类的宏量营养素或其他糖类区分开的神经编码系统。
对这一问题的深入认识源自一项黑腹果蝇研究。与味觉缺失小鼠类似,味觉缺失的果蝇在禁食状态下也能轻松区分营养性的D-葡萄糖与非营养性的L-葡萄糖。为筛选出响应D-葡萄糖而非L-葡萄糖所必需的细胞,研究人员开展了无偏倚GAL4筛选[酵母转录因子GAL4与特定DNA序列UAS(上游激活序列)的特异性结合,驱动下游基因的表达],最终在果蝇大脑的脑间部中鉴定出一组表达利尿激素44肽(DH44)的细胞,共6个。这些DH44神经元在动物区分“营养性与非营养性糖类”以及“饥饿状态下促进糖类摄入”的过程中发挥关键作用。需要特别指出的是,在禁食条件下,DH44神经元的活性会被D-葡萄糖强烈激活,但不会被L-葡萄糖、其他种类的宏量营养素或其他营养性糖类激活——这凸显了其对D-葡萄糖的特异性响应。鉴于黑腹果蝇的DH44与哺乳动物的促肾上腺皮质激素释放因子(CRF)具有同源性,作者提出假设:禁食状态下,小鼠下丘脑室旁核(PVN)中的CRF神经元(简称CRFPVN神经元)在介导D-葡萄糖的检测与摄入过程中具有重要作用。
CRFPVN神经元可激活下丘脑-垂体-肾上腺(HPA)轴,促使机体在应对生理或心理应激时产生糖皮质激素。这些糖皮质激素通过在长期禁食期间调控“反调节反应(CRRs)”,帮助维持葡萄糖稳态。除调控HPA轴外,CRFPVN神经元还介导多种生理功能,包括影响急性应激行为、对厌恶及奖赏性感觉刺激的响应、应激控制与防御行为调节,以及通过肠道微生物组调控社交行为。为支撑这些功能,CRFPVN神经元会接收来自大脑多个区域的大量信号输入。
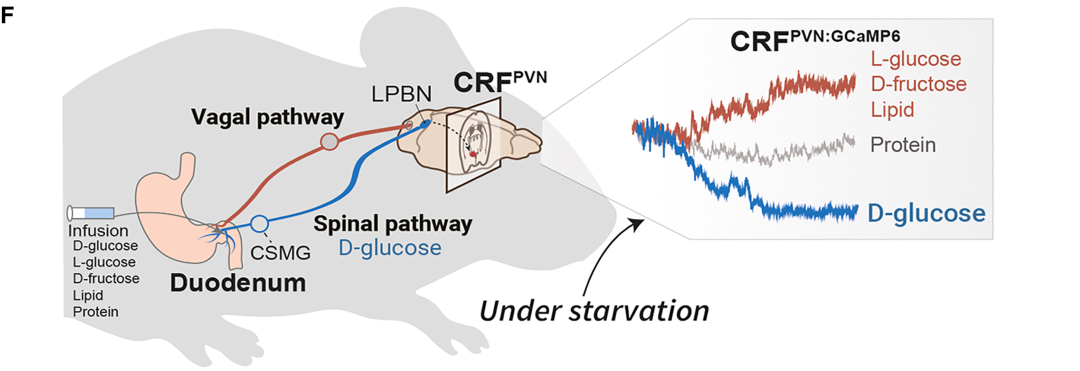
2025年6月20日,韩国科学技术院(简称KAIST)生物科学系Greg S.B. Suh教授课题组在Neuron期刊(IF=15)以“Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis”为题发表研究论文。该研究中,作者发现:CRFPVN神经元中的一个亚群能对肠道D-葡萄糖产生特异性、快速性响应,并促进D-葡萄糖的摄入。干扰CRFPVN神经元的活性会削弱禁食小鼠对含D-葡萄糖糖类的偏好。通过光纤光度法和梯度折射率(GRIN)透镜引导的单细胞成像技术,研究人员观察到:向小肠近端输注含D-葡萄糖的糖类快速抑制了CRFPVN神经元的活性,且这种响应模式与非营养性糖类、脂质、蛋白质或不含D-葡萄糖结构单元的糖类截然不同。研究者进一步描绘了将肠道营养信号传递至CRFPVN神经元的外周神经通路,发现脑桥背外侧臂旁核(PBNdl)的一个亚群可与CRFPVN神经元及脊神经形成单突触连接。该神经环路是CRFPVN神经元对肠道D-葡萄糖产生响应的必需条件。综上所述:禁食状态下,大脑中的CRFPVN神经元亚群会被募集,用于识别并编码肠道D-葡萄糖(作为大脑的能量来源),这一机制可能有助于缓解低血糖诱导的HPA轴激活。
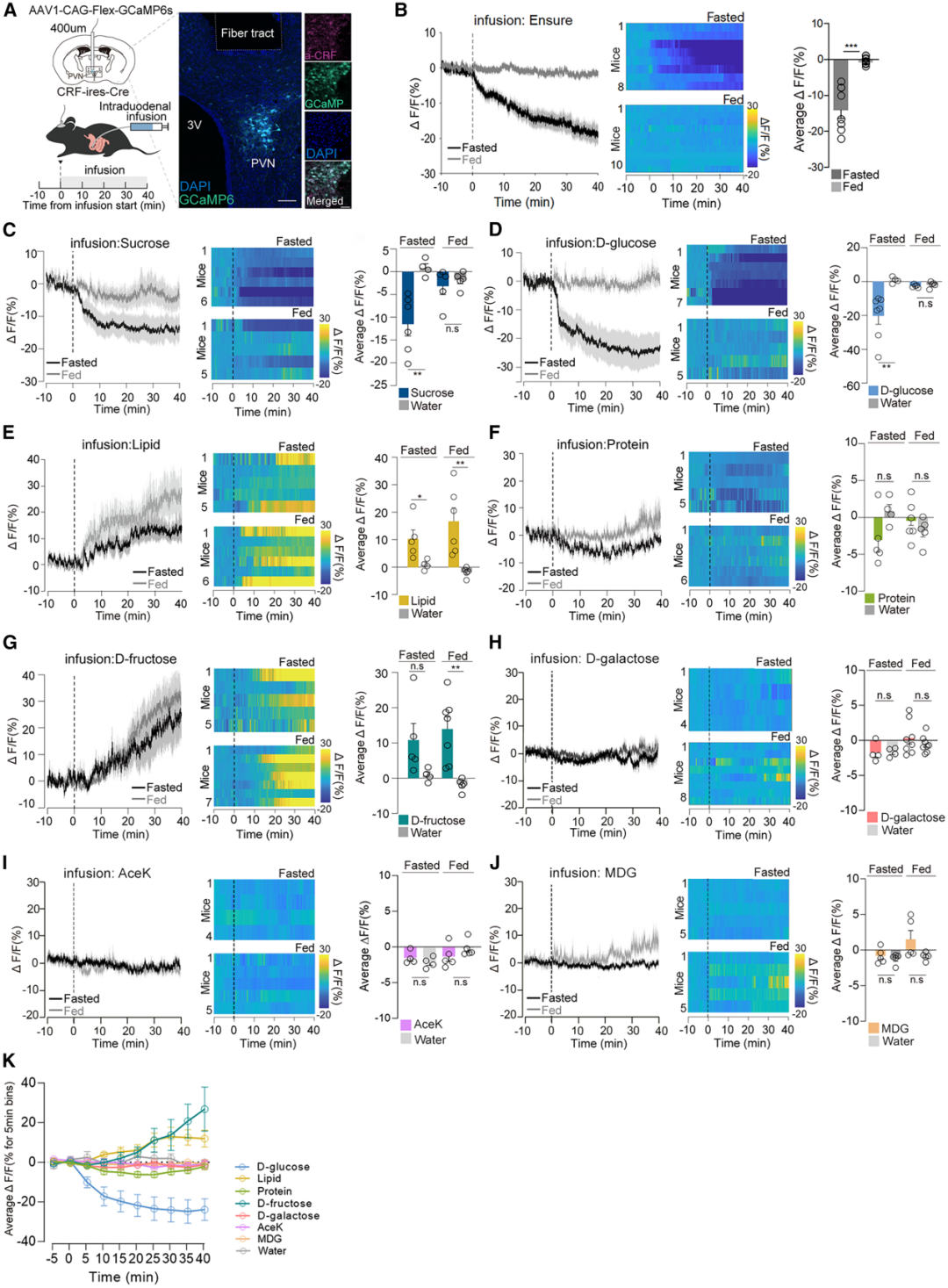
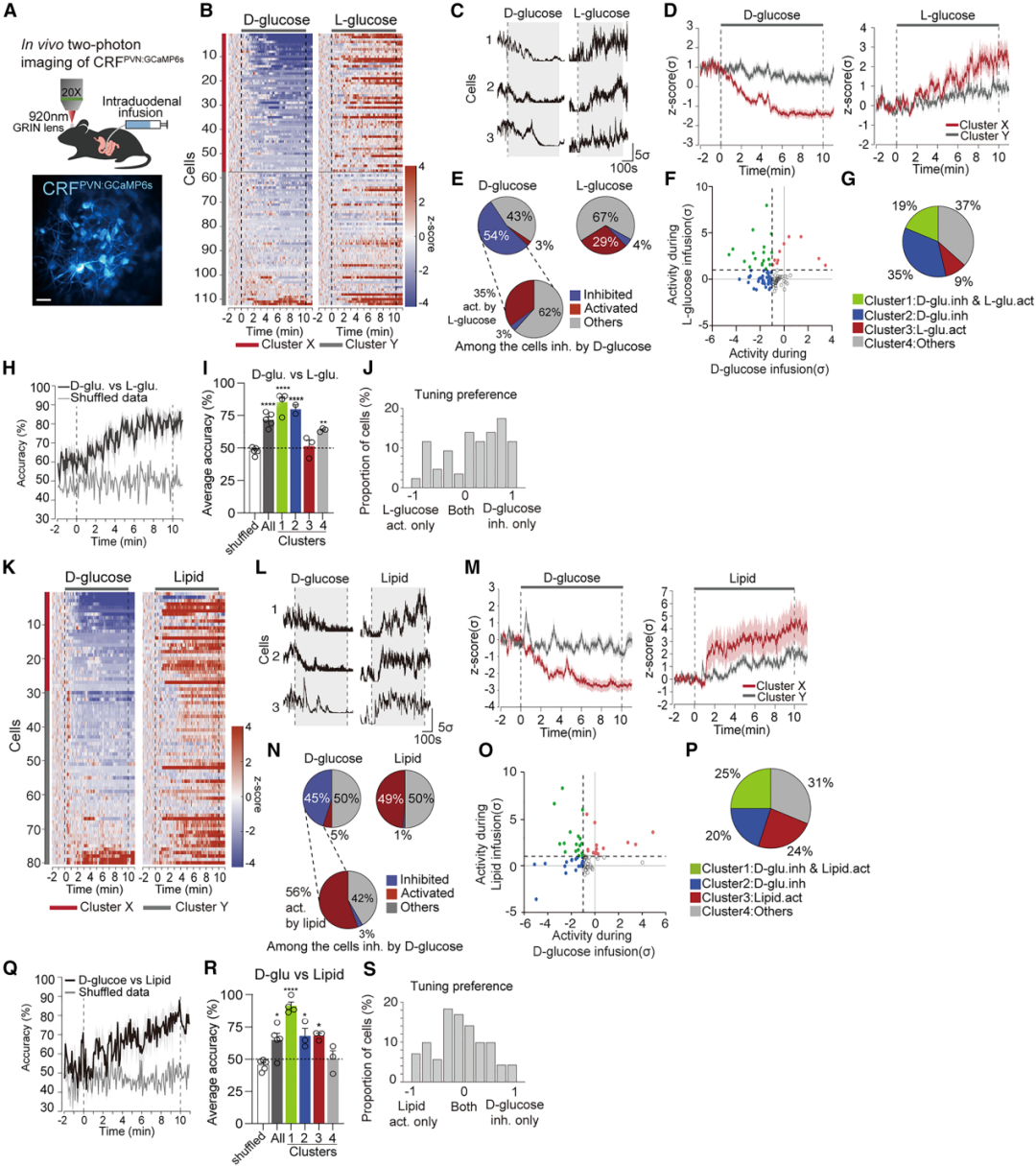
1.向肠道输注D-葡萄糖快速抑制了CRFPVN神经元活性
作者前期研究中报道,食物的口腔感觉感知(如味觉、触觉等)最初会抑制CRFPVN神经元活性,且在食物被摄入后,这种抑制状态仍会持续。于是,研究人员提出假设:胃肠道内存在营养物质的信号,可独立于口腔感觉介导的作用,对CRFPVN神经元活性产生显著抑制。为验证摄入营养性糖类会调控CRFPVN神经元活性这一可能性。研究者采用如下方法:通过植入导管,将营养物质直接输送至营养吸收起始部位——上段肠道(十二指肠),输注速率为15 μL/min,持续40 min(总输注量600 μL);同时,利用在体光纤光度法,在自由活动的CRF-IRES-Cre小鼠(Cre酶仅在CRF阳性神经元中表达)中记录CRFPVN神经元的GCaMP6s荧光信号。结果显示,以15 μL/min的速率向十二指肠内(ID)输注营养全面的流质饮食(Ensure,1.2 kcal/mL),对CRFPVN神经元活性产生强效且持续的抑制;与进食状态小鼠相比,禁食状态小鼠的这一反应更为显著。这些结果表明,在无口腔感觉刺激的情况下,直接向肠道输注营养物质,仍能对脑内CRFPVN神经元的活性产生强效影响。
为明确是哪种特定宏量营养素导致了CRFPVN神经元的强烈抑制效应,研究人员向ID输注了等体积的水、三氯蔗糖、等热量营养性糖类,以及脂质和蛋白质。结果显示:水和非营养性糖类三氯蔗糖(其可能无法进入血液循环被吸收)均未改变进食或禁食状态小鼠的CRFPVN神经元活性;而营养性糖类(30%蔗糖溶液)则显著抑制了CRFPVN神经元活性,且在禁食状态下的抑制效应尤为明显。与此一致的是,在禁食状态下,向ID输注等热量的营养性30%D-葡萄糖溶液后,CRFPVN神经元活性被强烈抑制。当输注的D-葡萄糖总量达到约20 mg时,这种抑制效应才具有统计学显著性[输注30%D-葡萄糖溶液(速率15 μL/min)后,抑制潜伏期均值为4.3±0.5 min;总摄入量:19.35 mg]。相比之下,向ID输注30%非营养性L-葡萄糖溶液则产生了相反效应:无论在禁食还是进食状态下,均显著增强了CRFPVN神经元的GCaMP信号。
为判断D-葡萄糖对CRFPVN神经元活性的抑制效应是否仅与输注的热量值相关(而非宏量营养素的种类或性质),研究者向小鼠ID输注了13.3%脂肪乳剂溶液或30%蛋白质溶液(二者均与此前输注的30%D-葡萄糖溶液热量相等),同时记录CRFPVN神经元活性。结果显示:这些输注均未导致CRFPVN神经元活性降低;相反,输注脂质会在禁食和进食状态下,均对CRFPVN神经元活性产生急性且显著的激活效应;而等热量的蛋白质溶液则对CRFPVN神经元活性无显著影响。鉴于CRFPVN神经元对D-葡萄糖和蔗糖的响应,与对其他宏量营养素的响应存在显著差异,作者进一步探究了向ID输注蔗糖的另一单糖组分——D-果糖是否会引发类似响应。结果显示:输注等热量的30%D-果糖溶液,并未降低进食或禁食状态小鼠的CRFPVN神经元活性,反而意外地引发了该神经元活性的强效增强,这一效应与非营养性L-葡萄糖引发的效应类似。向ID输注30%D-半乳糖溶液,无论在进食还是禁食状态下,均未对CRFPVN神经元活性产生抑制或激活效应。类似地,其他非营养性甜味剂(如30 mM安赛蜜钾(AceK)、30%α-甲基-D-吡喃葡萄糖苷(MDG)、500 mM D-甘露醇),在进食或禁食状态下均未对CRFPVN神经元产生抑制或激活效应。不过,这些甜味剂可能无法被高效吸收进入血液循环,因此未导致CRFPVN神经元活性发生改变。在所有输注物浓度较低时,CRFPVN神经元GCaMP信号的强度和持续时间均不那么显著;但即便在较低浓度下,ID D-葡萄糖对CRFPVN神经元活性的特异性抑制,这一效应仍清晰可辨。这些结果支持以下假说:CRFPVN神经元能够区分肠道内的D-葡萄糖或含D-葡萄糖结构单元的糖类(它们可作为脑细胞的能量来源),与其他宏量营养素(包括脂质、蛋白质以及不含D-葡萄糖结构单元的糖类)。
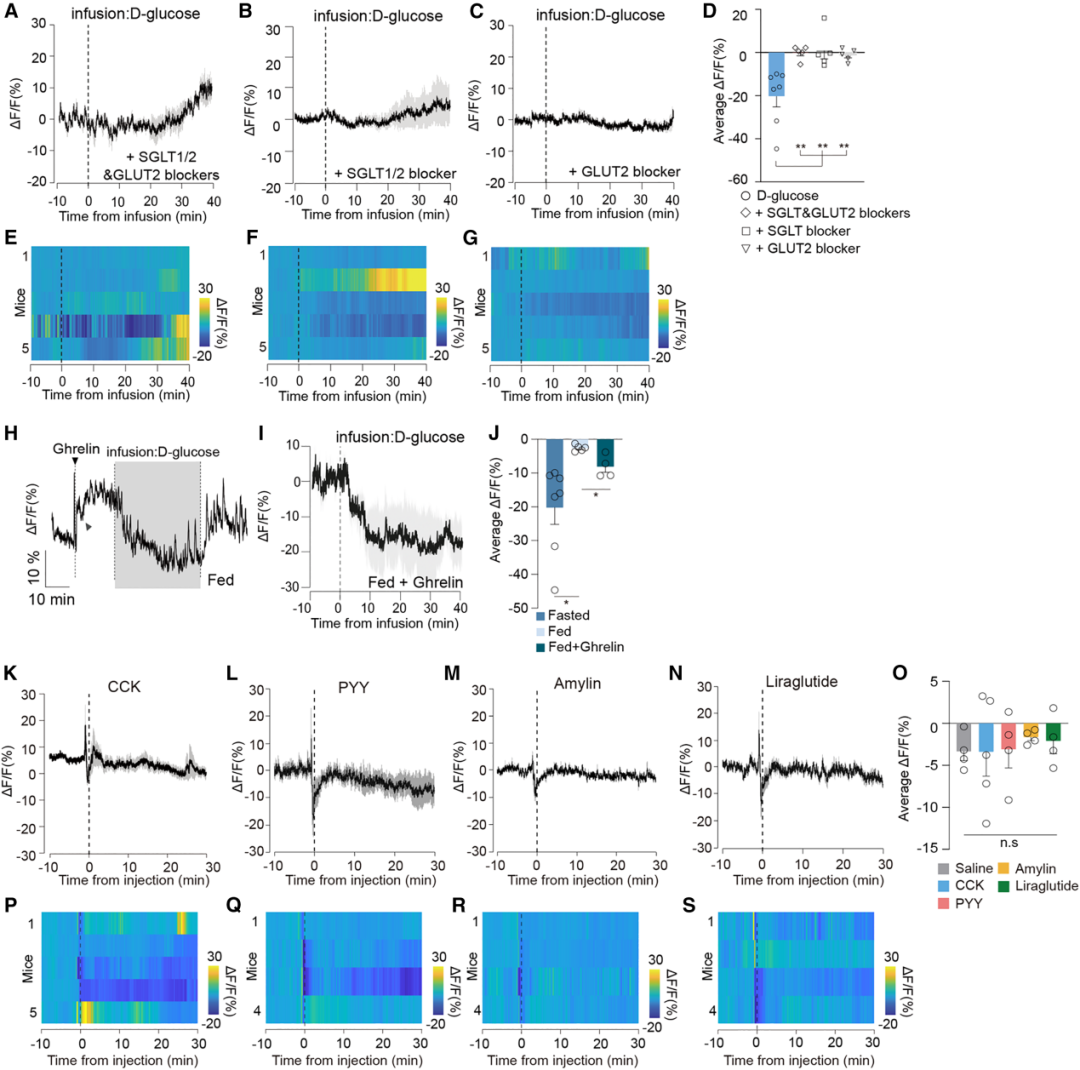
鉴于禁食状态下CRFPVN神经元对ID D-葡萄糖存在快速且特异性响应这一发现,作者进一步探究了肠道营养信号如何传递至脑内的CRFPVN神经元。为明确D-葡萄糖输注对CRFPVN神经元的抑制效应,是发生在肠道管腔的吸收前阶段,还是在D-葡萄糖通过肠壁(即穿过肠上皮细胞)被吸收之后,研究者将D-葡萄糖与两种D-葡萄糖转运蛋白阻断剂中的一种(根皮苷,作用于钠-葡萄糖协同转运蛋白SGLT1/2;或根皮素,作用于葡萄糖转运蛋白GLUT2),或两种阻断剂的混合物共同输注。结果显示,这些处理完全消除了D-葡萄糖诱导的CRFPVN神经元抑制效应,这表明ID D-葡萄糖对CRFPVN神经元活性的抑制作用,依赖于D-葡萄糖的吸收后信号传递。该发现与此前研究一致——已有研究证实,D-葡萄糖可通过SGLT1和GLUT2从肠道管腔转运至血液循环。这种转运机制与D-果糖和脂质的转运机制不同,且可能与CRFPVN神经元产生的相反响应相关。
已知肠道管腔内的营养物质可诱导多种饱腹激素释放,或激活外在传入神经。因此,研究人员进一步探究了体液信号对CRFPVN神经元的潜在影响。结果显示:对自由进食的小鼠进行腹腔内(i.p.)注射促食欲的饥饿激素——饥饿素后,CRFPVN神经元活性确实显著增强;但在随后进行ID D-葡萄糖输注后,该神经元活性又被抑制。这与禁食状态下ID输注D-葡萄糖对CRFPVN神经元活性的抑制效应一致。然而,在禁食状态下,对小鼠i.p.注射多种厌食性胃肠激素[包括胆囊收缩素(CCK)、酪酪肽(PYY)、胰淀素(amylin),或胰高血糖素样肽-1(GLP-1)激动剂利拉鲁肽],均未对CRFPVN神经元活性产生调控作用。这些结果表明,胃肠饱腹肽水平的变化可能不会直接影响CRFPVN神经元的活性,进一步支持了CRFPVN神经元活性不受体液饱腹信号影响,而是通过特定机制快速区分肠道内摄入的D-葡萄糖与其他营养物质这一结论。
图1.CRFPVN神经元对D-葡萄糖或含D-葡萄糖结构单元的糖类存在独特反应
图2.D-葡萄糖诱导的CRFPVN神经元抑制依赖于饥饿状态和葡萄糖转运蛋白,而非饱腹激素
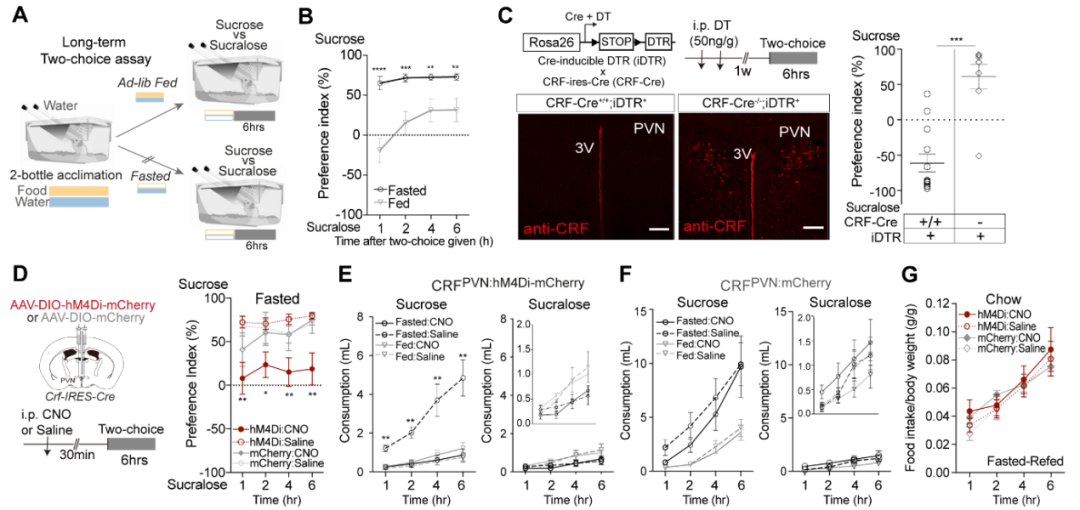
2.CRFPVN神经元活性是禁食诱导的D-葡萄糖行为反应所必需的
接下来,作者探究了在无条件反射训练的情况下,CRFPVN神经元是否对机体响应营养性D-葡萄糖发挥重要作用。为此,设计了一项二选一测试:在自由摄食或禁食条件下,给无经验小鼠(即从未接触过纯糖溶液的小鼠)提供两个带喷嘴的水瓶,一个装有100 mM营养性蔗糖溶液,另一个装有0.5 mM非营养性三氯蔗糖溶液(所选浓度经预实验验证,可使自由摄食小鼠对两种溶液表现出同等偏好)。其中蔗糖浓度与小鼠日常食用的饲料中蔗糖浓度相近。结果显示,自由摄食小鼠在实验开始后的最初几小时内,对蔗糖和三氯蔗糖无明显偏好,但在实验开始后4-6小时内,逐渐开始摄入更多蔗糖——此期间未提供其他食物。而经过20小时禁食的小鼠,在开始摄食后的1小时内,蔗糖摄入量显著高于三氯蔗糖。在建立了可检测“禁食诱导的营养性糖偏好”的行为学实验方法后,进一步探究:禁食条件下,CRFPVN神经元是否是介导这种偏好的必需因素。于是,研究者发现,通过i.p.注射白喉毒素(DT)消除CRFPVN神经元的小鼠[将CRF-IRES-Cre小鼠与诱导型白喉毒素受体(iDTR)小鼠(DTR基因在LSL序列下游)杂交获得],无法优先选择营养性糖而非无营养性甜味剂;而对照组小鼠(即iDTR小鼠)则会对营养性糖产生偏好。此外,对禁食状态的CRF-IRES-Cre小鼠进行双侧PVN注射,导入携带“双loxP反向开放阅读框(DIO)-hM4Di-mCherry”的腺相关病毒(AAV),以化学遗传学沉默CRFPVN神经元。行为学实验前该组小鼠i.p.注射氯氮平-N-氧化物(CNO,hM4Di受体激动剂),结果显示,其对蔗糖的偏好和摄入量均被消除,但对三氯蔗糖的摄入量无影响。
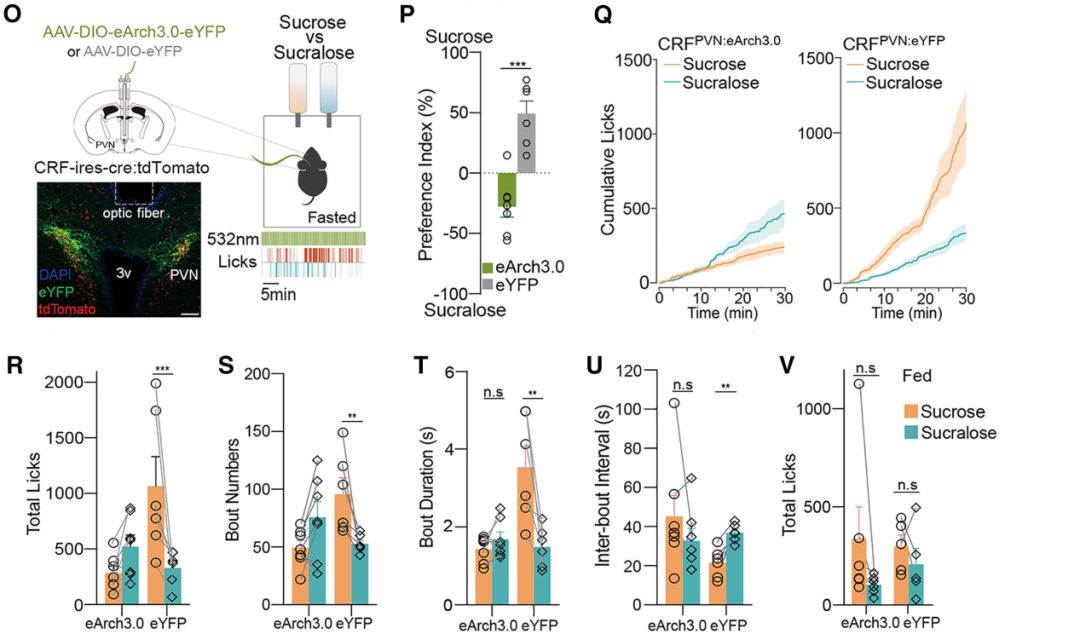
由于禁食诱导的营养性糖偏好在1小时内即会显著显现,作者采用短期二选一测试,探究光遗传学调控CRFPVN神经元是否会改变这种偏好。向小鼠注射携带DIO-eArch3.0-eYFP的Cre诱导型AAV病毒以实现CRFPVN神经元的光遗传学抑制。所有注射均在CRF-IRES-Cre/Ai14小鼠(CRF阳性神经元中表达tdTomato报告基因)的双侧PVN进行。使用舔舐计数器评估小鼠的摄食行为——该仪器可在毫秒级时间尺度上自动记录舔舐事件。结果显示,表达对照病毒AAV-DIO-eYFP的禁食无经验小鼠,无论是否接受光刺激,在实验开始后10分钟内即快速表现出对蔗糖的偏好,且蔗糖摄入量高于三氯蔗糖。具体而言,小鼠对蔗糖的舔舐次数和单次舔舐时长显著增加,舔舐间隔显著缩短——这与禁食小鼠偏好并摄入更多营养性糖的观点一致。与之相反,通过光遗传学沉默CRFPVN神经元活性的禁食小鼠,无法优先选择蔗糖而非三氯蔗糖,且蔗糖摄入量低于三氯蔗糖。与此一致,该组小鼠对蔗糖的舔舐次数、单次舔舐时长及舔舐间隔,与对三氯蔗糖的相应指标无显著差异。
需要特别指出的是,研究者发现光遗传学抑制CRFPVN神经元对自由摄食小鼠的蔗糖总摄入量无影响——这提示该神经元可能仅在禁食条件下对蔗糖摄入发挥重要作用。此外,抑制CRFPVN神经元活性虽显著降低了禁食小鼠的蔗糖摄入量,但对饲料(除糖外还含其他宏量营养素)的摄入量无影响。这一观察结果与既往研究报道一致:CRFPVN神经元活性通常不调控急性摄食量或体重。总的来看,这些证据支持以下假说:仅在食物剥夺(禁食)期间,CRFPVN神经元活性对糖的选择和摄入至关重要,而对其他宏量营养素则未必如此。
图3.禁食条件下,CRFPVN神经元活性介导糖的选择和摄入
3.CRFPVN神经元的一个亚群可响应肠道营养素
此前通过光纤光度法记录发现,群体水平的CRFPVN神经元活性会被D-葡萄糖及含D-葡萄糖的糖类抑制,却会被脂质、L-葡萄糖与D-果糖激活,基于此,作者进一步探究是否存在特定的CRFPVN神经元亚群对营养素具有选择性响应。实验中,在清醒、头部固定且植入ID导管的小鼠PVN上方植入梯度折射率透镜(GRIN透镜),通过双光子显微镜进行单细胞钙成像,监测营养素输注过程中单个CRFPVN神经元的GCaMP6s信号变化。对禁食18小时的小鼠,以随机顺序ID输注等浓度L-葡萄糖、等热量D-葡萄糖、脂质、蛋白质或D-果糖(能量密度均为1.2 kcal/mL)。为在不同成像时段追踪相同视野并对细胞进行配准,对比了同日或数日间隔内成像的CRFPVN神经元钙动力学特征,并设置至少20分钟的间隔以避免残留效应。结果显示,禁食小鼠中,大部分被成像的CRFPVN神经元被输注的D-葡萄糖抑制(被抑制:54%,被激活:3%,无明显响应:43%;样本量n=112个细胞),但会被L-葡萄糖激活(被激活:29%,受抑制:4%,无明显响应:67%;n=112个细胞)。部分被归为“无明显响应”的神经元仅表现出微弱反应。值得注意的是,在被D-葡萄糖抑制的CRFPVN神经元中,约35%会被L-葡萄糖激活。K均值聚类分析证实,存在一个被D-葡萄糖抑制但被L-葡萄糖激活的神经元亚群。基于双重响应特征对神经元进行分类发现,19%的CRFPVN神经元属于这一双向响应亚群。利用各簇CRFPVN神经元的钙动力学数据训练支持向量机(SVM),结果显示该模型能以较高准确率区分D-葡萄糖与L-葡萄糖刺激。尤其需要关注的是,用双向响应组CRFPVN神经元数据训练的解码器,其解码准确率显著高于用其他组神经元数据训练的解码器。调谐(Tuning)分析同样发现,17.44%的CRFPVN神经元表现出这种双向响应特征。
ID输注等热量脂质显著激活了大部分CRFPVN神经元(被激活:49%,受抑制:1%,无明显响应:50%;n=80个细胞),而蛋白质对其活性影响极小(被激活:8%,受抑制:9%,无明显响应:83%;n=149个细胞),这一结果与光纤光度法的观测一致。在单细胞水平上,约56%被D-葡萄糖抑制的CRFPVN神经元被脂质激活。K均值聚类分析与响应分类结果显示,25%的CRFPVN神经元被D-葡萄糖抑制且被脂质激活。利用这一双向响应CRFPVN神经元亚群钙动力学数据训练的SVM,实现了对刺激类型的高效分类。调谐分析也显示,30.98%的CRFPVN神经元具有这种双向响应特征。此外,相当比例的CRFPVN神经元对D-果糖产生响应(被激活:33%,受抑制:9%;n=90个细胞),其中约34%与被D-葡萄糖抑制的CRFPVN神经元存在重叠。这些结果表明,存在一个对D-葡萄糖与其他营养素产生双向响应的CRFPVN神经元亚群,该亚群可能有助于机体对D-葡萄糖的识别。
图4.CRFPVN神经元的一个亚群会对肠道营养物质产生响应
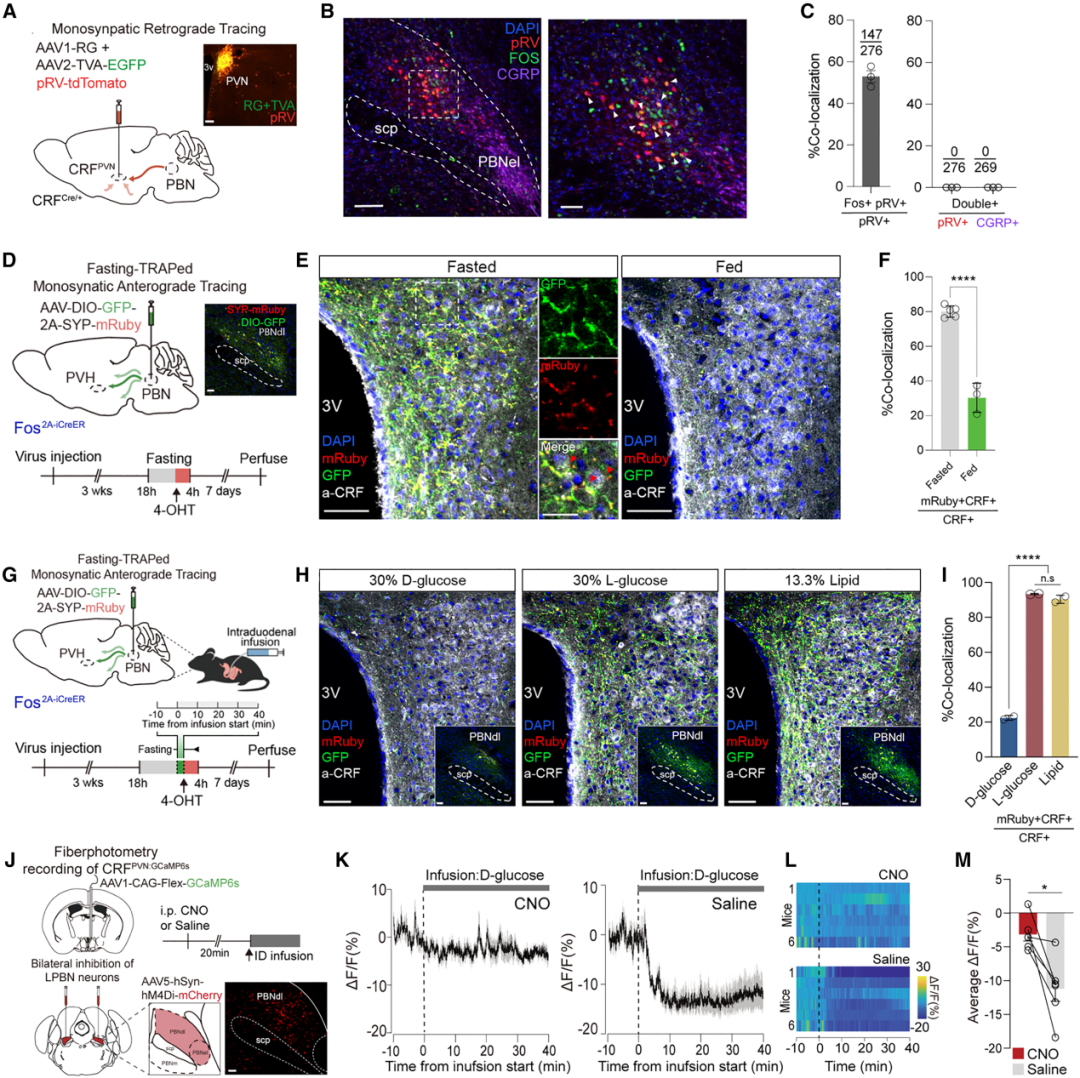
4.背外侧臂旁核(PBNdl)神经元亚群介导D-葡萄糖诱发的CRFPVN神经元抑制
为确定将十二指肠D-葡萄糖信号传递至CRFPVN神经元的上游神经元,作者采用伪型狂犬病病毒(RV-EnvA-ΔG-tdTomato)进行逆行单突触追踪。结果显示,后脑背外侧臂旁核(PBNdl)中存在一个神经元亚群,可通过单突触投射至CRFPVN神经元。此外,向CRFPVN神经元提供单突触输入的部分PBNdl神经元,在禁食18小时后出现cFos蛋白激活。
为验证禁食敏感的PBNdl神经元与CRFPVN神经元之间的解剖学连接,研究者对PBNdl向PVN的轴突投射进行了顺行追踪。为此,向Fos2A-iCreER小鼠(当神经元活动增强时,会启动Cre(iCreER)的表达;而已经表达的Cre能否发挥功能,则依赖他莫昔芬的诱导)的PBNdl区域注射了AAV1-hSyn-FLEX-mGFP-2A-Synaptophysin-mRuby病毒,观察禁食是否会导致mGFP(绿色荧光蛋白)和Synaptophysin-mRuby(红色荧光蛋白)在PBNdl轴突末梢中捕获,且这些轴突末梢需与CRFPVN神经元相邻。禁食18小时后,PVN区域的PBNdl传入纤维被mGFP和Synaptophysin-mRuby清晰标记,且与CRFPVN神经元紧密相邻;而进食状态小鼠的标记信号则极弱。这些实验结果表明,禁食可选择性激活PBNdl中的一个神经元亚群,该亚群通过单突触投射至PVN,且其突触前末梢与CRFPVN神经元距离极近,可能与CRFPVN神经元存在突触连接。
接下来,研究人员试图确定禁食小鼠PBNdl传入纤维中Synaptophysin-mRuby和mGFP的显著捕获现象,是否可通过ID输注D-葡萄糖或其他宏量营养素(排除口腔感觉刺激)来调控。结果显示,ID输注D-葡萄糖(而非无营养的L-葡萄糖或等热量脂质)显著降低了禁食诱导的、支配CRFPVN神经元的PBNdl传入纤维中Synaptophysin-mRuby和mGFP的捕获水平。基于这些发现,作者提出假设:禁食激活的PBNdl神经元(已知主要为谷氨酸能神经元)可被十二指肠D-葡萄糖抑制,且该神经元亚群能为CRFPVN神经元提供抑制性输入。
为评估这些PBNdl神经元在肠道葡萄糖诱发的CRFPVN神经元抑制过程中是否具有功能重要性,研究者在化学遗传学沉默PBNdl神经元的同时,监测CRFPVN神经元对ID输注D-葡萄糖的反应。先向小鼠双侧PBNdl区域注射AAV-hSyn-hM4Di-mCherry病毒,随后在禁食状态下启动ID输注D-葡萄糖前20分钟,为小鼠i.p.注射CNO或生理盐水。对照组(不表达hM4Di的禁食小鼠)对CNO无反应。值得强调的是,实验组中,与注射生理盐水组相比,通过CNO实现的PBNdl神经元化学遗传学沉默,完全消除了D-葡萄糖诱发的CRFPVN神经元抑制效应。然而,这种沉默并不影响CRFPVN神经元对L-葡萄糖、脂质或i.p.注射氯化锂(LiCl)的反应——i.p.注射LiCl会引发胃部不适或内脏痛,且已知会导致CRFPVN神经元激活。这些结果表明,PBNdl神经元可选择性介导D-葡萄糖诱发的CRFPVN神经元活性抑制。
图5.PBNdl神经元的一个亚群会将肠道D-葡萄糖信息传递给CRFPVN神经元
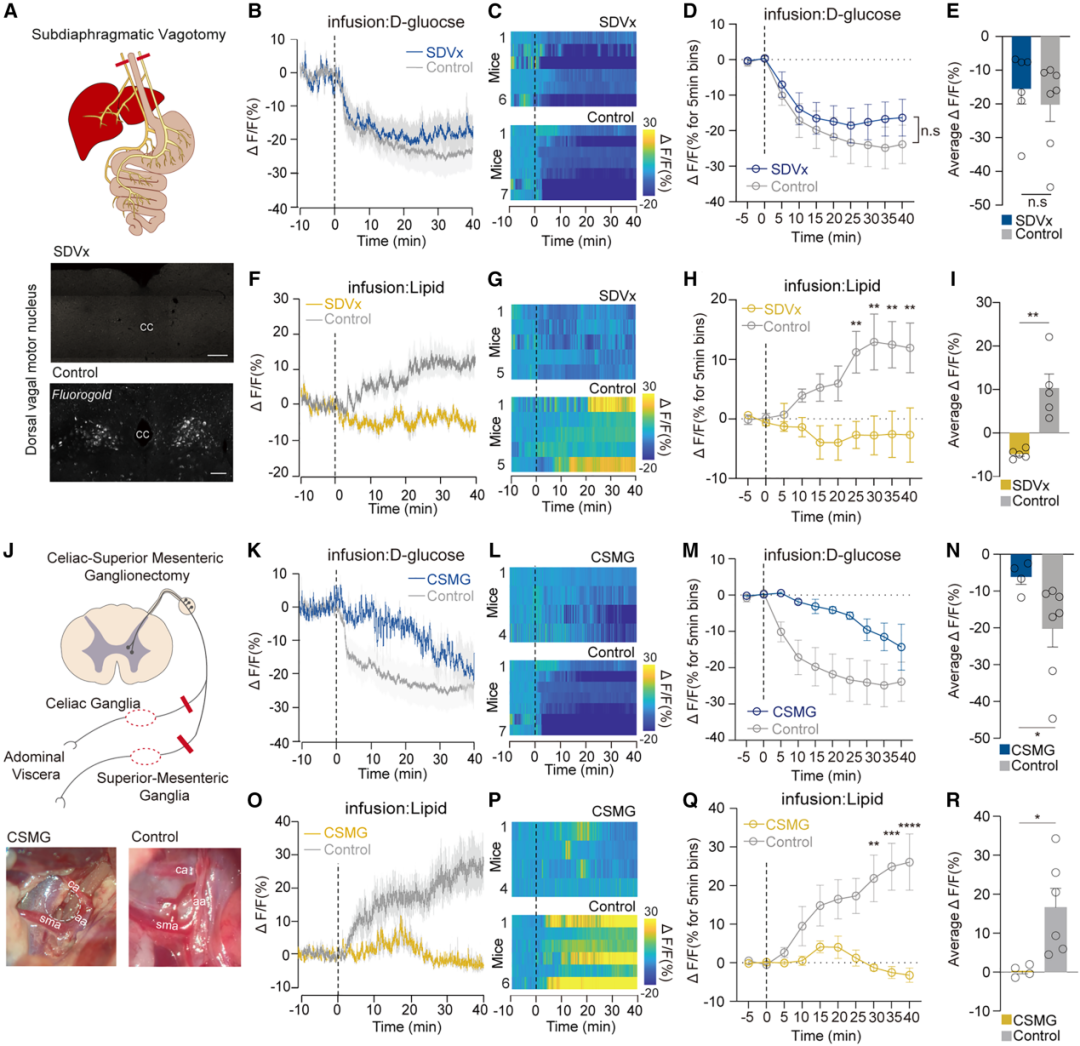
5.肠-脑轴介导营养素诱发的CRFPVN神经元反应
接下来,作者尝试明确迷走神经或脊髓神经通路在将肠道营养相关信号传递至CRFPVN神经元过程中的作用。首先,为已植入ID导管(以方便十二指肠营养素输注)的小鼠实施膈下迷走神经全切断术(SDVx);该手术切断了迷走神经中所有从十二指肠延伸至脑干的感觉轴突。随后,检测了CRFPVN神经元对ID输注糖类或脂质的反应。通过i.p.注射荧光金(一种逆行示踪剂)后,观察到迷走神经背侧运动核(DMV)内无荧光金存在,以此证实SDVx手术成功。结果显示,SDVx并未阻断ID输注D-葡萄糖或蔗糖对CRFPVN神经元反应的急性抑制作用。与之相反,SDVx显著减弱了CRFPVN神经元对ID输注脂质的兴奋性反应。此外,在切断迷走神经的小鼠中,无营养的L-葡萄糖所引起的CRFPVN神经元活性升高也受到了抑制。
由于十二指肠D-葡萄糖与CRFPVN神经元之间的信号传递似乎既不依赖体液信号,也不依赖迷走神经信号,作者进一步拓展研究,评估支配腹腔脏器的非迷走神经内脏大神经传入纤维的作用。研究表明内脏大神经需通过腹腔-肠系膜上神经节复合体(CSMG)从肠道向大脑传递信号。结果显示,切除CSMG(CSMGx)后,十二指肠D-葡萄糖快速降低CRFPVN神经元活性的能力显著减弱。同时,CSMGx也阻断了ID输注脂质对CRFPVN神经元活性的激活作用。然而,CSMGx并未阻碍L-葡萄糖对CRFPVN神经元活性的刺激作用。总的来说,这些结果表明:CRFPVN神经元对吸收后D-葡萄糖信号的反应依赖脊髓通路。与之相反,CRFPVN神经元对ID输注L-葡萄糖的反应依赖迷走神经通路,而CRFPVN神经元对输注脂质的反应则依赖脊髓神经通路或迷走神经通路中的任意一种。
图6.不同的神经通路将肠道营养信号传递至CRFPVN神经元
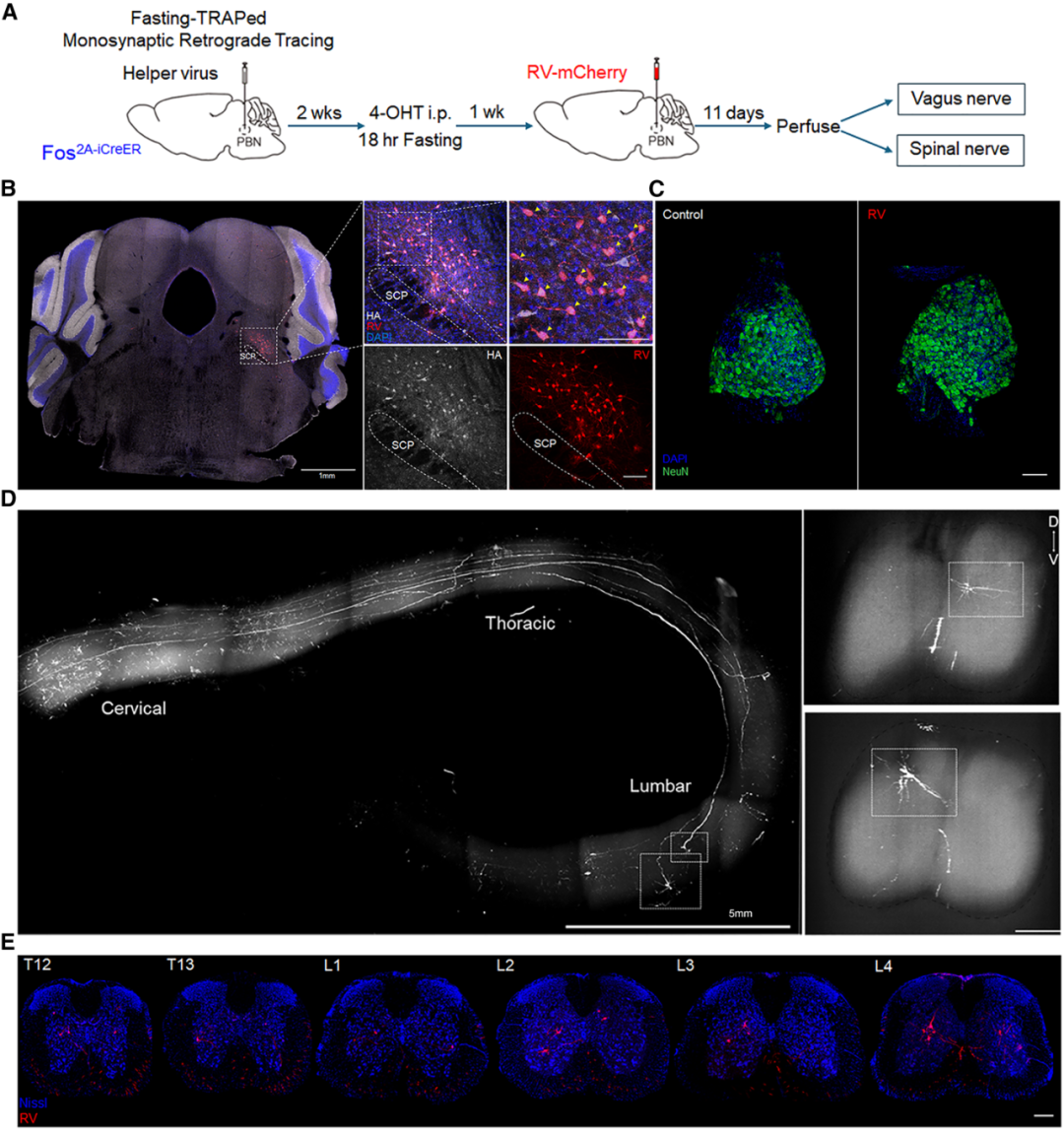
6.PBNdl神经元接收来自脊髓神经的单突触输入
作者已证实,D-葡萄糖诱发的CRFPVN神经元活性抑制依赖非迷走神经内脏大神经传入纤维与PBNdl神经元,且CRFPVN神经元会接收来自禁食激活的PBNdl神经元的单突触输入。在此基础上,作者接下来试图明确:对禁食敏感的PBNdl神经元是否会选择性地与来自脊髓的非迷走神经内脏大神经传入纤维形成连接。为此,利用工程化RV,对禁食敏感的PBNdl神经元的单突触输入进行逆行追踪。向Fos2A-iCreER小鼠的PBNdl区域共注射了RV[RV-EnvA-ΔG-mCherry或RV-CVS-EnvA-N2c(ΔG)-mCherry]与辅助AAV——该小鼠的creER表达需通过18小时禁食诱导;随后观察禁食是否会导致mCherry(红色荧光蛋白)在脊髓神经、迷走神经中任一者或两者中出现捕获现象。经过一段时间禁食后,证实PBNdl区域的起始细胞已被成功标记。通过对脊髓与结状神经节进行二维(2D)和三维(3D)组织学分析,发现脊髓中存在一个特征明确的神经群体:其胞体位于脊髓腰段和胸段,且轴突向吻侧(脑部方向)广泛投射;而在结状神经节的迷走神经中,未检测到任何由RV介导的mCherry标记信号。这些结果表明,对禁食敏感的PBNdl神经元亚群会接收来自脊髓通路的单突触输入。
图7.RV从PBNdl神经元逆行单突触追踪到脊髓神经元
总结
该研究首次在哺乳动物大脑中鉴定出一类可特异性编码D-葡萄糖的神经元亚群——CRFPVN神经元,这类神经元能特异性响应肠道D-葡萄糖。此外,研究进一步揭示了支撑这一特异性识别功能的神经环路基础——一条专属的脊髓-脑桥-下丘脑通路。具体而言,肠道感知的D-葡萄糖信号先经脊髓内脏传入纤维上传,经CSMG中继后,传递至脑桥PBNdl,再由PBNdl神经元通过单突触投射传递至下丘脑CRFPVN神经元,最终形成“肠道D-葡萄糖信号→脊髓→脑桥PBNdl→下丘脑CRFPVN神经元”的精准信号传导通路。
这一发现清晰阐明了饥饿状态下机体对葡萄糖的优先识别机制:当动物处于禁食状态时,上述神经元亚群通过该专属通路精准捕获肠道D-葡萄糖信号,并将其编码为“优先供能信号”,进而调控摄食偏好——促使动物优先选择富含D-葡萄糖的食物,以确保大脑获得最直接、高效的“救命燃料”(葡萄糖是饥饿状态下大脑最主要且可直接利用的优先供能物质,其他营养素需经复杂代谢途径转化,均无法快速满足脑供能需求)。
图8.神经环路模式图
本文使用的病毒产品,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK