2025-08-25 阅读量:739
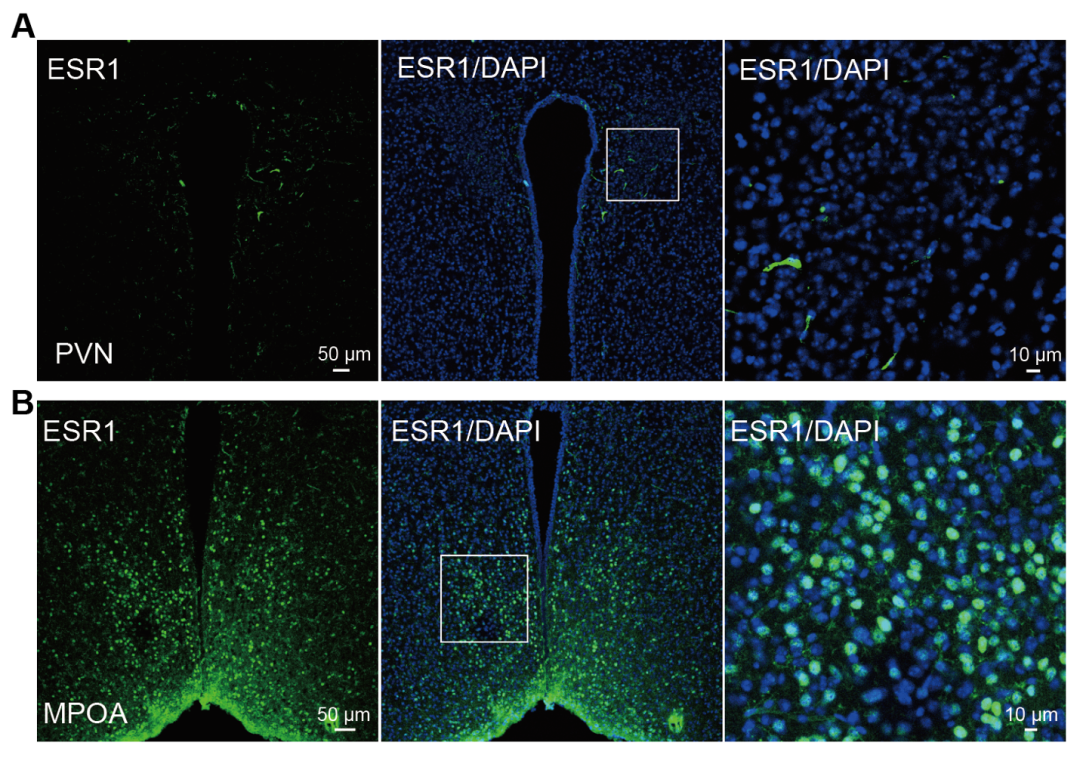
生殖激素水平,尤其是分娩后的激素波动,会影响一系列生理、行为和情绪状态。例如,主要由胎盘合成的雌激素在妊娠晚期会增加100至1000倍,而在产后则迅速降至孕前水平。雌激素水平的显著波动与产后抑郁症(PPD)的发病风险升高密切相关,其症状包括快感缺失、无助感、社交障碍和焦虑等。这些症状被认为源于分布在整个大脑中的复杂神经环路。研究发现,多个高表达雌激素受体的脑区可能参与检测生殖激素水平的变化,包括海马、杏仁核和内侧视前区(MPOA)。MPOA是一个具有性别二态性的结构,在雌性个体中雌激素受体1(ESR1)的表达量特别高,它似乎是整合雌激素水平波动信息的核心部位。MPOA包含谷氨酸能神经元和γ-氨基丁酸(GABA)能神经元,在调节社交行为(如育儿、交配和社会互动中至关重要。此外,它还参与调节基本生理过程,包括体温、睡眠和进食。关于产后情绪障碍,最近一项使用卵巢激素撤退(HW)小鼠模型的研究发现,MPOA的GABA能神经元(尤其是表达ESR1的神经元)在调节抑郁样和焦虑样行为中起关键作用。具体而言,MPOA的GABA能(MPOAGABA)神经元向腹侧被盖区(VTA)的投射调节快感缺失,而向中脑导水管周围灰质(PAG)的投射则介导不动行为。尽管这项研究证实了MPOAGABA神经元向VTA/PAG投射的环路在HW小鼠的抑郁行为中具有重要性,但MPOAGABA神经元是否以及如何靶向其他脑区仍有待探索。
先前的研究表明,下丘脑室旁核(PVN)可能参与抑郁样行为的产生和表现。例如,在慢性束缚应激(CRS)小鼠模型中,化学遗传学激活PVN神经元会加剧抑郁样行为,而抑制这些神经元则会减轻这些行为。关于母性行为和杀婴行为的研究也显示,MPOA的ESR1阳性(MPOAESR1)神经元向PVN投射,且雌性小鼠中这种投射的密度显著较高,并且在HW模型中观察到MPOAGABA神经元活性降低。这些结果促使作者提出假设:MPOAGABA-PVN环路可能参与介导由生殖激素波动引发的抑郁样行为。
在PVN内,精氨酸加压素(AVP)神经元是一个关键群体,参与调节多种生理和行为功能,包括睡眠、进食、自我修饰、筑巢、社会探究和攻击行为。此外,PVNAVP神经元还与应激反应有关,先前的研究发现抑郁症患者和大鼠的PVN中AVP阳性神经元数量增加。研究表明,敲除AVP基因可提高蔗糖偏好度并减少强迫游泳实验(FST)中的不动时间,这提示AVP在调节抑郁样行为中可能发挥作用。值得注意的是,一项临床研究表明AVP可能与产后抑郁症有关。尽管有这些见解,但AVP调节抑郁样行为(尤其是与生殖激素波动相关的抑郁样行为)的具体环路机制在很大程度上仍属未知领域。
2025年5月14日,南京大学生命科学学院景键教授、张果教授和朱景宁教授团队合作在Research期刊发表标题为The Hypothalamic Medial Preoptic Area-Paraventricular Nucleus Circuit Modulates Depressive-Like Behaviors in a Mouse Model of Postpartum Depression的研究论文。该研究表明,MPOAGABA神经元向PVN存在密集投射。在HW小鼠中,激活投射到PVN的MPOAGABA神经元可缓解抑郁样行为。相反,在非激素撤退(NHW)对照小鼠中(继续接受雌激素处理),抑制这些靶向PVN的MPOAGABA神经元会加剧抑郁样行为。进一步实验和分析发现,在HW小鼠模型中,AVP是该通路中的关键神经肽。在HW小鼠中化学遗传学抑制PVNAVP神经元可减轻抑郁样行为,而在NHW小鼠中激活这些神经元会加重这些行为。电生理记录显示,MPOAGABA神经元可直接抑制PVNAVP神经元。综上所述,这些发现表明,在NHW小鼠中,MPOAGABA神经元对PVNAVP神经元具有抑制性控制作用,而MPOAGABA神经元活性降低则会导致HW小鼠出现抑郁样行为。这凸显了MPOAGABA-PVNAVP环路在小鼠模型PPD病理生理过程中的关键作用。靶向这一环路可能为PPD提供一种新的治疗策略。
1.MPOAGABA神经元调节HW和NHW小鼠的抑郁样行为
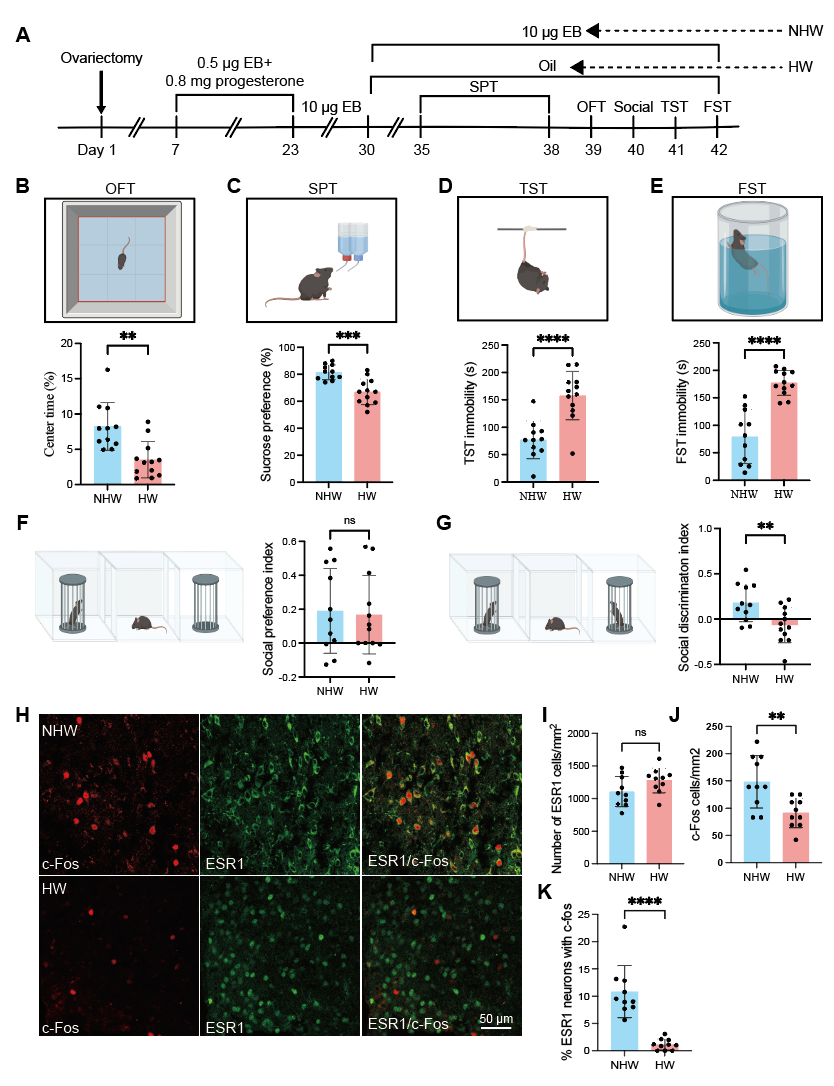
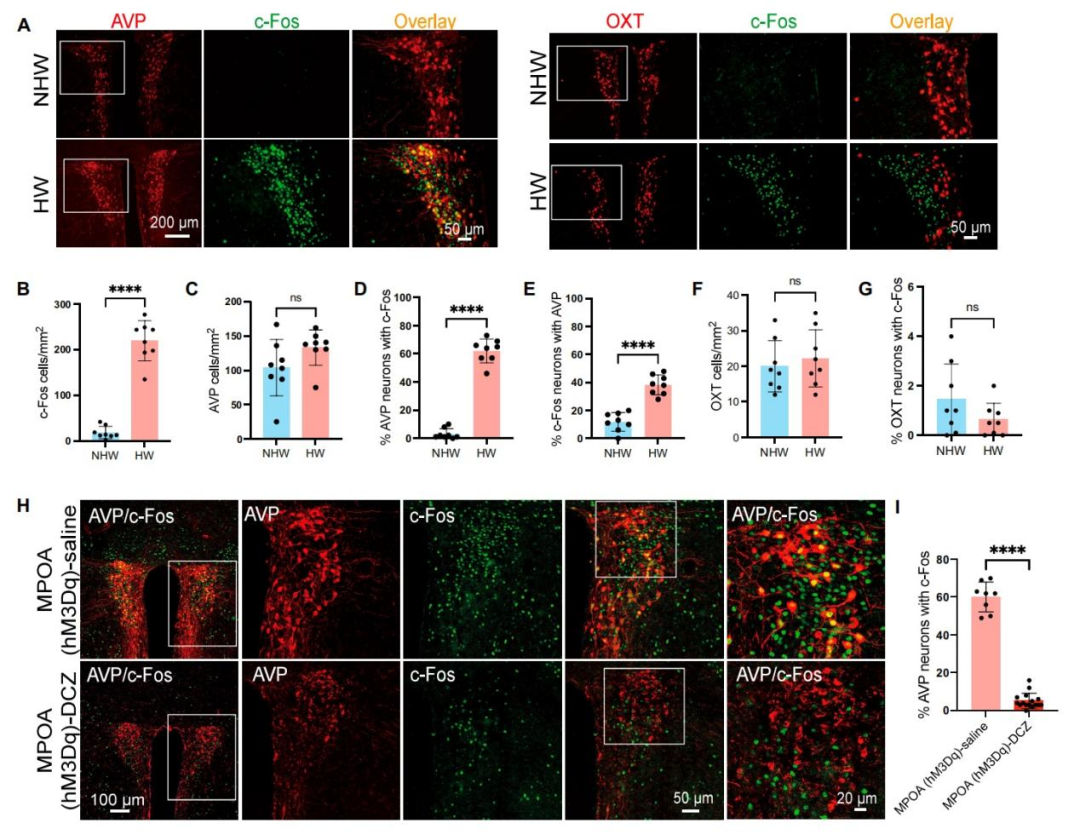
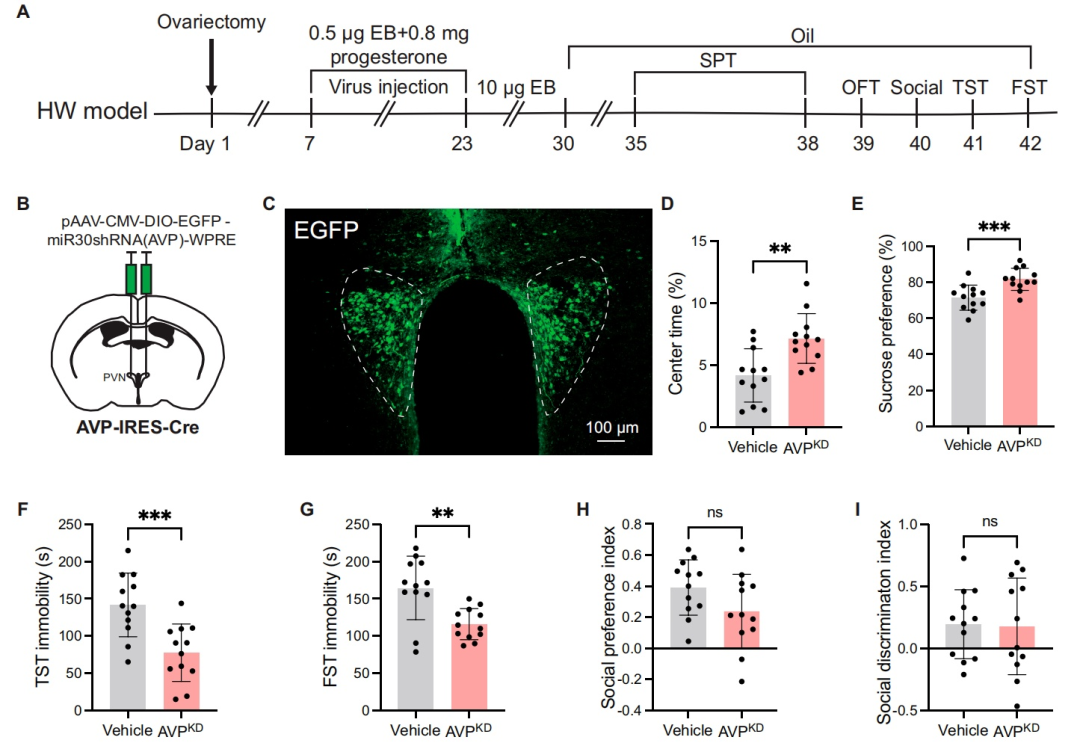
为评估MPOAESR1神经元的活性,研究人员建立了卵巢HW模型。HW小鼠表现出抑郁样行为,具体表现为:旷场实验(OFT)中央区域停留时间减少、蔗糖偏好实验(SPT)中蔗糖偏好度降低、悬尾实验(TST)和FST中不动时间增加。此外,HW小鼠的社交辨别能力受损,而社交偏好未受影响。
MPOA是富含ESR1阳性神经元的关键脑区,已被证实参与抑郁样行为的调节。研究者通过免疫荧光实验发现,HW组和NHW组的ESR1阳性细胞数量相当。然而,HW小鼠的c-Fos表达降低,且ESR1与c-Fos的共表达减少,表明ESR1神经元的活性减弱。鉴于MPOA的大多数ESR1神经元是GABA能神经元,且HW小鼠中MPOAGABA神经元的活性降低,作者在后续研究中重点关注MPOAGABA神经元。
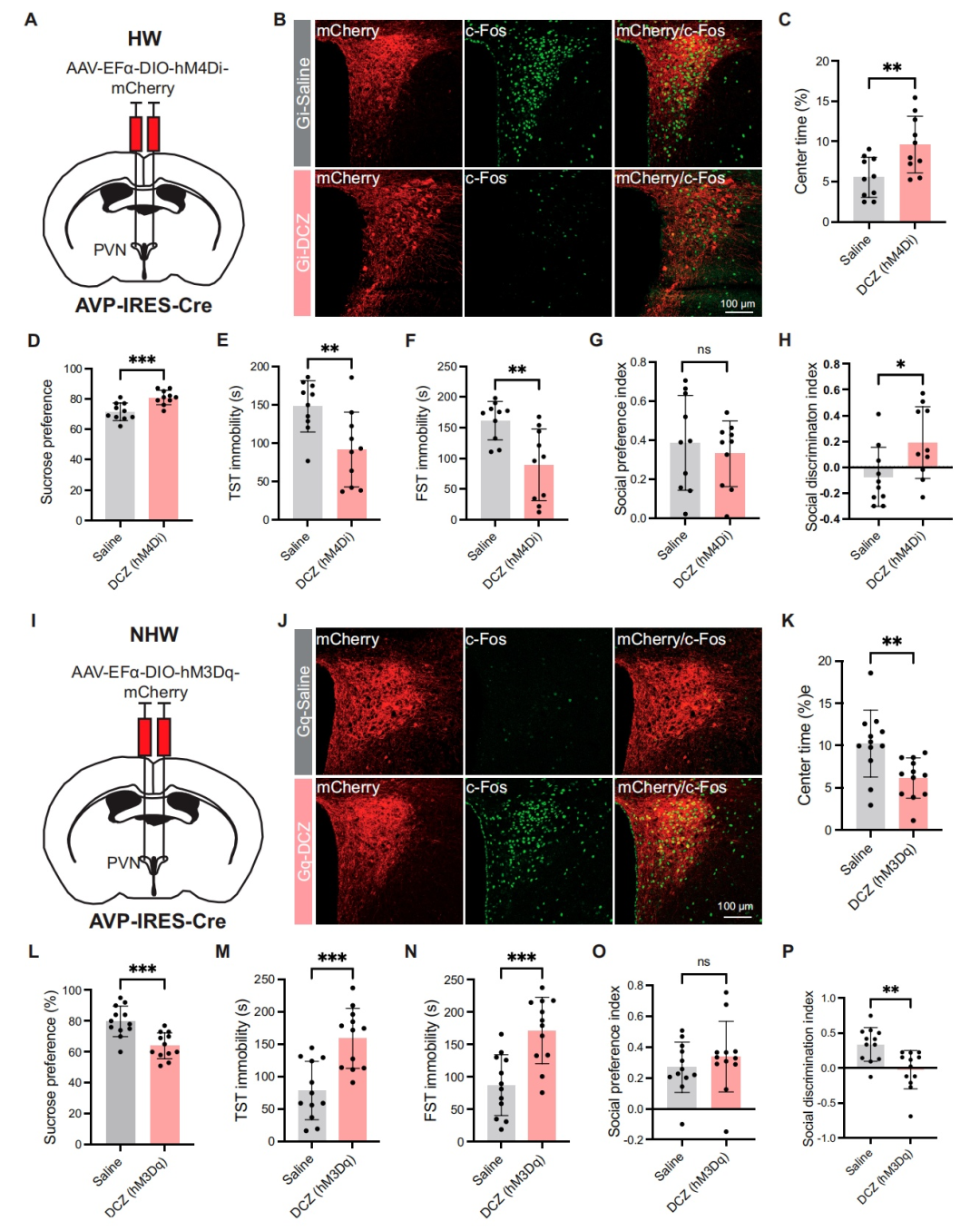
先前的光遗传学研究已证实MPOAGABA神经元在抑郁行为中发挥作用。于是,研究人员采用化学遗传学进一步探究其作用。向GAD2-IRES-Cre小鼠的MPOA立体定位注射AAV-DIO-hM3Dq-mCherry或AAV-DIO-hM4Di-mCherry,以选择性靶向GABA能神经元。在给予去氯氯氮平[DCZ,一种针对hM3Dq(激活)和hM4Di(抑制)的选择性DREADD受体激动剂]后,观察到激活MPOAGABA神经元增加了c-Fos的表达,而抑制则降低了c-Fos的表达。在HW小鼠中,化学遗传学激活这些神经元缓解了抑郁样行为,表现为OFT中央区域停留时间增加、蔗糖偏好度提高、TST和FST中不动时间减少。此外,社交辨别能力得到改善,而社交偏好未受影响。相反,在NHW小鼠中抑制MPOAGABA神经元加剧了抑郁样行为。概括来说,这些发现与先前的光遗传学研究相结合,为MPOAGABA神经元在调节HW小鼠抑郁样行为中的关键作用提供了有力证据。
图1.PPD模型建立、行为学检测及MPOA中ESR1的激活检测
2.PVN接受来自MPOAGABA神经元的直接输入
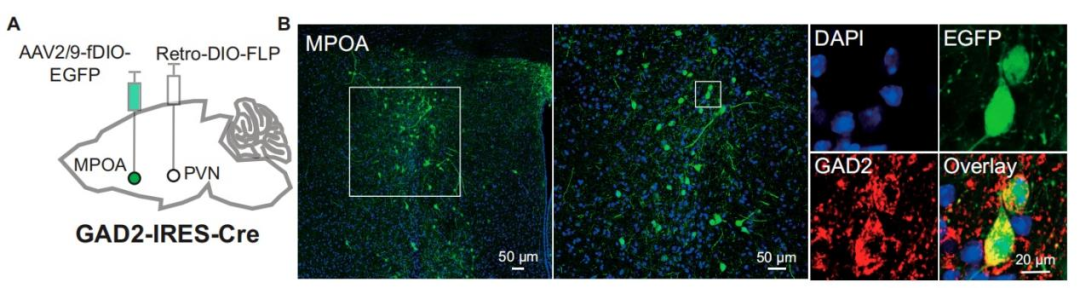
先前的研究已发现,表达ESR1的MPOA神经元会投射至PVN,且这些MPOA神经元中有相当一部分是GABA能神经元。基于这些发现,作者推测MPOAGABA神经元可能支配PVN。为验证这一点,向GAD2-IRES-Cre小鼠的PVN注射了rAAV2/R-EF1α-DIO-FLP-WPRE,随后向其MPOA注射了rAAV-hSyn-fDIO-EGFP-WPREs。三周后,逆行标记结果证实MPOAGABA神经元投射至PVN。
图2.PVN是MPOAGABA投射的重要下游靶点
3.MPOAGABA-PVN环路调节雌性小鼠的抑郁样行为
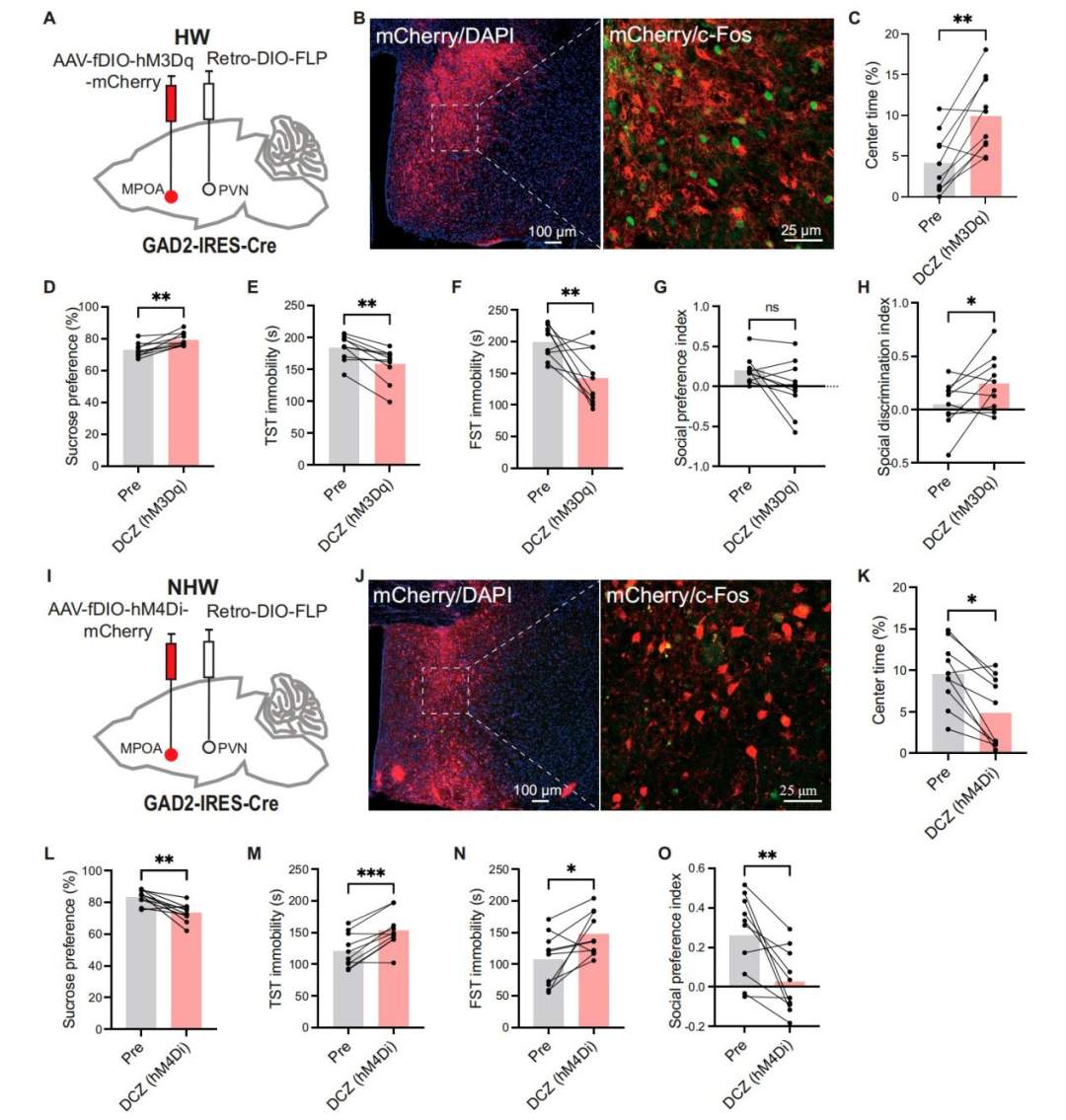
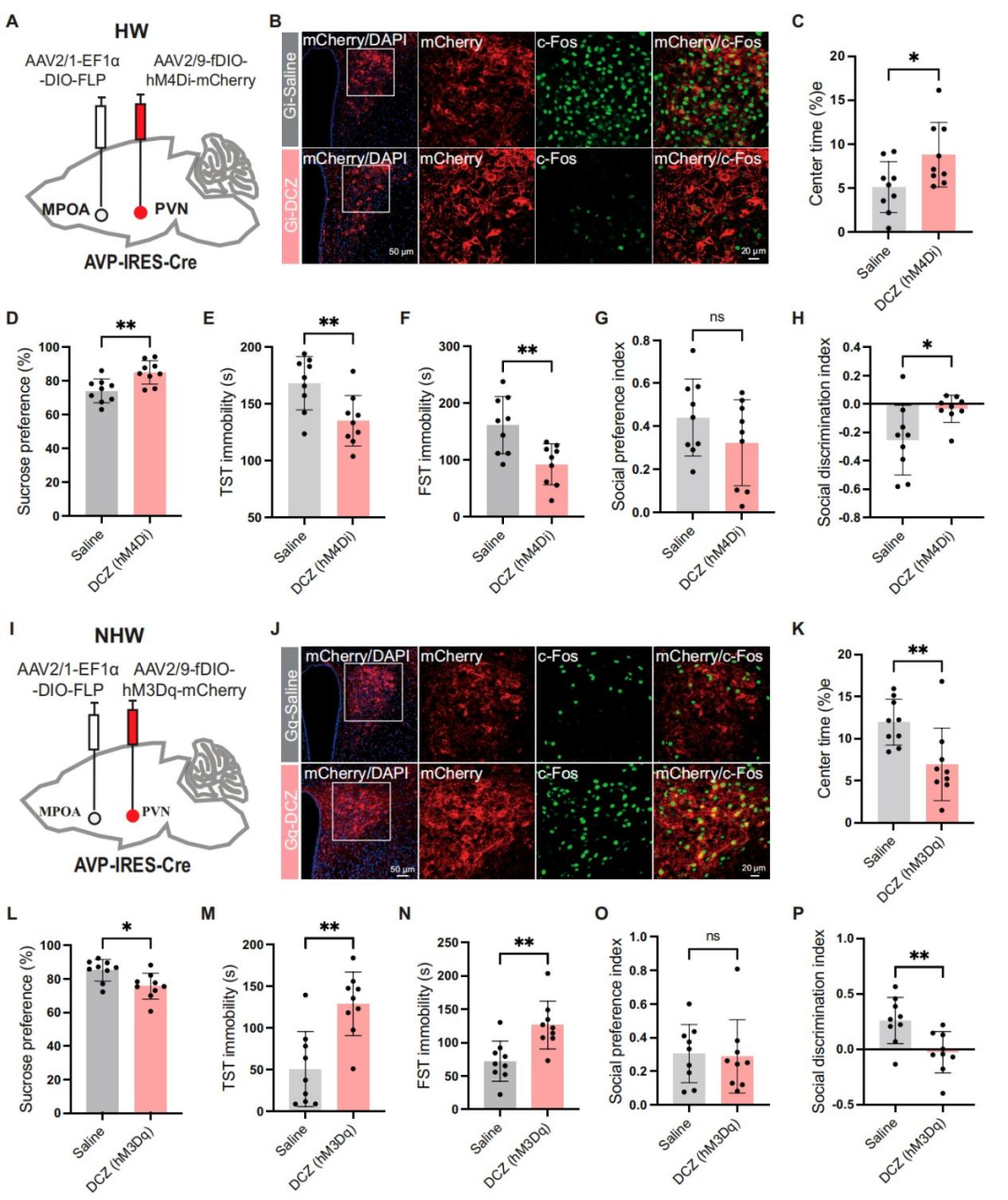
为进一步探究投射至PVN的MPOAGABA神经元在介导HW小鼠抑郁样行为中的潜在作用,研究人员对该通路进行靶向调控。具体而言,向GAD2-IRES-Cre小鼠的双侧MPOA注射编码hM3Dq或hM4Di受体的AAV载体,随后向其双侧PVN注射rAAV2/R-DIO-FLP。三周后,在HW小鼠中,化学遗传学激活投射至PVN的MPOAGABA神经元,增加了OFT中央区域停留时间和蔗糖偏好度,减少TST和FST中的不动时间,并改善社交辨别能力,且不影响社交偏好。相反,在NHW小鼠中,化学遗传学抑制这些神经元加剧了抑郁样行为。
考虑到MPOA神经元还会投射至PAG/VTA以调节抑郁样行为,作者通过雌性小鼠的逆行示踪[霍乱毒素B亚基(CTB)]实验,探究投射至PVN与投射至PAG/VTA的MPOA神经元是不同的细胞群还是存在重叠。结果显示,尽管部分MPOA神经元仅投射至PVN,但也存在同时投射至PVN和PAG或VTA的神经元,这表明前述的操控MPOA神经元可能至少部分通过作用于PAG或VTA来调节行为。总体而言,这些结果表明,与MPOAGABA神经元存在连接的PVN细胞群可能在介导HW小鼠抑郁样行为的表达中发挥关键作用。
图3.化学遗传学操纵投射到PVN的MPOAGABA神经元改变了HW和NHW小鼠的抑郁样行为
4.PVNAVP神经元对卵巢HW产生应答
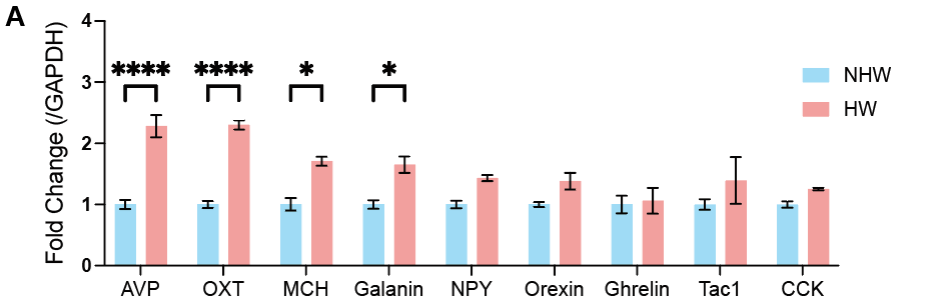
尽管上述证据表明,激活MPOAGABA-PVN环路减少了HW小鼠的抑郁样行为,但所涉及的PVN神经元具体类型尚不明确。由于PVN神经元会表达神经肽,作者尝试确定PVN内与抑郁样行为相关的神经肽信号。首先,通过qPCR检测了下丘脑PVN区域中神经肽的表达情况。结果显示,HW组的催产素(OXT)和AVP表达水平升高,这提示它们可能在HW相关的抑郁样行为中发挥作用。随后,通过神经元活性标志物c-Fos免疫染色检测了HW小鼠中AVP和OXT神经元的激活水平。研究发现,与NHW对照组相比,HW处理小鼠的PVN神经元激活水平升高。值得一提的是,与NHW组比较,HW小鼠PVN中较高比例的AVP表达神经元激活水平升高,但两组AVP阳性神经元的总数无显著统计学差异。另外,两组小鼠的OXT表达神经元数量及其激活比例均无显著统计学差异。除此以外,在下丘脑视上核(SON,已知AVP和OXT高表达的区域)中,HW和NHW小鼠的AVP及OXT神经元激活水平未观察到显著差异。综上,这些数据表明,HW小鼠中PVNAVP神经元(而非PVNOXT神经元)的特异性激活可能参与了抑郁样行为的表达,提示这些神经元在情绪调节中具有功能性作用。
接下来,在对照HW小鼠中,免疫荧光分析显示PVN中62.1%的AVP神经元共表达c-Fos。而在通过化学遗传学激活MPOAGABA神经元的HW小鼠中,PVN中AVP神经元与c-Fos的共定位率显著降至5.2%,这提示MPOAGABA神经元可能抑制PVNAVP神经元。有必要指出的是,免疫荧光染色显示PVN缺乏ESR1表达,而MPOA则高表达ESR1。这些结果表明,PVNAVP神经元可能受MPOA中表达ESR1的GABA能神经元调控,而非通过ESR1直接调节。这促使研究人员进一步探究PVNAVP神经元在抑郁样行为中的具体作用。
图4.PVNAVP神经元响应HW刺激
5.化学遗传学操控PVNAVP神经元,影响HW和NHW小鼠的抑郁样行为
基于PVNAVP神经元在HW小鼠中表现出更高的激活水平,研究者推测这些神经元的活动增强可能是导致HW小鼠出现抑郁样行为的原因之一。为验证这一假设,采用化学遗传学方法选择性操控PVNAVP神经元。具体而言,向AVP-IRES-Cre小鼠的PVN内注射了编码hM4Di和hM3Dq受体的Cre依赖的AAV载体,这些载体可选择性靶向AVP神经元。三周后,通过给予DCZ,实现对PVNAVP神经元的化学遗传学沉默或激活。结果显示,DCZ注射后,HW小鼠的抑郁样行为显著减轻。这些改善表现为:在OFT中处于中央区域的时间增加,蔗糖偏好度提高,在TST和FST中的不动时间减少,同时社交辨别能力得到改善,而社交偏好未发生变化。相反,对NHW小鼠的PVNAVP神经元进行化学遗传学激活,导致抑郁样行为加剧。有趣的是,在未接受激素处理的正常雌性小鼠中,化学遗传学操控并未影响其抑郁样行为。这表明,PVNAVP神经元对行为的影响依赖于激素波动。综合来看,在HW条件下,PVNAVP神经元激活会特异性加剧抑郁样行为。
图5.化学遗传学操纵PVNAVP神经元调节HW和NHW小鼠的抑郁样行为
6.AVP介导HW小鼠PVNAVP神经元的抑郁样行为
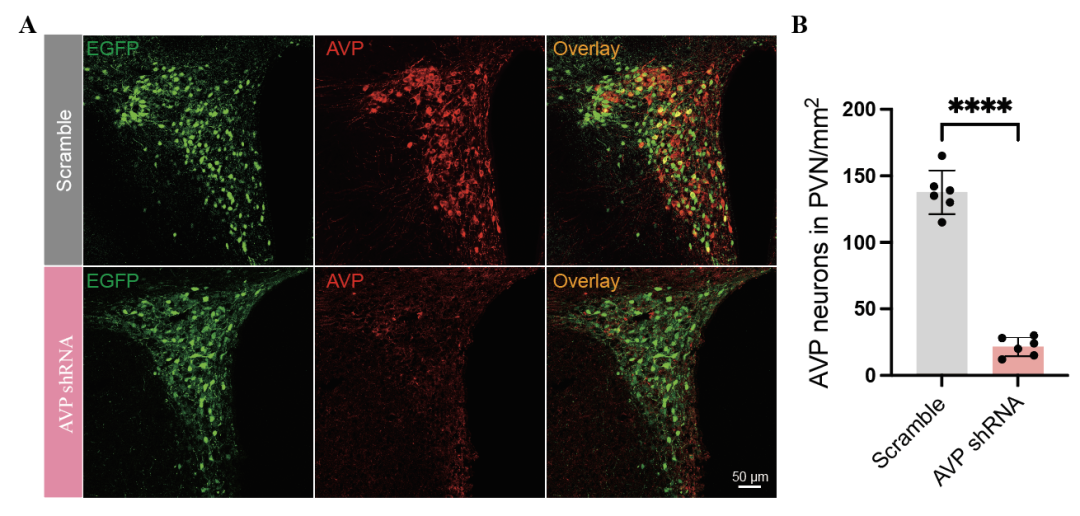
既然已证实PVNAVP神经元可调节抑郁样行为,接下来作者便探究在HW小鼠中,AVP是否对这些行为至关重要。为此,利用AAV载体敲低PVNAVP神经元中AVP的表达。三周后,确认AVP的表达成功下调。结果显示,AVP敲低显著缓解了抑郁样行为,具体表现为蔗糖偏好度升高、OFT中央区域停留时间增加,以及FST和TST中的不动时间缩短。然而,在HW小鼠中,AVP敲低并未影响社交偏好或社交辨别能力。这些结果表明,PVNAVP神经元释放的AVP会促成HW小鼠的抑郁样行为,但不会对社交互动产生影响。
图6.HW小鼠PVN内AVP成功敲低
图7.敲低PVN中AVP缓解了HW小鼠的抑郁样行为
7.MPOA-PVNAVP环路调节雌性小鼠的抑郁样行为
鉴于PVNAVP神经元可调节HW小鼠的抑郁样行为,作者推测MPOA-PVNAVP环路可能对HW小鼠的这些行为有所影响。为验证这一假设,在AVP-IRES-Cre小鼠的双侧PVN分别注射AAV-fDIO-hM4Di-mCherry和AAV-fDIO-hM3Dq-mCherry,并在其双侧MPOA注射AAV2/1-EF1α-DIO-FLP,以此进行化学遗传学调控。三周后,通过注射DCZ诱导接受MPOA输入的PVNAVP神经元发生化学遗传学沉默或激活。结果显示,对HW小鼠中接受MPOA输入的PVNAVP神经元进行化学遗传学抑制后,抑郁样行为有所减轻,具体表现为OFT中央区域停留时间增加、蔗糖偏好度升高,以及TST和FST中的不动时间缩短。社交辨别能力也有所增强,而社交偏好则未发生改变。相反,对NHW小鼠中接受MPOA输入的PVNAVP神经元进行化学遗传学激活后,抑郁样行为加剧。这些发现表明,MPOA-PVNAVP环路在HW小鼠中特异性地促成了抑郁样行为。
图8.化学遗传学操纵接受MPOA投射的PVNAVP神经元可调节HW和NHW小鼠的抑郁样行为
8.MPOAGABA神经元对PVNAVP神经元的直接抑制作用
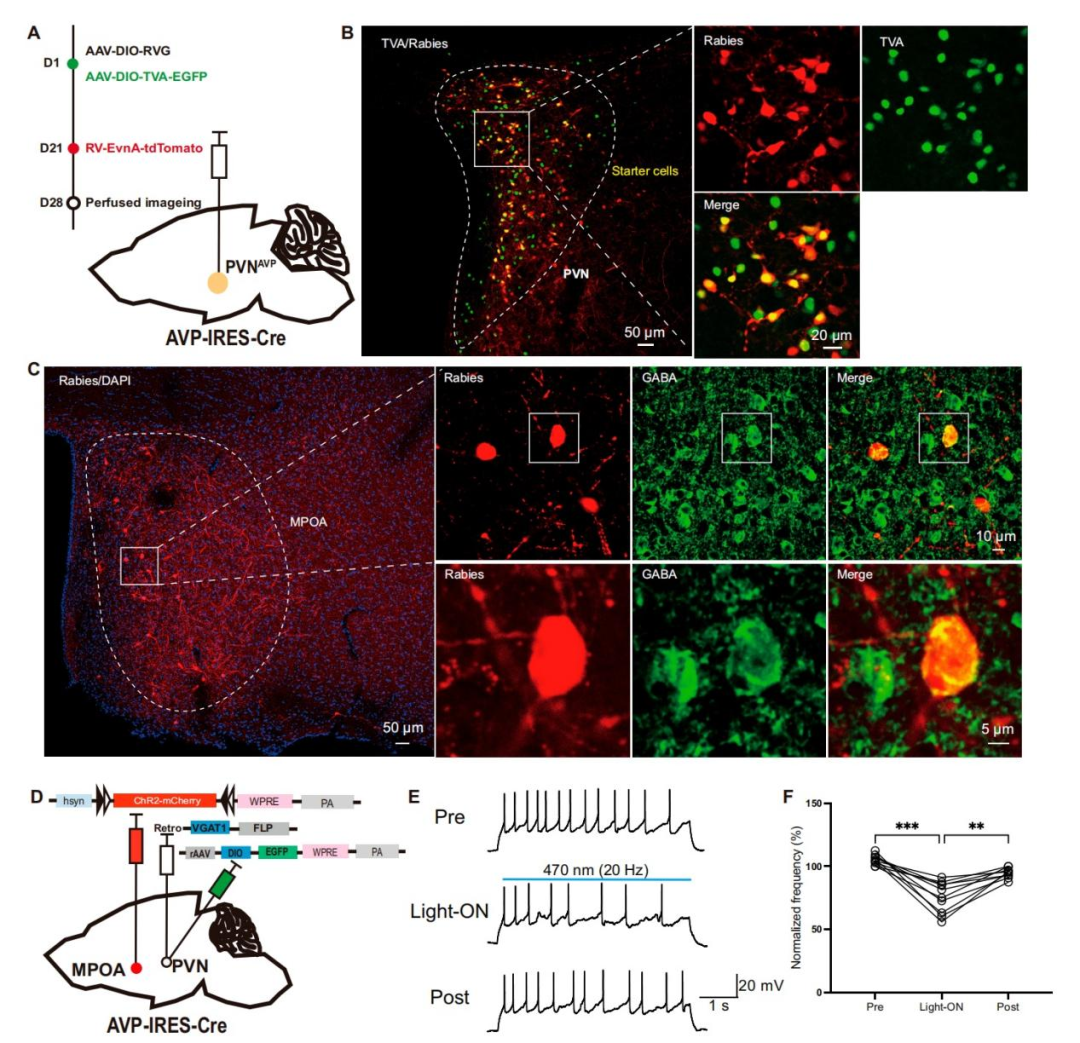
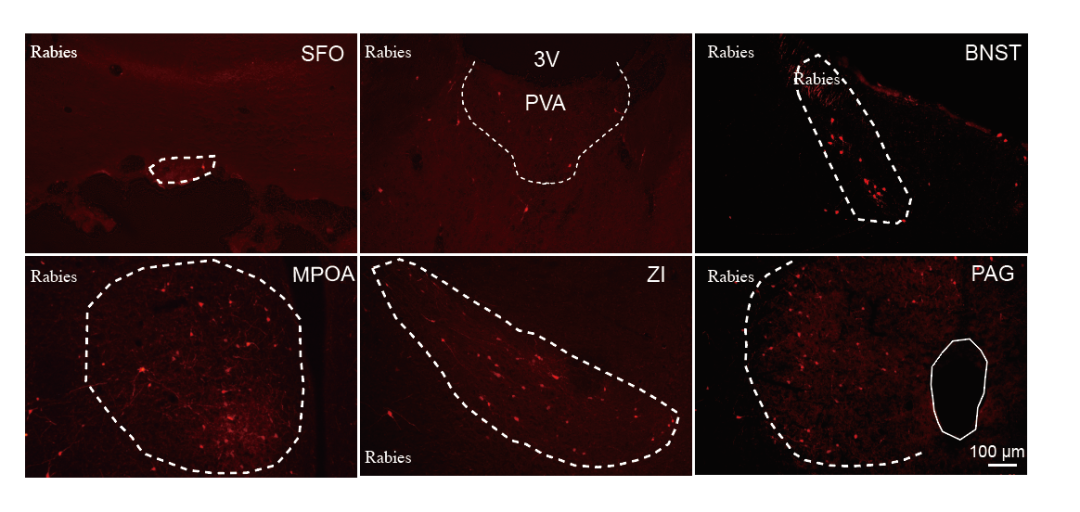
前述研究结果表明,投射至PVN的MPOAGABA神经元与接受MPOA输入的PVNAVP神经元在调节抑郁样行为中发挥相反作用,这提示MPOAGABA神经元可能通过抑制PVNAVP神经元来发挥其效应。为验证这一假设,研究人员采用狂犬病病毒(RV)介导的逆行跨单突触示踪技术,绘制PVNAVP神经元的单突触输入图谱。具体而言,向AVP-IRES-Cre小鼠的单侧PVN立体定位注射Cre依赖的AAV辅助病毒[rAAV-EF1α-DIO-H2B-EGFP-T2A-TVA和rAAV-EF1α-DIO-RVG]。21天后,将RV-CVS-ENVA-N2C(ΔG)-tdTomato注射到同一PVN位点。7天后,处死小鼠进行免疫组织化学分析。通过PVN中EGFP和tdTomato信号的存在,证实起始细胞标记成功。研究者发现多个同侧脑区向PVNAVP神经元发出直接投射,其中显著的输入来自MPOA、终纹床核(BNST)、未定带(ZI)和PAG。重要的是,这些MPOA传入神经元中,有相当一部分共表达GABA,表明PVNAVP神经元接受来自MPOAGABA神经元的单突触输入。
为证实MPOAGABA神经元对PVNAVP神经元存在直接抑制作用,作者利用离体急性脑片制备技术,对顺行标记的PVNAVP神经元进行细胞贴附记录,评估光遗传学激活MPOAGABA传入纤维是否可抑制雌性小鼠PVNAVP神经元的活性。为此,向AVP-IRES-Cre小鼠双侧PVN注射AAV-EF1α-DIO-EGFP-WPRE以标记PVNAVP神经元,同时向双侧PVN注射逆行病毒rAAV2/R-VGAT1-FLP-WPRE,并向其双侧MPOA注射rAAV-hSyn-fDIO-hCHR2-mCherry-WPRE,使MPOAGABA神经元表达mCherry和ChR2。三周后制备脑片,光遗传学激活ChR2阳性的MPOAGABA末梢后,PVNAVP神经元中电流诱发动作电位的发放频率显著降低。总的来说,这些发现表明MPOAGABA神经元与PVNAVP神经元形成直接的抑制性突触,从而调节其活性并影响抑郁样行为。
图9.MPOAGABA神经元直接抑制PVNAVP神经元
图10.PVNAVP神经元的单突触输入
总结
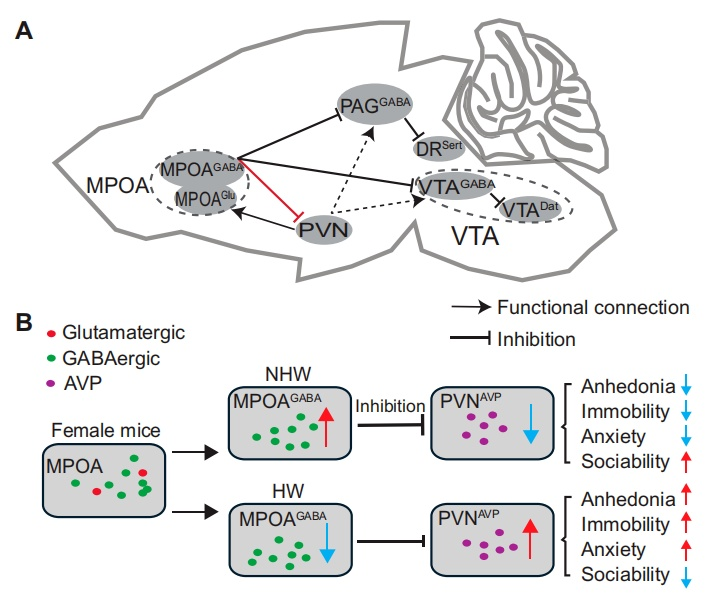
本研究揭示,在HW小鼠模型中,PVNAVP神经元是MPOAGABA神经元的下游靶标。这些神经元在介导抑郁样行为中发挥关键作用,而AVP则是其中重要的调控因子。MPOAGABA-PVNAVP环路可能作为先前发现的MPOAGABA-VTA环路和MPOAGABA-PAG环路的补充或中间通路,共同参与HW模型中抑郁样行为的调控。这些发现表明,MPOAGABA-PVNAVP环路是HW诱导的抑郁行为的关键神经基础,并凸显其作为激素相关情绪障碍治疗靶点的潜力。
图11.MPOA-PVN环路在NHW和HW雌性小鼠中发挥作用的工作模式图
本研究得到国家自然科学基金项目(项目编号:32471073、32171011、32100816)、科技创新2030重大项目(项目编号:2021ZD0202805)等支持。
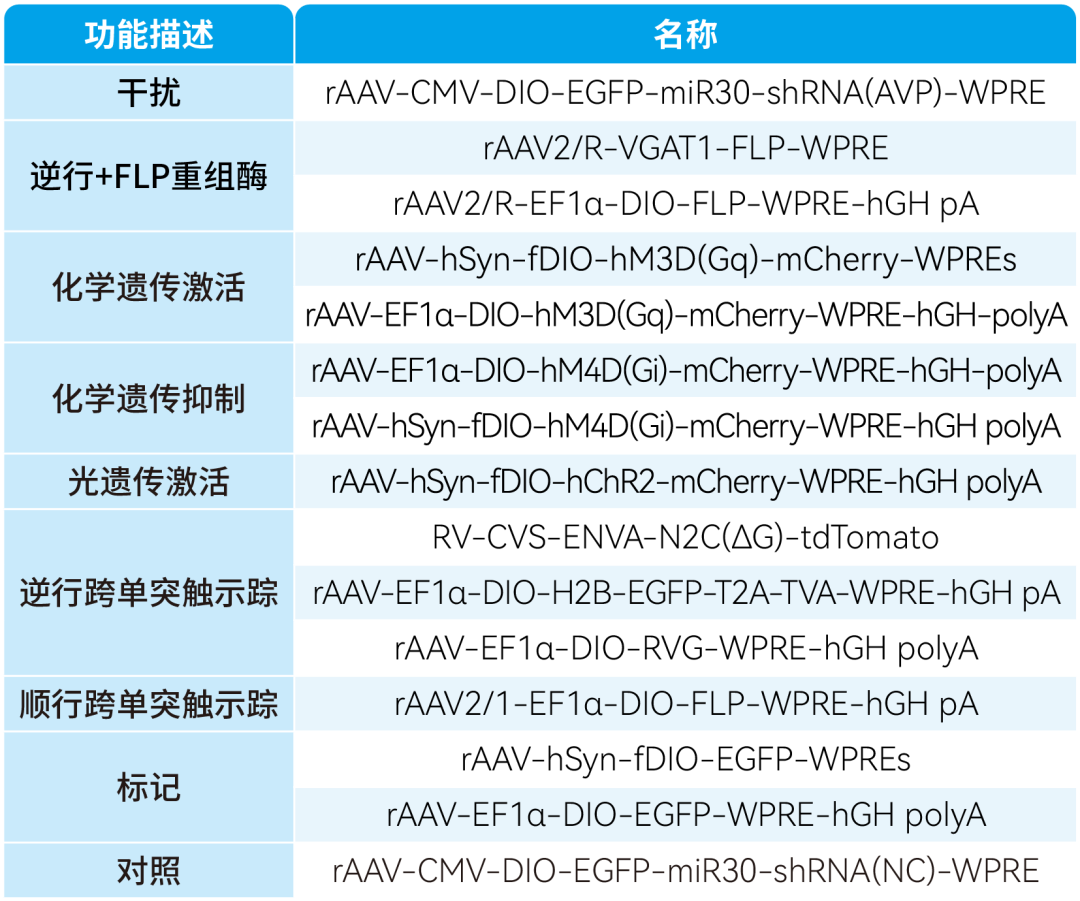
本文使用的病毒产品,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK