2025-08-25 阅读量:780
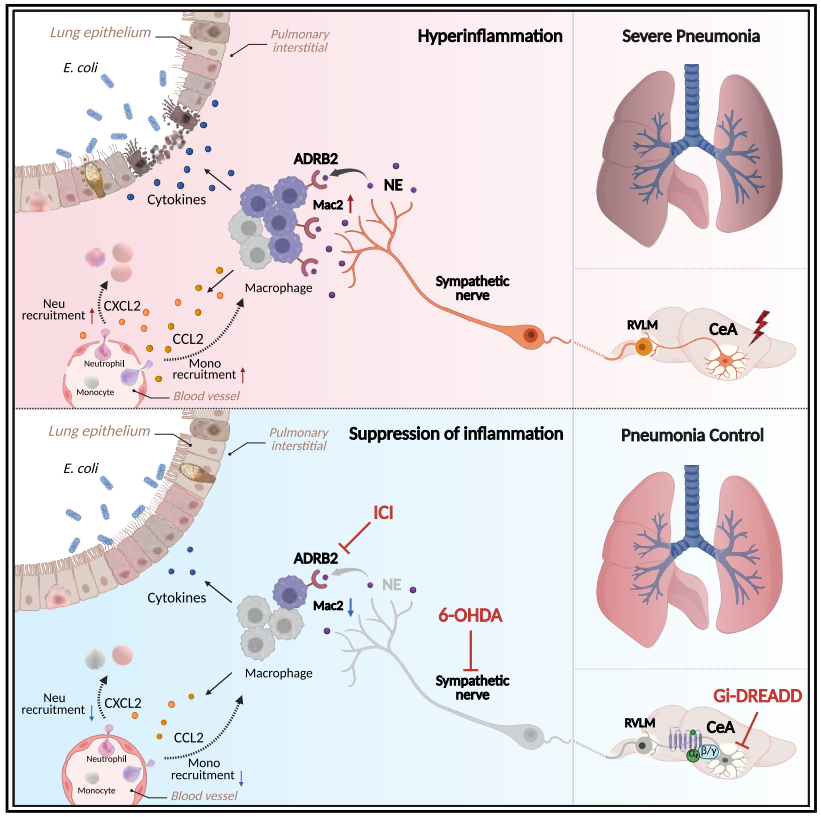
在呼吸道感染研究领域,肺炎作为一种常见且可能致命的疾病,始终是生物医药科研关注的重点。重症肺炎往往由肺部的细胞因子风暴引发,这一过程会导致严重的炎症反应和肺损伤,甚至危及生命,就像在新冠肺炎大流行中所观察到的那样,病原体入侵引发的一系列连锁反应可能造成极其严重的后果。越来越多的证据表明,在肺炎期间,感染和炎症信号会通过上行感觉神经通路从肺部传递到包括下丘脑在内的特定脑区,进而引发一系列疾病症状。同时,在病理状态下,特定脑区的激活还可通过下行自主神经通路调节外周器官的免疫反应,从而影响疾病的进展和结局。例如,岛叶皮层神经元通过自主神经回路协调结肠免疫反应,这是驱动结肠炎发展的关键机制;中央杏仁核(CeA)和下丘脑室旁核(PVH)中表达促肾上腺皮质激素释放激素(CRH)的神经元投射到脾神经,调节B细胞介导的体液免疫反应。但在细菌性肺炎期间,是否存在特定的脑-肺通路参与肺部免疫调控,仍然是一个有待探索的问题。
2025年6月,浙江大学医学院附属第一医院方向明教授、张凯副主任医师和美国华盛顿大学医学院病理与免疫学系Marco Colonna教授联合在Immunity期刊上发表了题为“A brain-to-lung signal from GABAergic neurons to ADRB2⁺ interstitial macrophages promotes pulmonary inflammatory responses”的研究论文,揭示了一条由CeA γ-氨基丁酸(GABA)能神经元起始,经延髓头端腹外侧区(RVLM)传递,最终通过肺交感神经(PSNs)释放去甲肾上腺素(NE),并特异性作用于肺间质内表达β2肾上腺素受体(ADRB2⁺)的Mac2巨噬细胞亚群的神经免疫通路。该通路在重症肺炎中被强烈激活,显著放大炎症反应、加重肺损伤并促进细菌扩散;而针对该通路不同节点(如CeA神经元、PSNs或ADRB2受体)的干预,均能有效改善重症肺炎的预后。本研究揭示的致病性脑-肺轴机制,为重症肺炎的治疗提供了极具潜力的靶点与策略。

1、重症肺炎时CeA的GABA能神经元被高度激活
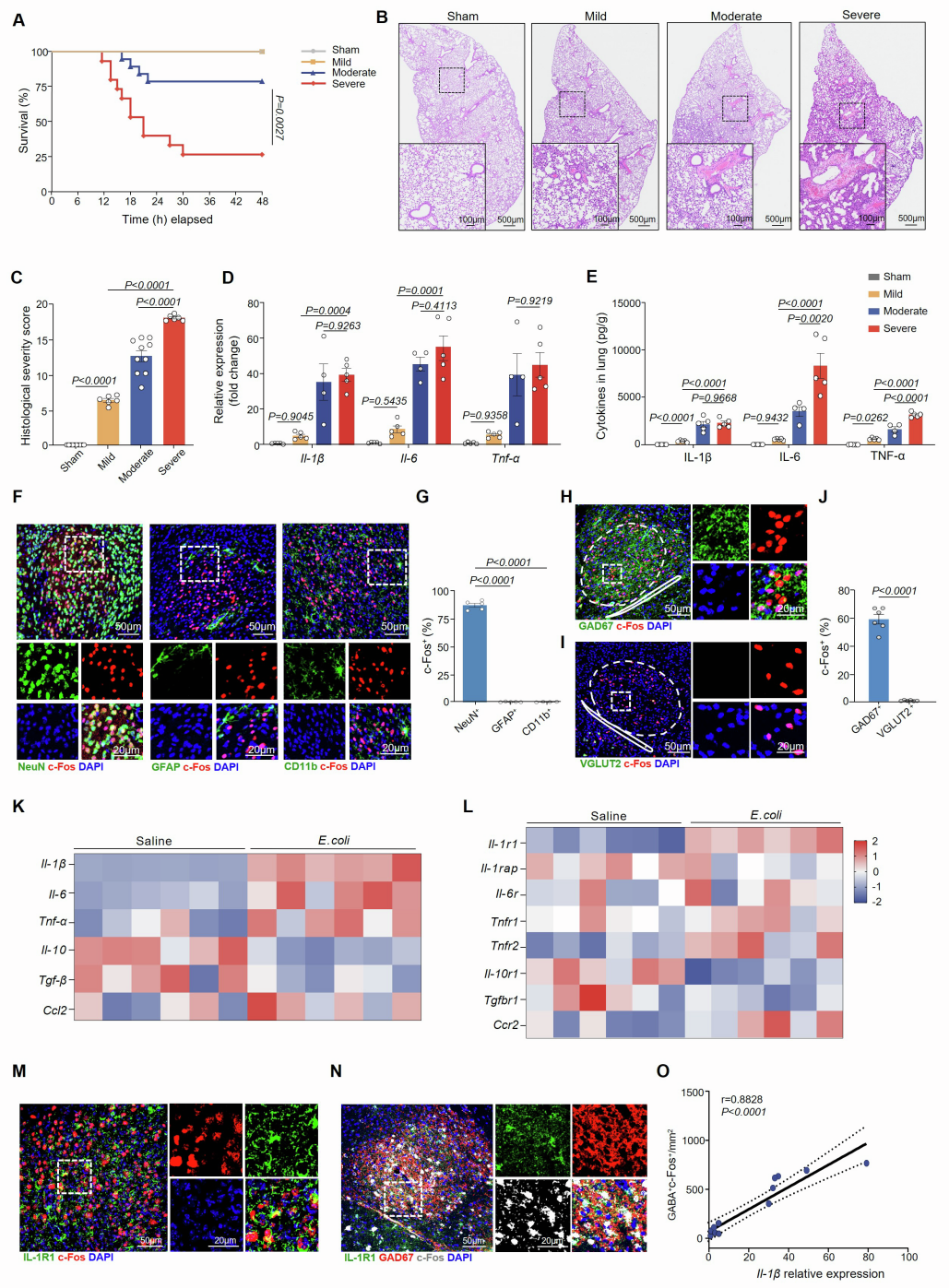
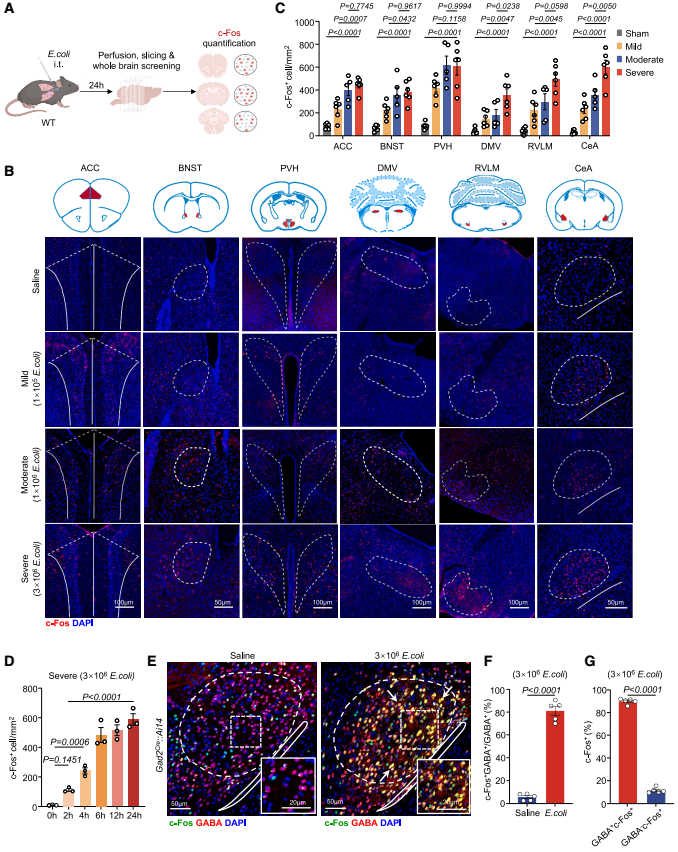
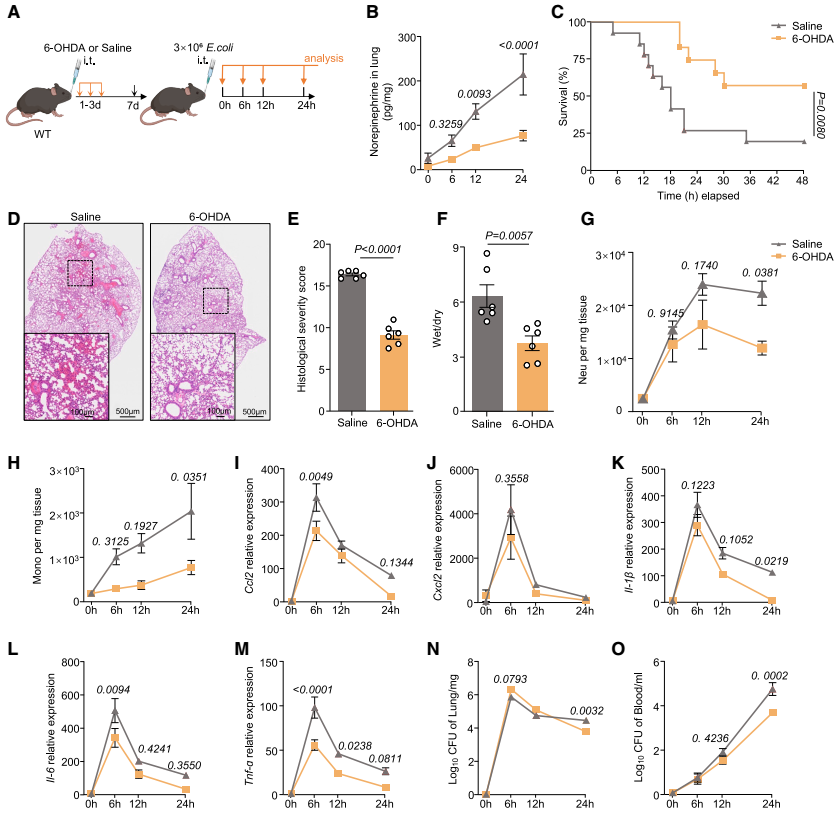
首先,为了确定对重症肺炎有特异性反应的脑区,研究团队通过小鼠气管内注射1×105、1×106、3×106菌落形成单位(CFU)的大肠杆菌,分别建立了轻度、中度和重度(重症)肺炎小鼠模型。结果发现,重度感染小鼠的死亡率显著更高,且在感染24 h后出现广泛的肺部病变,表现为肺实变、肺泡间隔水肿和明显的炎症细胞浸润。与假手术对照组相比,轻度和中度肺炎小鼠肺内促炎细胞因子的mRNA表达和蛋白浓度均升高,而重症肺炎组的升高更为显著。另外,感染后24 h对假手术组、轻度、中度和重度肺炎组小鼠脑切片的c-Fos(神经元激活标记物)染色结果显示,肺炎期间CeA和PVH的神经元被激活,其中重症肺炎组中CeA的激活神经元数量增幅最大。PVH的作用已得到充分证实,而CeA在肺炎中的功能仍不明确。
进一步的时间进程免疫荧光染色显示,CeA神经元在感染后4 h就开始被激活,c-Fos⁺神经元数量的升高持续至24 h,且被激活的神经元主要是抑制性GABA能神经元。在遭受重症肺炎的Gad2Cre::Ai14报告基因小鼠(其GABA能神经元被tdTomato标记)中,约80.6%的GABA能神经元在感染后24 h表现出c-Fos激活,且87.2%的c-Fos⁺神经元被鉴定为GABA能神经元。此外,重症肺炎时CeA中Il-1β(白细胞介素-1β)和Il-1r1(白细胞介素1受体1)的mRNA表达上调,且Il-1β的表达与激活的c-Fos⁺ GABA能神经元数量呈正相关,这表明IL-1β-IL-1R1信号可能是CeA GABA能神经元激活的驱动因素。总之,这些发现强调了CeA GABA能神经元在重症肺炎进展中的关键作用。
图1. 肺炎模型的建立及CeA神经元激活评估
图2. 重症肺炎期间CeA GABA能神经元被高度激活
2、CeA GABA能神经元的激活与抑制对肺炎炎症和肺损伤的相反影响
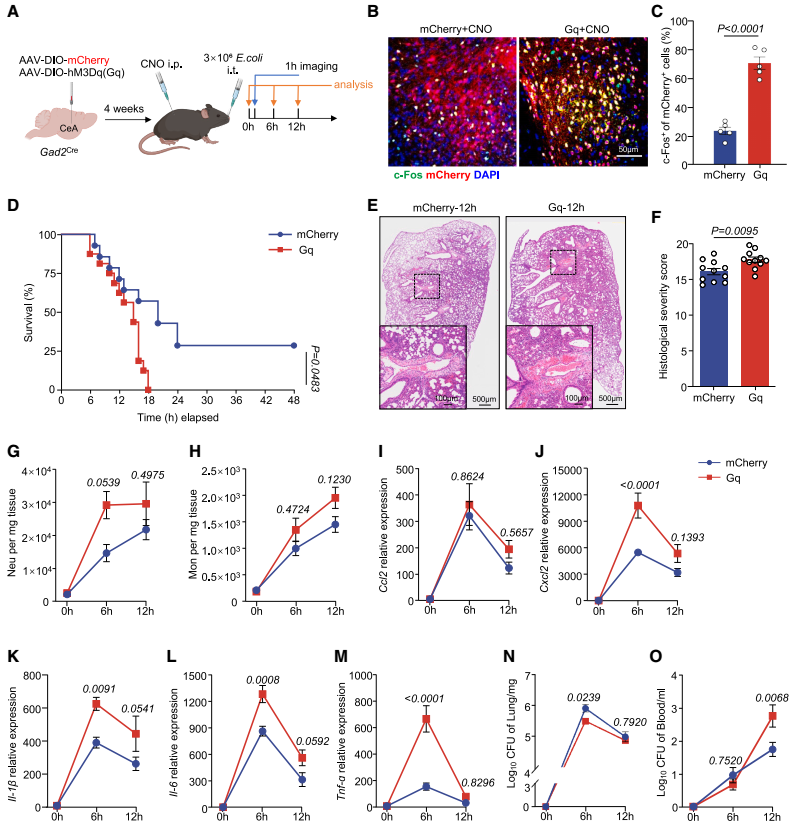
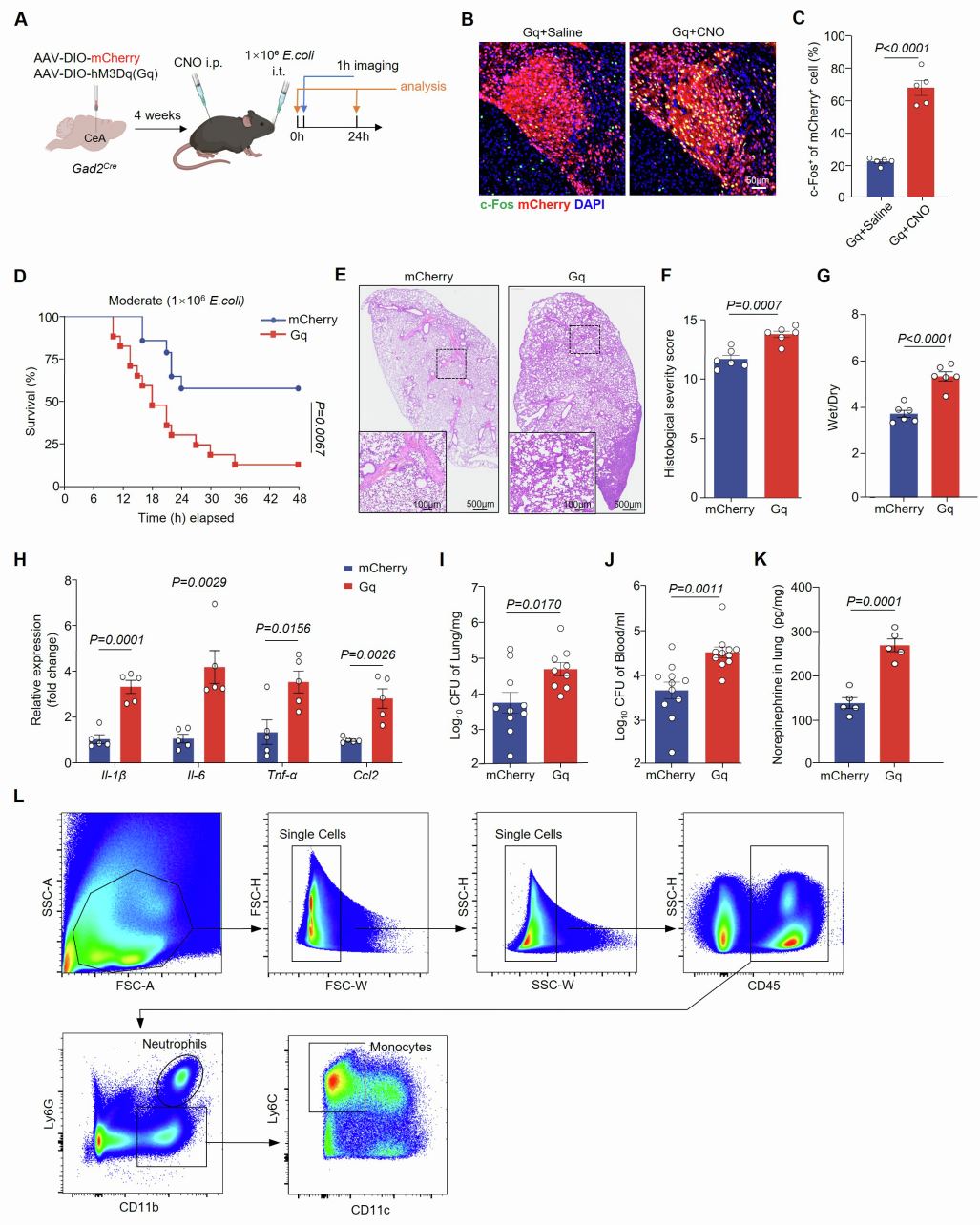
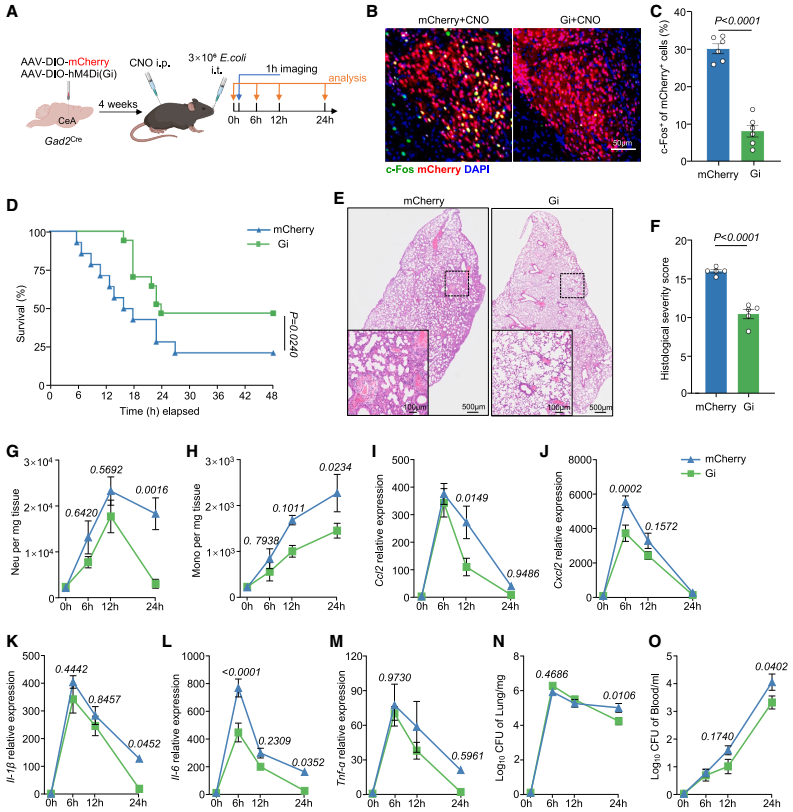
为确定CeA在肺炎中的作用,研究团队向Gad2Cre小鼠(GABA能神经元特异性表达Cre酶)的CeA立体定位注射腺相关病毒AAV-DIO-hM3D(Gq)-mCherry(或AAV-DIO-mCherry对照)以建立CeA GABA能神经元化学遗传激活模型。4周后通过气管内注射大肠杆菌诱导小鼠肺炎模型(中度和重度肺炎),并通过腹腔注射CNO激活CeA GABA能神经元,结果显示CeA GABA能神经元的激活降低了肺炎小鼠的存活率,加剧了肺损伤,促进了中性粒细胞和单核细胞的浸润,并增加了促炎细胞因子(Il-1β、Il-6和肿瘤坏死因子α(Tnf-α))和趋化因子(Ccl2、Cxcl2)的释放。虽然在化学遗传激活的条件下,早期(6 h)细菌清除效率有所提高,但在后期时间点(12、24 h)细菌杀伤效率下降;血液中大肠杆菌CFU增加。
图3. 肺炎期间CeA GABA能神经元的激活会加剧炎症与肺损伤
相反,通过向Gad2Cre小鼠的CeA立体定位注射AAV-DIO-hM4D(Gi)-mCherry(或AAV-DIO-mCherry对照)以建立CeA GABA能神经元化学遗传抑制模型。4周后通过气管内注射3×106 CFU大肠杆菌诱导小鼠重度肺炎,并通过腹腔注射CNO抑制CeA GABA能神经元,结果显示,CeA GABA能神经元的抑制提高了重度肺炎小鼠的存活率,减少了肺免疫细胞浸润,抑制了炎症,减轻了肺损伤,同时减少了感染后24 h肺和血液中的大肠杆菌CFU。综上,CeA GABA能神经元的激活能够加剧肺炎相关炎症和肺损伤,而抑制CeA GABA能神经元可减轻重症肺炎的炎症和肺损伤。
图4. 抑制CeA GABA能神经元减轻重症肺炎的炎症和肺损伤
3、CeA-RVLM-PSNs通路的鉴定与验证
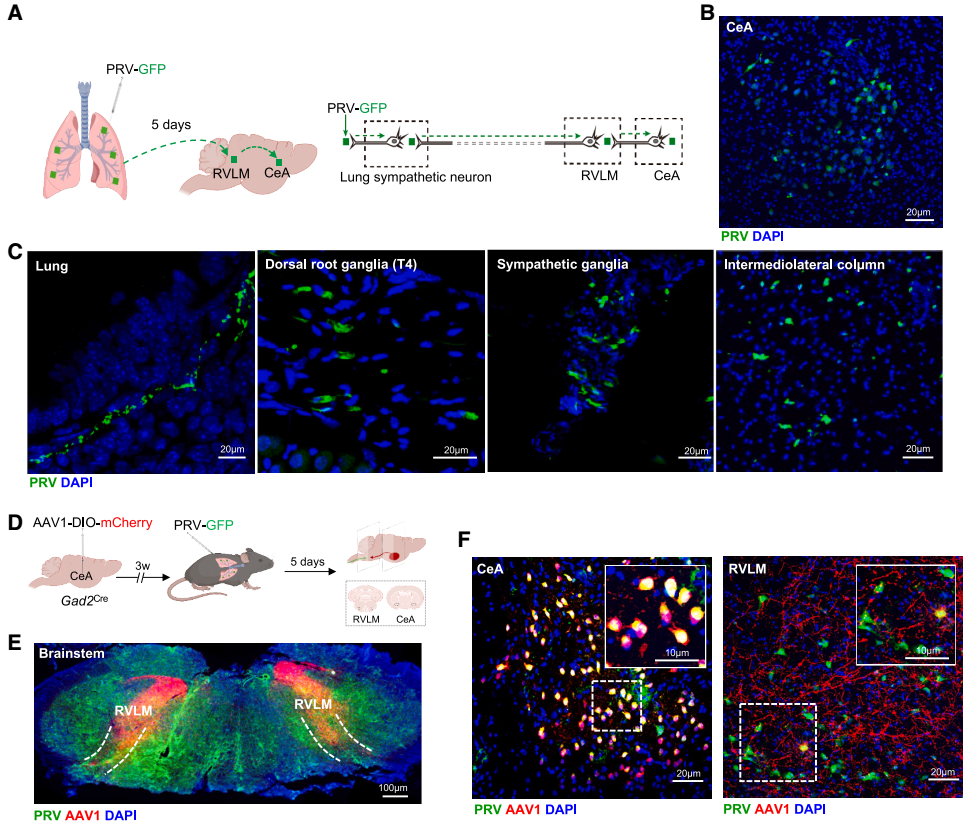
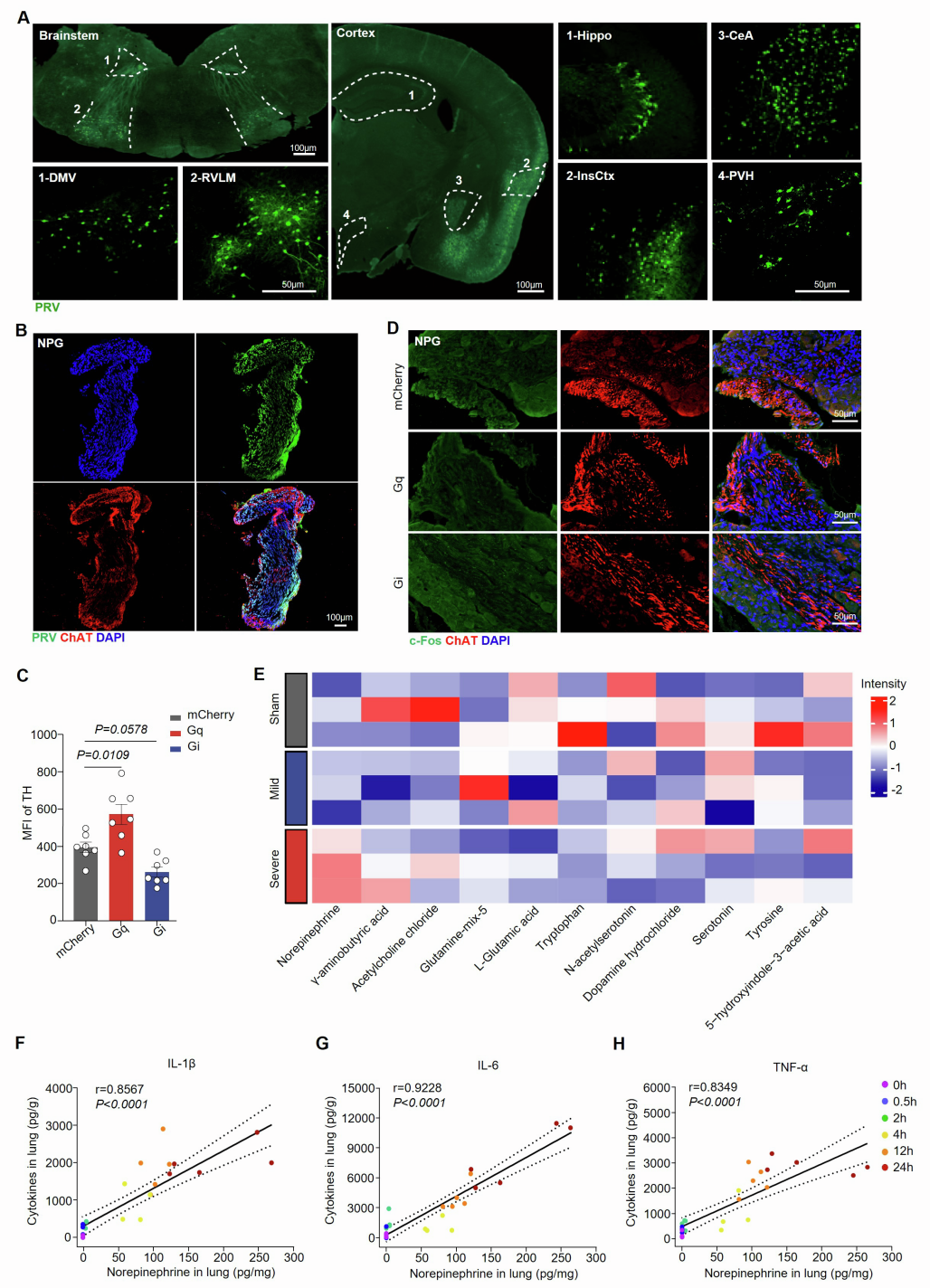
为揭示CeA与肺之间的解剖学联系,团队向野生型(WT)小鼠的肺中注射携带绿色荧光蛋白(GFP)报告基因的伪狂犬病病毒(PRV-CMV-GFP)进行逆行跨多突触示踪,发现GFP信号依次出现在肺(30 min时)、背根神经节(DRG,48 h时)、交感神经节(72 h时)、结状-岩神经节(NPG,72 h时)、中枢神经系统核团RVLM、PVH和CeA(5天时),表明存在CeA-PSNs连接。为进一步验证这种连接源自CeA GABA能神经元,团队在Gad2Cre小鼠CeA区注射顺行跨单突触示踪病毒AAV1-DIO-mCherry,并结合PRV-CMV-GFP(肺内注射)进行逆行示踪,结果在CeA和RVLM均观察到mCherry与GFP信号共标,证实CeA GABA能神经元可经RVLM中继后投射至PSNs。
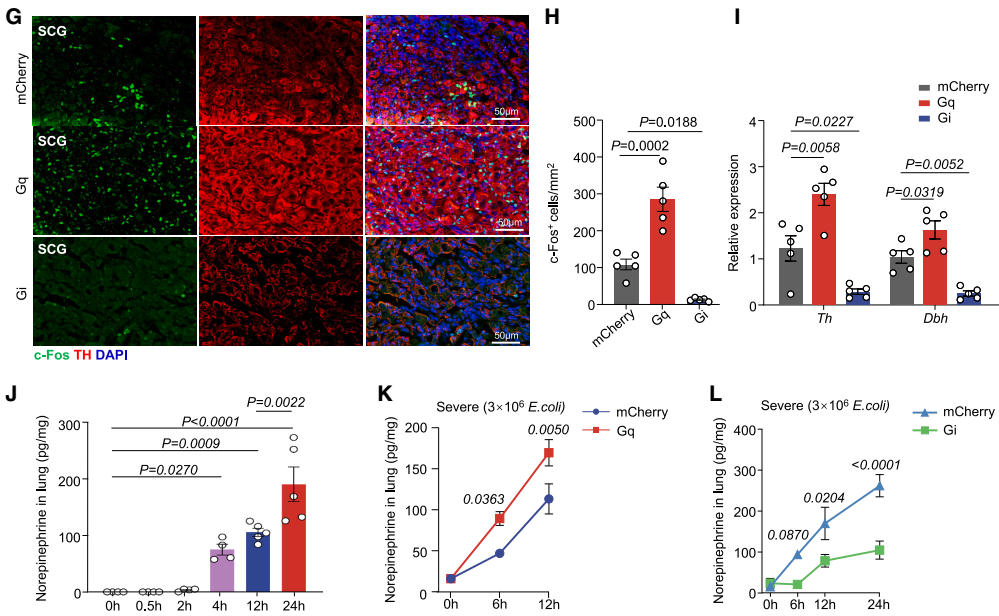
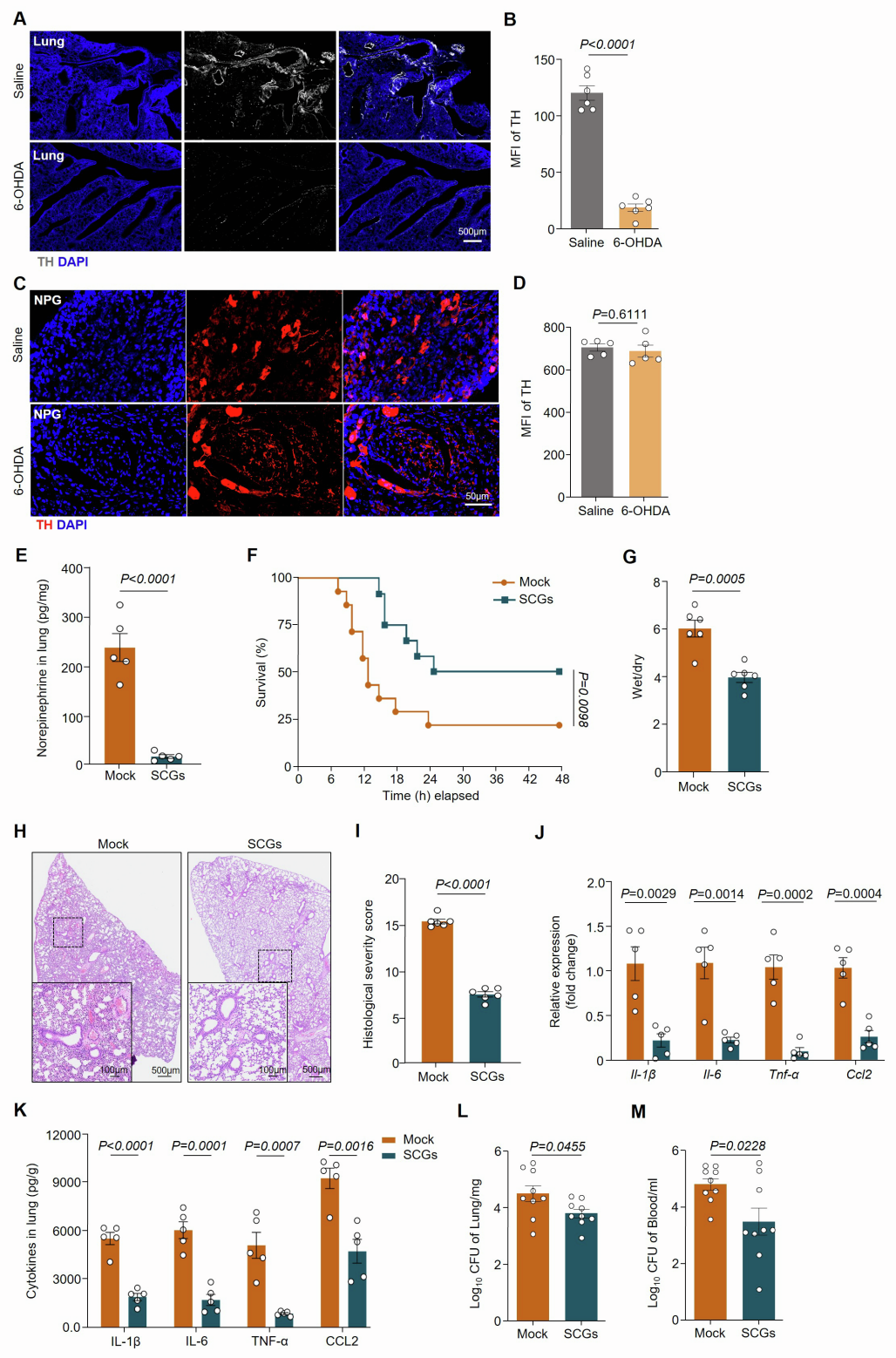
功能实验显示,在重症肺炎中,化学遗传激活CeA GABA能神经元(hM3D(Gq))可增加颈上神经节(SCG,呼吸调节的关键交感神经节)中c-Fos⁺神经元数量(这些神经元主要为酪氨酸羟化酶(TH)阳性),提升SCG中TH的平均荧光强度及TH和多巴胺β-羟化酶(DBH)的mRNA表达;化学遗传抑制CeA GABA能神经元(hM4D(Gi))则产生相反效果。并且,激活或抑制CeA GABA能神经元均未改变支配肺的迷走神经节NPG中神经元的c-Fos表达,表明在重症肺炎期间,CeA GABA能神经元通过交感神经与肺存在物理连接。
图5. CeA神经元与肺存在解剖学连接
图6. CeA神经元与肺存在解剖学连接,并可调控重症肺炎中与炎症相关的局部NE释放
4、局部NE释放与PSNs抑制对重症肺炎的影响
由于交感神经激活通常伴随神经递质释放,团队通过液相色谱-质谱(LC-MS)和ELISA(酶联免疫吸附测定)分析发现,重症肺炎小鼠肺局部NE浓度自感染后4 h开始上升,持续增加至24 h,且NE水平与肺炎症细胞因子IL-1β、IL-6、TNF-α浓度显著正相关;而其他神经递质无显著变化,且未检测到肾上腺素和左旋多巴(L-DOPA)。在化学遗传激活CeA GABA能神经元的模型(中度、重度肺炎)中,小鼠肺NE浓度高于对照组,而在化学遗传抑制模型(重度肺炎)中,肺NE浓度显著降低。表明CeA GABA能神经元通过驱动局部NE释放,进而参与肺炎细胞因子风暴的调控。(如图5和图6)
为评估PSNs对重症肺炎细胞因子风暴的影响,团队通过小鼠气管内注射6-羟基多巴胺(6-OHDA,选择性NE能神经元拮抗剂)以化学消融PSNs,结果显示肺中NE浓度和TH表达降低,小鼠存活率提高,肺损伤减轻,重症肺炎中的炎症细胞因子(Il-1β、Il-6、Tnf-α)、趋化因子(Ccl2、Cxcl2)和白细胞(中性粒细胞和单核细胞)浸润减少,同时肺和血液中的大肠杆菌CFU显著减少(在重度感染后24 h时)。SCG交感神经切除术也得到了类似的结果。这些结果表明,抑制PSNs可减轻重症肺炎所致的肺损伤并提高其存活率。
图7. 抑制PSNs可改善重症肺炎的预后
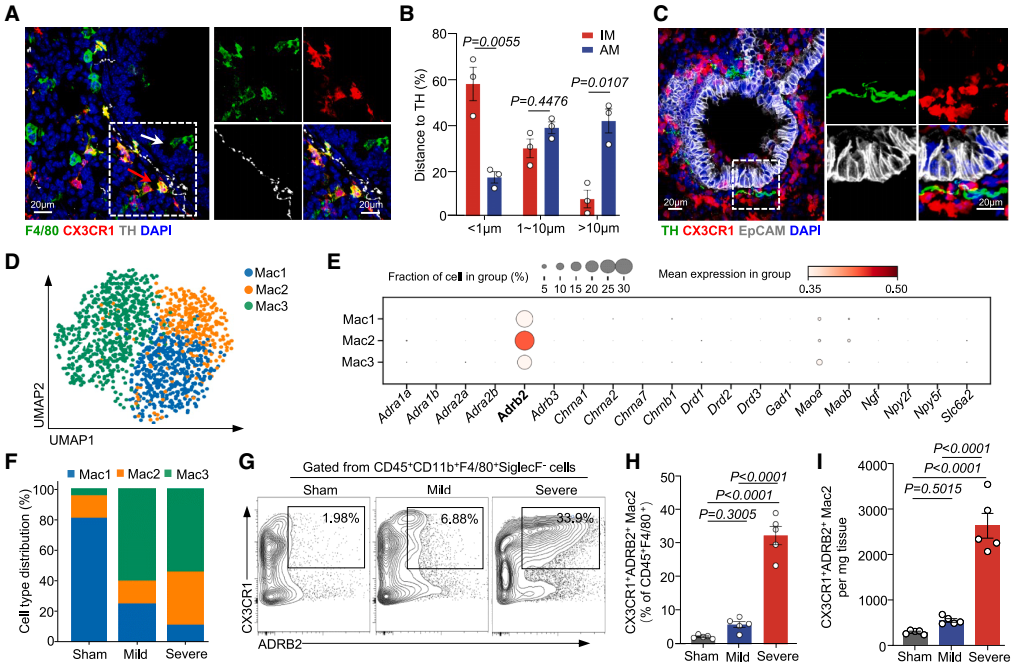
5、重症肺炎中PSNs周围ADRB2⁺间质巨噬细胞库的变化及特性
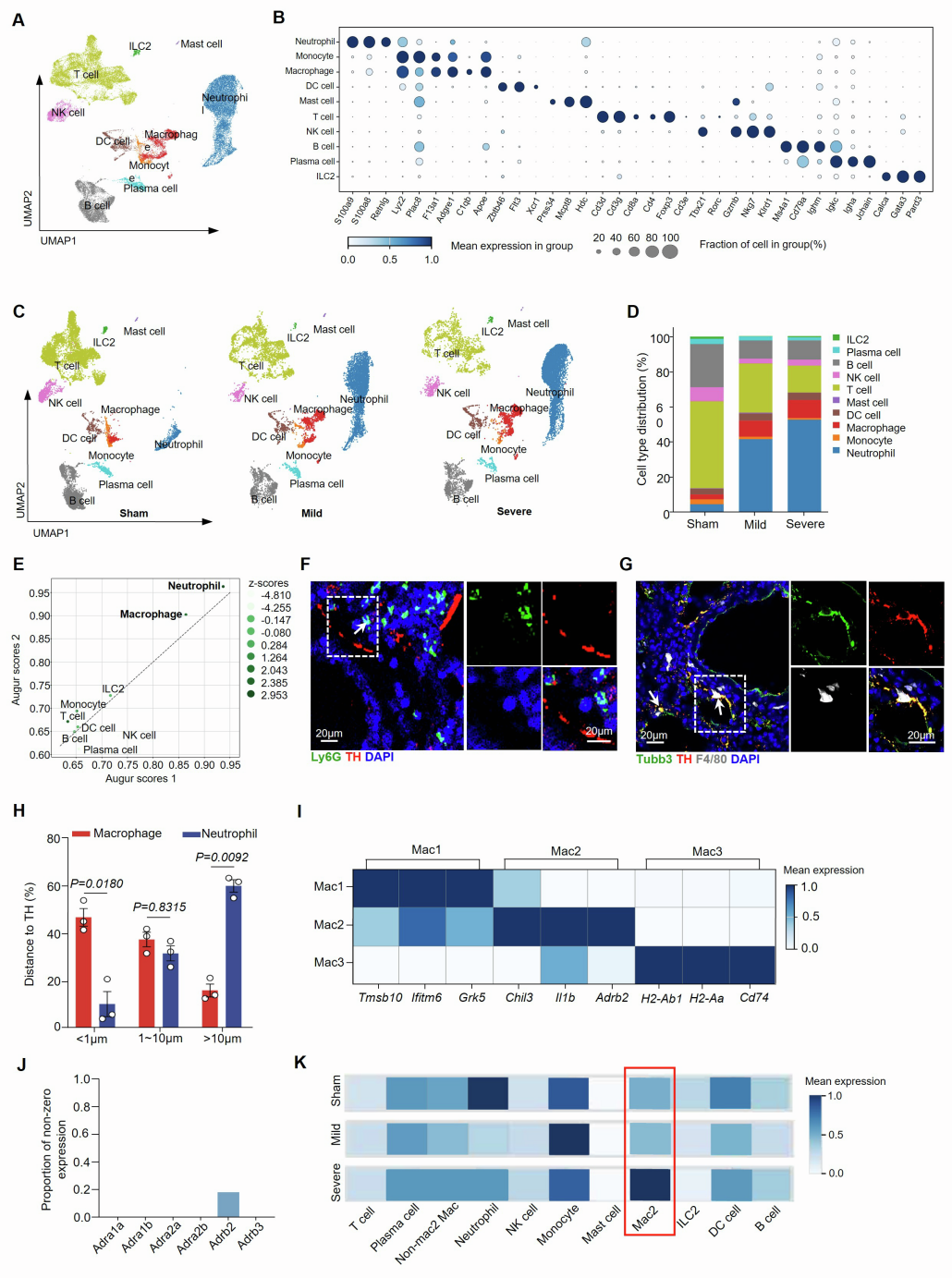
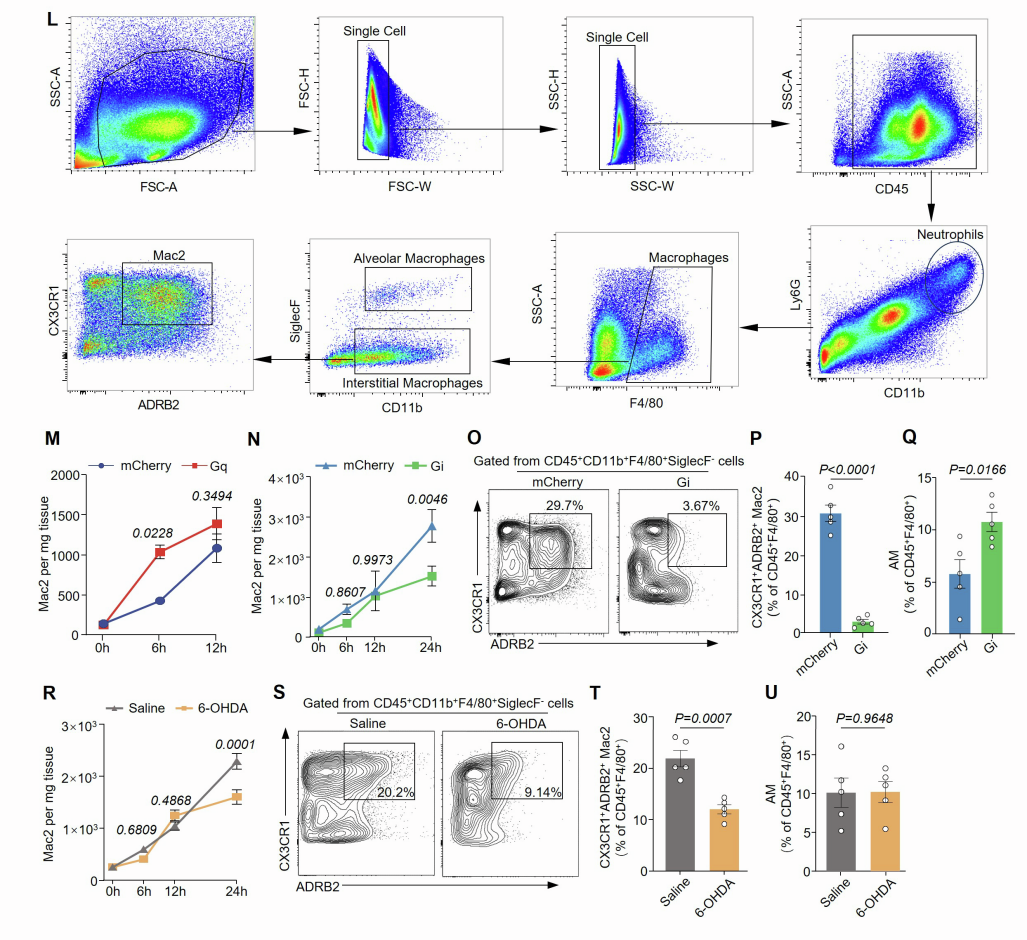
为解析肺炎小鼠肺部与炎症相关的细胞图谱,并探究PSNs对肺部细胞因子风暴的调控机制,研究团队采用单细胞RNA测序(scRNA-seq)技术分析了肺炎小鼠肺CD45⁺免疫细胞。结果显示,与假手术组相比,轻度和重度肺炎组中巨噬细胞和中性粒细胞的比例增加,而T细胞和B细胞的比例减少,且中性粒细胞和巨噬细胞在重度肺炎条件下表现出最显著的转录改变。接下来的空间关系分析显示,重度肺炎期间巨噬细胞比中性粒细胞更可能与交感神经相互作用,其中约57.63%的F4/80(巨噬细胞标志物)⁺ CX3CR1(趋化因子受体)⁺间质巨噬细胞(IMs)位于距离TH⁺ PSNs不到1 μm的范围内,高于肺泡巨噬细胞(AMs,16.93%),表明IMs而非AMs与PSNs密切相关。
鉴于IMs的异质性,团队通过无监督聚类分析确定了其三个不同的亚群:Mac1、Mac2和Mac3,均主要表达β2肾上腺素受体基因Adrb2。此外,在重症肺炎模型中,Mac2细胞Adrb2的表达水平最高,且该细胞群在重症肺炎中有扩增的现象。流式细胞术验证实验也显示重症肺炎中Mac2(定义为CX3CR1⁺ ADRB2⁺)细胞数量明显增加,免疫荧光与三维重建进一步证实其与PSNs共定位。机制上,CeA GABA能神经元的激活(hM3D(Gq))可促进Mac2扩增,而抑制(hM4D(Gi))或交感神经消融(6-OHDA)则减少Mac2的数量和比例,这些发现表明,CeA-PSNs信号在重症肺炎期间对Mac2亚群的扩增至关重要。
图8. scRNA-seq鉴定出重症肺炎中邻近PSNs的独特ADRB2⁺巨噬细胞亚群
图9. 重症肺炎会扩增位于PSNs周围的促炎性ADRB2⁺巨噬细胞库
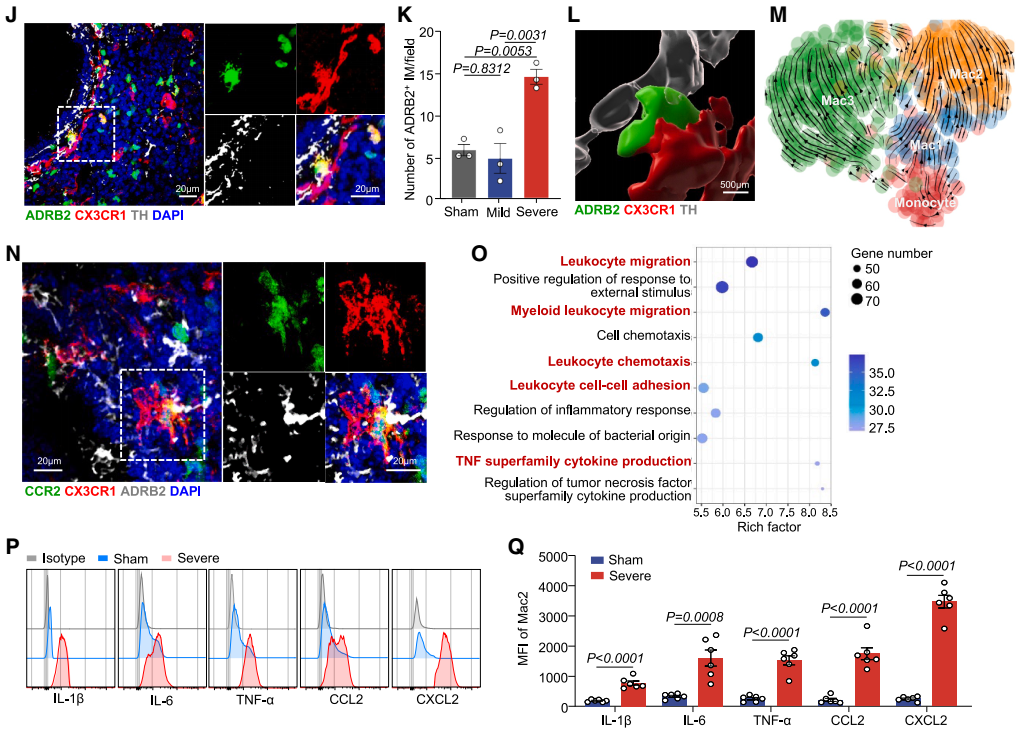
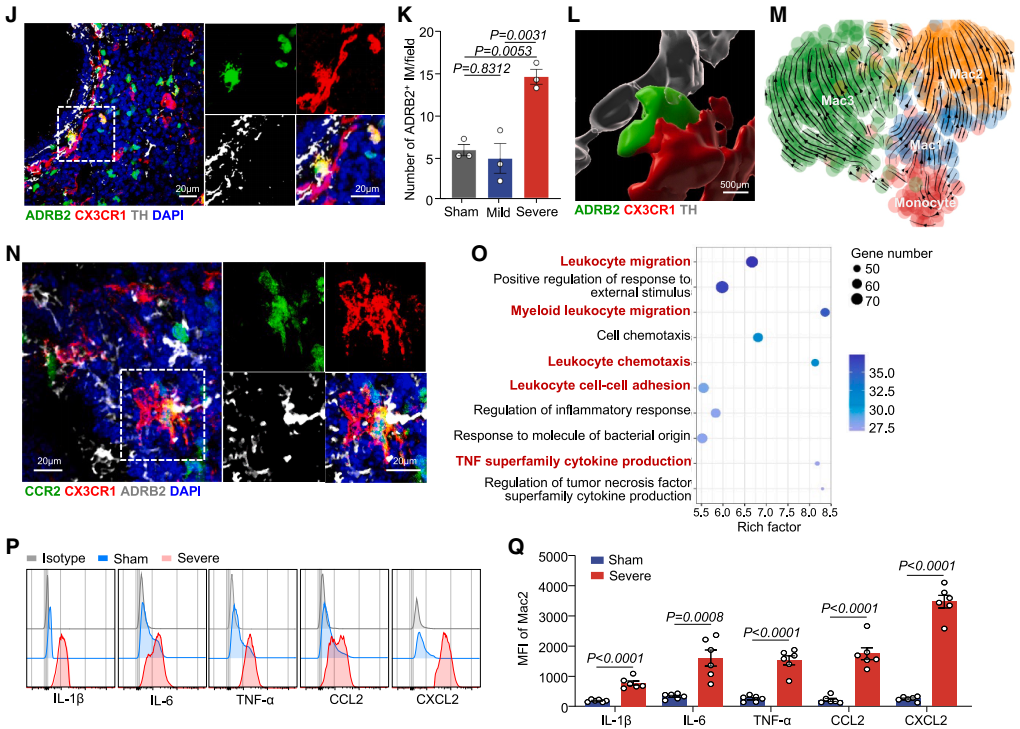
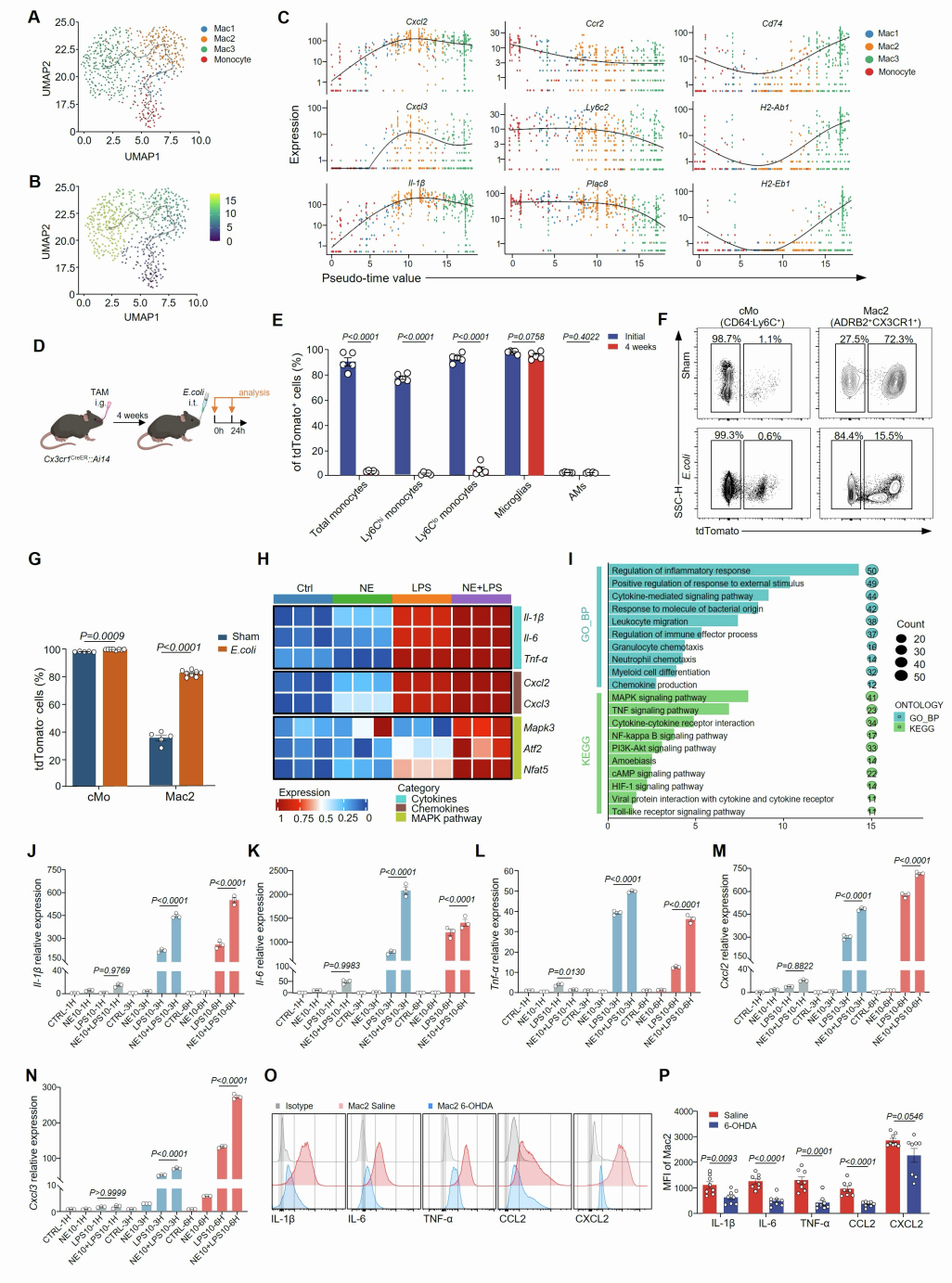
为追溯Mac2亚群的来源,研究通过RNA速率和Monocle3拟时序分析推断Mac2来源于单核细胞。免疫荧光染色也显示,位于PSNs周围的CX3CR1⁺ ADRB2⁺ Mac2细胞亚群表达单核细胞谱系标志物C-C趋化因子受体2(CCR2)。进一步通过他莫昔芬诱导的Cx3cr1CreERT2-Rosa26-tdTomato谱系追踪模型(该模型中组织驻留巨噬细胞被永久标记,而循环单核细胞来源的细胞则为tdTomato阴性),发现重症肺炎时tdTomato阴性Mac2比例从27.5%增至84.4%,证实了Mac2细胞的扩增源于循环单核细胞,而非组织驻留巨噬细胞,支持了重症肺炎中Mac2细胞的单核细胞起源。
功能上,基因本体论(GO)富集分析显示Mac2细胞高表达与白细胞迁移、细胞因子信号传递和炎症反应相关的基因,凸显其促炎和趋化特性。流式细胞术分析发现,与假手术组相比,重症肺炎组的Mac2细胞中细胞因子(IL-1β、IL-6、TNF-α)和趋化因子(CCL2、CXCL2)的平均荧光强度更高。体外实验中,研究人员从肺中分选Mac2细胞,给予vehicle(对照)、LPS、NE或LPS+NE联合刺激,并进行RNA-seq分析,结果显示NE预处理可进一步强化LPS诱导的促炎细胞因子上调,并上调丝裂原活化蛋白激酶(MAPK)促炎信号。此外,实时定量PCR分析证实,NE和LPS联合处理组中多种炎症和趋化介质的表达增加,而交感神经消融(6-OHDA)则降低了Mac2细胞中细胞因子和趋化因子的平均荧光强度。总之,这些发现表明NE可增强Mac2细胞的促炎能力。
图10. 重症肺炎中ADRB2⁺ Mac2巨噬细胞亚群的起源及功能
6、Mac2中ADRB2信号对重症肺炎炎症放大的关键作用
最后,为研究ADRB2信号对Mac2介导的细胞因子风暴是否至关重要,团队对重症肺炎小鼠气管内给予选择性ADRB2拮抗剂ICI,结果显示Mac2细胞的比例和绝对数量减少,细胞内炎症因子和趋化因子的平均荧光强度降低,同时小鼠的肺损伤减轻,存活率提高。在通过杂交生成的Cx3cr1ΔAdrb2(在CX3CR1⁺细胞中特异性缺失Adrb2)小鼠中也得到了类似的结果,表明Mac2中激活的ADRB2信号是加剧炎症和肺损伤所必需的。此外,所有的主要发现在雌性小鼠中均得到验证,表明无论性别如何,CeA-交感神经-肺轴均可调控ADRB2⁺间质巨噬细胞亚群Mac2,并放大重症肺炎中的细胞因子风暴。
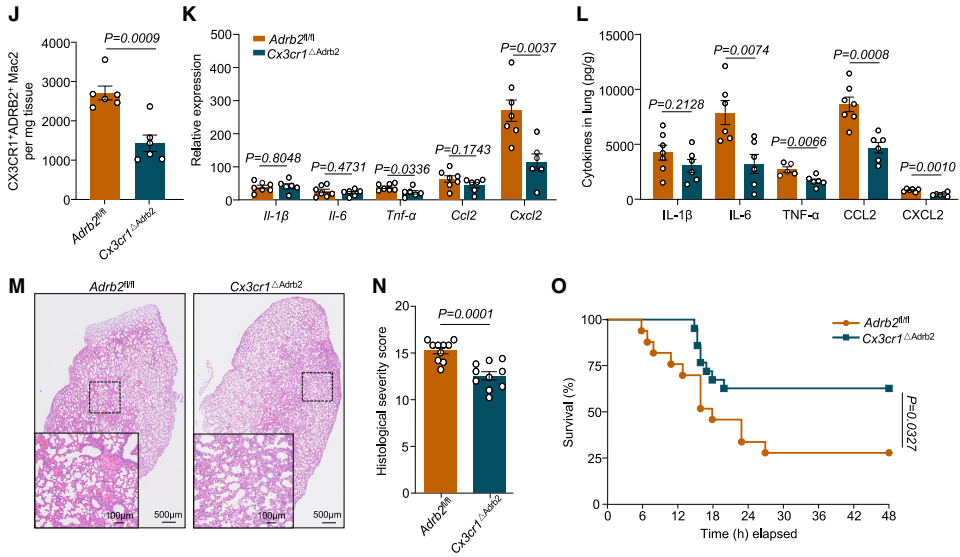
图11. Mac2细胞中的ADRB2信号对重症肺炎中炎症的加剧至关重要
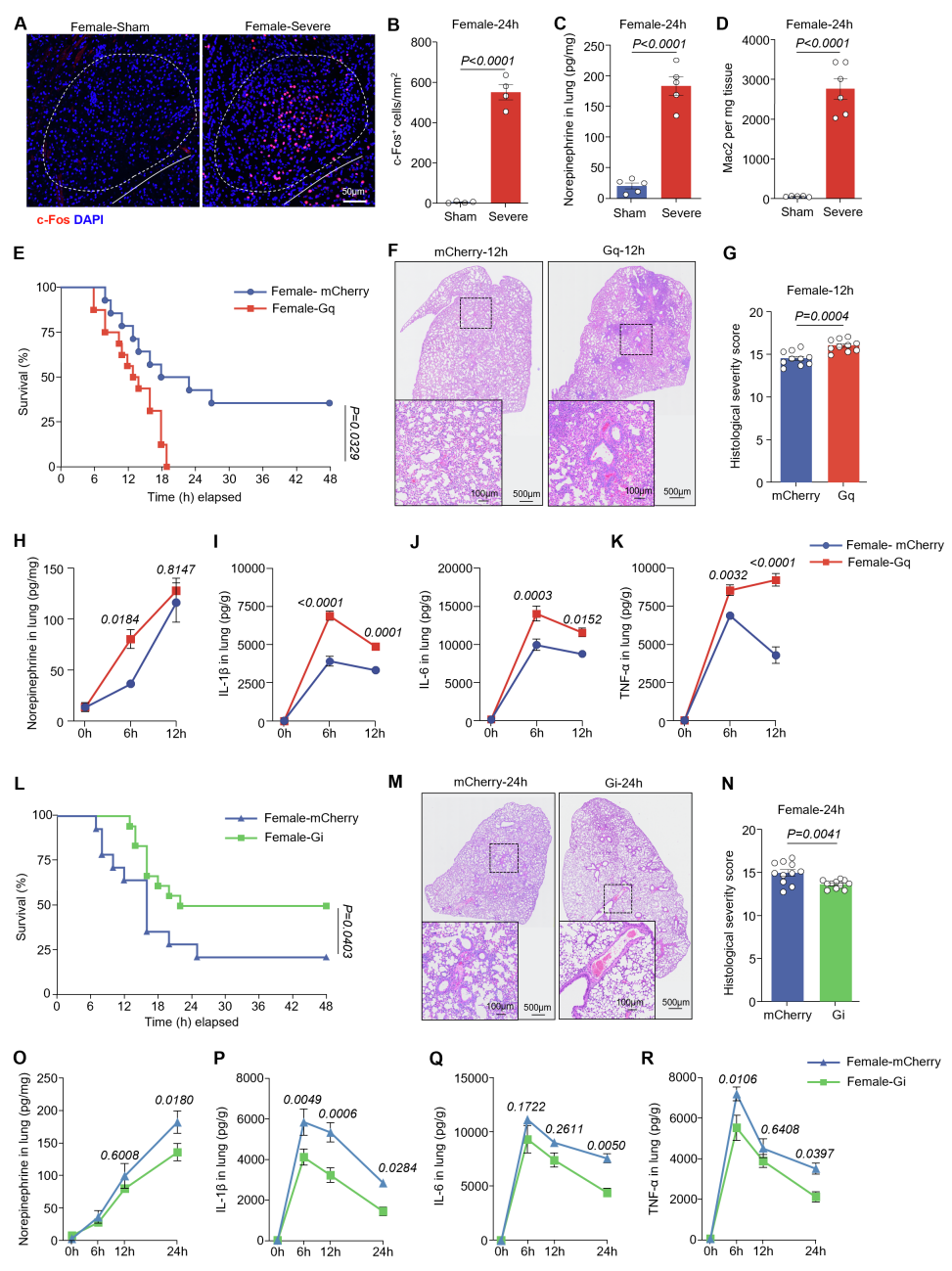
图12. CeA-交感神经-肺轴会加剧雌性小鼠重症肺炎的炎症反应
总结
总之,本研究系统揭示了一条CeA-RVLM-PSNs交感神经通路——在重症肺炎中通过释放NE,作用于PSNs周围单核来源的ADRB2⁺ Mac2巨噬细胞,从而放大细胞因子风暴并加剧肺损伤。因此,靶向CeA神经元、PSNs或ADRB2信号有望成为重症肺炎的潜在治疗策略。当然,本研究仍存在若干局限,例如对肺炎恢复期神经免疫变化、其他ADRB2⁺肺细胞(如肺泡上皮细胞、内皮细胞和成纤维细胞)的潜在作用、该通路在不同病原感染中的相关性,以及上游激活CeA GABA能神经元的精确信号机制等问题探讨不足,这些也将是未来研究的重要方向。
总结图
浙江大学医学院附属第一医院方向明教授、张凯副主任医师和美国华盛顿大学医学院病理与免疫学系Marco Colonna教授为本文共同通讯作者。该研究得到了国家自然科学基金和浙江省重点研究发展计划的资助。
方向明,教授,博士生导师,浙江大学医学院副院长、麻醉学教育部长江特聘教授、国家杰出青年科学基金获得者、中华医学会麻醉学分会常委、中国医师协会麻醉学医师分会副会长。主要研究方向为急重症病人的围术期管理、脓毒症发病机制和防治、围术期器官功能保护。作为课题负责人先后获得了国家自然科学基金重点项目、重点国际合作项目、杰出青年科学基金项目、面上和青年项目,教育部博士点基金,科技部“十二五”项目和“973”项目等资助;共发表SCI论文70余篇,系列文章刊登在AJRCCM、Critical Care Medicine、Chest、Anesthesiology和Critical Care等著名期刊,研究成果被F1000推荐,他引逾千次。
本文使用的来自枢密科技的病毒产品,列表如下:


了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK