2025-08-11 阅读量:381
脂肪组织(AT)被分隔成多个独立的脂肪库,广泛分布于全身,是一种高度动态的器官,在调节能量稳态、葡萄糖和脂质代谢及免疫反应中发挥重要作用。AT在功能上分为以甘油三酯的形式储存多余能量的白色脂肪组织(WAT)和将能量以热量形式散发的棕色脂肪组织(BAT)。此外,散在分布于WAT中的棕色样米色脂肪细胞,一旦被环境寒冷暴露或其他产热刺激激活/招募,便具有与棕色脂肪细胞相似的产热功能。除产热特性外,棕色和米色脂肪细胞还充当葡萄糖和脂质的代谢库。越来越多的动物和人类研究证据表明,激活棕色/米色脂肪细胞是治疗肥胖及其相关心脏代谢并发症的一种有前景的策略。
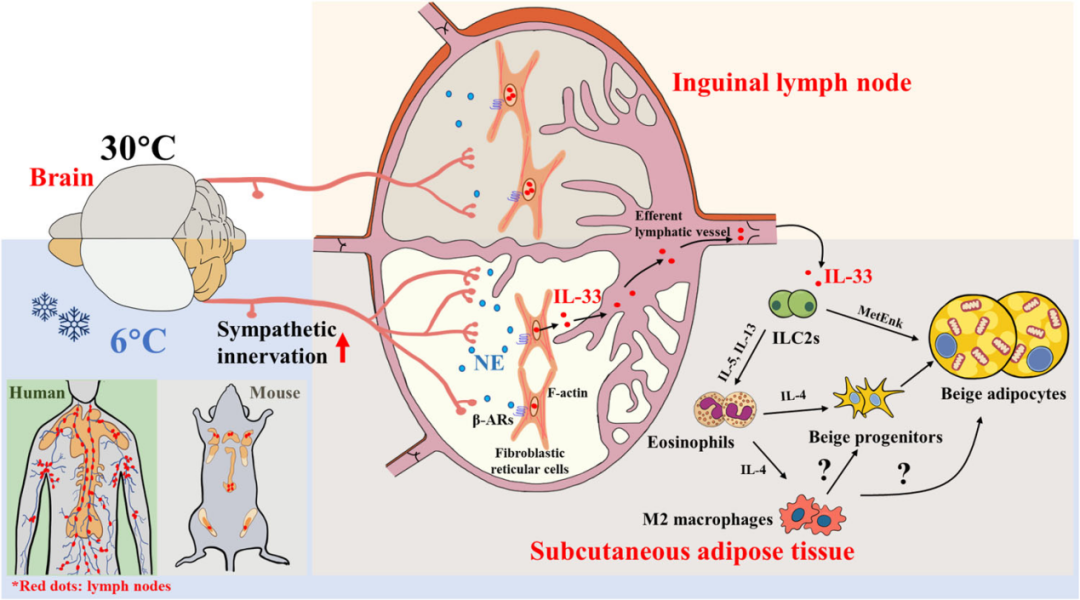
尽管经典棕色脂肪细胞和诱导性棕色脂肪细胞(即米色脂肪细胞)在功能上相似,但它们由不同的机制激活。寒冷暴露诱导的BAT中经典棕色脂肪细胞的激活主要由交感神经末梢释放的去甲肾上.腺素(NE)介导,而寒冷诱导的米色脂肪细胞生成则依赖于交感神经系统(SNS)及WAT内的局部微环境。WAT是一个高度异质性的器官,由脂肪细胞、各种类型的免疫细胞、基质细胞、血管和神经纤维组成。研究表明,小鼠和人类皮下WAT(scWAT)中的2型固有淋巴细胞(ILC2s)受IL-33激活后,可分泌IL-5、IL-13等2型细胞因子,促进米色脂肪细胞生成。而这些细胞因子进一步募集嗜酸性粒细胞并诱导M2型巨噬细胞极化,共同促进scWAT的米色化。然而,SNS和局部免疫微环境如何协调WAT米色化和产热以应对寒冷刺激,目前仍有待阐明。
多项研究发现,scWAT内部的米色脂肪细胞生成存在显著的库内差异。具体表现为:寒冷诱导的米色化优先发生于scWAT的核心区域——该区域紧邻腹股沟淋巴结(iLN),且相比于远离iLN的区域,该核心区域具有更高的血管化程度;通过对整个scWAT进行解偶联蛋白1(UCP1)免疫荧光染色的3D成像分析进一步观察到,随着寒冷暴露时间的延长,米色化会从靠近iLN的腹股沟区域逐渐扩散至远离iLN的背腰部区域。不过,这种米色脂肪细胞生成区域异质性背后的分子机制仍不清晰。
淋巴结(LNs)是分布于全身的适应性免疫系统的关键组成部分。研究表明,在啮齿动物和人类中,LNs均与AT在解剖结构和功能上相关联。几乎所有的LNs都嵌入在AT中,且大多数外周脂肪库都包含一个或多个LNs。靠近LNs的脂肪细胞在应对局部免疫攻击时表现出更活跃的脂解作用;与远离LNs的脂肪细胞对比,这些细胞对NE的反应也更敏感。有研究认为,LNs周围的脂肪细胞可作为能量储备库,为LNs内快速有效的免疫反应提供能量支持。在肥胖状态下,肥大的脂肪细胞通过增加游离脂肪酸(FFA)和活性氧(ROS)的产生(可诱导淋巴细胞凋亡)来破坏LNs的结构和功能。值得注意的是,在啮齿动物和人类中,LNs的解剖位置与WAT中易发生米色化的区域高度重叠,然而LNs在WAT米色化中所发挥的作用尚未得到研究。
因此,香港大学医药生物技术国家重点实验室徐爱民研究团队在Nature Communications期刊(IF=17.694)发表题为“Fibroblastic reticular cells in lymph node potentiate white adipose tissue beiging through neuro-immune crosstalk in male mice”的研究论文,作者发现,在寒冷条件下,iLN作为关键枢纽,通过介导SNS与2型免疫之间的相互作用,驱动scWAT米色化及米色脂肪细胞产热。此外,研究者还揭示了其潜在机制:即iLN的交感神经支配诱导其成纤维网状细胞(FRCs)释放IL-33,进而激活ILC2s及下游效应细胞,最终促进scWAT的米色化。综上所述,该研究揭示了iLN中FRCs在介导神经-免疫互作以维持能量稳态中所发挥的此前未被认知的关键作用。
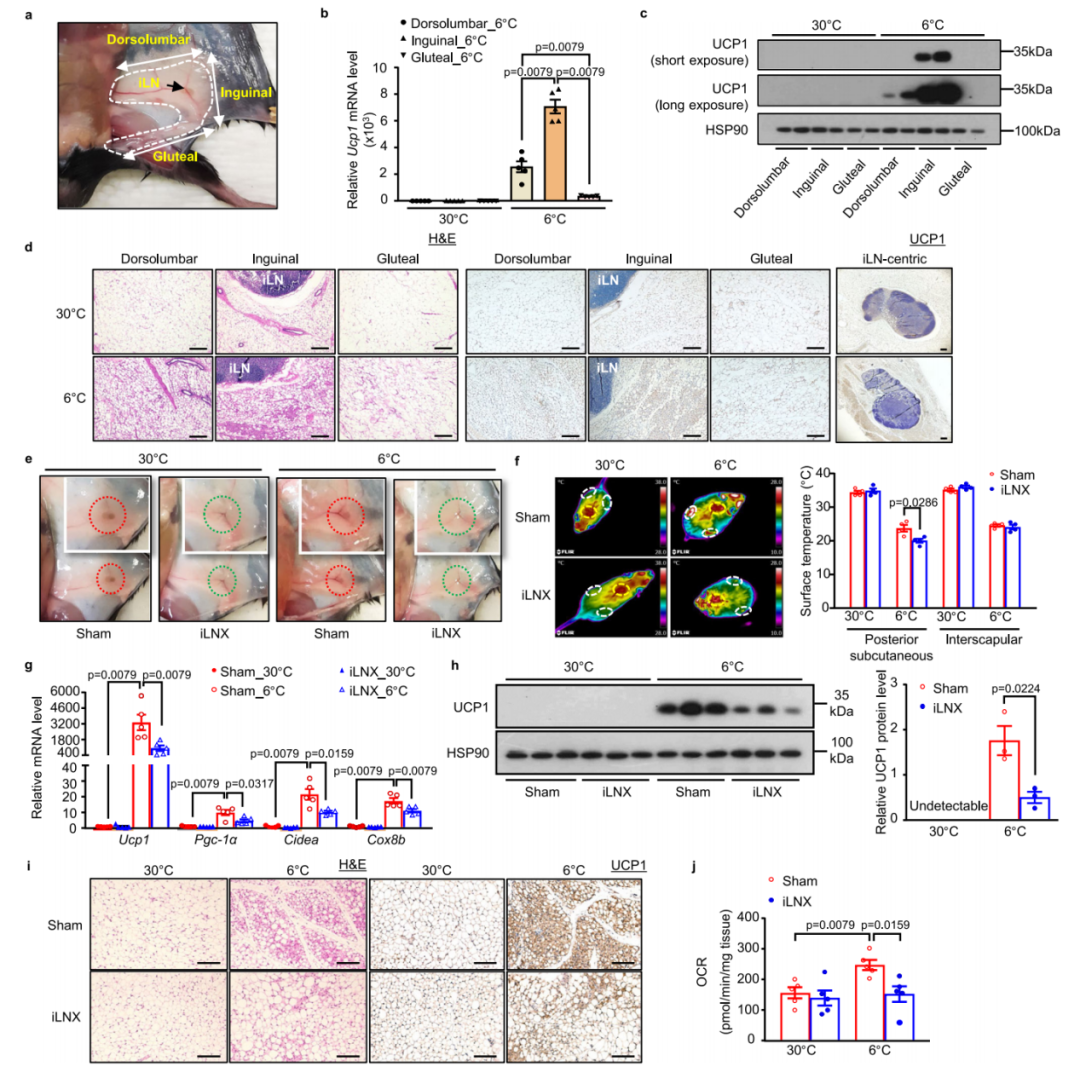
1.冷诱导的米色脂肪细胞生成主要聚集在iLN周围的scWAT
为探究米色化的区域差异是否与iLN的位置相关,研究人员比较了三个不同区域scWAT的米色化能力,即iLN周围的腹股沟区、远离iLN的背腰区和臀区。有趣的是,与另外两个区域比较,寒冷暴露后(6℃ 2d)腹股沟scWAT中UCP1的mRNA和蛋白表达水平均最高。长时间曝光后,仅在腹股沟和背腰区scWAT中可检测到UCP1,而在臀区scWAT中未检测到。为巩固这一发现,作者还进行了免疫组化染色,结果显示冷暴露2天后,与背腰区和臀区相比,靠近iLN的腹股沟scWAT中多房UCP1+(免疫染色阳性)米色脂肪细胞的数量最多。这些数据共同表明,靠近iLN的scWAT比其他远端区域更易发生冷诱导的米色化。
2.腹股沟淋巴结切除术(iLNX)会减弱冷诱导的scWAT中米色脂肪细胞的形成
为探究iLN在冷诱导scWAT米色化中的作用,研究者对C57BL/6 N小鼠进行了iLNX或假手术,术后恢复3周后,将其置于冷环境(6℃)或热中性环境(30℃)中饲养2天。通过肉眼观察及伊文思蓝染色检测LNs(呈现蓝色),证实了iLNX小鼠scWAT中已无iLN存在。
在6℃环境中暴露48小时后,假手术组小鼠和iLNX组小鼠的肛温无显著差异。值得注意的是,在6℃环境中,iLNX组小鼠腹股沟scWAT区域皮肤温度显著低于假手术组小鼠,而肩胛间BAT区域的温度则无差异,这表明切除iLN会选择性地损害scWAT中冷诱导的适应性产热,而对BAT无影响。进一步实验发现,iLN的缺失显著抑制了冷诱导的scWAT中UCP1的mRNA和蛋白表达,并显著降低了scWAT中其他几种与产热相关的基因[包括过氧化物酶体增殖物激活受体γ辅激活因子1α(Pgc-1α)、细胞死亡诱导DNA断裂因子α亚基样效应蛋白A(Cidea)和细胞色素c氧化酶亚基8B(Cox8b)]的mRNA表达。对腹股沟scWAT的组织学检查显示,冷刺激2天后,假手术组小鼠的scWAT中出现了明显的多房UCP1+脂肪细胞簇,而这种变化在iLNX组小鼠中显著减弱。与此同时,在冷暴露条件下,iLNX组小鼠腹股沟scWAT离体样本的基础耗氧率(OCR)显著低于假手术组。此外,在30℃或6℃条件下,与假手术组比较,iLNX组小鼠的BAT和附睾白色脂肪组织(eWAT)中UCP1蛋白表达及其组织学形态均未发生显著变化。
作者还探究了iLN是否参与急性冷暴露诱导的scWAT米色化。时间进程分析显示,冷暴露8小时后,scWAT中几乎检测不到UCP1蛋白,而冷暴露16小时后,UCP1蛋白水平明显升高。同样,切除iLN减弱了急性冷暴露(16小时)诱导的scWAT米色化,表现为相较于假手术组,iLNX组小鼠scWAT中UCP1+米色脂肪细胞数量显著减少,且UCP1的蛋白表达水平同步降低。
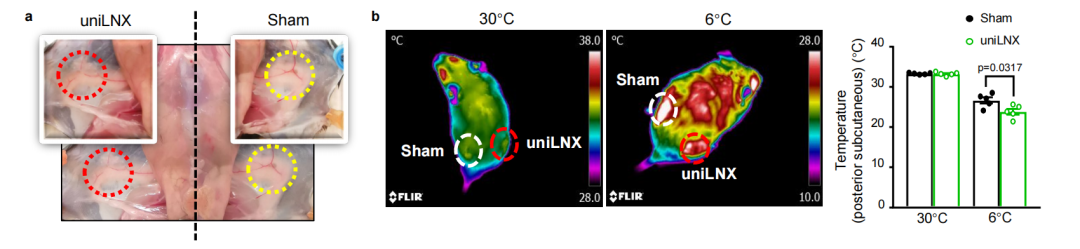
为进一步验证iLN在冷诱导scWAT米色化中的作用,研究人员还对小鼠实施了单侧iLNX(uniLNX),并以其对侧仅行假手术的腹股沟区域作为自身对照。结果显示,与双侧iLNX小鼠的研究结果一致:在冷暴露条件下,与对照组相比,uniLNX组小鼠腹股沟scWAT局部温度显著降低,且该区域产热相关基因的诱导性表达及其离体样本的基础OCR也均显著下降。综上所述,这些数据表明,切除iLN会选择性地削弱其邻近scWAT中冷介导的米色化。
图1.iLN促进冷诱导scWAT的米色化
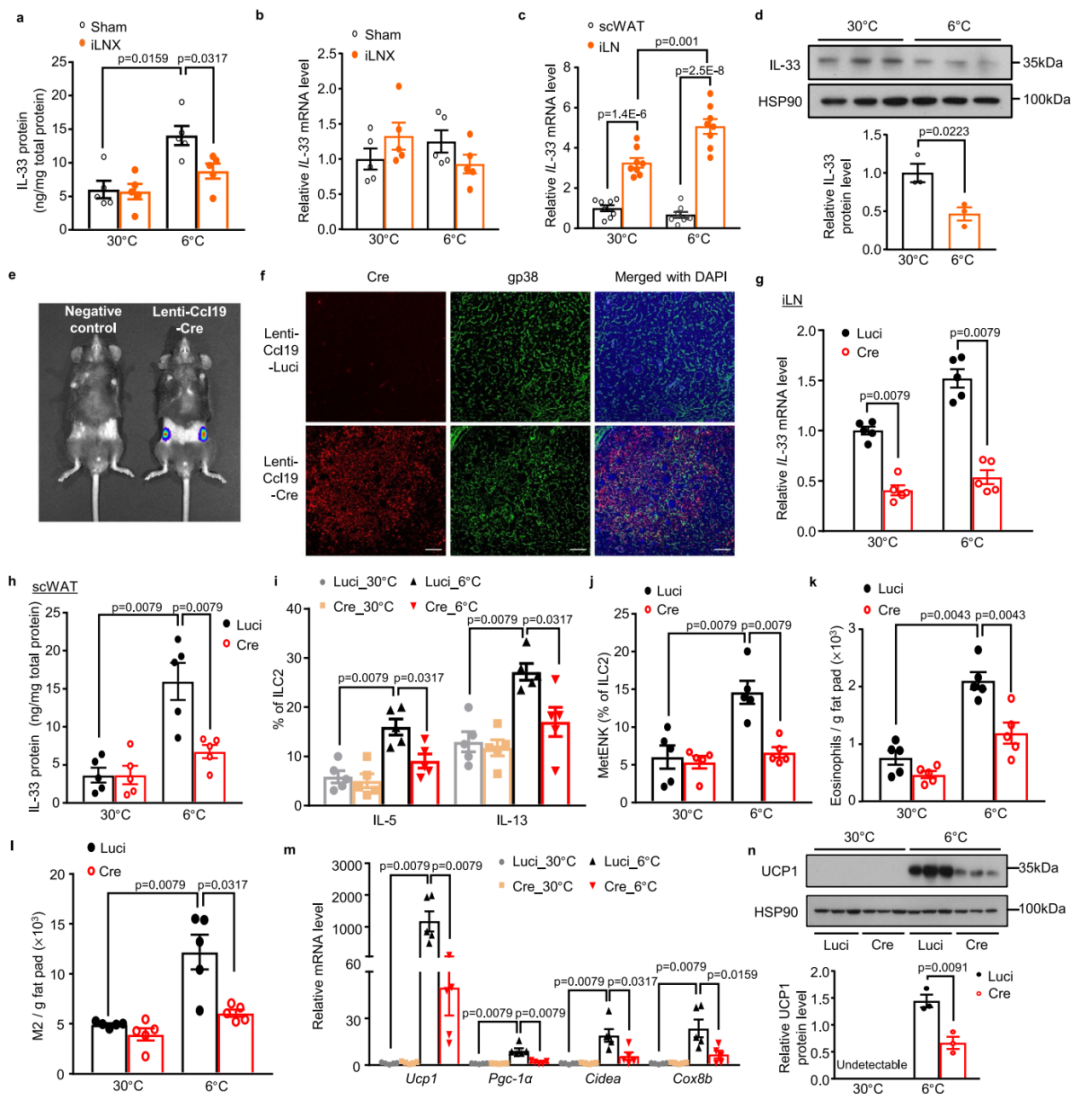
3.iLNX小鼠中寒冷诱导的2型固有淋巴细胞(ILC2s)活化及米色脂肪细胞谱系定向分化均受损
由于假手术组小鼠和iLNX组小鼠的功能性BAT水平相当,作者推测iLN可能调控scWAT中寒冷诱导米色脂肪细胞生成所需的局部微环境。与先前研究报道一致,寒冷暴露显著诱导假手术小鼠scWAT中多种2型细胞因子(IL-5、IL-13和IL-4)的mRNA表达,而手术切除iLN后,scWAT中这些2型细胞因子的寒冷诱导性升高被大幅消除。鉴于WAT中的ILC2s可通过分泌2型细胞因子和甲硫氨酸脑啡肽(MetEnk)促进米色脂肪生成,研究人员接下来通过流式细胞术分析了scWAT中ILC2s(Lin-Cd5-Cd45+Cd127+IL33R+)的丰度。与既往研究一致,在30℃或6℃环境下饲养的两组小鼠中,scWAT中ILC2s的数量相当。假手术小鼠中,寒冷暴露增加了scWAT驻留ILC2s中IL-5、IL-13和MetEnk的表达,尤其在腹股沟区域。然而,这些寒冷诱导的变化在iLNX小鼠中大幅减弱。值得注意的是,手术去除iLN对iLN周围scWAT中的淋巴管和血管密度,及γδT细胞、中性粒细胞和树突状细胞的募集均无明显影响。此外,假手术对照组scWAT中ILC2s的活化及NE含量未受单侧iLNX影响。毫无例外地,寒冷暴露诱导的嗜酸性粒细胞(F4/80-Cd11b+Cd45+Siglec F+)和M2型巨噬细胞(F4/80hiCd11b+Cd206+)丰度增加在iLN切除后显著受损,而这两种细胞都是ILC2s介导scWAT米色化的下游效应细胞。相反,在30℃或6℃条件下,假手术组和iLNX组小鼠scWAT中M1型巨噬细胞的比例无显著差异。综上,这些结果表明,在寒冷诱导的scWAT米色化中,iLN是ILC2s活化及嗜酸性粒细胞/M2型巨噬细胞募集所必需的。
研究表明,寒冷暴露通过促进双潜能脂肪前体细胞定向分化为米色脂肪细胞谱系来诱导米色脂肪细胞生成。因此,作者接下来通过流式细胞术分析了iLN缺失对米色脂肪前体细胞(基础表型:Lin-Cd45-Cd31-Sca1+Pdgfrα+,分选策略:Tmem26+或Cd137+)谱系定向分化的影响。结果显示,假手术小鼠中,寒冷刺激显著增加了scWAT基质血管组分(SVFs)中米色脂肪前体细胞的丰度,而这种寒冷诱导效应在iLNX小鼠中明显减弱。同样,寒冷诱导的多种米色谱系标志物(包括Tnfrsf9/Cd137、Tmem26和Tbx1)的基因表达也因iLN缺失而被消除。此外,scWAT中存在一类仅分化为米色脂肪细胞的前体细胞亚群(Lin-Cd45-Cd31-Sca1+Cd81+)。寒冷刺激显著促进该亚群在scWAT的SVFs中的谱系定向分化,而此效应在iLNX小鼠中减弱。这些结果,连同iLN调控ILC2s活性的发现,支持了“iLN通过调控2型免疫最终介导寒冷诱导的米色脂肪细胞生成”这一观点。
4.iLN中成纤维网状细胞(FRCs)产生的IL-33是寒冷诱导ILC2s活化及scWAT米色化所必需的
IL-33是米色脂肪细胞生成过程中ILC2s的激活剂。研究者发现,寒冷暴露可显著增加scWAT中IL-33浓度(ELISA测得),尤其在腹股沟区域。然而,iLNX小鼠scWAT中IL-33浓度的寒冷诱导性升高显著减弱。而在30℃或6℃条件下,两组小鼠scWAT中IL-33的mRNA水平均无明显差异。同样,单侧iLNX组scWAT中IL-33浓度的寒冷诱导性升高显著降低,而假手术对照组则无此现象。有趣的是,iLN中IL-33的mRNA水平是scWAT中的3倍多,且寒冷刺激进一步上调了iLN中IL-33的mRNA水平,但对scWAT无此作用。相反,Western blot检测显示寒冷刺激下iLN中IL-33的蛋白丰度显著降低,而未透化的scWAT切片中IL-33的蛋白水平在寒冷暴露后升高。进一步的流式细胞术分析表明,IL-33主要在iLN的成纤维网状细胞(FRCs,定义为Cd45-Cd31-gp38+细胞)中表达,且寒冷刺激后FRCs的相对比例未受影响。尽管有报道称iLN中的淋巴管内皮细胞(LECs)可表达IL-33,但作者的结果显示,FRCs中IL-33的表达水平比LECs(定义为Cd45-Cd31+gp38+细胞)中的约高3倍。此外,与热中性(30℃)环境下的小鼠相比,经过2天寒冷暴露后,仅FRCs胞内IL-33水平显著降低,而LECs中无明显变化。IL-33与淋巴管内皮受体1(LYVE-1,淋巴管标志物)的免疫荧光染色显示,寒冷刺激后iLN中IL-33与LYVE-1存在明显共定位,表明FRCs释放的IL-33可能进入淋巴管。一致地,淋巴结内注射FITC标记的葡聚糖后2分钟,可在iLN内的淋巴管中检测到,注射20分钟后,其从iLN迁移至周围的腹股沟scWAT,并与围脂滴蛋白1(PLIN1)部分共定位。综上,这些发现表明,iLN中的FRCs是IL-33的重要来源,在寒冷暴露期间,IL-33可能通过淋巴管释放到邻近的scWAT中发挥作用。
鉴于内源性IL-33在FRCs中大量表达,研究人员接下来通过特异性敲除iLN FRCs中的IL-33,探究FRCs是否是寒冷刺激期间scWAT中IL-33的蛋白水平升高的主要贡献者。为此,将两种慢病毒直接注射到IL-33fl/fl小鼠的iLN中:一种是Lenti-Ccl19-Cre,由FRCs特异性启动子Ccl19驱动,携带FLAG标签并表达Cre重组酶;另一种是Lenti-Ccl19-Luc,同样由Ccl19启动子驱动,仅表达荧光素酶(作为对照)。腹腔注射荧光素后,Luc活体成像显示,荧光素酶表达主要集中在iLN,而在其他器官中未检测到。此外,Cre与FRCs标志物gp38共染色发现,Cre主要在iLN FRCs中表达;FLAG与脂肪细胞标志物PLIN1共染色也证实,Cre在scWAT中不表达。一致地,流式细胞术分析显示,注射Lenti-Ccl19-Cre的小鼠iLN中分离的FRCs中约80%为Cre+,而对照组中几乎检测不到Cre的表达。作者还通过流式细胞术分析排除了iLN中树突状细胞表达Cre重组酶的可能性。结果显示,从注射Lenti-Ccl19-Cre的小鼠iLN中分离的树突状细胞(Cd45+Cd11b+Cd64-Cd11c+)中未检测到Cre的表达。
与Lenti-Ccl19-Luc组对比,Lenti-Ccl19-Cre组小鼠iLN中分离的FRCs中IL-33的mRNA表达显著降低约65%。一致地,流式细胞术分析也显示,相较于对照组,Cre阳性FRCs中核内IL-33蛋白的染色强度显著降低,从而证实iLN FRCs中IL-33被高效且特异性地敲除。值得注意的是,特异性敲除iLN FRCs中的IL-33导致寒冷诱导的scWAT中IL-33蛋白升高、ILC2s活化、嗜酸性粒细胞和M2型巨噬细胞募集及产热相关基因上调均显著减弱。通过免疫荧光染色(CD31,血管标志物)、相关免疫细胞的流式细胞术分析、NE含量(评估交感神经活性)及酪氨酸羟化酶(TH)蛋白水平检测发现,慢病毒介导的IL-33敲除对scWAT的血管密度、ILC2s绝对数量、M1型巨噬细胞、γδT细胞、中性粒细胞、树突状细胞数量及交感神经支配均无影响。综上,这些发现支持iLN中的FRCs是IL-33的主要来源,其通过驱动ILC2活化进而促进局部scWAT的米色化。
图2.iLN FRCs分泌的IL-33对于冷诱导的ILC2s激活与scWAT米色化是必不可少的
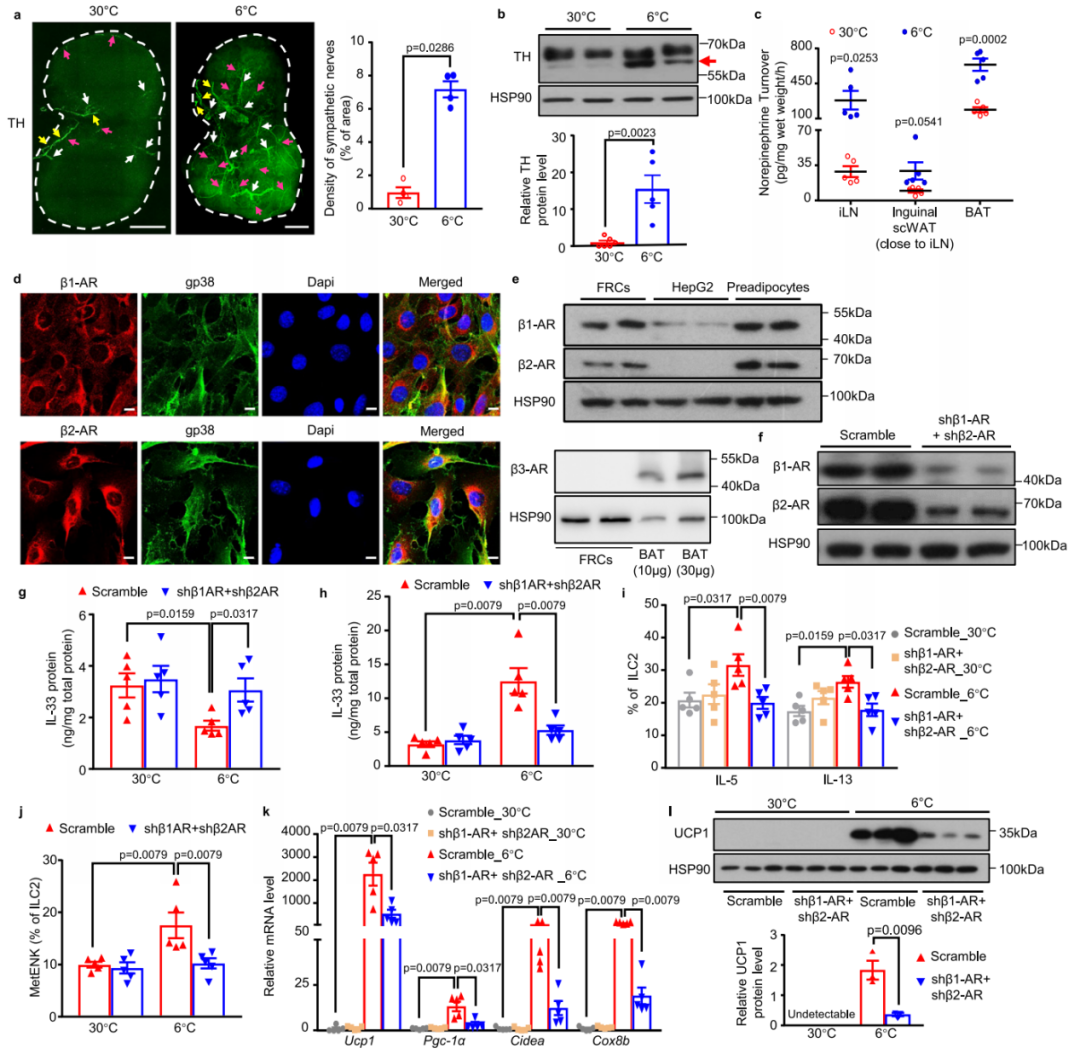
5.冷暴露会增强iLN的交感神经支配,并激活FRCs中的β1和β2肾上.腺素能受体信号,从而促进IL-33的释放
前人研究表明,在小鼠和人类中,LNs都受交感神经系统(SNS)的支配。因此,研究者接下来探索了冷暴露是否会调节iLN内的SNS活性。全组织免疫荧光染色结果显示,相较于热中性条件,冷暴露显著增加了iLN内TH+交感神经纤维密度(增幅达约6倍)。与此一致,冷暴露2天后,iLN内的TH蛋白水平也显著升高。尽管有报道称在淋巴细胞中可检测到TH的表达,但作者的免疫荧光染色结果显示,在iLN中TH与Cd3(T淋巴细胞标记物)之间没有共定位。此外,通过NE周转率(NETO)测定发现,冷刺激后iLN中的交感神经活性显著增强(约10倍)。
考虑到IL-33在FRCs中大量表达,研究人员进一步推测,流向iLN的交感神经传出信号可能会促进iLN中FRCs合成IL-33并将其释放到周围的scWAT中。因此,研究者从小鼠iLN中分离出FRCs,以探究FRCs是否表达肾上.腺素能受体(ARs)。免疫荧光染色和蛋白质免疫印迹结果显示,在gp38+FRCs中存在β1-AR和β2-AR,但不存在β3-AR。为进一步探究FRCs中β1-AR和β2-AR信号的生理作用,研究者将编码由Ccl19启动子驱动的靶向β1-AR或β2-AR的短发夹RNA(shRNA)的慢病毒共注射到C57BL/6 N野生型小鼠的iLN中。通过蛋白质免疫印迹验证了β1-AR和β2-AR的敲低效率,结果显示,与scramble(无序对照)组比较,实验组分选的FRCs中β1-AR和β2-AR蛋白表达分别减少了约75.8%和83.9%。冷暴露后,敲低β1-AR和β2-AR导致iLN中IL-33蛋白水平显著升高,但scWAT中IL-33水平降低,这表明IL-33从iLN中的FRCs向其周围scWAT的分泌受损。同样地,选择性敲低iLN FRCs中β1-AR和β2-AR,导致冷诱导的iLN中ILC2s激活、嗜酸性粒细胞和M2型巨噬细胞的募集及scWAT的米色化均明显减弱,而scWAT中的血管形成及ILC2s、M1型巨噬细胞、γδT细胞、中性粒细胞和树突状细胞的募集则保持不变。总的来说,这些结果表明,冷诱导交感神经释放的NE作用于表达β1-AR和β2-AR的FRCs,进而促进IL-33从iLN合成并分泌到其周围的scWAT中。
为探究iLN的交感神经支配是否在冷诱导的iLN周围scWAT米色化中发挥作用,研究人员通过向iLN直接注射儿茶酚胺能神经毒素6-羟基多巴胺(6-OHDA)进行交感神经去支配,随后通过检测scWAT米色化程度及IL-33的释放水平等实验证明,iLN的交感神经支配通过调控IL-33的释放来调节scWAT米色化。
图3.冷暴露增强iLN的交感神经支配,激活FRCs中β1-AR和β2-AR信号,从而促进IL-33的释放
总结
本研究发现一条新通路:寒冷刺激诱导的流向iLN的交感神经传出信号,促进FRCs释放IL-33,从而塑造支持米色脂肪细胞生成的免疫微环境。具体而言,FRCs是寒冷诱导scWAT米色化中IL-33的主要来源,并介导ILC2s的激活;LNs除经典的抗病原体感染功能外,首次揭示其在适应性产热中的新功能——作为神经-免疫互作的关键界面,通过维持能量稳态调控米色化。
图4.iLN通过FRCs释放IL-33,将交感神经信号与2型免疫反应相偶联,从而介导寒冷诱导的scWAT米色化
本文使用的病毒产品,列表如下:
枢密科技已开发一系列慢病毒现货产品,可提供基因下调、基因过表达、基因敲入/敲除、功能扰动、钙信号检测等现货产品及包装定制服务。质量稳定,周期短!

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK