2025-07-21 阅读量:1240
基于造血干细胞(HSC)的基因治疗是治愈多种疾病的重要方向,因其经校正后能够重建并修复整个造血系统,而这一治疗方式的实现离不开载体对治疗性基因的高效递送。早期在该领域应用的基于鼠白血病病毒(MLV)的逆转录病毒载体虽有一定成效,但临床研究中出现的严重基因毒性副作用,促使领域转向安全性更优的慢病毒载体(LVs)。目前,LVs已在X连锁肾上腺脑白质营养不良、β地中海贫血等单基因遗传病的临床治疗中展现成效,然而经典的水疱性口炎病毒G蛋白(VSV-G)修饰的LV在应用中存在明显局限性:对处于静止期(G0期)的HSC(其中75%处于G0期)转导效率极低;且转导过程需依赖高剂量载体及强效细胞因子组合刺激,这不仅可能损害HSC的自我更新特性、促进其分化,还会增加多拷贝整合及插入突变的风险,难以满足终身治愈所需的高水平HSC校正需求。因此,研发能高效转导静止期HSC且无需强细胞因子刺激的新型LVs,成为优化HSC基因治疗的关键研究方向
来自法国的Els Verhoeyen研究团队在Blood期刊上发表了题为“Baboon envelope pseudotyped LVs outperform VSV-G-LVs for gene transfer into early-cytokine-stimulated and resting HSCs”的研究成果,该研究创新性地构建了以狒狒内源性逆转录病毒(BaEV)包膜糖蛋白(gp)为假型的LVs(BaEV-LVs)。实验表明,BaEV-LVs凭借对人补体的抗性及对hCD34⁺(人源CD34阳性)细胞上存在的ASCT-1和ASCT-2(中性氨基酸转运蛋白1和2)双受体的识别能力,在温和细胞因子预刺激条件下,仅需低剂量即可实现高达90%的hCD34⁺细胞转导效率。另外,在无外源性刺激时,BaEV-LVs对hCD34⁺细胞的基因转移效率显著优于VSV-G-LVs和RDTR-LVs(猫内源性逆转录病毒RD114突变糖蛋白假型化LVs)。此外,BaEV-LVs可转导高达30%的静止期hCD34⁺细胞(VSV-G-LV仅为5%)。更重要的是,BaEV-LVs转导的hCD34⁺细胞在NOD/Lt-SCID/γc-/-(NSG)小鼠中可长期维持髓系、淋巴系(含早期祖细胞)的高转导水平,且次级移植后转导效率未降低,证实其能高效靶向真正的HSC。该研究为解决现有LVs在HSC基因治疗中的局限性提供了新策略,其低剂量、低细胞因子依赖及高静止期细胞转导特性,有望推动以HSC为基础的基因治疗向更安全、高效的临床应用迈进。
枢密科技重磅推出BaEV-LVs——BaEVTR-LV与BaEV-Rdomain less-LV!可高效转导CD34⁺细胞、初始T细胞、初始B细胞、记忆B细胞及自然杀伤细胞,凭借低剂量即可实现高效转导、低细胞因子依赖的核心优势,为造血干细胞基因治疗、免疫细胞精准修饰及相关疾病研究提供突破性工具!选择枢密科技,解锁造血与免疫细胞基因递送新维度!相关产品见文末~
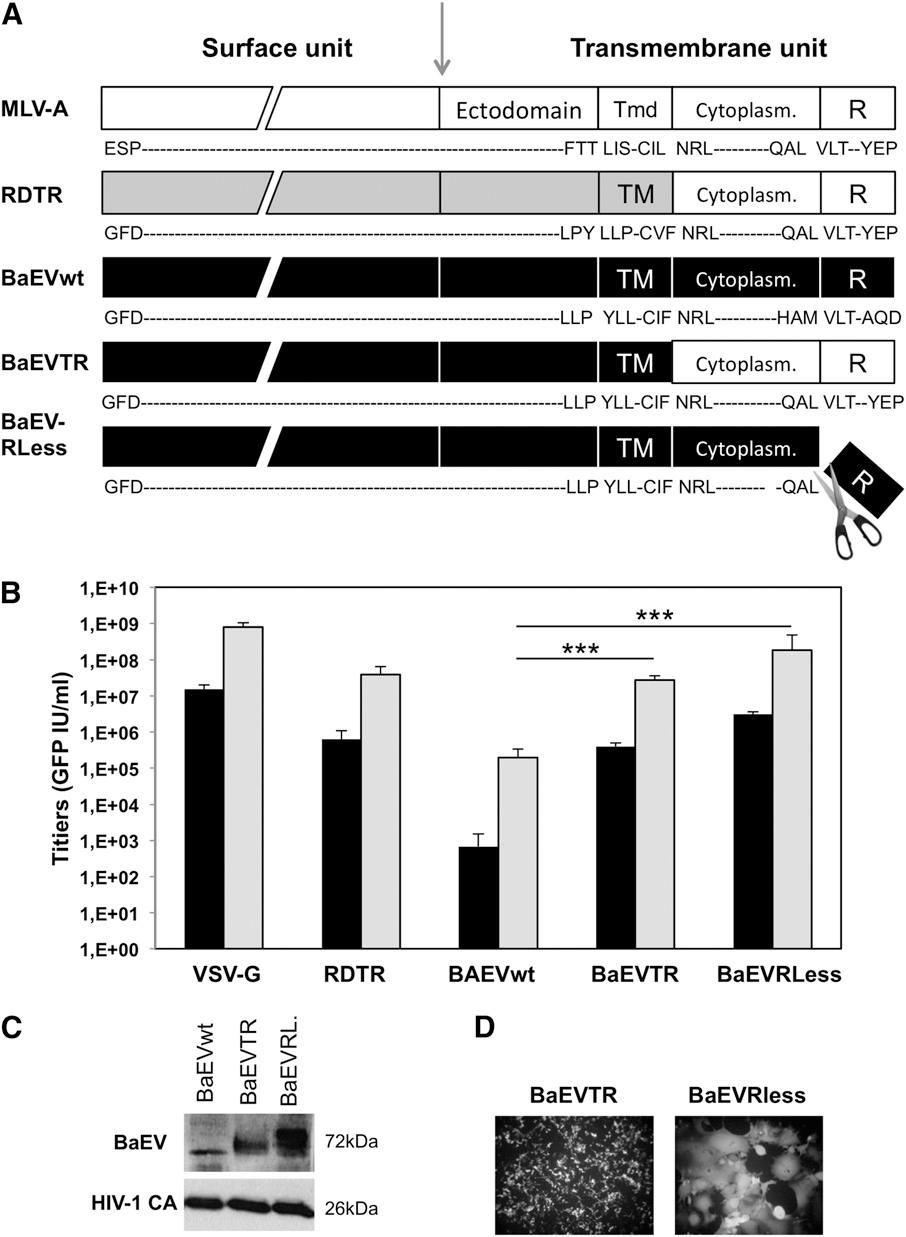
1、狒狒包膜糖蛋白突变体BaEVTR和BaEVRLess可高效实现LVs的假型化
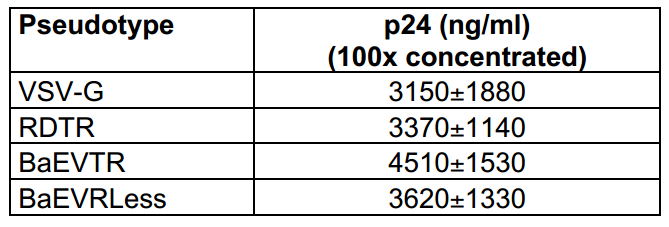
在基于HSC的基因治疗中,LVs假型化是提升转导效率的关键。研究人员发现,野生型(WT)BaEV gp对LVs进行假型化时效率较低,其新鲜病毒滴度和100倍浓缩后的滴度仅为6×10³和2×10⁵ IU/mL。为改善这一情况,研究者通过结构改造构建了两种BaEV gp突变体:通过将其细胞质结构域替换为MLV gp(MLV-A-gp)设计了嵌合型BaEVTR-gp;通过删除融合抑制R肽,构建了第二种突变体BaEVRLess-gp。研究者将这两种突变体与VSV-G和RDTR-gp在LV假型化能力方面进行了比较:通过在293T细胞中瞬时转染,构建了RDTR、BaEVTR、BaEVRless及VSV-G假型化的编码GFP(绿色荧光蛋白)的自失活型(SIN)LVs,随后进行100倍浓缩。结果显示,BaEVTR-LV和BaEVRLess-LV的平均浓缩滴度分别为5×10⁷ IU/mL和2×10⁸ IU/mL,相较野生型BaEV-LV,滴度分别提高了250倍和1000倍,这源于突变体在LV颗粒中更高的整合效率。正如预期,RDTR-LV和VSV-G-LV的滴度分别为6×10⁷和1×10⁹ IU/mL,且不同假型载体的物理颗粒含量相近。值得注意的是,BaEVTR-gp无细胞融合毒性,而BaEVRLess-gp会诱导合胞体形成。BaEVTR-LV和BaEVRLess-LV所展现的高滴度特性,促使研究者进一步评估其对hCD34⁺早期祖细胞的转导效能。
图1. BaEV糖蛋白胞质尾部的修饰实现LVs的高效假型化
表1. Q-PCR(实时荧光定量聚合酶链式反应)和FACS(荧光激活细胞分选)分析获得的滴度比较
表2. 基于HIV p24(人类免疫缺陷病毒p24衣壳蛋白)含量的LVs假型滴度测定
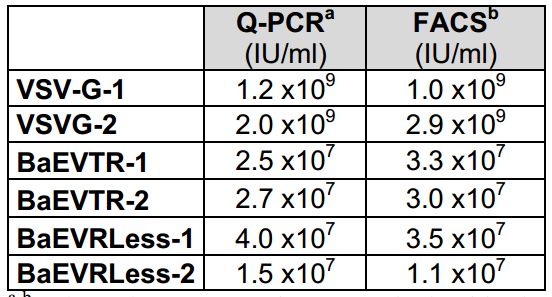
2、BaEV-LVs在转导未成熟hCD34⁺细胞方面优于VSV-G-LVs和RDTR-LVs
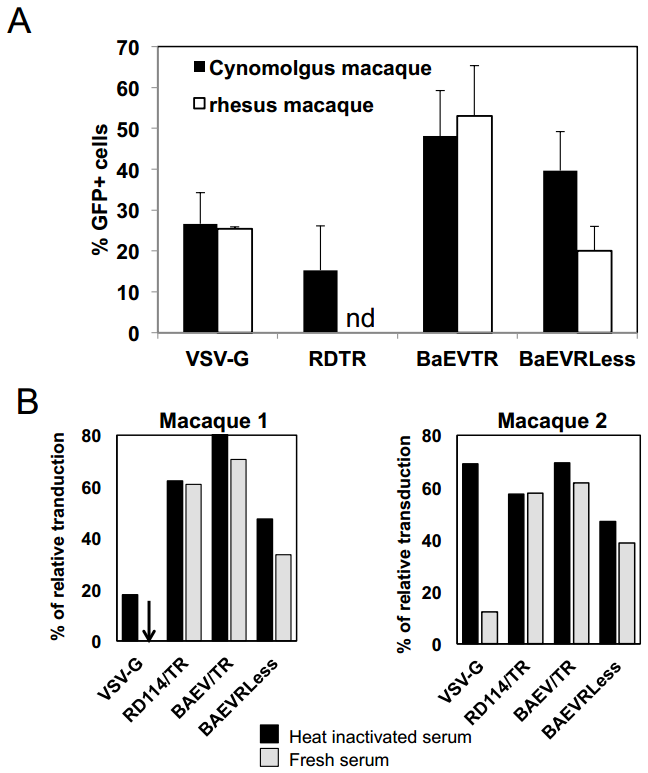
在HSC基因治疗中,载体对未成熟hCD34⁺细胞的高效转导及体内应用稳定性至关重要。研究者发现,BaEV-LVs凭借独特的双受体结合特性,在hCD34⁺细胞转导中展现出显著优势。相较于仅结合hASCT2受体的RDTR-LVs,BaEV-LVs(BaEVTR-LVs和BaEVRLess-LVs)可额外结合hASCT1受体,在多种细胞因子(SCF/TPO/Flt3-L)预刺激并添加转导促进剂RetroNectin的条件下,以10的感染复数(MOI)单次应用BaEV-LVs即可实现转导高达90%的hCD34⁺细胞,显著优于VSV-G-LVs和RDTR-LVs。由于使用感染滴度难以比较不同假型载体,研究者还使用等量物理颗粒(通过检测HIV p24反映病毒颗粒的总数量)转导活化的CD34⁺细胞,结果显示BaEVgp-LVs的转导效率仍显著高于VSV-G-LVs。
考虑到临床体内应用,若BaEV-LVs能抵抗人补体系统的灭活,将是一大优势。为此,研究者比较了LVs在新鲜人血清与热灭活人血清中孵育后的转导效率。结果显示,VSV-G-LVs被3种来源不同的人血清灭活;而BaEVTR-LVs和BaEVRLess-LVs对人补体的抵抗能力达到了与RDTR-LVs相当的水平。另外在临床前评估中值得关注的是,BaEV-LVs能高效转导食蟹猴和猕猴的骨髓(BM)hCD34⁺细胞,并可抵抗猕猴补体系统的灭活。综上,BaEV-LVs凭借其超高转导效率与血清稳定性,成为hCD34⁺细胞转导的优良候选载体,较VSV-G-LVs更适合于体内应用。
图2. BaEV-LVs对hCD34⁺细胞的转导效率优于VSVG-LVs和RDTR-LVs
图3. 同等物理颗粒剂量下不同假型LV对hCD34⁺细胞的转导效果
图4. 以BaEVgps假型化的猴免疫缺陷病毒载体(LV的一种)可高效转导猕猴BM CD34⁺细胞
3、BaEV-LVs可在温和细胞因子预刺激及低载体剂量下实现hCD34⁺细胞的高水平转导
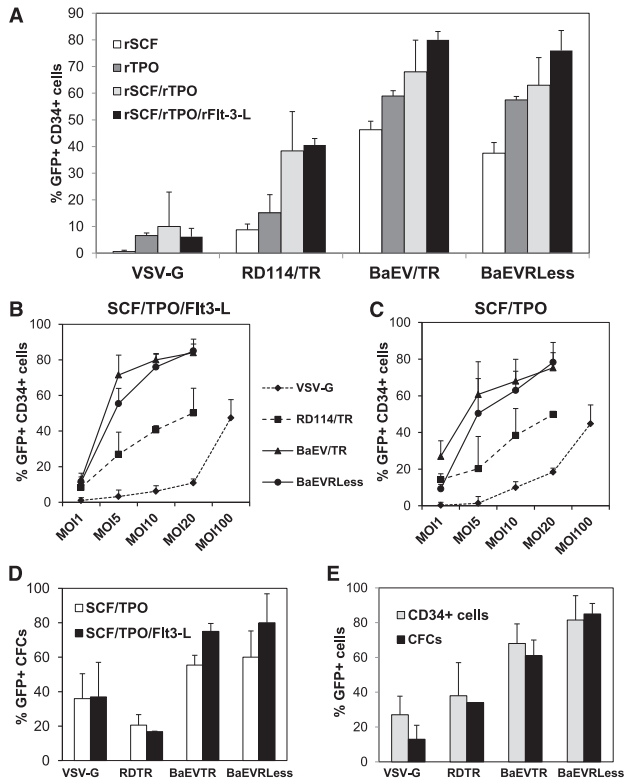
强细胞因子刺激易诱导HSC分化并丧失自我更新能力,因此细胞预刺激程度越低,越能保留其干细胞特性。为此,研究者系统评估了温和刺激条件下低剂量BaEV-LVs的转导效能。结果表明,BaEV-LVs在低强度细胞因子预刺激及低载体剂量下展现出显著优势:仅用rTPO(重组血小板生成素)单因子刺激时,BaEV-LVs即可实现高达60%的hCD34⁺细胞转导,而VSV-G-LVs和RDTR-LVs仅能转导8%-20%的hCD34⁺细胞;单一rSCF(重组干细胞因子)预刺激可使BaEV-LVs介导的hCD34⁺细胞转导率高达35%-50%,而VSV-G-LVs和RDTR-LVs的最大转导水平仅为10%;联合rTPO+rSCF刺激时,转导率进一步提升至60%-80%,而相同MOI下RDTR-LVs和VSV-G-LVs的平均转导率分别为40%和10%;三联细胞因子组合[rTPO+rSCF+rFlt3-L(重组FMS样酪氨酸激酶3配体)]可使BaEV-LVs的转导水平进一步提升至80%-90%,而其他假型载体的转导率显著更低。
基因治疗中需限制插入突变以规避副作用,较低的细胞载体拷贝数可降低遗传毒性风险。因此,研究者在rSCF+rTPO及rSCF+rTPO+rFlt3-L刺激条件下测试了不同载体剂量。结果表明,低剂量时BaEVTR-LVs和BaEVRLess-LVs对hCD34⁺细胞的转导率显著高于其他假型LVs:MOI为5时转导率已达60%(rSCF+rTPO)和70%(rSCF+rTPO+rFlt3-L),而VSVG-LVs不足5%;仅当MOI=100时,VSV-G-LVs才能实现hCD34⁺细胞的有效转导,但其转导率仍远低于BaEV-LVs。最强细胞因子刺激下,BaEVTR-LVs和BaEVRLess-LVs转导率稳定在80%-90%,且细胞内载体拷贝数较低,转导后的hCD34⁺细胞向髓系谱系的分化实验也证实了转导的稳定性。针对临床易获取的动员hCD34⁺细胞,BaEV-LVs同样可实现90%的转导,且在集落形成细胞(CFCs)中保持稳定转导,证实其对短期造血祖细胞已实现稳定转导。以上结果表明,即使在低细胞因子刺激和低载体剂量下,BaEV-LVs对hCD34⁺细胞的转导效率仍显著优于VSV-G-LVs和RDTR-LVs。
图5. BaEV-LVs在温和细胞因子预刺激条件下实现hCD34⁺细胞的高效转导
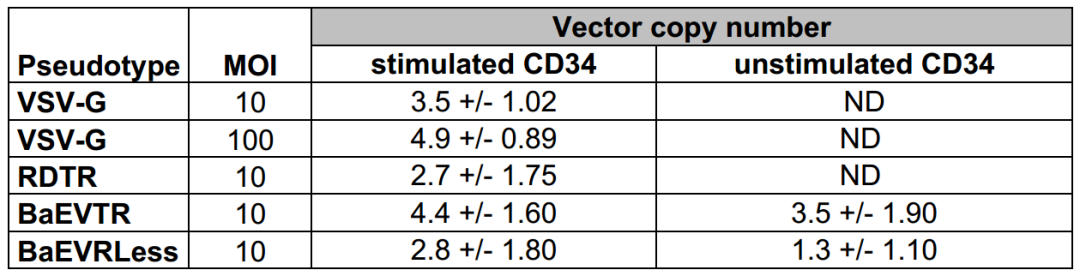
表3. 经细胞因子预刺激和未刺激的hCD34⁺细胞中LV转导的拷贝数
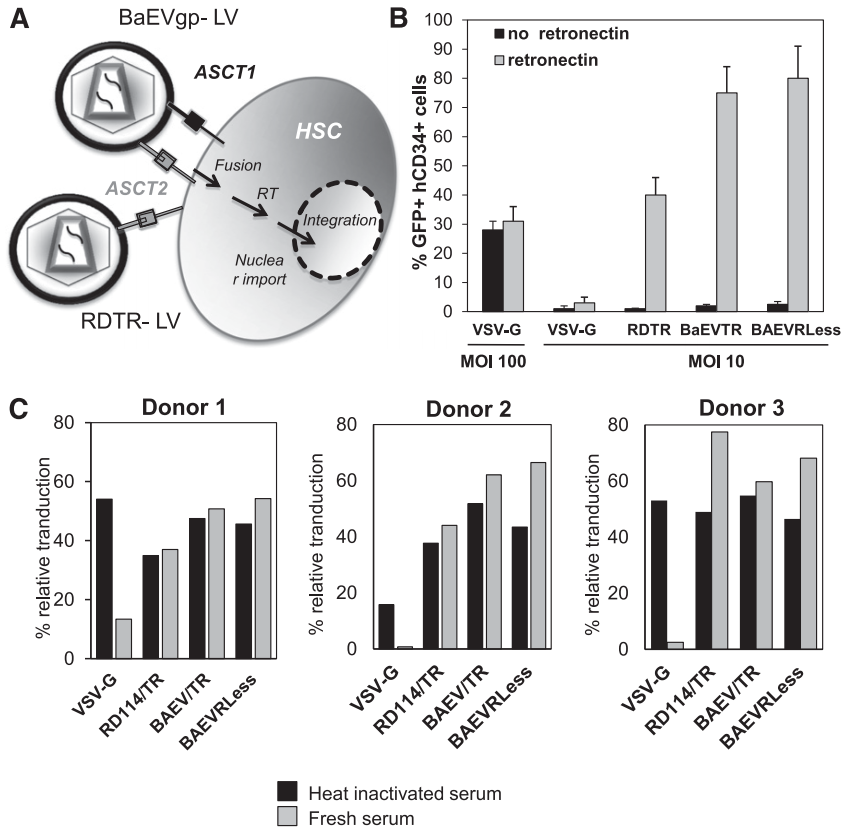
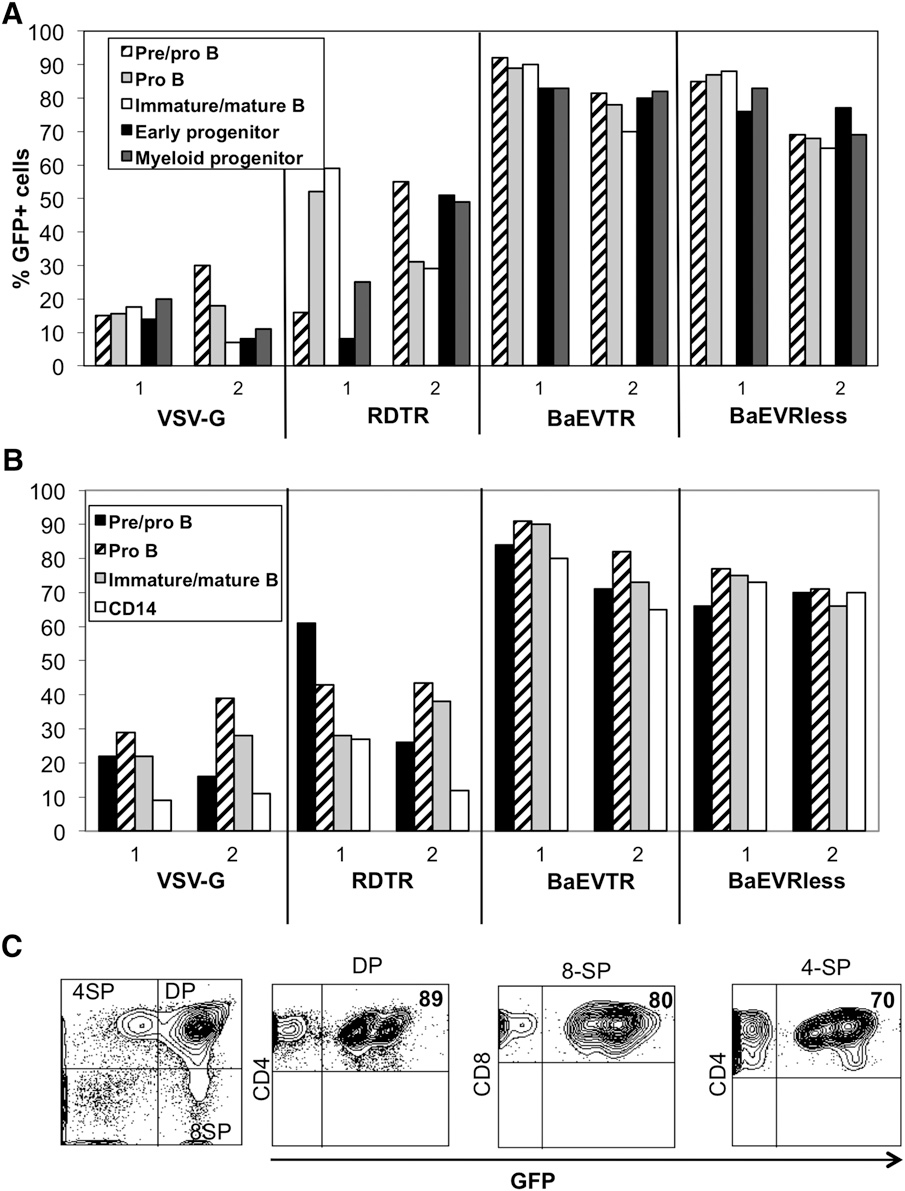
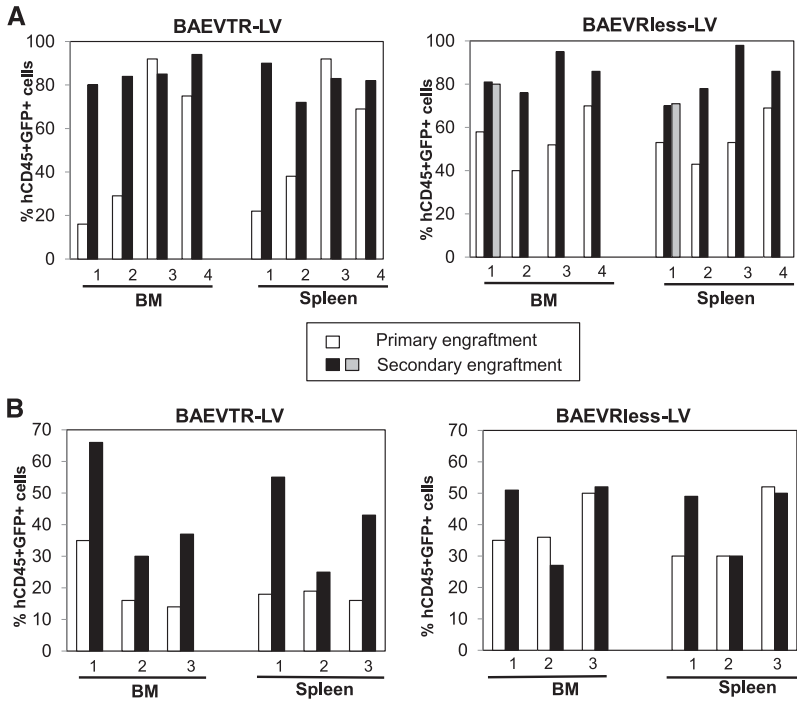
4、BaEV-LVs高效转导预刺激HSC,并可在初级及次级受体NSG小鼠中实现重建
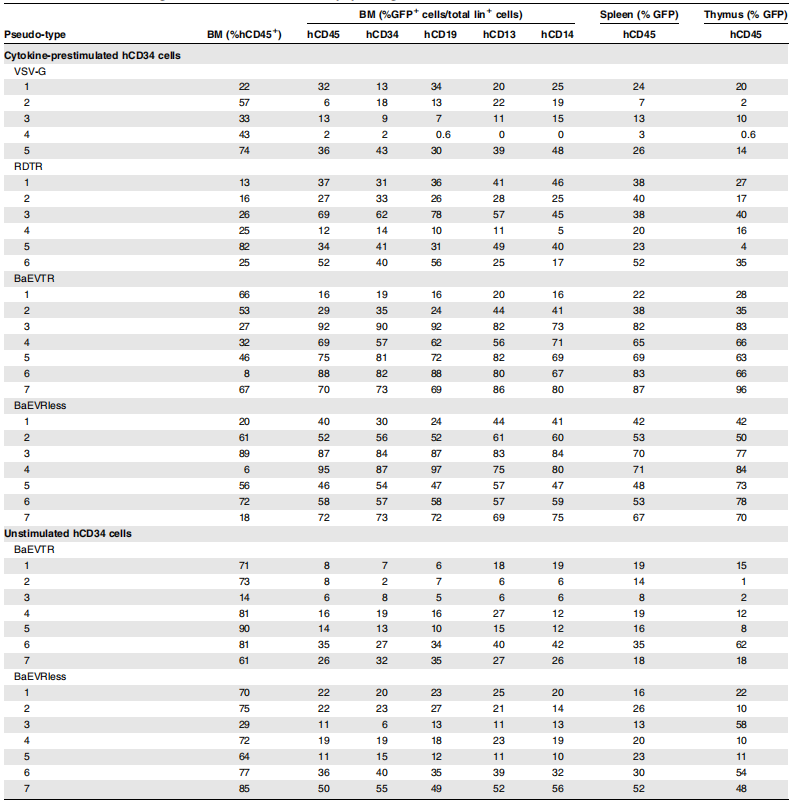
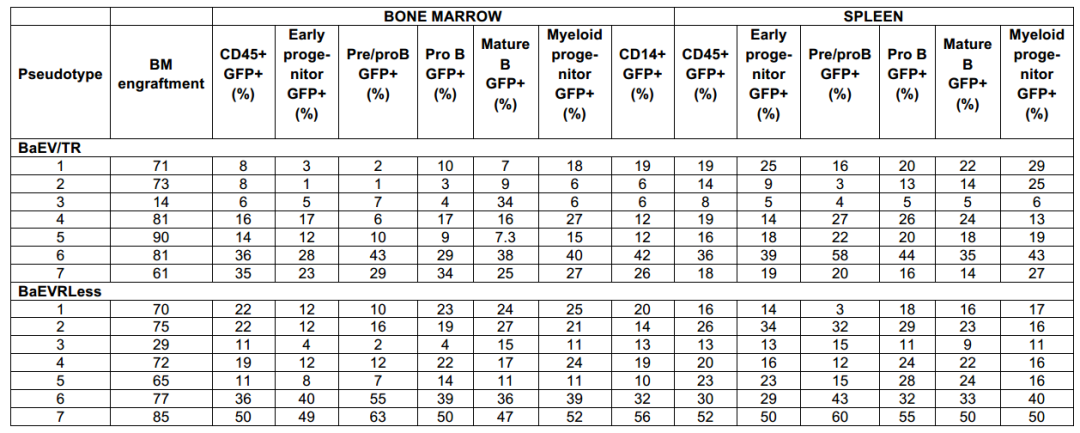
在HSC基因治疗的体内有效性验证中,研究团队利用NSG小鼠模型(免疫缺陷小鼠模型)评估了BaEV-LVs转导的hCD34⁺细胞长期重建能力。将经不同LVs转导的预刺激脐带血(CB)hCD34⁺细胞移植至辐照NSG小鼠,结果显示,BaEVTR-LVs和BaEVRLess-LVs转导的hCD34⁺细胞在移植BM后,NSG小鼠BM人源细胞中CD45⁺GFP⁺双阳性率达95%,提示极高的转导效率,显著优于VSV-G-LVs和RDTR-LVs组;另外,其在脾脏、胸腺等所有造血组织中持续维持高转导水平;各谱系细胞(B细胞亚群、髓系祖细胞、单核细胞等)均呈现一致的高效转导。而VSV-G-LVs和RDTR-LVs在不同组织和BM中不同细胞谱系间转导变异性较高。
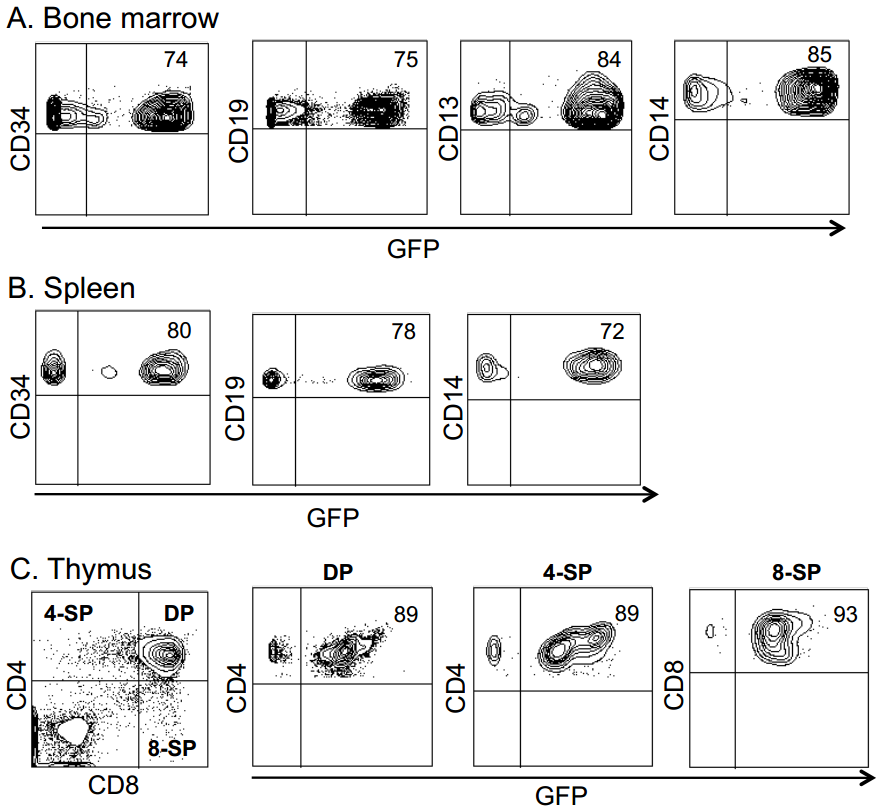
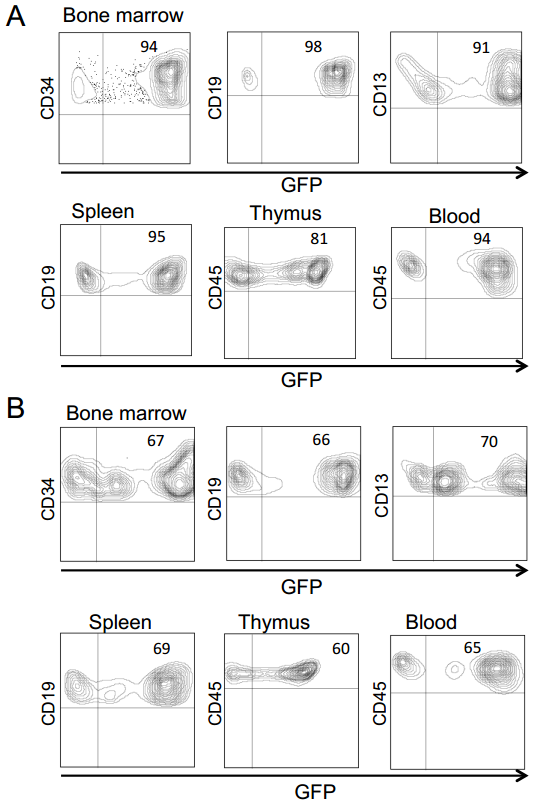
关键的是,为验证真正的HSCs(具有长期造血重建能力)已被基因修饰,研究人员开展了二次移植实验:从首次用BaEVTR-LVs和BaEVRless-LVs转导的预刺激hCD34⁺细胞重建的NSG小鼠中分离hCD34⁺细胞,将其用于二次NSG小鼠重建。为提高在次级受体中的植入效率,首次重建NSG小鼠BM来源的hCD34⁺细胞在注射前经SCF和IL-6(白细胞介素-6)培养以维持其归巢能力。移植后12周分析发现,次级受体小鼠的BM和脾脏中hCD45⁺GFP⁺细胞比例不仅得以维持,甚至有所升高。重要的是,在两种BaEV-LVs处理组中,次级受体小鼠BM均检测到高水平GFP表达的早期祖细胞(CD34⁺)、淋巴系细胞(CD19⁺)和髓系细胞(CD13⁺),且在BM及其他造血组织的不同淋巴系和髓系细胞中,GFP⁺细胞比例基本一致。总体而言,这些数据有力表明,BaEV-LVs能够对极早期祖细胞(hHSCs)进行基因修饰,使其能够在体内实现长期植入并分化为所有不同的细胞谱系。
表4. BaEV-LVs可高效转导NSG小鼠重建细胞
图6. LV转导的CD34⁺细胞在NSG小鼠中的移植情况
图7. BaEV-LVs可高效转导具有NSG小鼠重建能力的hCD34⁺细胞
图8. BaEV-LVs可在NSG小鼠中高效转导经细胞因子刺激的动员hCD34⁺细胞
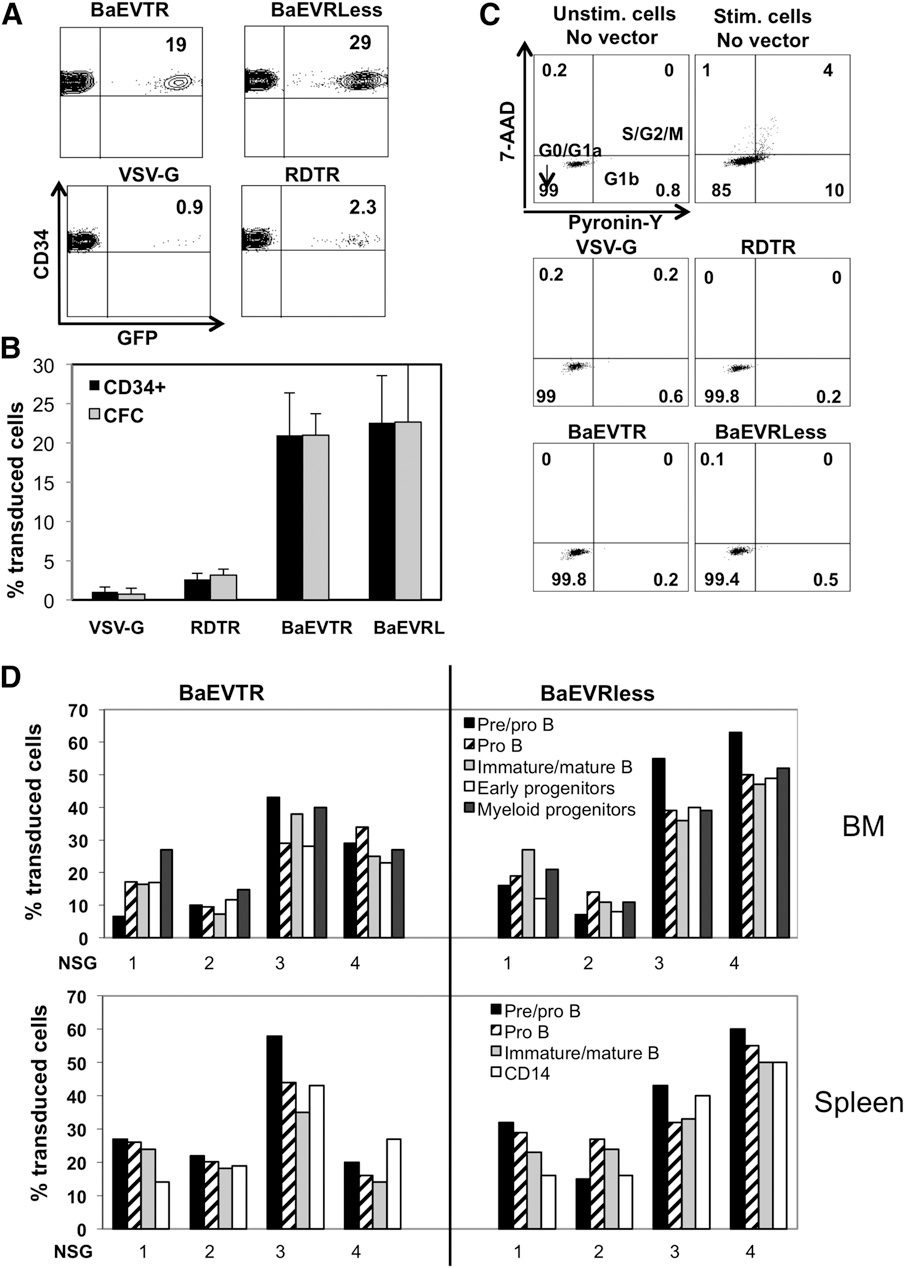
5、BaEVgp-LV假型可高效转导静止期hCD34⁺细胞且不诱导细胞周期进程
在HSC基因治疗中,避免细胞因子刺激导致的干细胞分化是关键挑战。研究人员发现,BaEVgp-LVs假型凭借对ASCT-1/ASCT-2双受体的识别能力,无需外源性刺激即可高效转导静止期hCD34⁺细胞:单次低剂量的(MOI=10)BaEVTR-LVs和BaEVRLess-LVs处理即可实现对静止期hCD34⁺细胞高达15%-30%的转导效率;而VSV-G-LVs即使在高剂量下仍无法有效转导静止期hCD34⁺细胞;仅结合ASCT-2受体的RDTR-LVs也无法高效转导静止期hCD34⁺细胞(<5%)。另外,BaEVgp-LVs转导后的细胞在集落形成实验中仍维持稳定转导,且细胞内载体拷贝数低,显著降低基因毒性风险。
经典VSV-G-LVs转导hCD34⁺细胞需细胞因子预刺激(会诱导细胞周期进入和分化),而BaEVgp-LV是否通过结合ASCT-1/2诱导细胞周期进入尚不明确。因此,研究人员通过基于流式细胞术的细胞周期分析技术分析了不同假型载体转导后的细胞周期状态,结果显示:BaEVTR-LVs及BaEVRless-LVs虽高效转导hCD34⁺细胞,但未诱导其进入细胞周期,细胞仍停留在G0/G1a期。由于具备SCID(重症联合免疫缺陷病)重建造血潜能的hCD34⁺细胞主要处于G0期,该特性对维持造血干细胞干性至关重要。以上结果表明,BaEVgp-LVs无需细胞因子刺激即可高效转导静止期hCD34⁺细胞,且能维持细胞处于G0/G1a期以保留其造血干细胞干性。
图9. BaEV-LVs在未刺激hCD34⁺细胞转导中显著优于RDTR-LVs和VSV-G-LVs
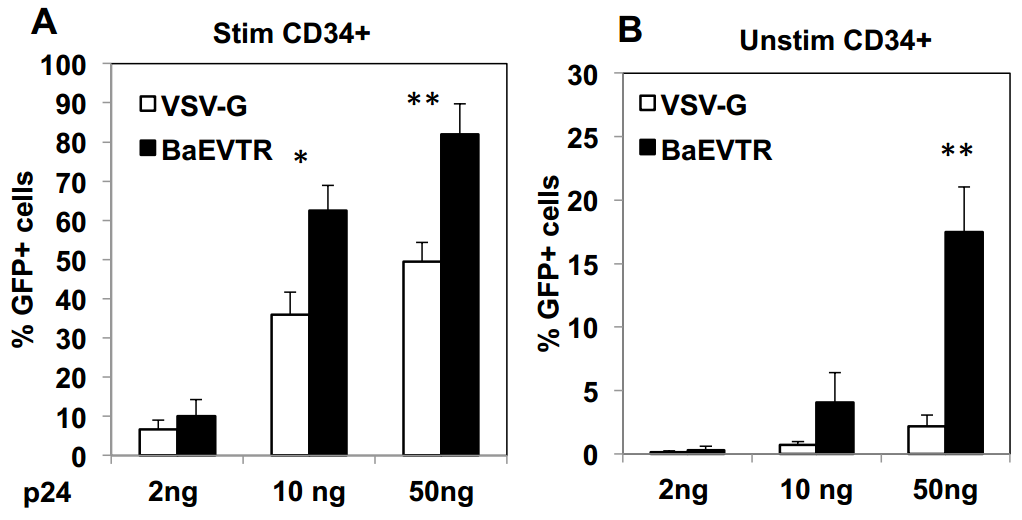
6、BaEV-LVs可促进静止期HSCs的高水平转导
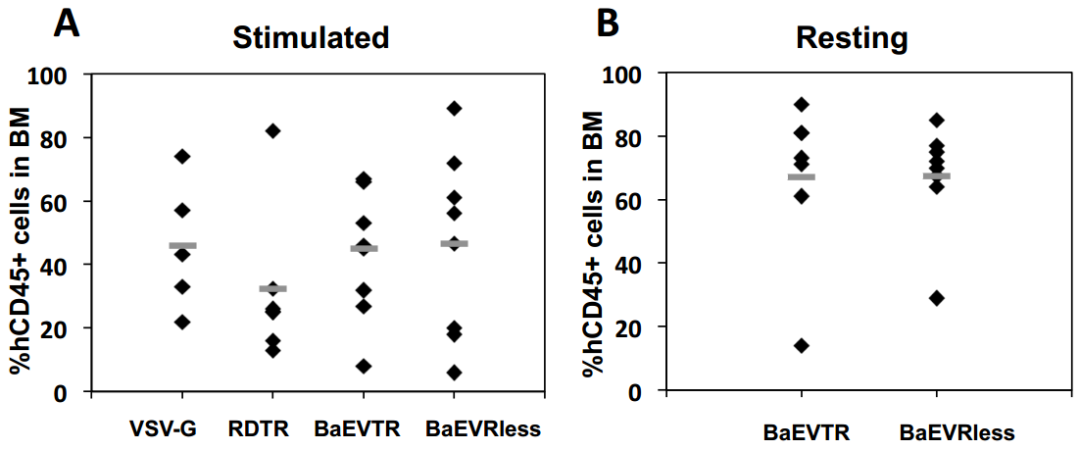
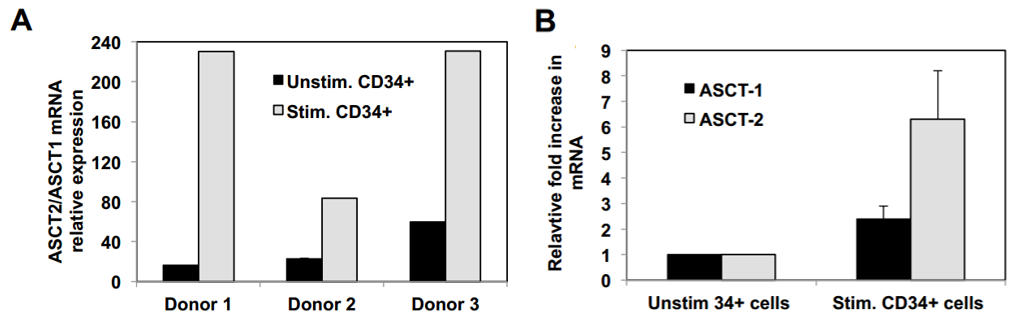
为评估BaEV-LVs能否转导静息态hCD34⁺细胞群中的长期重建HSCs,研究人员开展了系列实验:采用短期转导方案(18-24小时),以低载体剂量(MOI=10)处理细胞且不添加任何细胞因子,随后将其注入新生NSG小鼠。结果显示,经BaEV-LV转导的G0期hCD34⁺细胞可在小鼠体内实现高水平人类细胞重建,表明其归巢、植入及分化能力未受影响,且其植入率显著高于经预刺激的细胞。进一步观察发现,无论转导效率处于低水平(8%-20%)还是高水平(>30%),BM和脾脏中各谱系细胞的转导率均保持一致。值得注意的是,细胞因子刺激会使ASCT-1和ASCT-2的mRNA水平上调,这可能增强BaEV-LVs对hCD34⁺细胞的亲和力,从而解释了经刺激的细胞转导水平高于静息态细胞的现象。
研究人员还对经预刺激的hCD34⁺细胞进行了NSG小鼠次级重建实验,结果显示次级受体小鼠BM和脾脏中CD45⁺GFP⁺细胞的比例保持稳定甚至提升1.5-3倍;且两种BaEV-LVs均能在次级受体小鼠BM中检测到高比例的转导早期祖细胞(CD34⁺)、淋巴系细胞(CD19⁺)和髓系细胞(CD13⁺),其他造血组织中GFP⁺细胞比例也保持一致。综上,这些BaEVgp-LVs可对具有重建能力的极早期祖细胞进行基因修饰——即在未受刺激的hCD34⁺细胞群体中,这类细胞被称为hHSCs,它们能够在初级和次级NSG小鼠体内归巢、植入并分化为所有不同谱系的细胞。
表5. BaEV-LVs可高效转导静止期hCD34⁺细胞并实现高水平植入NSG小鼠
图10. 未刺激及细胞因子刺激的CD34⁺细胞上ASCT-1和ASCT-2的表达水平
图11. BaEV-LVs可高效转导长期重建HSCs
图12. BaEV-LVs可高效转导SCID重建性hCD34⁺细胞
总结
本研究首次开发了基于BaEV-gp假型化的新型LVs(BaEV-LVs),在HSC基因治疗领域取得突破性进展。相较于传统的VSV-G-LVs和RDTR-LVs,BaEV-LVs具有三大核心优势:首先,其独特的双受体机制(同时靶向ASCT-1和ASCT-2)使其在温和细胞因子刺激条件下即可实现hCD34⁺细胞高达90%的转导效率,且完全无需预刺激时仍能转导30%静止期HSC;其次,低剂量载体即可达到高转导率,显著降低插入突变风险;最重要的是,该载体系统能保留HSC干性——移植实验证实转导细胞在NSG小鼠中维持长期多系重建能力,二次移植后基因修饰干细胞(GFP⁺)在BM和脾脏中的占比显著提升1.5-3倍。这些特性对临床治疗具有深远意义:1)为范可尼贫血等不耐受细胞因子刺激的疾病提供安全治疗方案;2)通过“低刺激+低剂量”策略最大化保留HSC库完整性;3)BaEV-gp无细胞毒性的特性为建立稳定包装细胞系奠定基础。该研究不仅解决了HSC基因治疗中效率与干性保留不可兼得的难题,更为实现“一次治疗,终身治愈”的目标提供了革命性工具。
我司可提供BaEV-LVs产品,列表如下:


详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK