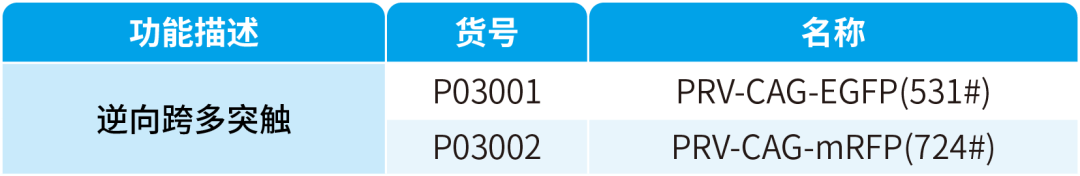
2025-07-01 阅读量:1454
简介
伪狂犬病毒(Pseudorabies virus,PRV)属于疱疹病毒科α-疱疹病毒亚科,病毒粒子呈球形,直径约150-200 nm,由二十面体衣壳、皮层和囊膜组成。其基因组为长度约150 kb的线性双链DNA,囊膜表面分布有gB、gC、gD等糖蛋白,介导病毒与宿主细胞的黏附与融合。通过同源重组等分子遗传学技术,PRV可定向插入超过10 kb的外源基因(如荧光蛋白、报告基因),为神经环路示踪提供灵活的基因编辑工具。
病毒株特性与神经示踪应用
自然宿主与安全性:PRV自然宿主为猪,啮齿动物可感染,灵长类动物对其敏感性极低。尽管PRV对实验人员致病性低,但仍需在生物安全二级(BSL-2)实验室中操作,采取黏膜防护(如护目镜、手套)等措施。
经典毒株对比:
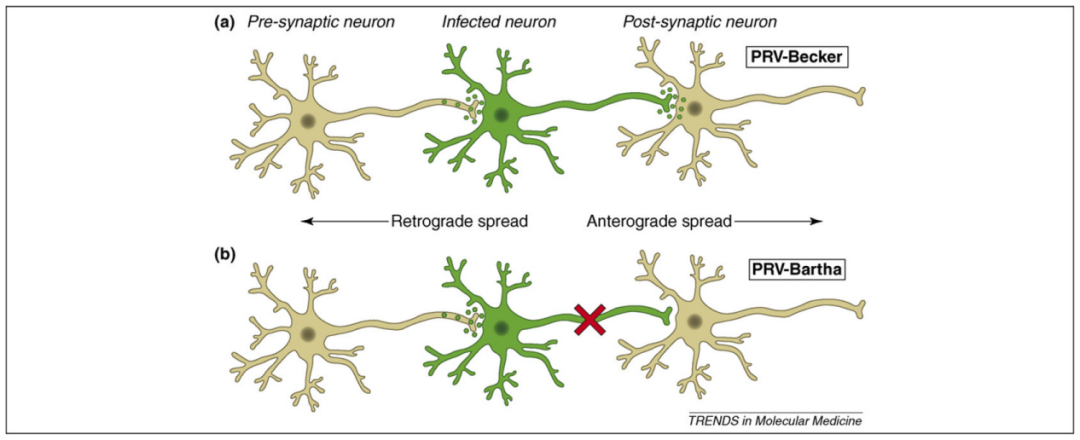
Becker株:毒力强,可顺行及逆行跨突触传播,因安全性风险和示踪方向性差,极少用于神经科学研究。
Bartha株(疫苗株):经基因缺失致弱,仅能逆向跨突触传播(从突触后神经元至突触前神经元),可沿神经轴突从外周快速向中枢神经系统扩散,是解析神经网络的常用工具株。
荧光标记株的技术优化
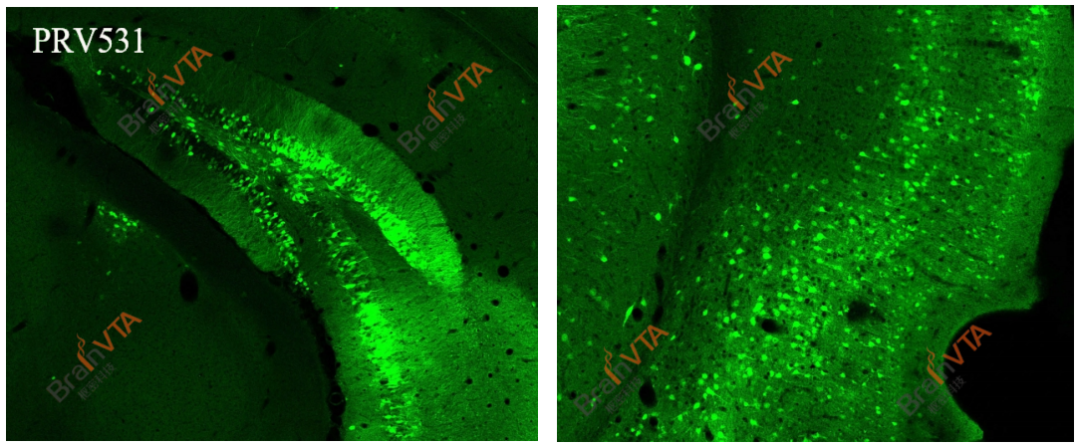
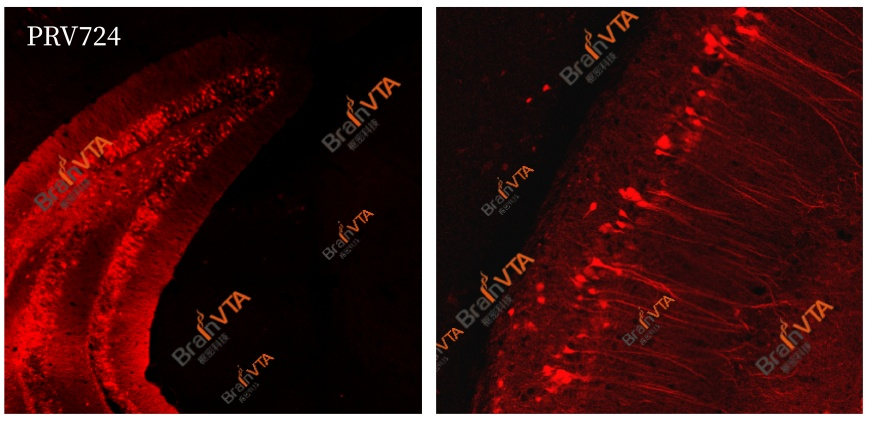
采用免疫荧光检测野生型PRV感染时(PRV抗原),信号通常较弱,需依赖免疫组化等信号放大技术进行检测。为解决这一问题,我司基于Bartha株开发PRV531(EGFP标记)和PRV724(RFP标记),将荧光蛋白基因插入非必需区域,实现高强度组成型荧光表达,无需免疫组化即可直接观察,成为高效的逆向跨多突触示踪剂,适用于标记神经元的多级上游输入连接。
PRV示踪的核心优势
跨突触传递能力:可逆向跨越多个突触层级,示踪全脑范围的输入神经网络;
基因工程灵活性:支持大片段外源基因插入,兼容荧光标记、基因表达调控等操作;
神经元特异性感染:高亲和力结合神经元受体,极少感染胶质细胞等非神经细胞。
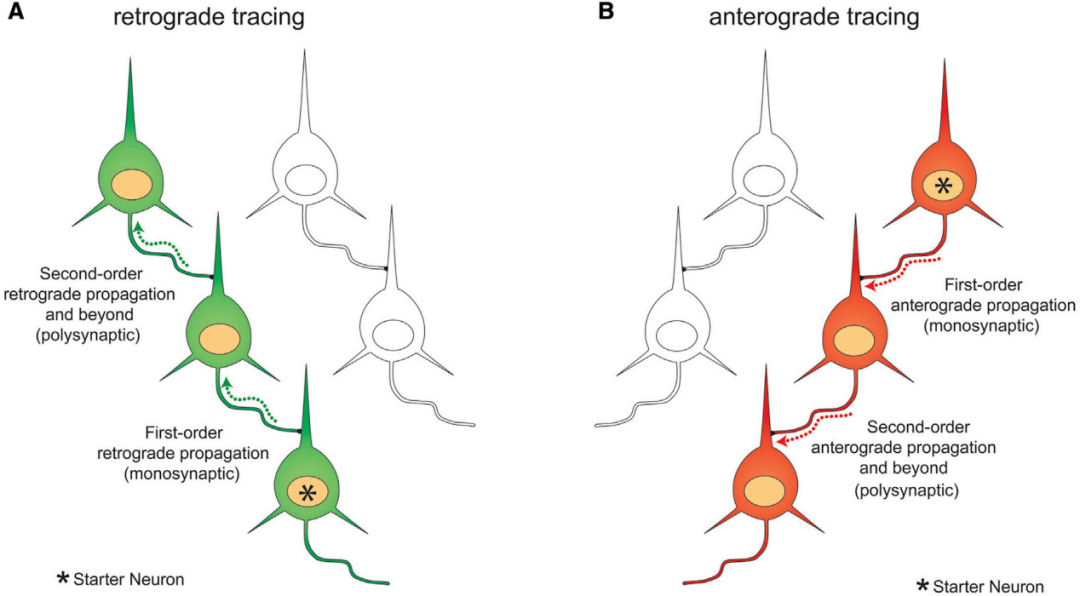
图1.跨突触病毒标记细胞的方式(Xu X, Holmes TC, Luo MH, et al. Neuron. 2020)
图2.PRV感染在神经环路中的跨突触传播(Ekstrand MI, Enquist LW, Pomeranz LE. Trends Mol Med. 2008)
逆向跨突触示踪原理
1.逆向跨多级系统
病毒感染神经细胞后,其基因组释放并进入细胞核,一方面完成病毒DNA复制、转录及翻译等生命循环事件,另一方面可介导外源基因的表达。新产生的子代病毒粒子通过逆向轴突运输,从被感染神经元的突触后膜释放,继而侵入与之形成突触连接的突触前神经元,此过程称为逆向跨突触传播。病毒可在突触前神经元内再次复制,并重复上述逆向跨突触过程,实现跨多级神经网络的传播。
2.逆向跨单级系统
逆向跨单级系统的构建基于PRV Bartha株的胸苷激酶基因(TK)缺失突变。TK是病毒在神经细胞中复制的必需基因,其缺失会导致病毒无法在非分裂细胞(如神经元)中完成DNA合成,进而丧失产生子代病毒粒子的能力,阻断跨突触传播。当通过AAV载体向TK缺失病毒感染的神经元中补充TK基因后,病毒可恢复复制能力,仅能从该神经元逆向跨单级突触感染其上游突触前神经元。该系统可结合Cre/Flp重组酶介导的转基因动物模型,通过AAV辅助病毒递送TK基因或标记基因,实现对特定神经网络单级输入连接的精准解析。
适用的神经科学问题
1.研究大脑特定区域的全脑多级输入神经网络层级结构
利用PRV的逆向跨多级突触特性,解析目标脑区(如皮层、海马)接收的全脑范围内跨突触层级的输入连接网络,明确神经元之间的多级环路联系。
2.动态追踪神经发育过程中神经网络的连接重塑
通过不同发育阶段(如胚胎期、幼年期)的PRV示踪,研究神经网络形成、修剪及功能成熟过程中的输入连接变化,揭示神经发育的环路构建机制。
3.解析神经精神疾病模型中枢-外周传出神经网络的异常特征
在抑郁、自闭症等模型中,利用PRV追踪中枢神经系统至外周器官的传出通路(如边缘系统-内脏神经投射),分析疾病状态下传出网络的结构损伤或重塑模式。
4.量化神经损伤及康复模型中传出/传入网络的连接损伤与修复
结合PRV逆向追踪(研究传入连接)与顺向示踪技术,评估脑损伤(如脑卒中、脊髓损伤)后中枢-外周传出通路的损伤程度及康复过程中神经网络的再生与功能重建。
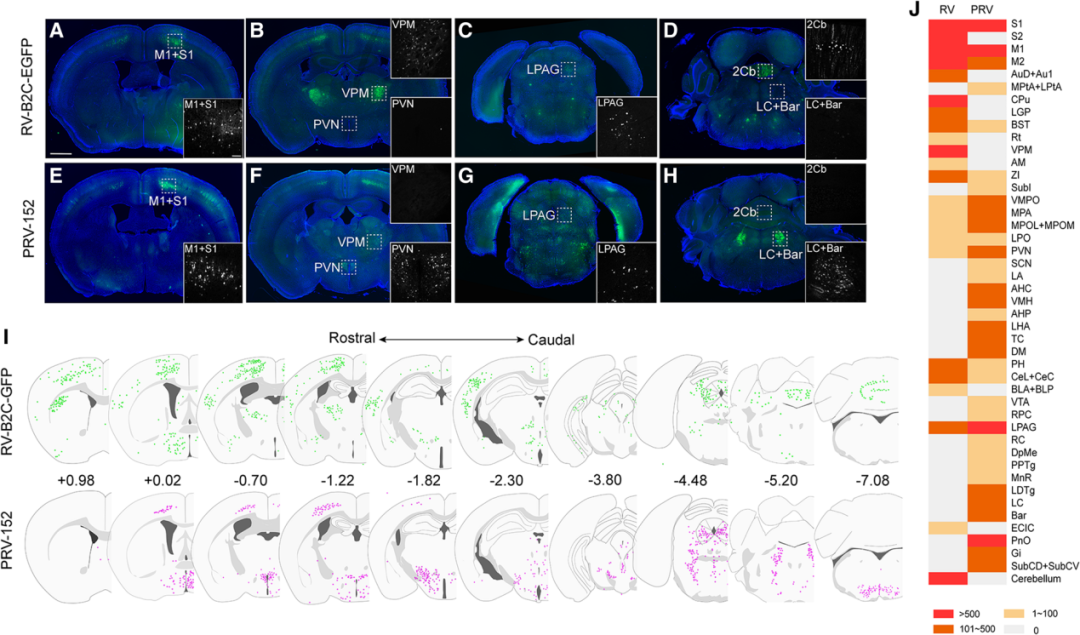
5.逆行追踪外周-中枢神经联系通路及运动系统传入网络
外周-中枢环路:通过PRV示踪四肢、内脏等外周器官向中枢神经系统的传入投射通路(如皮肤-脊髓-丘脑通路),解析躯体感觉或内脏感觉的中枢编码机制。
运动相关传入网络:逆行追踪运动系统的感觉传入通路(如肌肉、肌腱本体感觉向脊髓和脑的投射),研究四肢运动控制的中枢环路整合机制。
穴位神经投射:探索针灸穴位对应的外周神经-脊髓-脑区的传入连接路径,为穴位作用的神经机制提供解剖学依据。
图3.经淋巴结注射PRV152进行逆向跨多突触示踪(Sun L, Tang Y, Yan K, et al. Mol Neurodegener. 2019)
客户案例分享
客户文章(IF=11.7):
Cao P, Liu Y, Ni Z, Zhang M, Wei HR, Liu A, Guo JR, Yang Y, Xu Z, Guo Y, Zhang Z, Tao W, Wang L. Rescue-like behavior in a bystander mouse toward anesthetized conspecifics promotes arousal via a tongue-brain connection. Sci Adv. 2025 Jan 24;11(4):eadq3874. doi: 10.1126/sciadv.adq3874. Epub 2025 Jan 22. PMID: 39841840; PMCID: PMC11753405.
使用我司病毒:
PRV-CAG-EGFP
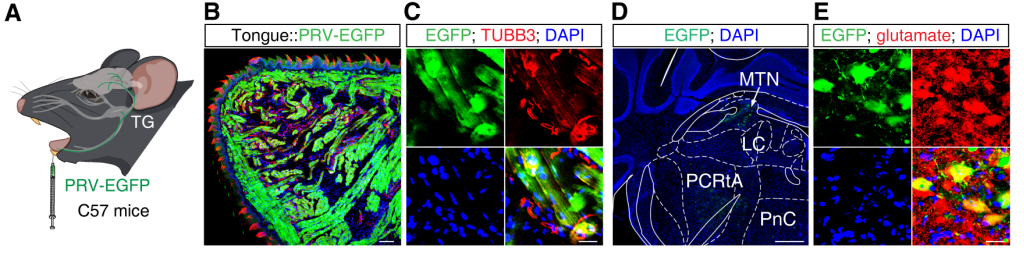
研究人员采用基于病毒的示踪方法探究中脑三叉神经核(MTN)与舌之间的神经连接,具体操作如下:将逆行跨多级突触的伪狂犬病毒(PRV-CAG-EGFP,531#)注入C57小鼠舌内。注射后7天,经心脏灌注4%多聚甲醛固定小鼠,取脑制备冠状冰冻切片,随后对脑片进行谷氨酸特异性抗体免疫荧光染色。结果显示,在包括MTN在内的多个核团中观察到了EGFP+信号。进一步的免疫荧光染色显示,这些EGFP+神经元与谷氨酸特异性抗体呈共标阳性(即同时表达EGFP和谷氨酸),提示其为谷氨酸能神经元。
图4.MTNGlu神经元投射到舌
我司产品列表:
升级版PRV测试效果
逆标效率与第一代PRV产品等同,但荧光亮度显著增强。
图5.PRV531标记VHPC后2天取样制片。无需抗体染色,直接成像。
图6.PRV724标记VHPC后2天取样制片。无需抗体染色,直接成像。
常见问题解答
Q1:PRV注射后什么时间取材?
答:PRV为逆向跨多突触病毒,对动物具有较强感染毒性,动物感染病毒后存活时间一般为3~5天(中枢注射),动物体质不同,存活时间也有差异。外周注射存活时间延长2~4天。因此,病毒注射后,可根据环路连接级数多少在不同时间点取样。在中枢,跨突触数目经验值为:跨1~2级,需24~48小时;跨2~3级,36~72小时;需经常查看动物状态,以免动物提前死亡,影响正常取样。
Q2:PRV注射滴度和体积一般是多少?
答:中枢注射:≥1E+8 PFU/mL(高浓度保证感染效率);外周注射:≥5E+8 PFU/mL(因外周组织摄取效率低)。注射体积:中枢:50-200 nL(避免组织损伤);外周:1-5 μL(肌肉/器官需分多点注射)。
Q3:病毒注射后无信号或信号弱的可能原因。
答:病毒滴度过低/注射位点偏差。可通过预实验验证定位坐标、提高病毒滴度2倍增强信号。
Q4:病毒注射后非特异性扩散的可能原因。
答:注射过快/体积过大/针道回流。需保持限速≤20 nL/s;退针分段停留;用更细针头。
注意事项:
1.中枢注射时:控制注射速度≤20 nL/s,避免组织损伤;
2.所有接触过病毒的废弃物需121℃高压灭菌30分钟或10%漂白剂浸泡后再丢弃。
3.病毒应适当分装,避免反复冻融。
参考文献:
[1].Liu Q, Wu Y, Wang H, et al. Viral Tools for Neural Circuit Tracing. Neurosci Bull. 2022 Dec;38(12):1508-1518.
[2]Xu X, Holmes TC, Luo MH, et al. Viral Vectors for Neural Circuit Mapping and Recent Advances in Trans-synaptic Anterograde Tracers. Neuron. 2020 Sep 23;107(6):1029-1047.
[3]Ekstrand MI, Enquist LW, Pomeranz LE. Trends Mol Med. 2008 Mar;14(3):134-40.
[4]Li J, Liu T, Dong Y, et al. Trans-synaptic Neural Circuit-Tracing with Neurotropic Viruses. Neurosci Bull. 2019 Oct;35(5):909-920.
[5]Qiu L, Zhang B, Gao Z. Lighting Up Neural Circuits by Viral Tracing. Neurosci Bull. 2022 Nov;38(11):1383-1396.
[6]Sun L, Tang Y, Yan K, et al. Differences in neurotropism and neurotoxicity among retrograde viral tracers. Mol Neurodegener. 2019 Feb 8;14(1):8.
[7]Cao P, Liu Y, Ni Z, et al. Rescue-like behavior in a bystander mouse toward anesthetized conspecifics promotes arousal via a tongue-brain connection. Sci Adv. 2025 Jan 24;11(4):eadq3874.

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK