2025-06-23 阅读量:2083
简介
在神经科学领域,腺相关病毒(AAV)作为一种高效的基因递送工具,因其非致病性、低免疫原性和广泛的组织靶向性而受到广泛关注。然而,AAV具有多种血清型(Serotypes),每种血清型在不同的细胞类型、组织中表现出不同的转导效率和特异性。因此,选择合适的AAV血清型对于实验的成功至关重要。下面将从AAV血清型的基本特性、靶向性以及应用等方面进行介绍,帮助科研小白在实验中正确选择合适的AAV血清型。
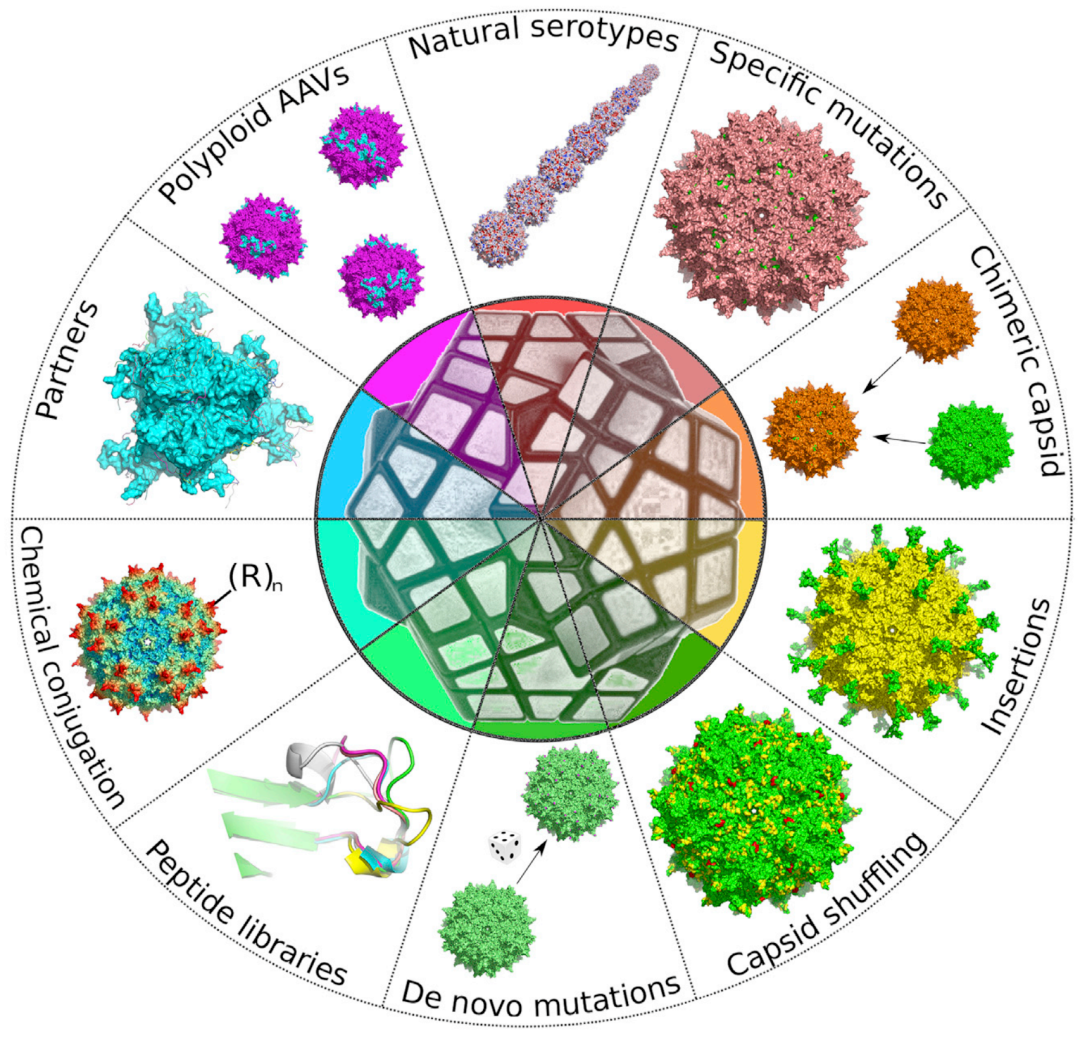
图1. 基于衣壳改造策略优化AAV基因递送载体(Pupo A et al., Mol Ther, 2022.)
AAV血清型的基本特征
想要理解AAV血清型,得先从病毒的结构说起。AAV本质上是由衣壳蛋白(Cap)和单链DNA基因组组成的“小包裹”,其中衣壳蛋白就像包裹的外包装,而AAV血清型,正是依据这层外包装的空间构象差异来划分的。简单来说,不同血清型的AAV,它们衣壳蛋白的氨基酸序列和空间结构存在细微差别,这些差别会被免疫系统识别为不同的“身份标签”。目前已发现13种自然血清型(AAV1-13)和数百种变体,科研中最常用的是1、2、5、6、8、9型。
这些血清型的差异,最关键的体现在细胞表面受体结合特异性上。就像不同形状的钥匙只能打开对应锁芯的锁,每种血清型的衣壳蛋白只能与特定细胞表面的糖类或受体结合,从而影响它的组织趋向性、转导效率、抗原性以及血清型AAV之间免疫原性的交叉反应。比如,AAV2通过肝素硫酸蛋白聚糖(HSPG)作为初级受体,FGFR1和αVβ5整合素等作为共受体。由于HSPG在神经元、肝脏、肾脏广泛分布,其感染谱较广,但脑部递送需局部注射以避免外周器官脱靶;而AAV9则通过N-连接的半乳糖作为主要受体,其在血脑屏障(BBB)内皮细胞高表达,故能高效穿透实现全脑递送。
市面上许多AAV病毒以2型为改造基础,原因有三:一是AAV2基因组结构研究最透彻,特性明确,便于改造;二是其受体HSPG分布广,具备广谱感染潜力,改造后可增强靶向性;三是AAV2安全性与稳定性好,能在保障实验安全的同时,提升基因递送效果。例如,通过将AAV2的衣壳蛋白与其他血清型的关键结构域融合,就诞生了像AAV2/9这样兼具AAV2稳定性和AAV9 BBB穿透能力的新型载体,为科研实验提供了更多可能。
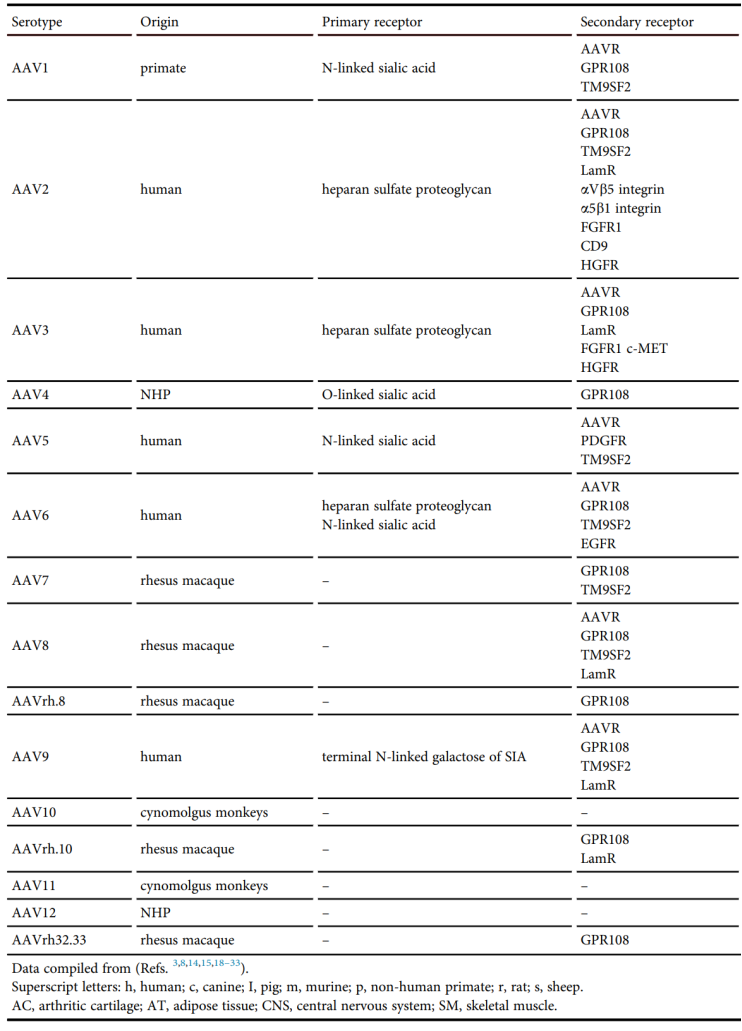
表1. AAV载体的常见血清型和变异亚型,及其来源、初级受体、二级受体
(Pupo A et al., Mol Ther, 2022.)
AAV血清型在不同组织中的靶向性
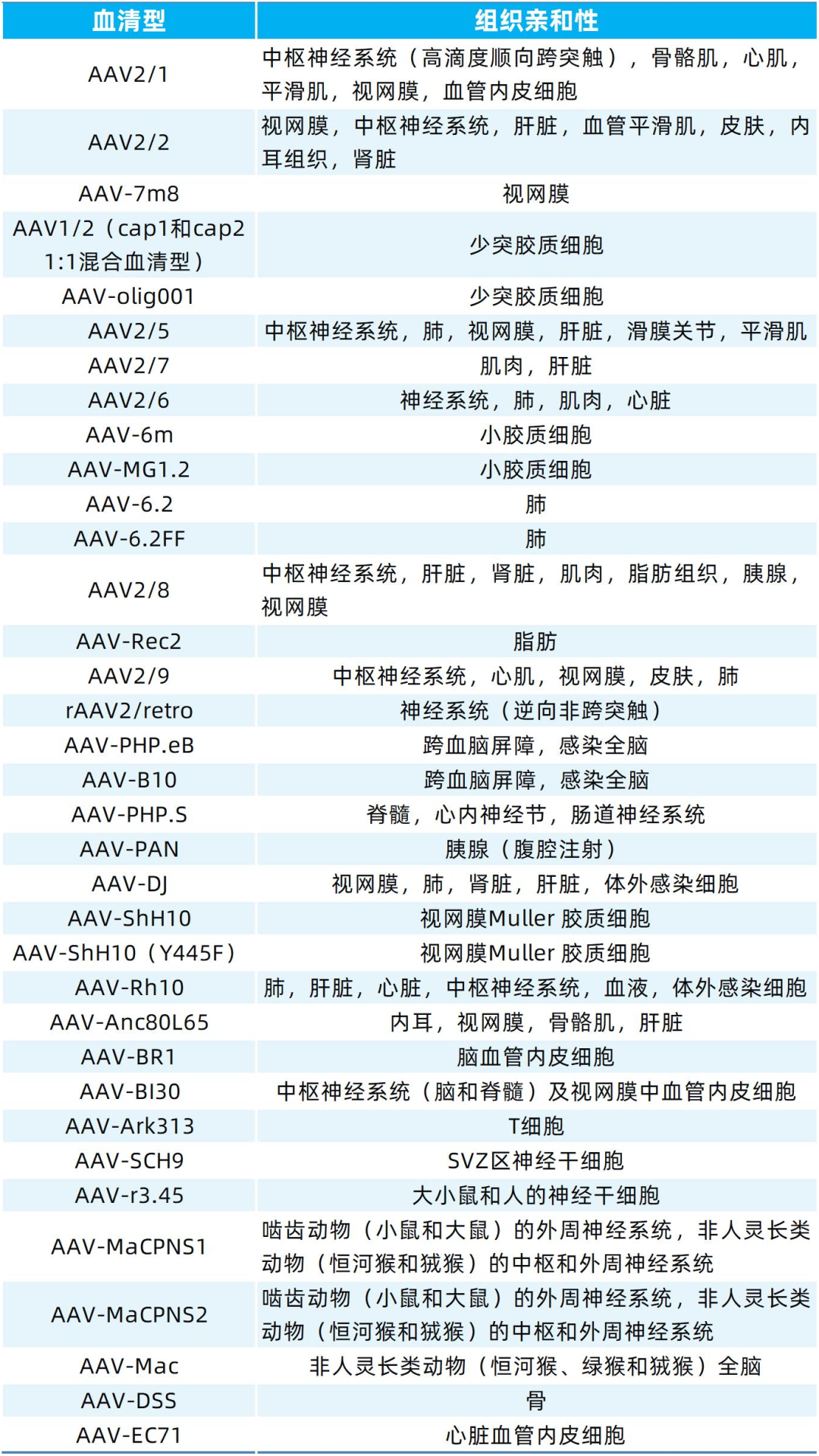
表2. 部分血清型在不同组织中的靶向表现
主要应用
1.基因治疗:AAV血清型是实现精准基因治疗的临床级载体,通过组织特异性靶向(如AAV2视网膜、AAV8肝脏、AAV9肌肉/中枢),已推动多款疗法上市(如Luxturna®、Zolgensma®),并拓展至溶酶体病、代谢病等疑难疾病治疗。
2.基础研究:通过定向进化与衣壳工程实现细胞类型与屏障穿透能力的精准定制,成为解析神经环路、操控特定细胞、突破生物屏障及探索基因功能的基石工具,持续推动生命科学底层机制的革新。
3.药物研发:通过特定血清型构建疾病动物模型,筛选基因治疗药物,评估载体安全性与有效性。
如何选择合适的AAV血清型
1.明确实验目的与递送范围
神经环路示踪:
AAV2/1:高滴度实现顺行跨单突触
AAV2/9:顺行示踪
AAV2/Retro:逆行示踪
全脑范围递送:
若需在全脑范围内表达基因(如构建全脑疾病模型),优先选择能高效穿透BBB的血清型:如AAV9、AAV-Rh10、AAV-PHP.eB和AAV-B10,通过系统性注射(如静脉注射)实现全脑神经元的广泛高效转导。
局部靶向:
针对特定脑区如海马、纹状体的研究,推荐使用AAV5、AAV8、AAV9,其通过脑立体定位注射展现高转导效率;外周部位如视网膜研究,常用AAV2、AAV5、AAV8、AAV9,通过眼内注射实现感光细胞、视网膜色素上皮细胞等不同层级细胞的高效转导。
2.锁定目标细胞类型
中枢神经系统:
外周组织/器官:
转导心脏细胞选择AAV9、肺细胞选择AAV6.2、肝脏细胞选择AAV8等。
3.借鉴权威文献
参考目标研究领域内高影响力论文的血清型选择方案,关注相似实验模型(物种、靶组织/细胞、递送方式)的成功案例。
4.避坑指南:新手常忽略的细节
种属差异:
AAV血清型在不同物种(如小鼠、大鼠、非人灵长类)中的转导效率、组织嗜性甚至穿透BBB的能力可能存在显著差异,需提前查阅跨物种研究数据。
启动子搭配:
血清型主要决定组织/细胞层面的趋向性,而启动子则决定基因表达在细胞类型层面的特异性,两者协同才能实现精准靶向。例如,使用具有广泛神经嗜性的AAV9递送时,搭配神经元广谱特异性启动子(如hSyn)可实现神经元的高效表达;若需进一步靶向兴奋性神经元,可选用CaMKIIa启动子。
预实验验证:
首次使用新血清型或组合时,强烈建议开展预实验。通过系统性地调整病毒滴度、注射体积、注射位点、注射速度以及观察时间点等关键参数来优化实验条件,尽可能避免正式实验中出现转导效率低下、脱靶效应或非预期毒性等问题。
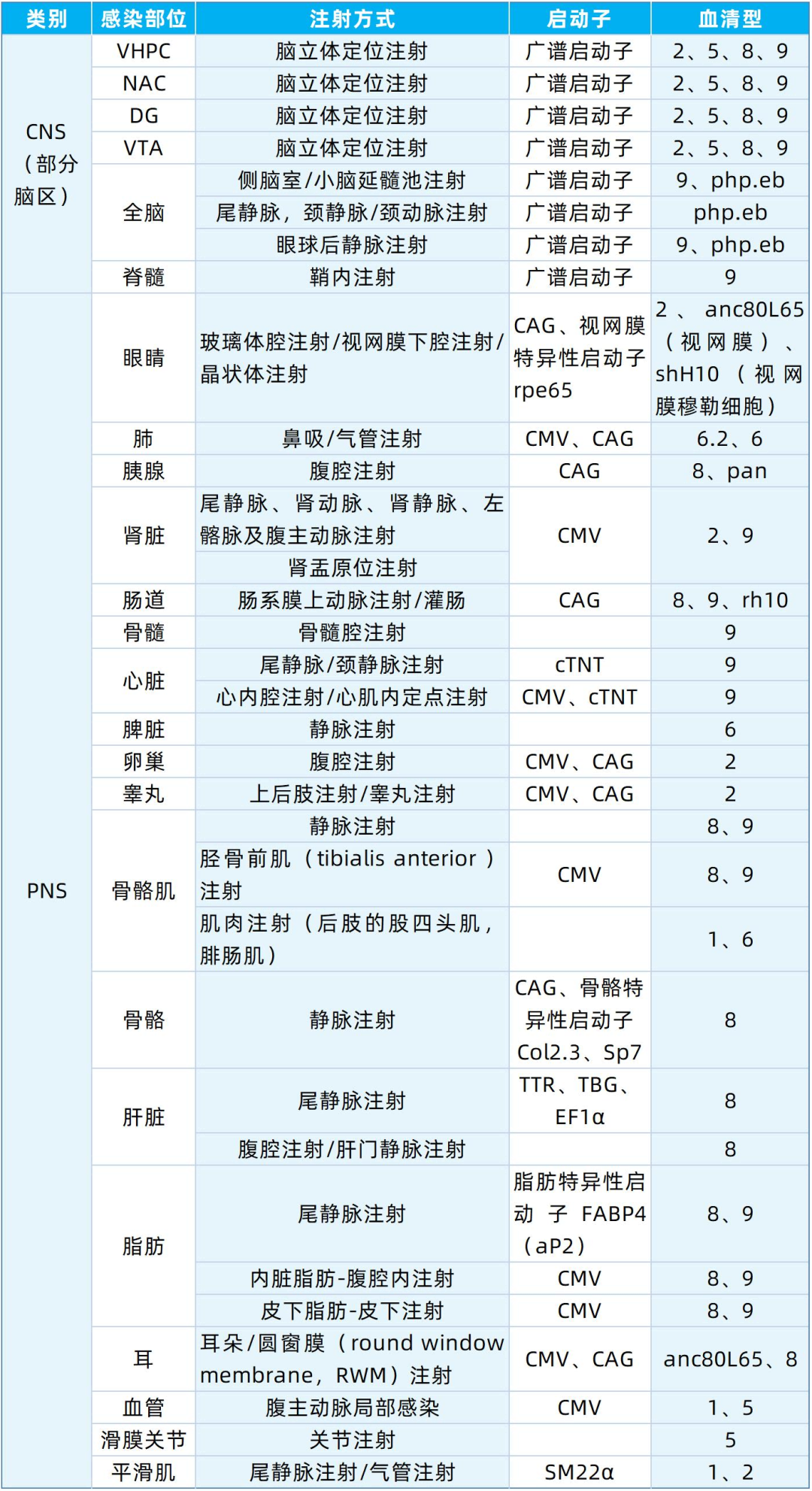
表3. 靶向不同器官/组织推荐使用的AAV血清型、启动子及注射方式
客户应用案例
客户文章(IF=13):
Feng Y, Wang S, Yang D, Zheng W, Xia H, Zhu Q, Wang Z, Hu B, Jiang X, Qin X, Ni C, Pan W, Zhao Y, Pan S, Zhang Y, Song W. Inhibition of IFITM3 in cerebrovascular endothelium alleviates Alzheimer's-related phenotypes. Alzheimers Dement. 2025 Feb;21(2):e14543. doi: 10.1002/alz.14543. Epub 2025 Jan 14. PMID: 39807629; PMCID: PMC11851164.
使用我司病毒:
AAV2/BI30-shRNA(IFITM3)-mCherrry
AAV2/BI30-shRNA(Scramble)-mCherrry
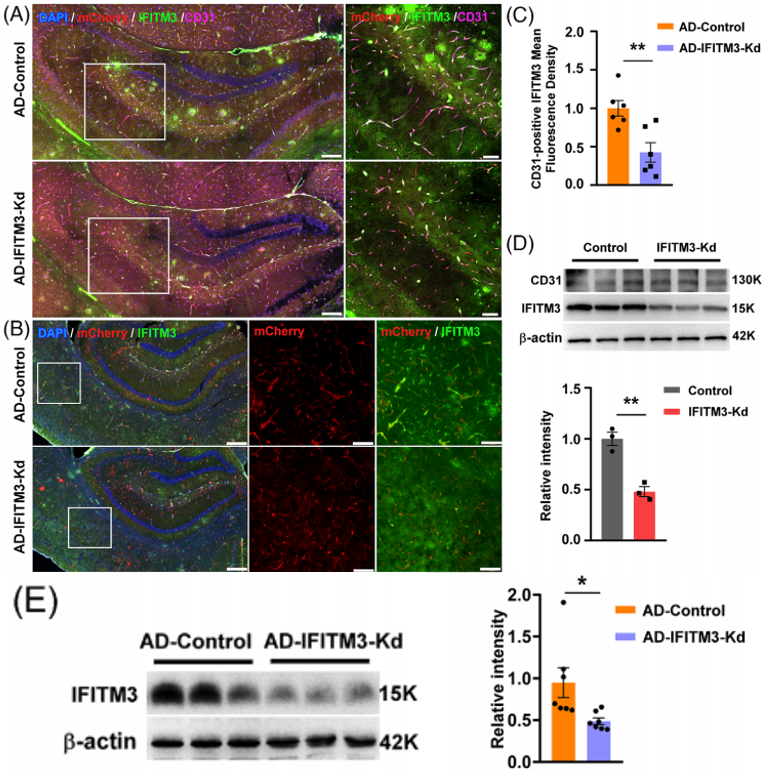
为了特异性抑制阿尔茨海默病(AD)模型小鼠脑血管内皮细胞(CVECs)中干扰素(IFN)诱导跨膜蛋白(IFITM)的表达,研究人员使用了AAV2/BI30血清型病毒载体,该载体能够高效转导中枢神经系统血管内皮细胞。免疫荧光染色结果显示,静脉注射AAV2/BI30-shRNA(IFITM3)-mCherry两个月后,在DTg-AD小鼠(APP23/PS45双转基因AD小鼠)的CD31(血小板内皮细胞黏附分子1,血管内皮细胞标志物)阳性CVECs中出现了强烈的mCherry荧光表达,且该病毒感染的CVECs中观察到IFITM3的显著降低。研究人员从注射了该病毒的野生型(WT)小鼠中分离出CVECs并进行原代培养,4天后收集CVECs进行蛋白质免疫印记(WB)分析,结果显示,CVECs中IFITM3的水平显著降低。表明AAV2/BI30血清型能高效靶向脑血管内皮细胞,借助载体编码的shRNA(IFITM3)实现IFITM3表达的特异性抑制。
图2. 利用AAV2/BI30-shRNA(IFITM3)-mCherry高效转导CVECs并抑制IFITM3表达

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK