2025-06-23 阅读量:900
腺苷(Ado)是一种多功能分子,在众多生理和病理过程中发挥着关键作用。它影响星形胶质细胞活性、神经元可塑性、运动功能、学习记忆以及睡眠调节。除了作为神经调质的作用外,Ado还充当大脑中的代谢传感器,促进细胞间通讯,并调节突触网络和神经炎症。此外,Ado还与癫痫、卒中和神经退行性疾病等病症相关。因此,理解Ado在大脑中如何产生和释放至关重要。近期研究表明,细胞外间隙中的Ado浓度源自多种生物过程,包括胞外Ado(“eAdo”,例如通过胞外ATP降解)的产生以及胞内Ado(“iAdo”)的形成,后者随后通过平衡型核苷转运体(ENT1/2)释放。ENT2介导的Ado信号已在40 Hz闪光诱导睡眠和脑类淋巴系统调节的研究中被报道。然而,关于Ado的细胞来源、其释放的触发因素以及释放机制方面常存在争议,这主要源于实验方法的差异。当前该研究领域面临的挑战之一是更精确地确定eAdo的不同来源,并阐明响应生理和病理刺激时调控Ado释放的机制。
由于缺乏具有足够时空分辨率的技术来区分eAdo和iAdo的效应,确定它们各自的相对贡献一直颇具挑战。传统方法通常依赖于匀浆组织样本,这掩盖了空间信息,且可能无法准确反映特定细胞群体内iAdo或eAdo的变化。相比之下,基因编码荧光探针具有显著优势,使研究人员能够靶向特定细胞类型,并以微创方式在活体生物内实时监测变化。最近的研究利用GRABAdo探针在体内监测睡眠-觉醒周期中的eAdo动态,发现谷氨酸能神经元对eAdo增加的贡献远大于其他细胞类型。然而,iAdo在不同细胞类型中对eAdo的贡献作用仍不清楚。这凸显了对新工具的需求,即需要能够以细胞类型特异性,选择性、特异性地实时监测iAdo的代谢和释放途径。
为响应这一需求,2025年5月7日,北京大学药学院王晶教授课题组联合中国科学院遗传与发育生物学研究所武照伐研究员课题组和北京大学生命科学学院李毓龙教授课题组,在Nature Communications杂志发表题为“A high-performance fluorescent sensor spatiotemporally reveals cell-type specific regulation of intracellular adenosine in vivo”的文章,该研究成功开发了用于活体检测的基因编码荧光探针Hypnos(Hypersensitive intracellular adenosine Sensor,超敏iAdo探针),这是一种绿色荧光探针,具有高灵敏度、高特异性、高时空分辨率和快速响应(亚秒级)的特点。它通过将构象敏感的环状排列增强型绿色荧光蛋白(cpEGFP)与间日疟原虫腺苷脱氨酶(PvADA)偶联而设计,专为实时监测活细胞和模式生物中的iAdo动态。它能够在活细胞、小鼠急性脑片以及包括果蝇和小鼠在内的动物模型完整大脑中实时检测iAdo。利用HypnoS在小鼠中进行双色介观成像,研究人员发现癫痫发作诱导的iAdo波在皮层中传播,紧随钙信号之后。此外,双光子成像显示,在癫痫发作期间,iAdo在星形胶质细胞中的衰减比在神经元中更快。再者,通过记录睡眠-觉醒周期中基底前脑(BF)的iAdo动态,研究者观察到iAdo信号在觉醒期和快速眼动(REM)睡眠期均存在,并受到ENT1/2的调控。因此,HypnoS是一种多功能且强大的工具,可用于研究iAdo在一系列生理和病理状态下的生物学功能。

1.iAdo探针HypnoS的开发
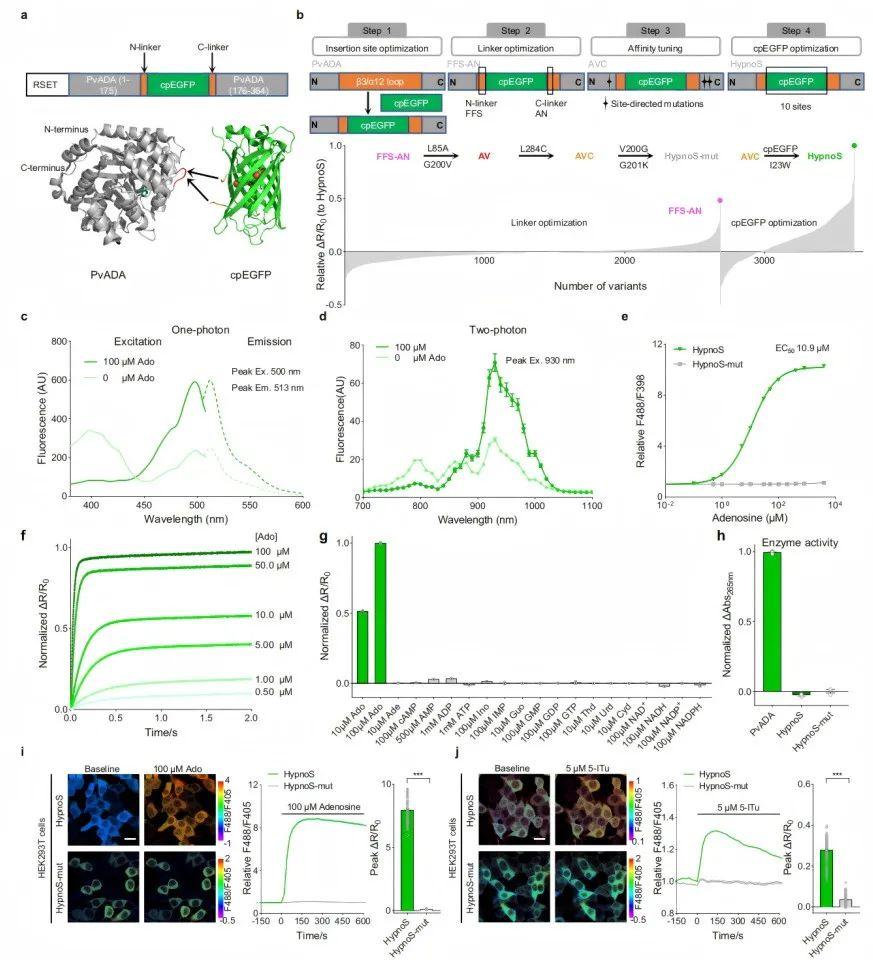
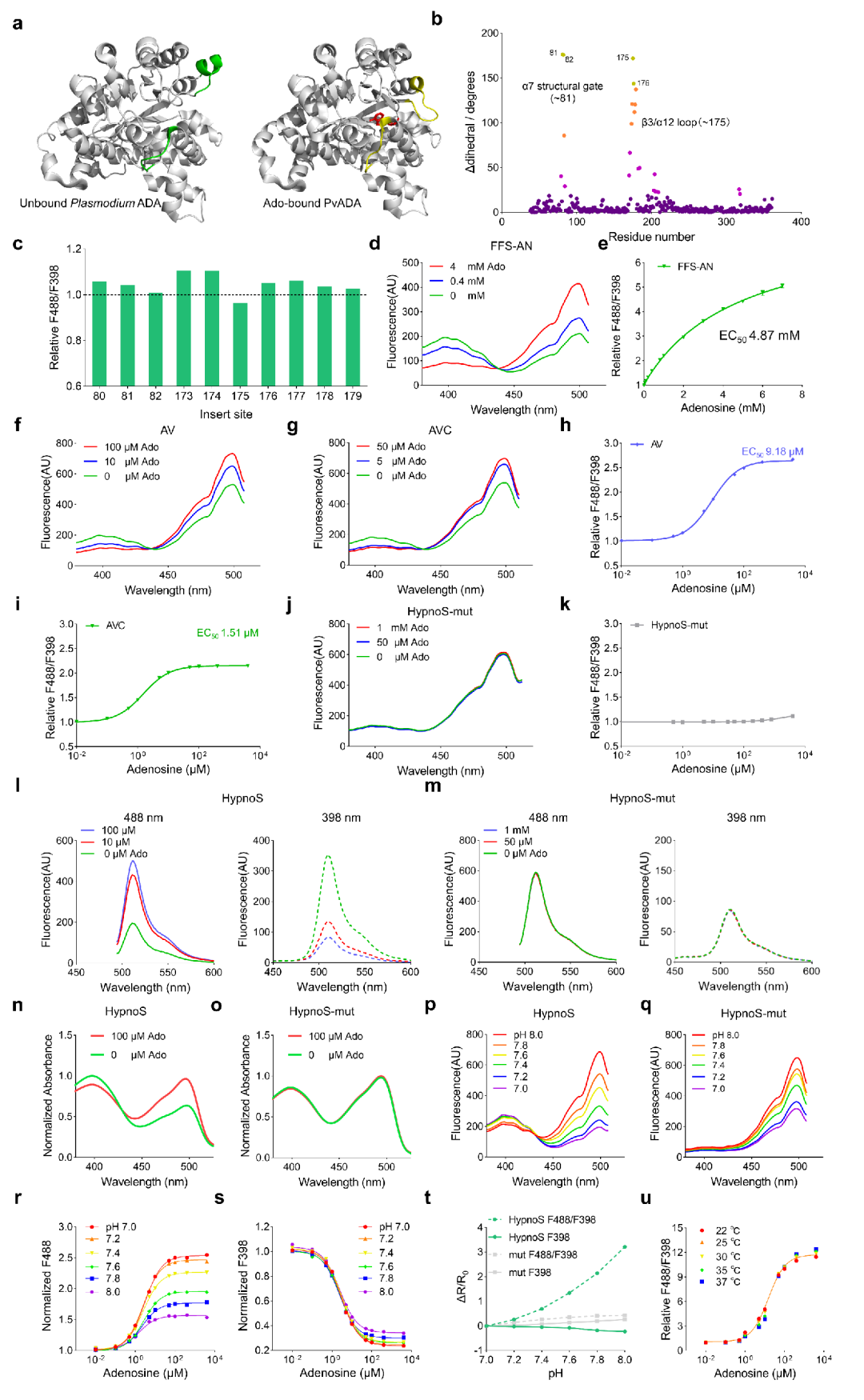
为开发一种基因编码的iAdo探针,研究者采用PvADA作为传感模块。基于PvADA晶体结构的预测表明,其α7结构门和/或β3/α12环在结合Ado时会发生显著的构象变化。作者计划将一个带有连接肽的cpEGFP插入α7结构门或β3/α12环中,预期Ado诱导的构象变化可能改变荧光。
为确定最佳的cpEGFP插入位点,研究人员利用PvADA结构,分析了Ado结合与未结合状态下Cα二面角的差异,这指示了局部构象变化。研究者选择了10个具有显著构象变化的位点进行cpEGFP插入。其中,变体175(cpEGFP插入175-176位残基之间)显示出4%的响应。随后通过连接肽随机化对该响应进行了改进,筛选了超过2500个变体,最终鉴定出变体FFS-AN,其响应达405%,EC50[横坐标(物质浓度)上对应纵坐标(反应强度)为最大反应值的50%时的浓度值]为4.9 mM。
接下来,为增强FFS-AN的亲和力,作者在Ado结合口袋中引入了突变(L85A、G200V、L284C),得到了亲和力改善的变体AV和AVC(EC50分别为9.18 μM和1.51 μM)。然后,在AVC基础上对cpEGFP进行了随机诱变,鉴定出一个具有929%响应的变体(cpEGFP的I23W突变)。于是,作者将此传感器命名为HypnoS(Hypersensitive intracellular adenosine Sensor,超敏iAdo探针)。此外,还构建了HypnoS-mut,一种对Ado不敏感的对照,其在Ado结合口袋中携带V200G和G201K突变,显示出强荧光但无Ado响应。
2.HypnoS的体外表征及其在哺乳动物细胞中对iAdo动态的监测
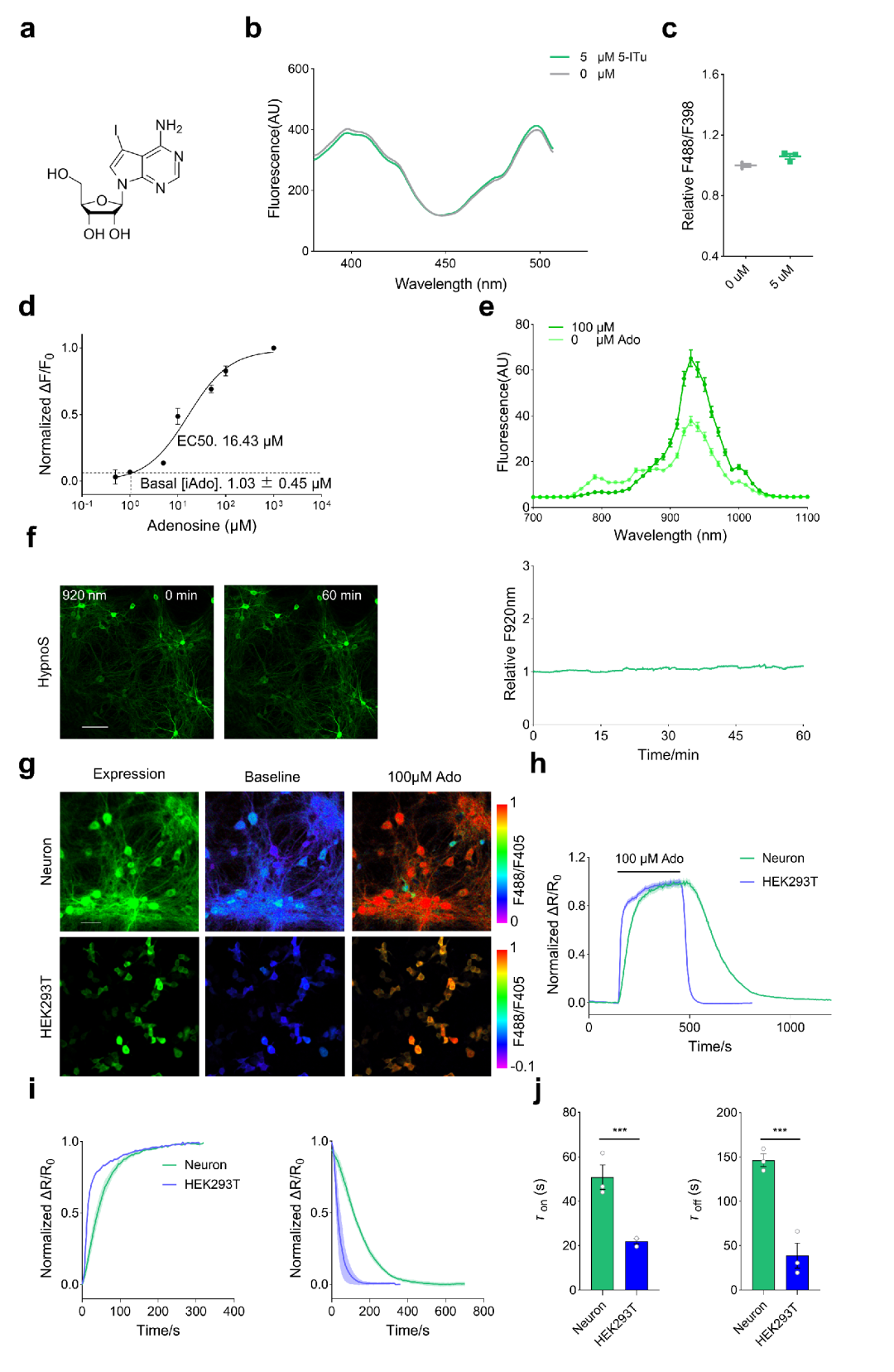
为在体外表征HypnoS的特性,研究人员纯化了该蛋白并进行了全面分析。结果显示,HypnoS在398 nm和500 nm处都表现出激发峰,发射峰则位于513 nm,这与其他基于cpEGFP的传感器相似。结合Ado时,HypnoS显示出比率响应:488 nm处的荧光增强,而398 nm处的荧光减弱。吸收光谱显示,在Ado结合与未结合状态下均在398 nm和500 nm处有两个峰。Ado结合使HypnoS的消光系数(EC)提高至未结合时的约1.5倍(500 nm处为9408 vs.6316 M-1cm-1),并使其量子产率(QY)提高到未结合时的约1.8倍(0.44 vs.0.25)。在双光子激发下,HEK293T细胞(人胚肾细胞)和神经元中的HypnoS在~800 nm和~930 nm处显示峰;结合Ado时,930 nm处的荧光增强,800 nm处的荧光减弱。HypnoS显示出强烈且均匀的荧光,在长期(60 min)连续双光子成像中未检测到光漂白。
当在488 nm激发时,HypnoS的荧光强度随pH值(7.0至8.0)升高而增加;而在398 nm激发时,可在pH非依赖性条件下测量Ado。22℃至37℃之间的温度变化未显著影响HypnoS对Ado的荧光响应。HypnoS对Ado的亲和力EC50为10.9 μM,适用于检测生理性Ado波动(估计值为1.8±1.4 μM)。停流分析揭示了快速的响应动力学:表观结合速率常数(kon)和解离速率常数(koff)分别为0.31 μM-1s-1和1.84 s-1,在10 μM Ado条件下ton[探针从无信号状态(Off)到有信号状态(On)所需的时间]为0.22 s,toff[探针从有信号状态(On)恢复到无信号状态(Off)所需的时间]为0.38 s,从而能够实现亚秒级的Ado动态报告。该传感器对Ado表现出高度特异性,对其他测试核苷酸如肌苷(Ino)、AMP、ADP和ATP均未检测到响应。此外,HypnoS和HypnoS-mut均未显示出ADA酶活性。
接下来,作者检测了HypnoS在哺乳动物细胞中的定位和亮度。研究人员观察到HypnoS在HEK293T细胞中显示出强烈的胞质荧光,并在施加100 μM Ado时F488/F405比值增加了800%。相比之下,HypnoS-mut无响应。为评估HypnoS监测内源性iAdo动态的能力,研究者用腺苷激酶(AdK)抑制剂5-碘杀结核菌素(5-ITu)处理表达HypnoS的细胞。结果显示,施加5 μM 5-ITu使HypnoS的荧光增加了30%,而HypnoS-mut则无。此外,5-ITu未诱导纯化的HypnoS传感器产生可检测的响应,排除了5-ITu与HypnoS相互作用的可能性。
为测量传感器在细胞培养中的亲和力并评估HypnoS传感器在量化活细胞内iAdo浓度方面的性能,研究者采用了一种先前报道的方法:用洋地黄皂苷(digitonin,10 μM)渗透处理细胞,使iAdo与标准化的细胞外浓度达到平衡,然后通过流式细胞术监测荧光。在表达HypnoS的经渗透处理的HEK293T细胞中,添加了浓度范围从0.5 μM到1 mM的Ado。滴定曲线(由流式细胞术数据生成)表明,HypnoS的荧光比值(F488/F405)随Ado添加呈剂量依赖性增加,表观EC50值约为16.43 μM,与使用纯化HypnoS测得的EC50值相当。随后,将未经渗透处理的HEK293T细胞中HypnoS的荧光比值(F488/F405)内插到滴定曲线中,揭示胞浆iAdo浓度为1.03±0.45 μM。这些结果表明,HypnoS是一种用于哺乳动物细胞中iAdo的灵敏、特异且快速响应的传感器。
图1.HypnoS的开发及体外表征
图2.HypnoS的构建、优化及体外表征
图3.培养细胞中HypnoS的表征
3.HypnoS揭示神经元和星形胶质细胞中不同的iAdo动态
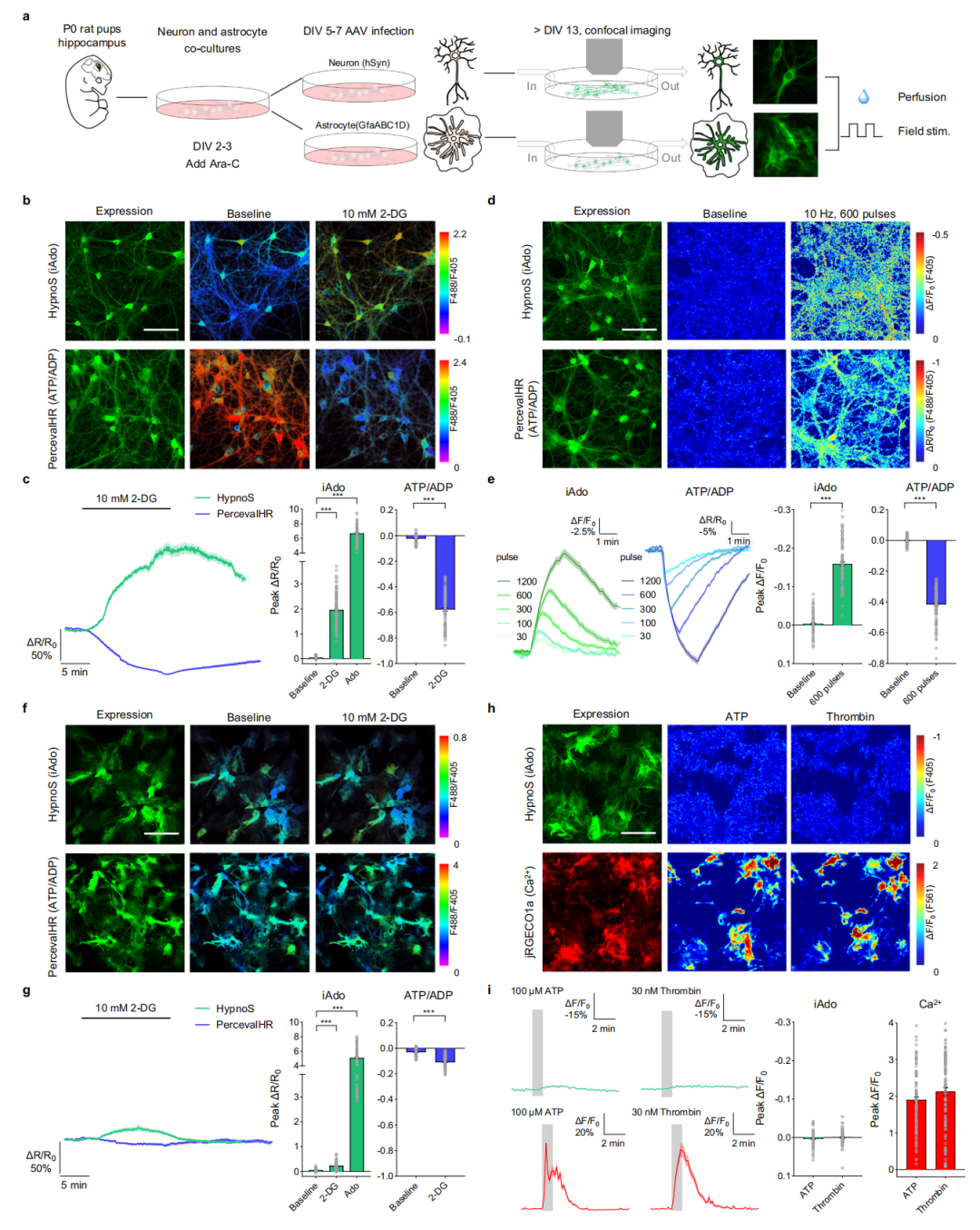
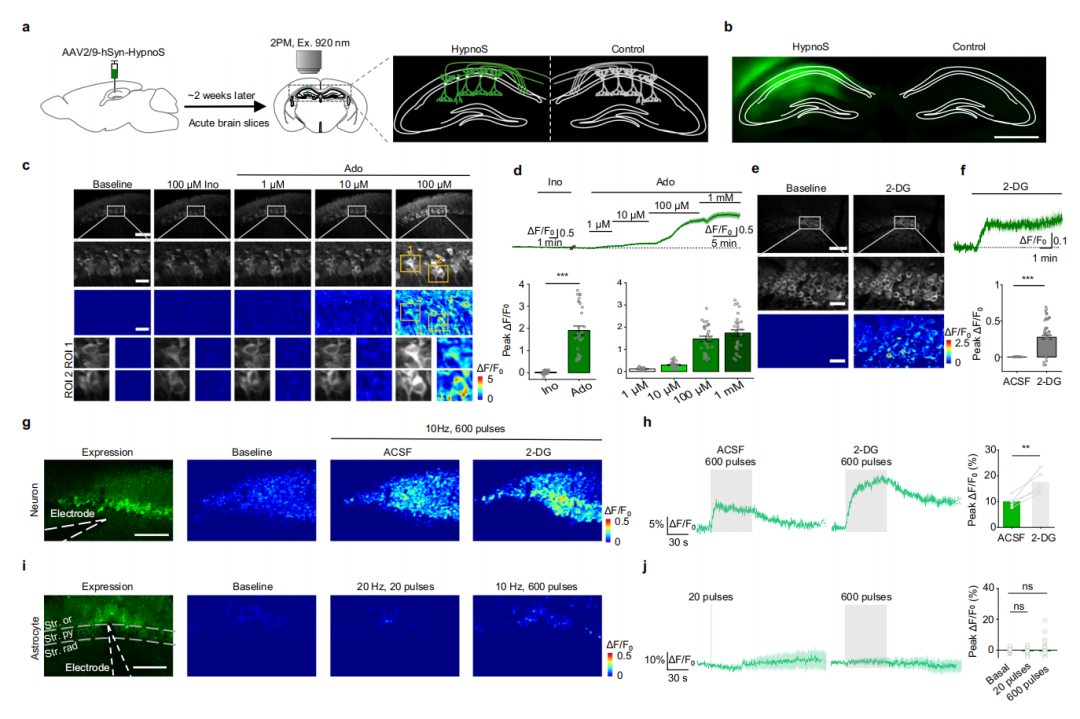
在验证了HypnoS传感器检测HEK293T细胞中iAdo动态的能力后,作者探索了其在大鼠原代神经元-胶质细胞共培养中的性能。利用腺相关病毒(AAVs)分别在人类突触素(hSyn)或胶质纤维酸性蛋白(GfaABC1D)启动子的控制下,选择性地在神经元和星形胶质细胞中表达HypnoS。结果显示,两种细胞类型对100 μM Ado表现出相似的荧光响应和动力学(τon表示上升时间常数,反映HypnoS与Ado结合后,荧光信号达到稳定状态的速度。分别为22.0 s与50.8 s;τoff表示衰减时间常数,反映HypnoS与Ado解离后,荧光信号恢复到基线的速度。分别为38.8 s与146.3 s),证实HypnoS的亚秒级响应足以捕捉不同细胞类型间的动力学差异。关键的是,场刺激诱发的钙信号在表达HypnoS的神经元与对照神经元之间保持一致,确认HypnoS的表达不干扰钙信号。此外,qPCR分析显示HypnoS传感器并未改变基底前脑(BF)Ent1、Ent2、Ada或Adk的mRNA水平,表明HypnoS不干扰正常的腺苷代谢。这些结果证明HypnoS可在神经元和星形胶质细胞中可靠地表达并发挥功能。
为评估HypnoS监测神经元和星形胶质细胞中响应细胞应激和活动的内源性iAdo动态的能力,研究者对神经元-胶质共培养物施加了两种不同的扰动:代谢抑制和电刺激。结果显示,10 mM 2-脱氧葡萄糖(2-DG)阻断糖酵解,导致神经元中iAdo水平显著增加,这由HypnoS的荧光(F488/F405比值)报告;在表达HypnoS-mut的对照细胞中未检测到此类增加。这种增加伴随着细胞内ATP:ADP比值的下降,这通过PercevalHR(一种ATP:ADP比值传感器)测得。
接下来,研究人员通过施加电脉冲或高浓度胞外K+(75 mM)刺激培养物,研究了神经元活动与iAdo之间的关系。通过在pH非敏感通道(405 nm)对HypnoS成像发现,电刺激和施加高浓度胞外K+(75 mM)均在神经元胞体和突起中诱发了显著且持久的iAdo升高。在10 Hz下增加刺激次数(从30次到1200次)会逐步提高iAdo水平,这由HypnoS荧光(F405)报告。同时观察到ATP:ADP比值下降。这些发现表明神经元能量代谢与iAdo动态之间存在直接联系。
相比之下,星形胶质细胞对代谢应激和电刺激的响应中,iAdo水平和ATP:ADP比值变化极小。此外,尽管星形胶质细胞对100 μM ATP或30 nM凝血酶刺激表现出强烈的钙响应,但HypnoS未检测到iAdo水平的相应变化。这些结果强调了神经元与星形胶质细胞中截然不同的iAdo代谢过程,并凸显了HypnoS在共培养中用于细胞类型特异性iAdo检测的效用。
图4.HypnoS在培养的神经元和星形胶质细胞中显示不同的iAdo动态
4.利用HypnoS检测离体脑片和果蝇活体内的iAdo动态
为评估HypnoS检测脑组织中iAdo动态的灵敏度,研究人员使用AAV在小鼠海马CA1神经元中表达该传感器。感染后2-4周的急性脑片的双光子成像显示,响应Ado时,细胞内荧光以单细胞分辨率呈剂量依赖性增加,而对Ino则未观察到显著变化。与培养神经元类似,在急性脑片的神经元中,响应2-DG诱导的代谢抑制和电刺激,观察到iAdo水平逐渐升高。并且,这些刺激的组合导致了iAdo的协同性增加,这与先前关于神经元活动驱动ATP合成的研究结果一致。
相比之下,星形胶质细胞对电刺激的响应中,iAdo水平变化极小,但对施加100 μM Ado确有响应,这些发现与培养星形胶质细胞的观察结果相似。这些结果表明,神经元与星形胶质细胞中发生着迥然不同的iAdo代谢过程,并凸显了HypnoS在脑组织中进行细胞类型特异性iAdo测量的效用。
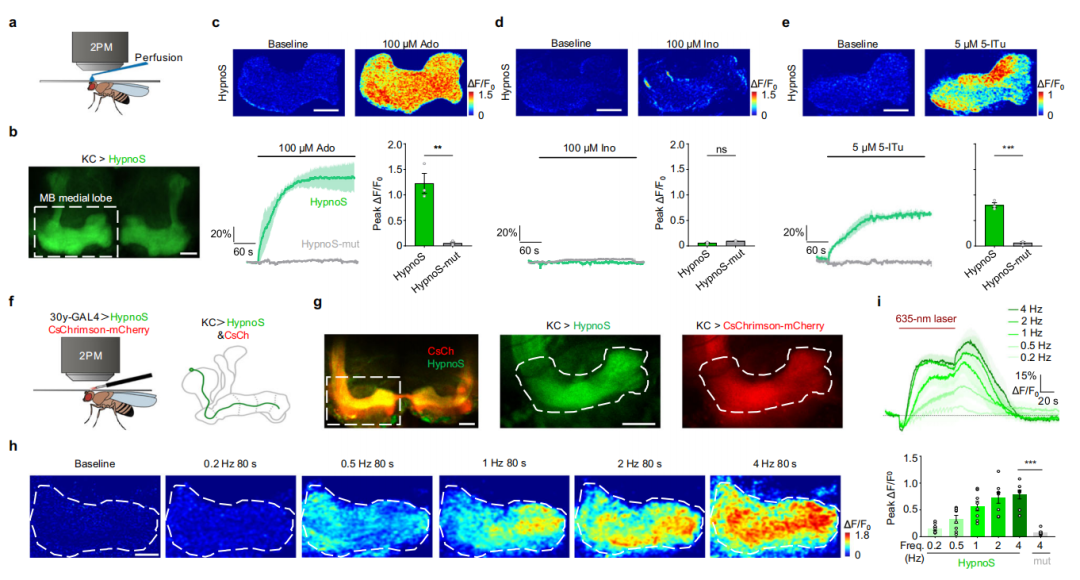
鉴于神经元活动与能量代谢在包括果蝇在内的多种物种中密切相关,研究者在活体内研究了这种关系。作者构建了在蘑菇体(MB)肯扬细胞(Kenyon Cells,KCs)中表达HypnoS的转基因果蝇。对MB内侧叶进行的双光子成像显示,HypnoS特异性地响应Ado,不受Ino干扰。在对照实验中,未观察到表达HypnoS-mut的KCs有响应。抑制AdK增加了iAdo水平,证实了HypnoS报告果蝇内源性Ado变化的能力。
为监测神经元激活期间的iAdo动态,研究人员在KCs中表达了光遗传学工具CsChrimson。在635 nm激光激发下,在MB内侧叶观察到时间锁定的荧光增加。提高刺激频率(0.2、0.5、1、2、4 Hz)引发了逐步增强的响应,支持了KCs中神经元活动与iAdo动态之间的耦合;在表达HypnoS-mut的KCs中未检测到此类增加。这些发现证明了HypnoS在小鼠急性海马切片离体实验和果蝇活体实验中,以高特异性和高灵敏度监测神经元活动诱导的iAdo增加的有效性。
图5.利用HypnoS对急性小鼠脑片中iAdo动态进行离体双光子成像
图6.利用HypnoS对果蝇活体内iAdo动态进行双光子成像
5.癫痫发作期间iAdo的时空动态
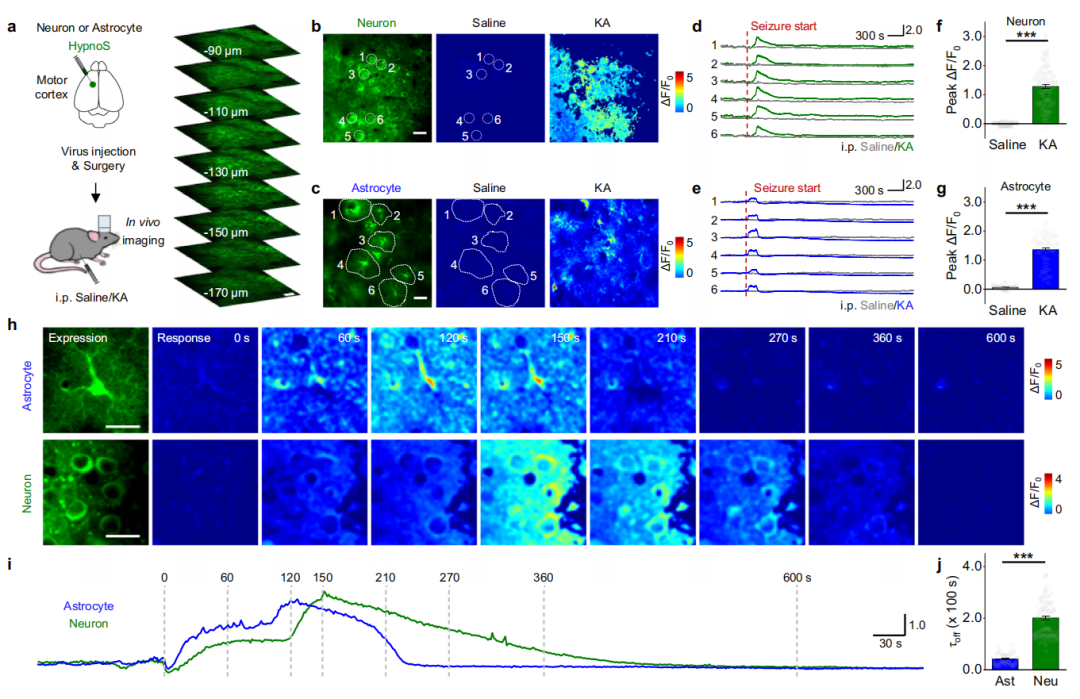
既往研究表明,iAdo在包括海马和皮层在内的多个脑区对癫痫发作具有保护作用,其在神经元中的水平会升高(海马中升高2-6倍),其清除主要由星形胶质细胞调控。为阐明癫痫发作期间iAdo的时空动态及其在癫痫传播和终止中的潜在作用,研究人员利用海人酸(KA,腹腔注射)诱导的小鼠癫痫模型,将HypnoS与钙成像和电生理记录技术结合使用。将分别携带HypnoS和膜靶向红移钙传感器mjRGECO1a的AAVs注射到新生[出生后第0天(P0)至P1]小鼠中。在对小鼠背侧皮层进行成像的同时进行脑电图(EEG)和肌电图(EMG)记录,作者识别出由KA注射诱导的癫痫发作。与既往报道类似,研究者观察到KA诱导的癫痫发作期间钙信号增加,随后出现更大范围的扩散性钙波,该现象与癫痫发作期脑电信号波幅低平化呈现同步伴随特征。同时,研究人员检测到一个扩散的iAdo波,反映在HypnoS信号中,该波紧随钙波的传播。由HypnoS和mjRGECO1a报告的波起源于大致相同的位置,以相似的速度传播(分别约为75 μm/s和85 μm/s),并从外侧皮层向内侧区域移动。此外,iAdo波比钙波延迟约20 s出现,并表现出更慢的衰减动力学(约100 s),这表明小鼠体内癫痫发作期间神经元活动驱动了iAdo的累积。作为对照,HypnoS-mut在KA诱导的癫痫发作期间几乎没有荧光变化。
接下来,作者通过在神经元特异性(hSyn)或星形胶质细胞特异性(GfaABC1D)启动子下表达HypnoS,研究了神经元和星形胶质细胞之间iAdo动态的差异。在M1/M2运动皮层进行的HypnoS双光子成像显示,KA注射后,神经元和星形胶质细胞中的HypnoS均显示出显著的荧光增强,而HypnoS-mut则未检测到响应。值得注意的是,与星形胶质细胞相比,神经元中的Ado升高表现出更长的衰减时间,这暗示了小鼠体内神经元和星形胶质细胞中存在不同的iAdo代谢途径。这些结果证明了HypnoS在小鼠癫痫发作期间,能够以高灵敏度、分子和细胞类型特异性报告iAdo动态。
图7.头部固定小鼠在体时空分辨介观成像监测iAdo动态
图8.在体双光子成像解析细胞类型特异性的iAdo动态
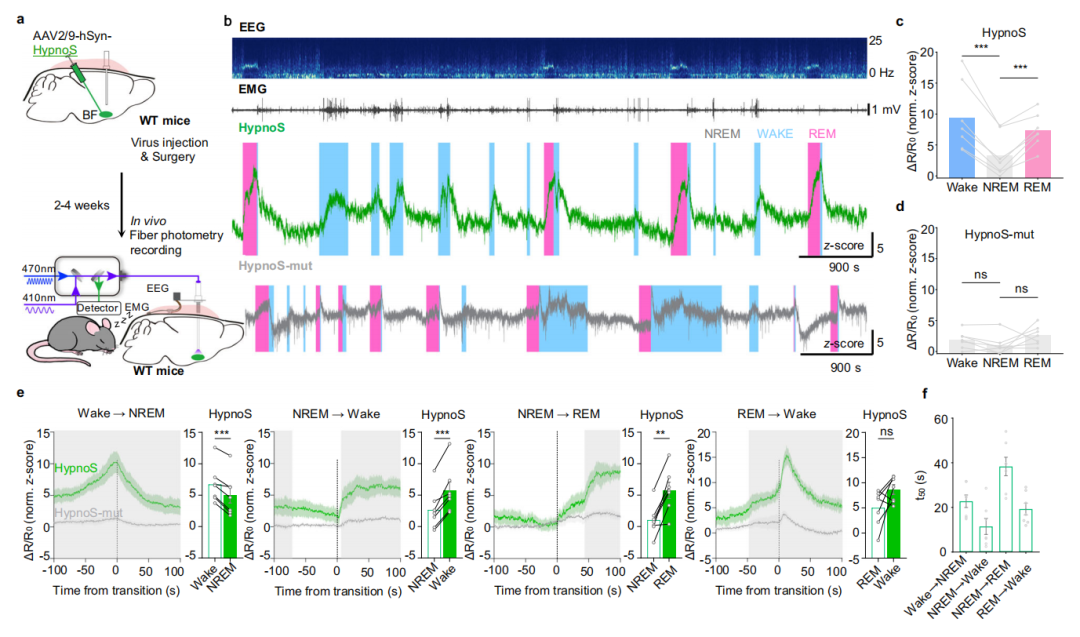
6.在自由活动小鼠的睡眠-觉醒周期中监测iAdo动态
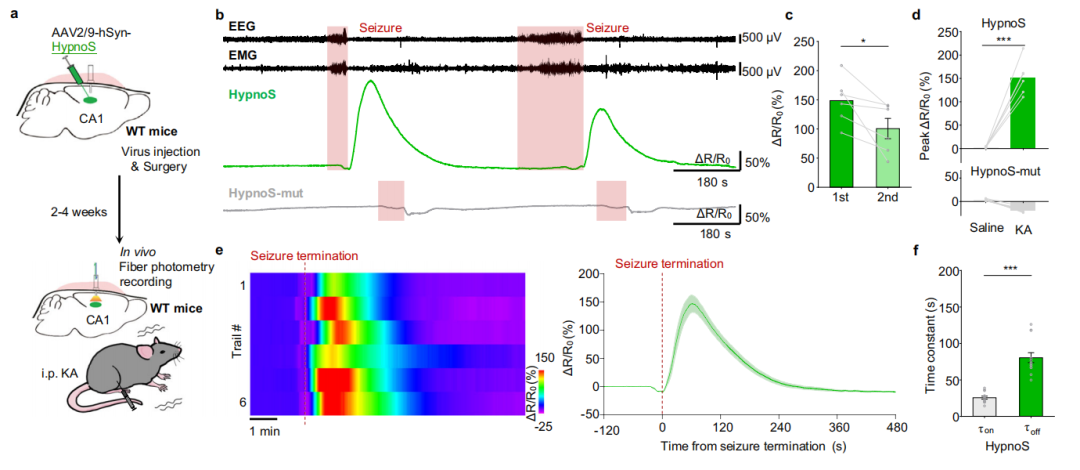
为在自由活动小鼠的深部脑区评估HypnoS在光纤光度法中的应用,研究者在海马CA1区表达了HypnoS或HypnoS-mut,并通过植入的光纤在KA诱导的癫痫模型中记录荧光信号。KA注射后,表达HypnoS的小鼠显示出荧光增强,而在表达HypnoS-mut的小鼠中则未观察到这种增强。在连续癫痫发作期间,第二次癫痫发作时的iAdo幅度低于第一次发作,这一发现与一项基于微透析的研究中观察到的胞外腺苷(eAdo)模式一致,该研究中KA诱导的连续eAdo升高显著减弱。这些发现都支持癫痫发作期间iAdo和eAdo之间存在耦合。值得注意的是,HypnoS信号的增加与EEG测量的癫痫发作终止时间相吻合,这支持了Ado在癫痫发作终止中的作用。信号动力学显示上升时间(τon)约为25 s,衰减时间(τoff)约为80 s,表明HypnoS适用于在自由活动小鼠中实时检测iAdo动态。
为研究生理性睡眠-觉醒周期中的iAdo动态,研究人员通过AAVs在BF(一个通过Ado信号调节睡眠稳态的脑区)表达了HypnoS或HypnoS-mut。使用光纤光度法(荧光通道)的同时进行EEG和EMG记录,作者观察到在清醒期和快速眼动(REM)睡眠期,iAdo水平显著高于非快速眼动(NREM)睡眠期。在表达HypnoS-mut的小鼠中未检测到此类差异。得益于HypnoS的高时间分辨率,研究者捕捉到了睡眠-觉醒转换期间快速且显著的iAdo变化,睡眠状态转换平均时间(t50)分别为:22.8 s(清醒到NREM)、11.5 s(NREM到清醒)、38.3 s(NREM到REM)和19.3 s(REM到清醒),表明iAdo的增加依赖于神经活动。
图9.HypnoS监测自由活动小鼠癫痫发作期间iAdo动态
图10.HypnoS监测自由活动小鼠在睡眠-觉醒周期中的iAdo动态
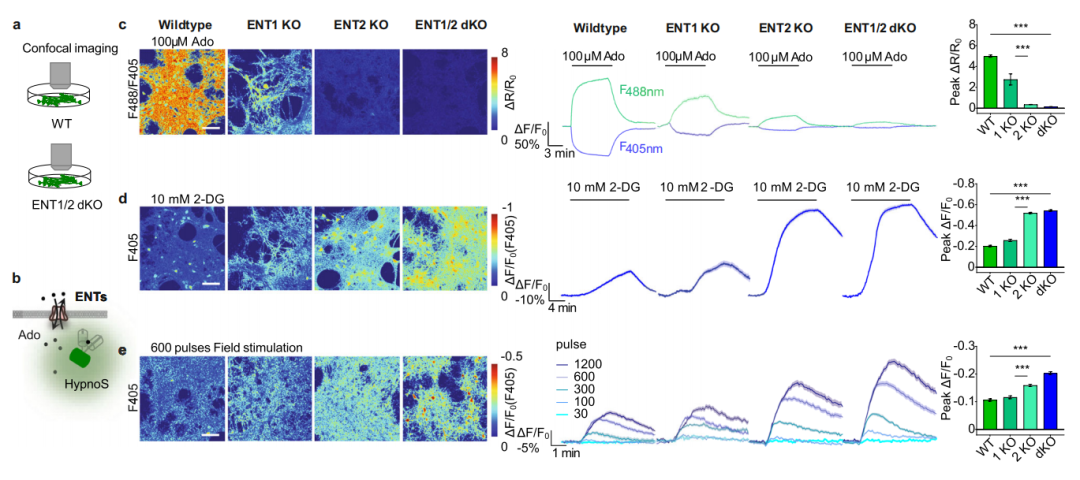
7.ENT1/2调控睡眠-觉醒周期中的iAdo水平
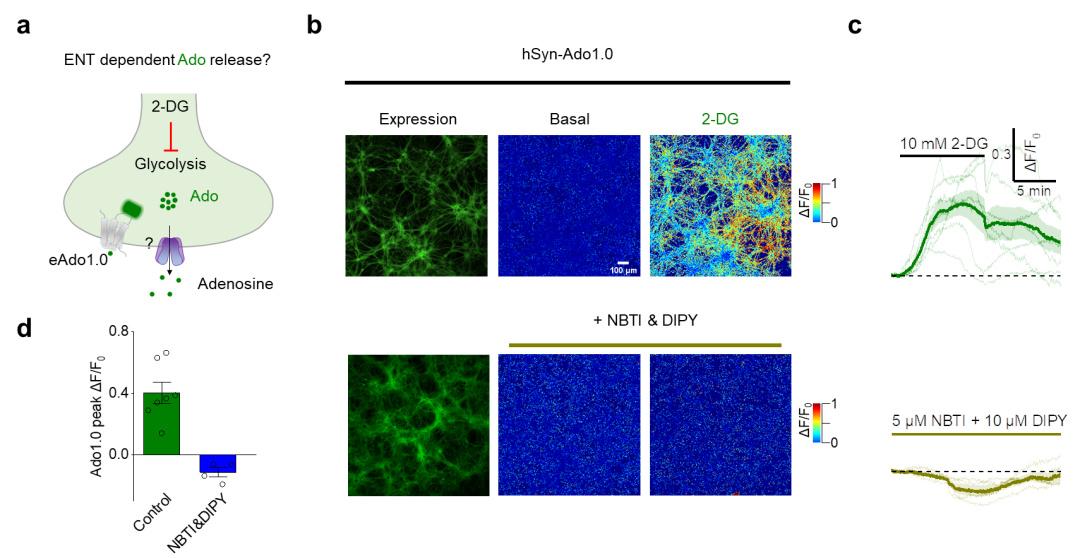
平衡型转运蛋白(ENT1/2)在调节iAdo水平及其与eAdo的耦合中至关重要。不同睡眠-觉醒状态下神经元的iAdo动态在很大程度上反映了使用GRABAdo探针记录到的、与神经元活动相关的eAdo动态,表明iAdo和eAdo之间存在紧密耦合。然而,iAdo如何增加并贡献于eAdo仍不清楚。为研究ENT1/2对Ado转运的影响,研究人员在体外培养细胞和体内利用HypnoS测量了iAdo水平。观察到响应外源性Ado时iAdo水平显著升高;而在缺乏ENT1、ENT2或同时缺乏ENT1和ENT2的海马神经元中,这种升高显著减弱。作者还发现,在糖酵解抑制和神经元激活条件下,与野生型(WT)神经元相比,ENT1/2敲除神经元中的iAdo水平显著升高。此外,在先前的研究中或本文研究者使用ENT1/2抑制剂S-(4-硝基苄基)-6-硫代肌苷(NBTI,5 μM)和双嘧达莫(DIPY,10 μM)时,均未检测到eAdo的增加。这些发现支持在培养的神经元中,iAdo通过ENT1和ENT2共同作用贡献于eAdo的转运。
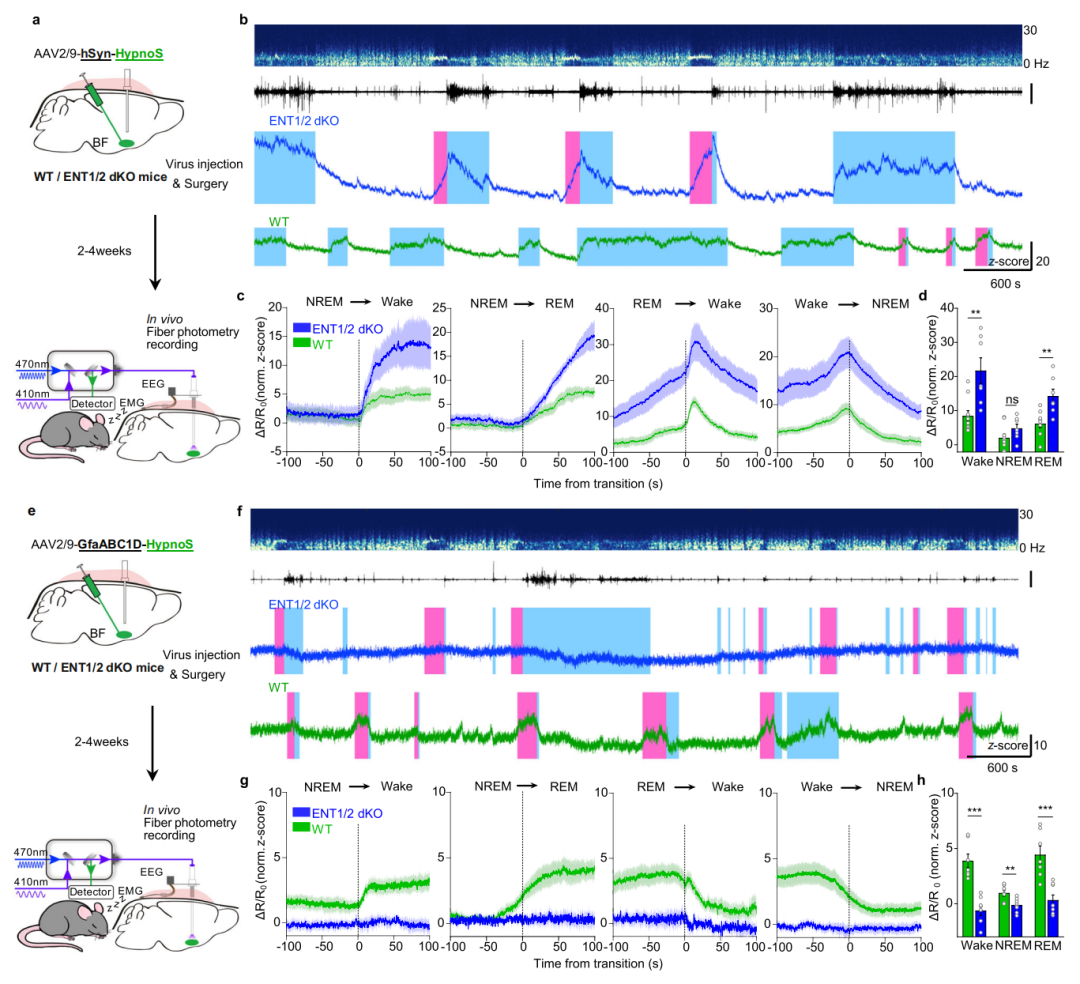
为在体内检验ENT1/2在调节iAdo动态中的作用,研究人员在ENT2敲除小鼠中,通过注射表达SaCas9-sgENT1的AAV选择性敲除BF的ENT1(构建ENT1/2双敲除小鼠,ENT1/2 dKO)。随后,作者比较了在睡眠-觉醒周期中,HypnoS记录的dKO与WT小鼠BF的iAdo动态,观察到ENT1/2双敲除显著增加了神经元在清醒期和REM睡眠期的iAdo,而在星形胶质细胞中则显著降低了清醒期和REM睡眠期的iAdo。总的来说,这些结果证明了HypnoS能够在自由活动小鼠体内,以细胞类型特异性监测ENT1/2依赖性的Ado转运。
图11.HypnoS揭示培养物中ENT1/2介导的Ado转运
图12.ENT1/2的药理学抑制阻断了糖酵解抑制诱导的Ado释放
图13.HypnoS揭示睡眠-觉醒周期中ENT1/2介导的Ado转运
总结
这项研究首次在活体动物中,以单细胞分辨率展示了皮质神经元和星形胶质细胞内的iAdo活性。此外,它突显了哺乳动物大脑中iAdo水平在癫痫发作和睡眠-觉醒周期期间的动态波动。基于其高灵敏度和直接测量能力,HypnoS有望成为通过高通量筛选试验来靶向筛选作用于iAdo代谢通路药物的一项宝贵工具。
通讯作者简介:
王晶,理学博士,研究员(PI),教授,博士生导师,化学生物学系副主任。2009年博士毕业于中国科学院上海有机化学研究所。随后进入美国芝加哥大学化学系/霍华德休斯医学院(HHMI)从事博士后研究;2016年加入北京大学药学院化学生物学系和天然药物及仿生药物国家重点实验室PI并入选中组部海外高层次青年人才项目,兼聘北京大学国家生物医学成像科学中心PI。目前担任中国药理学会分析药理学专业委员会委员和青年委员会常委。获得北京大学拜耳研究员奖、医学部青年科技奖等奖励。课题组聚焦开发高特异性、高灵敏度和高时空分辨率的化学生物学技术(化学标记、组学、探针和成像技术)实现细胞信号分子动态的精准检测和分子机制研究。
主要研究领域
1.开发信号转导小分子的分子探针以及通过蛋白组学,高通量测序等技术研究其调控机制。
2.针对肿瘤内源性代谢分子的荧光蛋白探针(Biosensor)和超分辨显微成像。
3.新型抗肿瘤靶标和先导化合物的发现与确证。
李毓龙,北京大学生命科学学院教授,北大-清华生命科学联合中心、北京大学-IDG/麦戈文脑科学研究所研究员,博士生导师、国家杰出青年基金获得者,新基石研究员。课题组聚焦于神经元通讯的基本结构——突触,从两个层面上开展研究工作:一是开发前沿的新型遗传编码的成像探针,用于在时间和空间尺度上解析神经系统的复杂功能;二是借助此类工具探究突触传递的调节机制,特别是生理及病理条件下对神经递质释放的调控。李毓龙教授团队先后开发了针对乙酰胆碱、单胺类、嘌呤类、脂类和神经肽类等神经调质的GRAB(GPCR activation-based)荧光探针,并成功用于多种模式动物的在体检测。研究成果先后入选2018年及2023年中国生命科学十大进展,曾获全国创新争先奖、谈家桢生命科学奖、第二十届吴阶平-保罗·杨森医学创新奖(吴杨奖)、首届“科学探索奖”、首届峰基金支持、教育部基础学科拔尖学生培养计划“优秀导师奖”等奖项。目前担任Neuron杂志编辑委员会成员及National Science Review和Journal of Neurochemistry杂志编辑。
武照伐,博士,研究员,博士生导师。2013年获西北农林科技大学学士学位;2019年获北京大学博士学位(导师:李毓龙教授);2019-2023年先后获勃林格殷格翰博士后基金、CLS杰出博士后基金,在北京大学从事博士后研究(合作导师:李毓龙教授和Bastian Hengerer教授)。2023年10月加入中国科学院遗传与发育生物学研究所,2024年获基金委“优秀青年科学基金项目”支持。2023年入选“北京市青年人才托举工程”,2024年获朝阳区“凤凰计划”高层次人才认定。
研究方向介绍:
大脑作为生物体内结构最复杂且功能最强大的器官,拥有近860亿个神经元,每个神经元能与其它神经元或靶细胞形成多达10000个连接点,从而构成一个庞大的互连网络。工具对研究复杂的大脑至关重要;如何开发和运用新的工具,从而为脑科学的研究带来新的突破是领域内的重大挑战。
武照伐研究员课题组致力于结合荧光探针技术开发、活体成像、光遗传学/基因编辑操控和化学生物学手段解析大脑细胞间的通讯机制与脑功能。具体研究内容包括:重要神经代谢分子(核苷和脂类)的检测及其在生理(睡眠、情绪等)及病理(癫痫、卒中等)过程的功能;大脑中不同细胞类型的能量代谢规律和调控机制;神经-肿瘤-免疫之间的通讯。
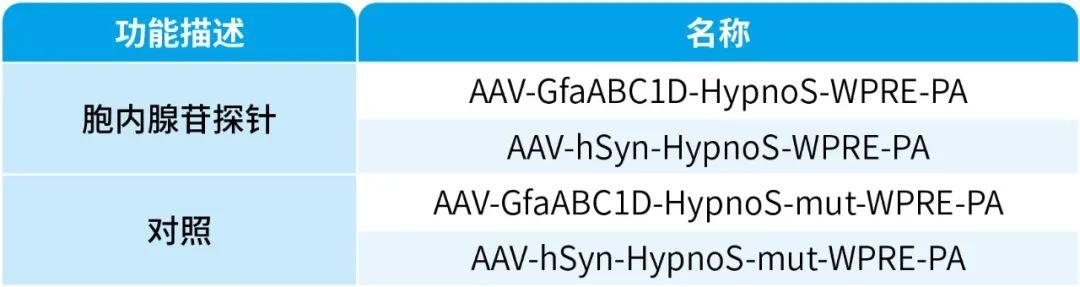
我司可提供HypnoS病毒产品,列表如下:

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK