2025-07-07 阅读量:866
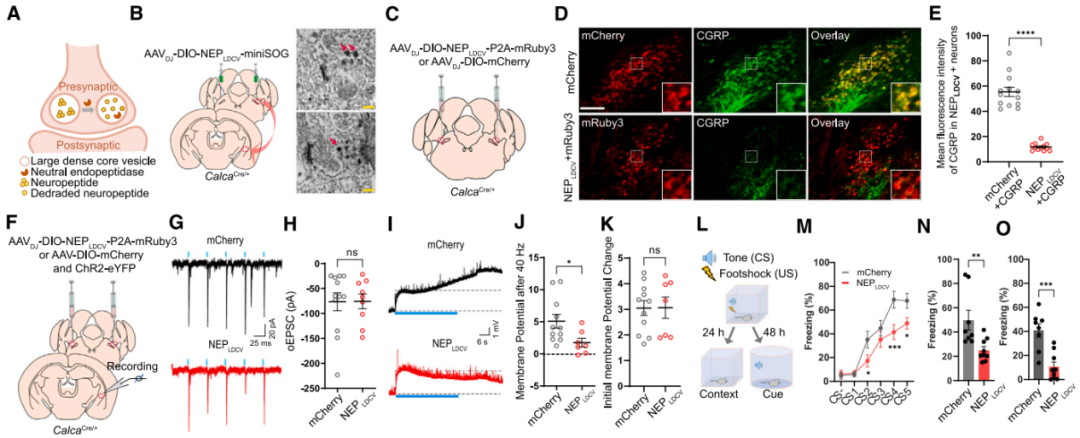
神经元能够通过产生和释放神经肽实现细胞间通讯,其在脑功能中占据关键地位,但基于神经环路的肽能传递机制长期以来因缺乏在体监测与操控神经肽释放的工具而知之甚少。经典快效神经递质(如谷氨酸、GABA等)包装于突触小泡(SVs)并以活动依赖性方式释放,而神经肽作为重要的神经调质存储于大致密核心囊泡(LDCVs),在高频动作电位串刺激下释放,其独特功能与释放特性表明,神经肽可作为关键信号调质,表现出类似多巴胺、去甲肾上腺素等经典神经递质的核心调控作用。目前已发现超100种神经肽及其突触后受体参与威胁感知等生理过程,且其失调与多种神经及精神疾病密切相关,因此解析脑环路中的神经肽能系统亟需精准工具。传统基于G蛋白偶联受体(GPCR)的突触后神经肽传感器虽能监测部分神经调质释放,却因神经肽的多样性难以构建通用工具,且无法精准反映突触前释放过程;而现有荧光标记策略又因神经肽释放后的快速耗竭,难以在清醒行为动物中实现活动依赖性神经肽释放的动态观测。
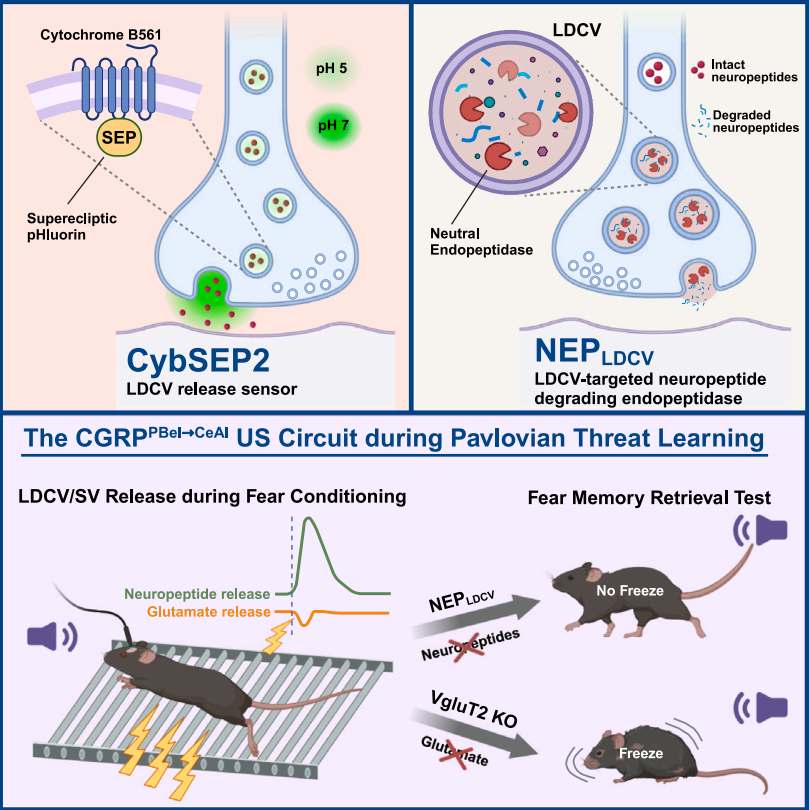
美国索尔克生物研究所的Sung Han研究团队在Cell上发表了一篇题为“Presynaptic sensor and silencer of peptidergic transmission reveal neuropeptides as primary transmitters in pontine fear circuit”的研究成果,该研究开发了遗传编码的LDCV释放传感器CybSEP2与肽能传递沉默器NEPLDCV。其中,CybSEP2将pH敏感型绿色荧光蛋白SEP整合于LDCV特异性膜蛋白细胞色素b561(Cyb561)的腔环,通过检测LDCV释放时的腔内pH变化直接监测突触前神经肽释放;NEPLDCV则将中性内肽酶(NEP)靶向定位到LDCV腔内,通过酶解疏水氨基酸链特异性降解多种神经肽(如脑啡肽、降钙素基因相关肽(CGRP)等),特异性阻断肽能传递,且不干扰快效神经传递。借助上述工具,团队研究揭示了巴甫洛夫威胁学习中臂旁核-杏仁核通路的非条件刺激由神经肽而非谷氨酸编码;同时证实在杏仁核-臂旁核内源性阿片能环路中,神经肽兼具编码正性效价与抑制条件性威胁反应的双重功能。该研究不仅为清醒行为动物的神经肽能系统研究提供了可靠工具,更为解析神经肽在恐惧记忆、疼痛感知等复杂行为中的核心作用奠定了方法学基础。
枢密科技重磅推出神经肽研究利器——遗传编码的LDCV传感器CybSEP2与LDCV沉默器NEPLDCV!CybSEP2可实时监测突触前神经肽释放动态,NEPLDCV则能特异性降解LDCV内神经肽,二者结合实现“监测-干预”闭环,为解析神经肽在多种生理病理中的作用提供有力工具。选择枢密科技,解锁神经肽研究新维度!
1、LDCV传感器的设计与表征
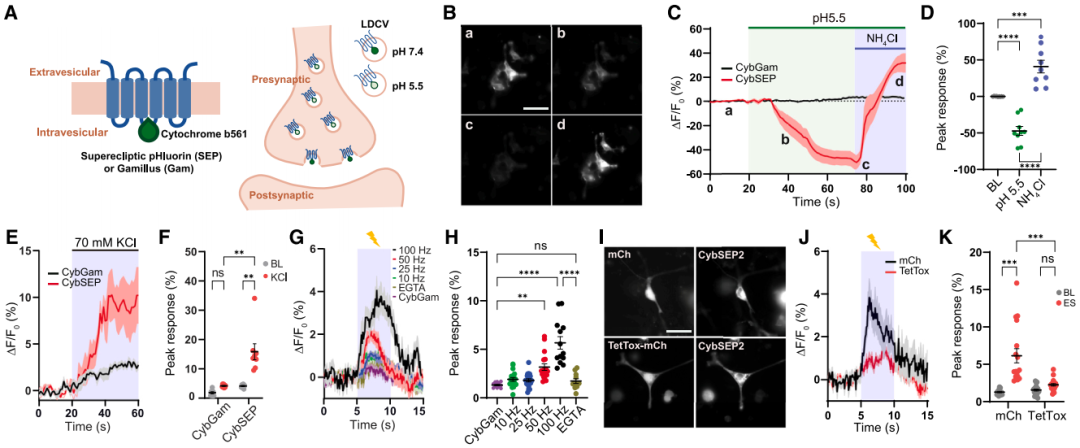
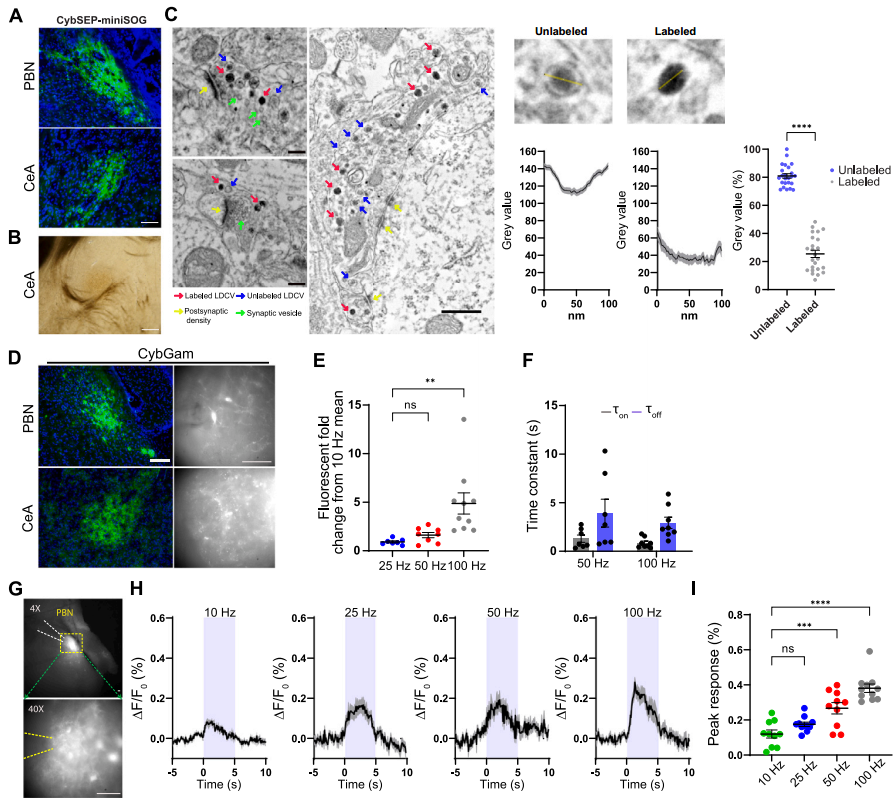
最初,SEP(superecliptic pHluorin)通过整合到SV特异性膜蛋白中,靶向SV内部实现对突触传递的检测。在研发神经肽释放监测工具时,研究团队借鉴这一设计思路,创新性地将其应用于LDCV的动态监测。团队首先通过定点突变(86和159位组氨酸替换为丙氨酸)灭活了LDCV特异性膜蛋白Cyb561的电子转运活性,再将SEP编码序列插入其跨膜结构域3和4之间的腔环,构建出LDCV荧光传感器CybSEP,并以耐酸性单体GFP(Gamillus)插入Cyb561相同位置构建对照蛋白CybGam。为验证CybSEP荧光的pH响应性,团队在经神经生长因子诱导分化的PC12细胞中表达了该传感器。结果显示,经pH5.5酸性溶液灌流后,CybSEP的荧光近乎完全淬灭;NH4Cl解除酸化后信号恢复,而对照CybGam荧光无变化;应用70 mM KCl诱导细胞膜去极化(模拟动作电位触发囊泡融合)可诱发CybSEP荧光显著增强,而CybGam无响应。
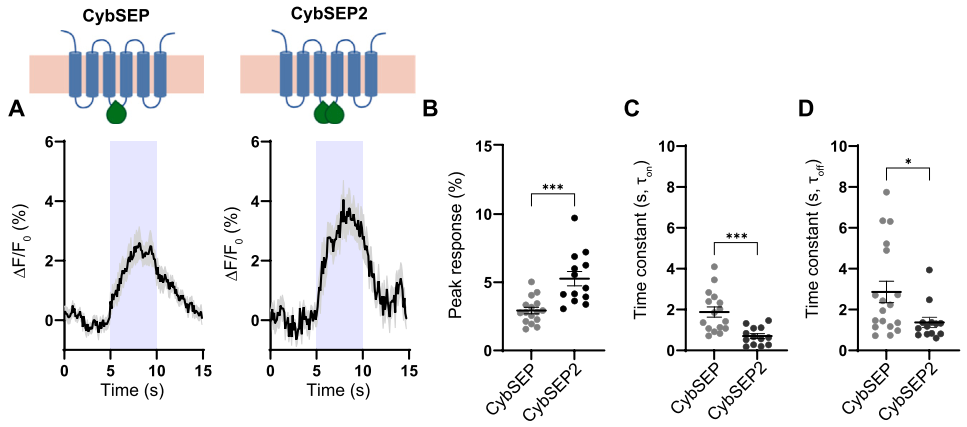
为进一步优化性能,研究者开发了双SEP嵌入版本CybSEP2,其荧光响应幅度较CybSEP提升30%,且电刺激响应的上升时间(ton)和衰减时间(toff)更短,因此后续实验均采用CybSEP2。在分化的PC12细胞模型中的功能验证显示:1)电刺激诱发的荧光信号呈频率依赖性增强(100 Hz达峰值);2)钙螯合剂EGTA可完全阻断该响应,证实其钙依赖性释放特征;3)破伤风毒素(TetTox)介导的囊泡融合抑制可显著降低荧光强度。这些结果表明,CybSEP2的荧光信号变化可特异性反映LDCV的释放事件。
图1. LDCV传感器的设计与表征
图2. 电刺激诱发的CybSEP与CybSEP2荧光水平比较
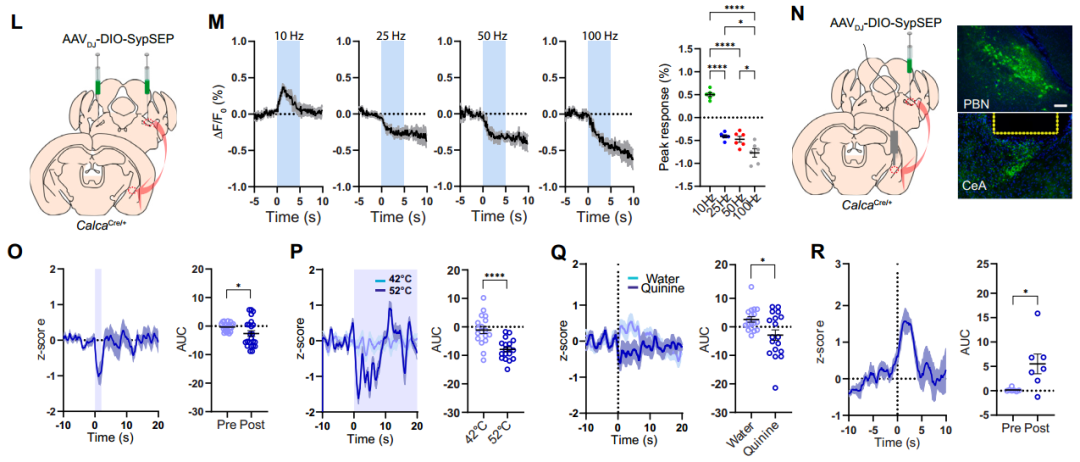
2、急性脑切片中突触前LDCV释放的成像研究
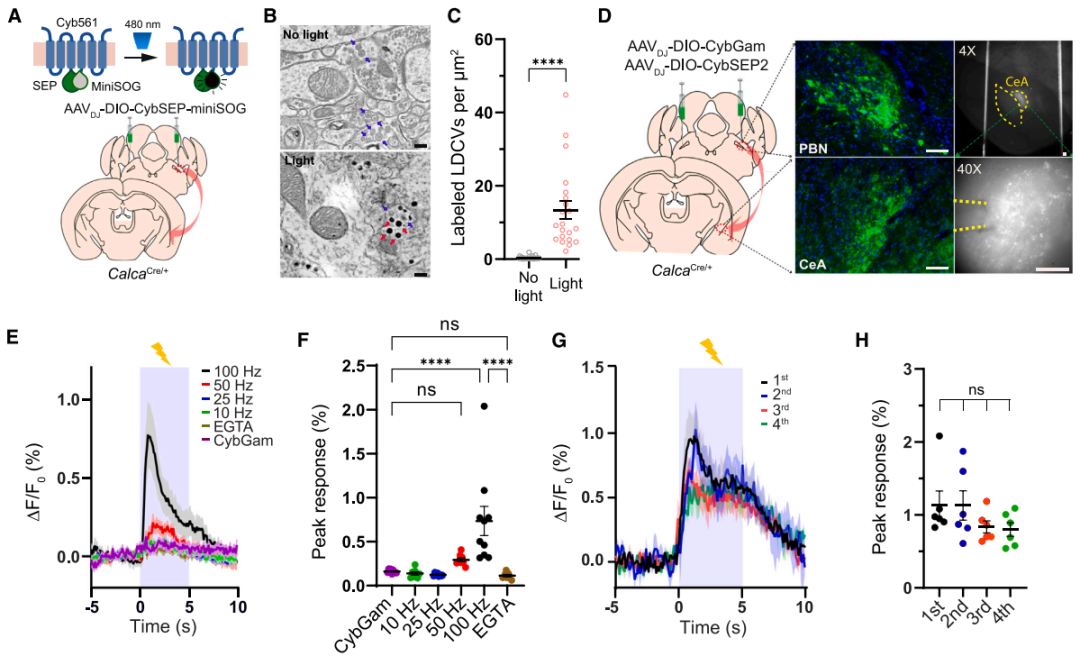
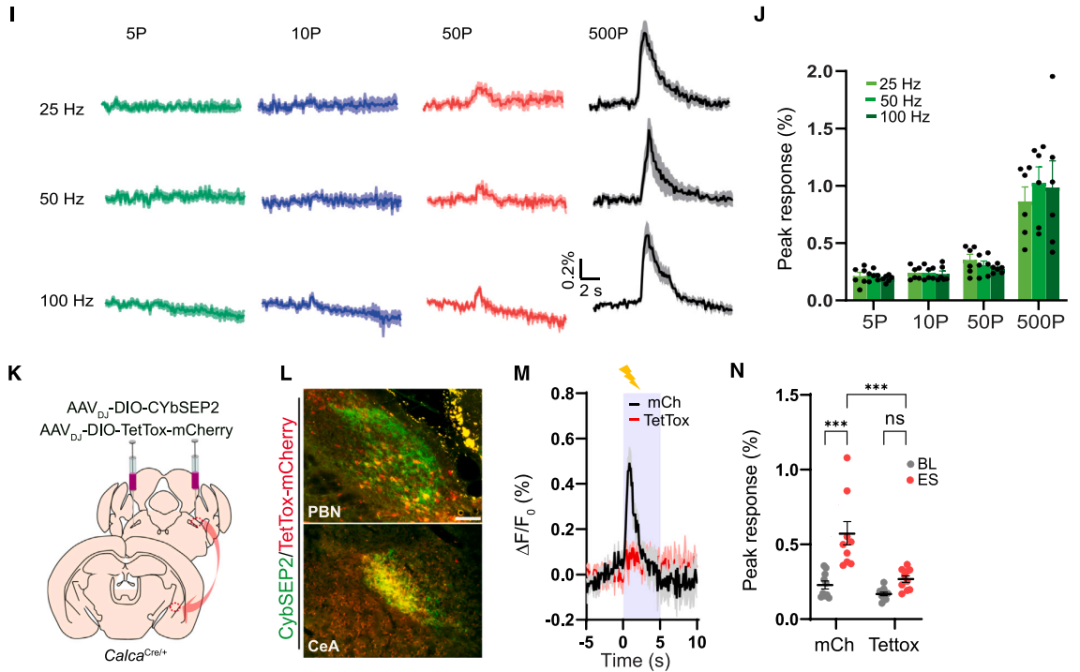
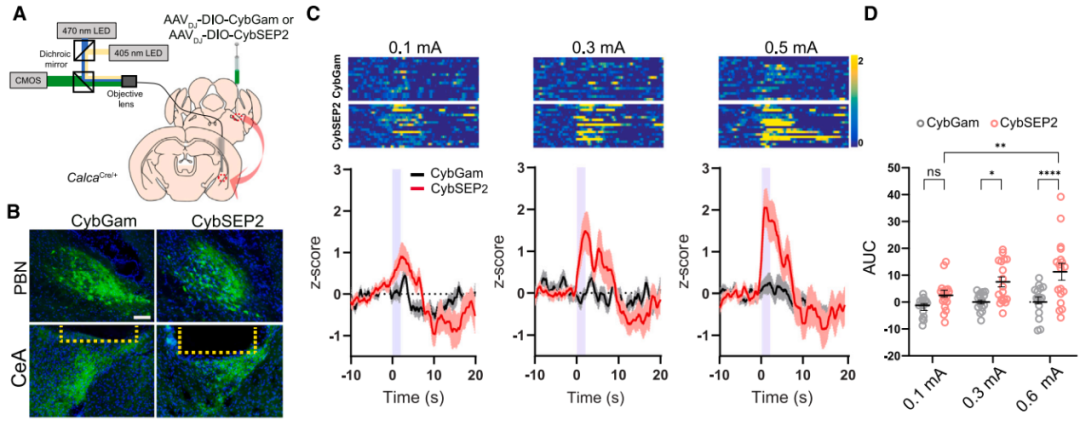
接下来研究者在已知的臂旁核-杏仁核威胁学习通路[臂旁核外侧亚区(PBel)的CGRP神经元(CGRPPBel)投射至中央杏仁核外侧亚区(CeAl)]中验证了CybSEP2的检测效能。首先通过微型单线态氧发生器(miniSOG)电镜定位技术证实,腺相关病毒(AAV)递送的CybSEP能特异性富集于CGRPPBel→CeAl突触前末端的LDCV(而非SV)内。随后通过向CalcaCre/+小鼠(CGRP阳性神经元中特异性表达Cre酶)臂旁核双侧注射AAVDJ-DIO-CybSEP2或AAVDJ-DIO-CybGam,荧光成像证实传感器能特异性表达在PBel神经元胞体及投射至CeAl的轴突中。利用高速荧光成像系统观察脑切片发现,电刺激CeAl内CGRPPBel轴突末端可诱发CybSEP2荧光呈频率依赖性增强(100 Hz时达峰值),该响应可被EGTA完全消除,而CybGam荧光无明显变化。动力学分析显示,50和100 Hz刺激下荧光ton快于toff,重复刺激(20分钟内4次,间隔5分钟)未导致信号耗竭,且不同脉冲数的电刺激均能引起CybSEP2荧光增强,表明CybSEP2可稳定监测LDCV释放。值得注意的是,CGRPPBel神经元胞体及树突附近也检测到显著荧光,提示PBel内存在功能性神经肽信号传导。另外,通过共表达TetTox抑制囊泡融合后,100 Hz刺激诱发的荧光变化显著减弱,而对照组荧光无明显差异,进一步证实该信号源自钙依赖的LDCV释放过程。以上结果表明,CybSEP2能够可靠用于急性脑切片中突触前LDCV释放的实时监测。
图3. 脑切片中LDCV的释放成像
图4. PBel脑切片中CybSEP-miniSOG与CybGam的表达及CybSEP2的响应
3、行为小鼠突触前LDCV和SV释放的监测
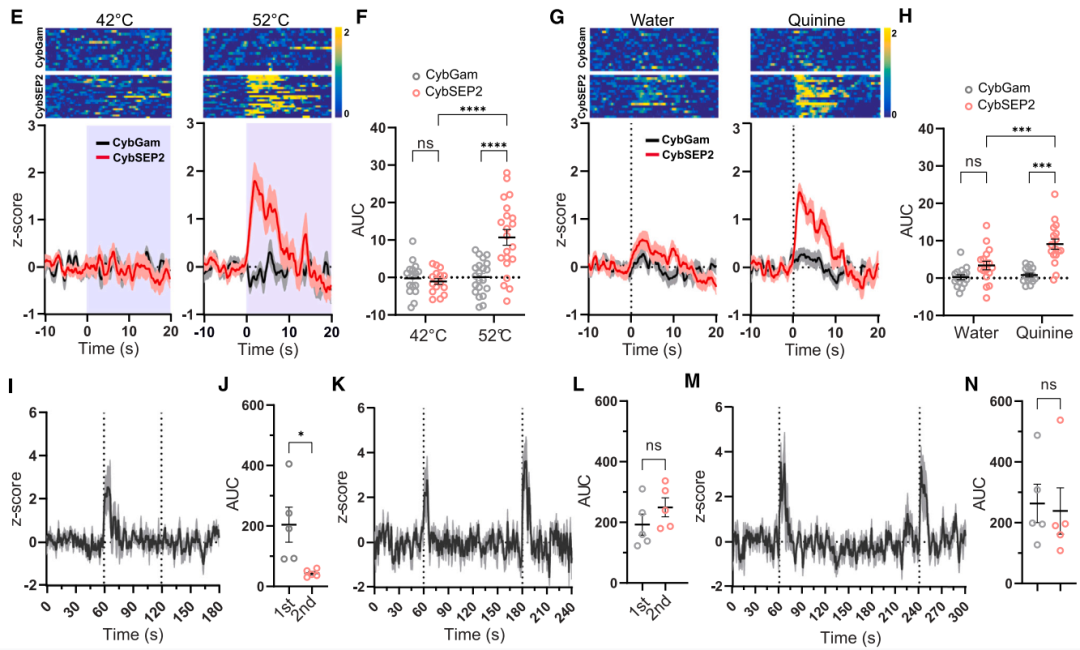
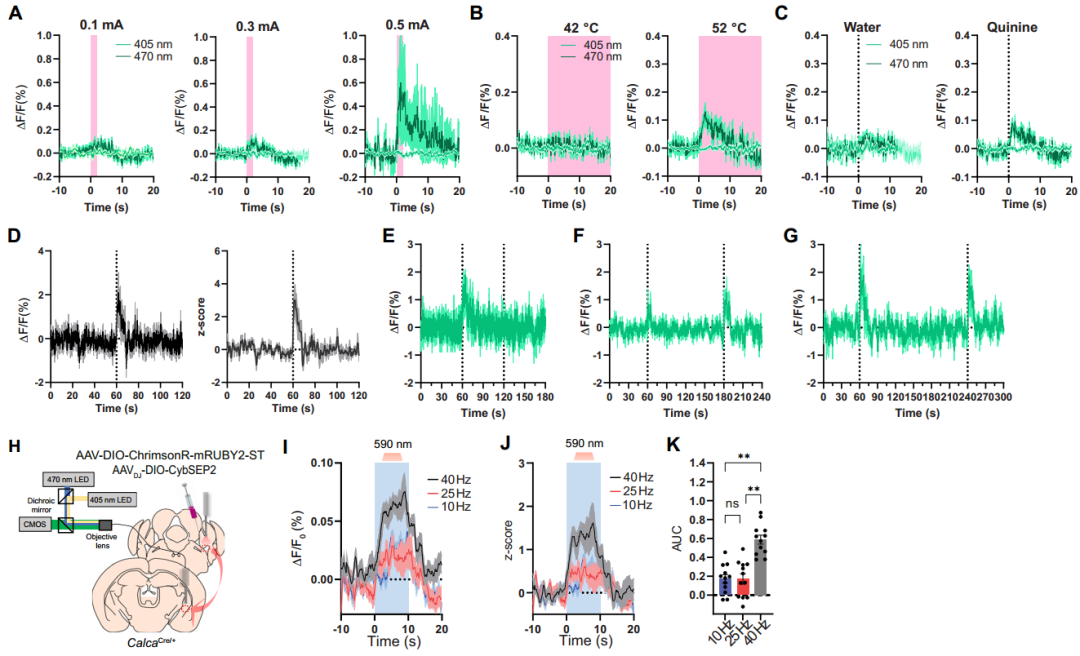
在行为学水平研究中,鉴于CGRPPBel在巴甫洛夫威胁条件反射中可被非条件刺激(US,如足底电击)激活,研究者通过向CalcaCre/+小鼠PBel注射AAVDJ-DIO-CybSEP2或对照病毒,并在CeAl上方植入光纤,同时采用互补金属氧化物半导体(CMOS)光纤光度系统(交替照明模式)监测发现:足底电击、52℃热刺激及苦味剂奎宁等厌恶刺激均可特异性触发CybSEP2荧光骤升,而对照组无变化;双尾夹刺激实验结果表明,间隔2-3分钟的重复刺激可诱发CybSEP2信号叠加,而1分钟内重复刺激无反应,提示神经肽释放后存在约1分钟的补充窗口期。光遗传激活实验进一步证实,CybSEP2可实时捕捉LDCV释放动态。以上结果表明,厌恶感觉刺激可促使CGRPPBel→CeAl末端释放LDCV。
鉴于该神经元能同时表达囊泡型谷氨酸转运体2(Vglut2),并与CeAl神经元形成谷氨酸能突触连接,为探究其在厌恶刺激下的谷氨酸能传递,团队同步开发了SV传感器SypSEP。监测结果显示,10 Hz电刺激可增强CGRPPBel→CeAl末端的SypSEP荧光,高频刺激(>10 Hz)则抑制荧光信号;厌恶刺激下SypSEP荧光不升反降,而高营养摄入可显著增强其荧光信号,与CybSEP2的响应模式形成鲜明对比。这一结果证实,基于SEP的LDCV或SV释放传感器能够独立检测自由活动小鼠突触前末端的肽能和谷氨酸能传递,且厌恶刺激特异性激活CGRPPBel→CeAl通路中的肽能传递而非谷氨酸能传递。
图5. 行为小鼠突触末端LDCV释放的监测
图6. 自由活动小鼠体内LDCV或SV的释放的监测
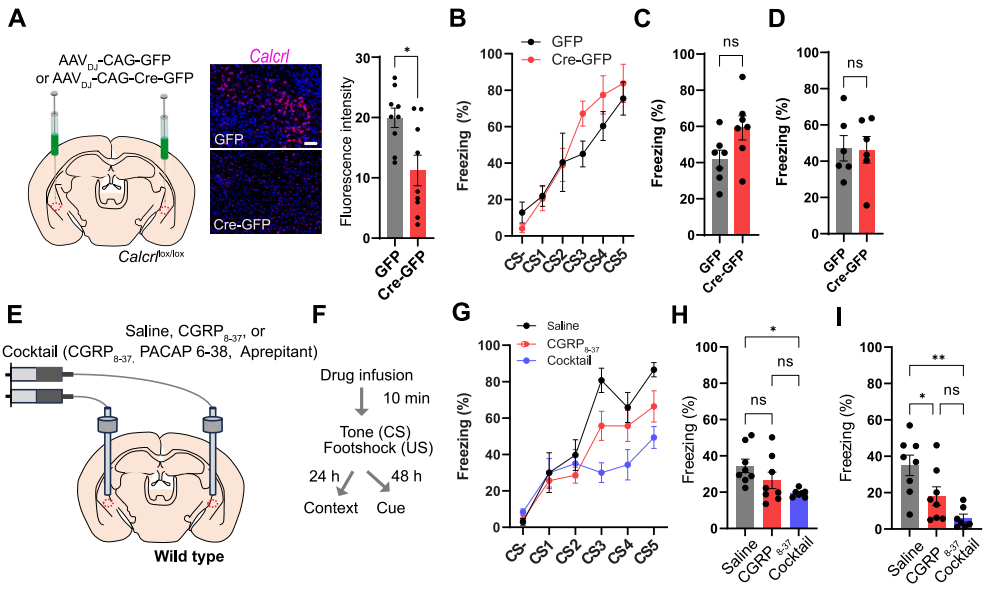
4、抑制肽能传递可减弱威胁学习
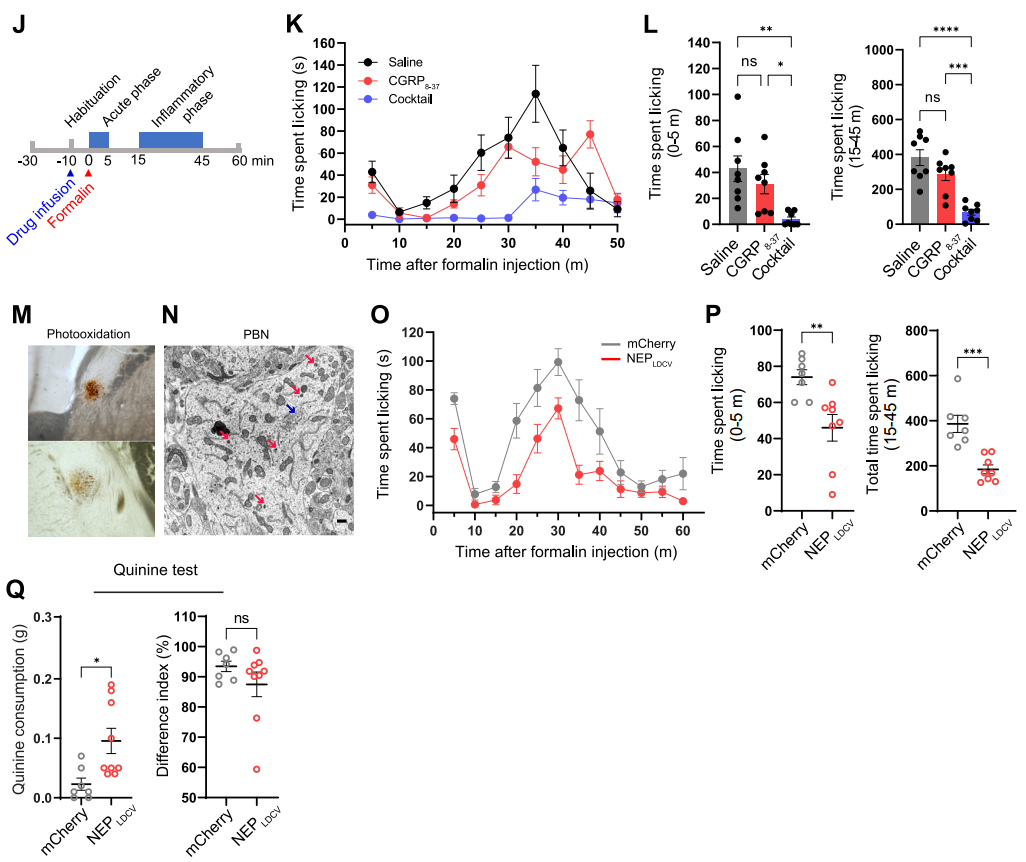
在上述威胁学习机制研究中,团队已证实CGRPPBel→CeAl通路的神经肽释放是传递厌恶刺激的关键。为进一步探究厌恶感觉传递依赖单一神经肽还是多种神经肽协同作用,团队开展了以下实验:通过向Calcrllox/lox小鼠(Calcrl两侧带有loxP位点的条件性基因敲除小鼠)CeA注射AAVDJ-CAG-Cre-GFP(或对照AAVDJ-CAG-GFP)病毒条件性敲除CeA中编码CGRP受体的Calcrl基因,团队发现单一CGRP信号缺失不影响威胁学习中的僵直行为,而通过药理学方法联合阻断CGRP、垂体腺苷酸环化酶激活多肽(PACAP)和P物质可显著降低情境与线索诱发的僵直反应,并缓解福尔马林诱导的疼痛行为,提示多种神经肽协同介导厌恶信号传递。
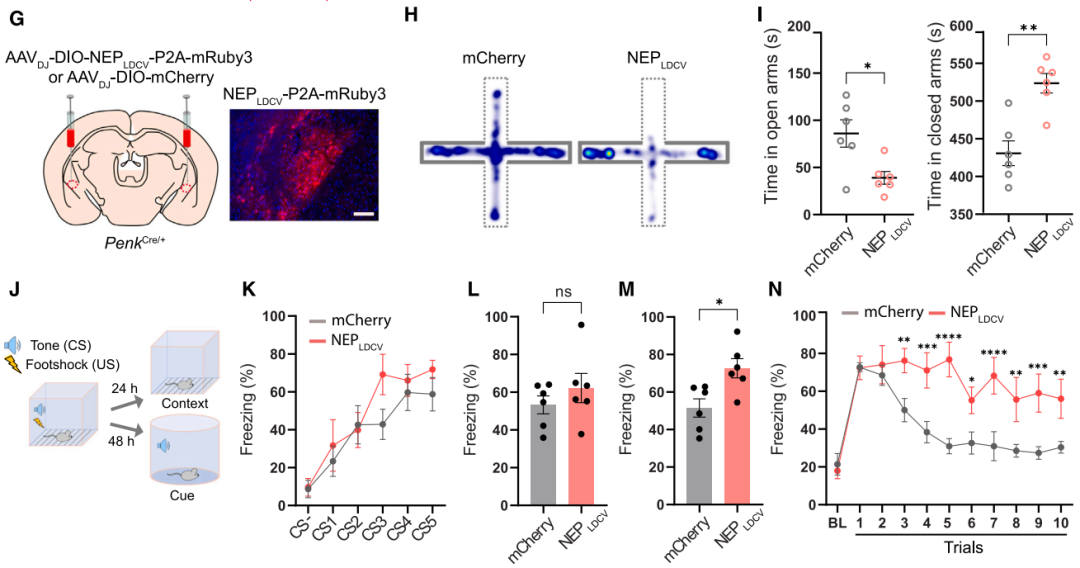
基于此,团队设计了靶向LDCV腔内侧的肽酶工具NEPLDCV以选择性降解神经肽。将前阿片促黑素皮质素原(POMC,能被包装入LDCV的神经肽前体蛋白)的LDCV靶向信号肽整合至NEP(细胞表面跨膜蛋白酶,可切割含疏水氨基酸的多种神经肽)中,使其选择性转位至LDCV腔面,电镜证实其可特异性定位于LDCV,免疫荧光染色显示其能高效降解CGRP。为探究CGRPPBel神经肽缺失对CGRPPBel→CeAl突触肽能传递的影响,团队在CalcaCre/+小鼠PBel共注射AAVDJ-DIO-ChR2-EYFP与AAVDJ-DIO-NEPLDCV-P2A-mRuby3(或对照病毒AAVDJ-DIO-mCherry)。在mCherry/mRuby3标记的CeAl神经元中记录光遗传诱发的兴奋性突触后电流(oEPSCs)和电位(oEPSPs),验证NEPLDCV对肽能传递的选择性抑制作用。通过同一神经元的oEPSCs监测谷氨酸能传递,通过40 Hz脉冲串刺激诱发的持续膜电位变化(肽能传递特征性反应)评估肽能传递。结果显示,与对照组相比,NEPLDCV不影响谷氨酸能传递的oEPSCs,但显著减弱40 Hz刺激诱发的肽能传递相关oEPSPs。表明NEPLDCV可选择性沉默肽能传递而不干扰谷氨酸能传递。行为学研究表明,与对照组相比,NEPLDCV表达小鼠在听觉威胁条件反射中僵直反应显著降低,对情境和听觉线索诱发的僵直行为表现出显著抑制,福尔马林诱导的舔舐行为减少、苦味剂奎宁摄入量增加,证实NEPLDCV能够通过消除神经肽信号,显著削弱动物对厌恶刺激的感知。
图7. NEPLDCV降低神经肽释放并减弱威胁学习
图8. CGRPPBel→CeAl中多种神经肽(非单一CGRP)参与威胁学习及情感性疼痛感知
5、谷氨酸能传递不参与威胁学习
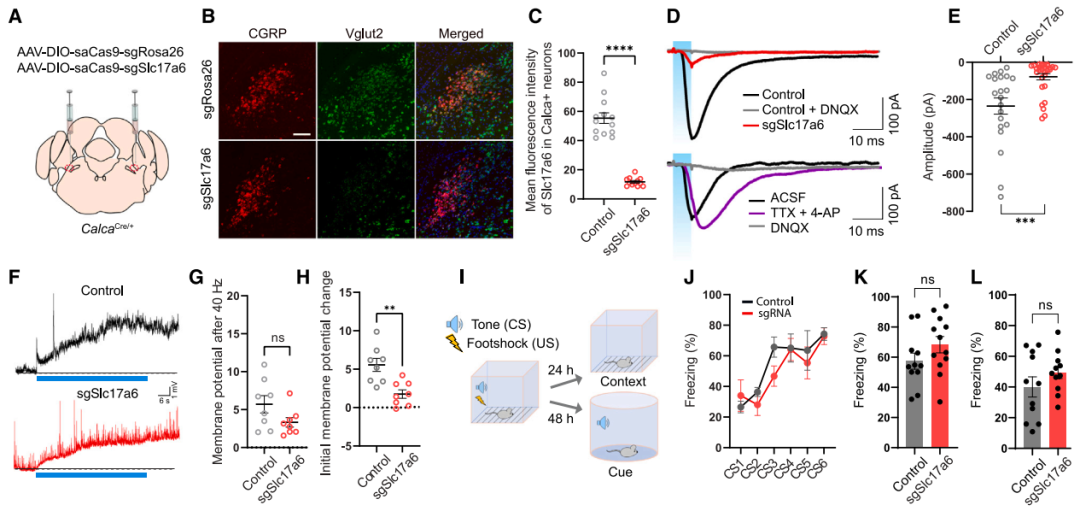
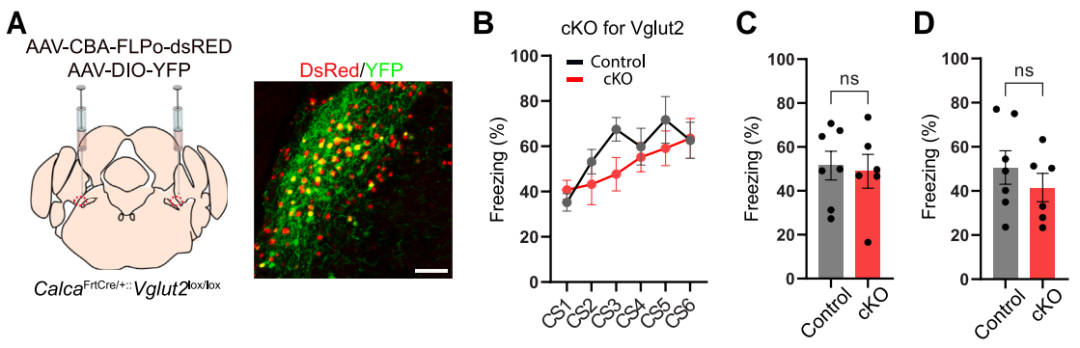
在威胁学习机制研究中,鉴于厌恶刺激未增强CGRPPBel→CeAl末端的SypSEP荧光,研究团队进一步探究了其中谷氨酸能传递的作用。已知PBel中Vglut2是主要的谷氨酸转运体,团队通过Cre依赖性AAV介导的CRISPR-saCas9系统,在CalcaCre/+小鼠的CGRPPBel中特异性敲除谷氨酸转运体基因Slc17a6(编码Vglut2),从而阻断谷氨酸能传递。电生理实验显示:与对照组相比,sgSlc17a6处理组的oEPSC幅值显著降低,在河豚毒素(TTX,阻断动作电位传导)+4-氨基吡啶(4-AP,增强突触释放)存在下,该反应仍可被检测到,证实其由单突触谷氨酸能传递介导;sgSlc17a6处理组的oEPSC平均幅值较对照组降低78.3%(70%神经元无响应,30%幅值减弱)说明敲除效率高且细胞间敲除效率存在异质性;40 Hz高频刺激诱发的oEPSPs总体无变化,但初始幅值减弱,提示谷氨酸能传递的快速成分被抑制,而肽能传递的长时程效应仍保留(神经肽作用时程较谷氨酸更持久)。行为学实验表明,Slc17a6敲除组与对照组在威胁条件反射中的僵直行为及情境/线索记忆测试结果无显著差异。团队还通过杂交制备Slc17a6条件性敲除(cKO)小鼠,验证了降低CGRPPBel谷氨酸释放不影响威胁学习。以上结果再次证实CGRPPBel→CeAl通路中神经肽是传递厌恶刺激的关键调质,而谷氨酸能传递不参与威胁学习过程。
图9. 减弱CGRPPBel中谷氨酸能传递不影响巴甫洛夫威胁条件反射
6、行为小鼠内源性阿片肽释放的监测
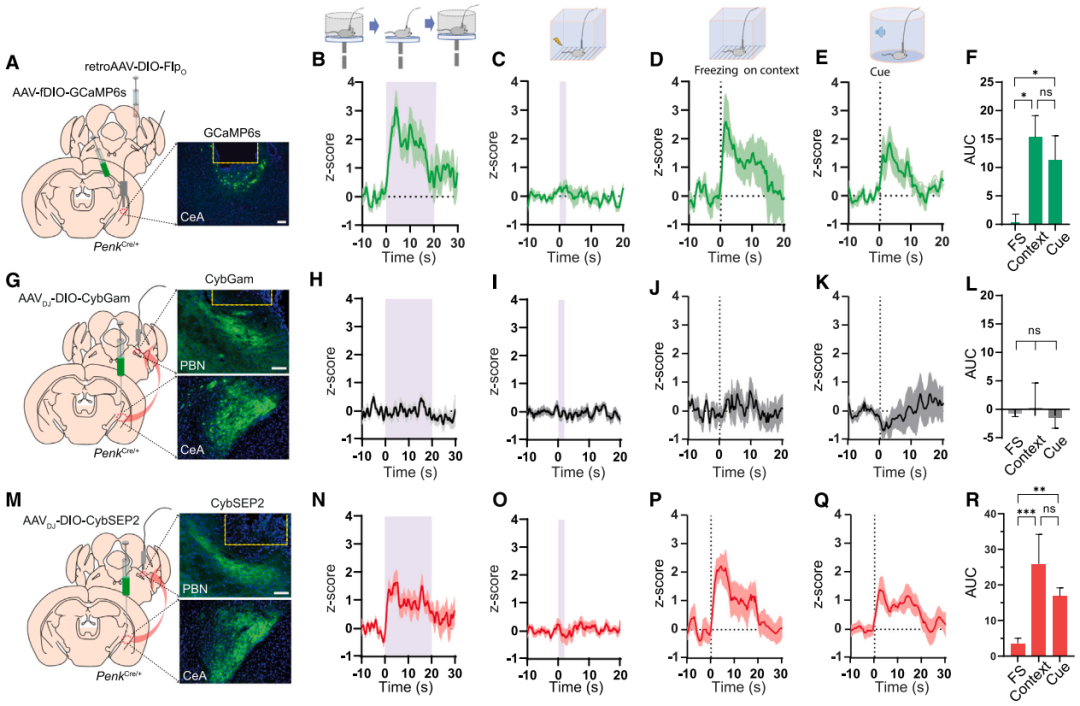
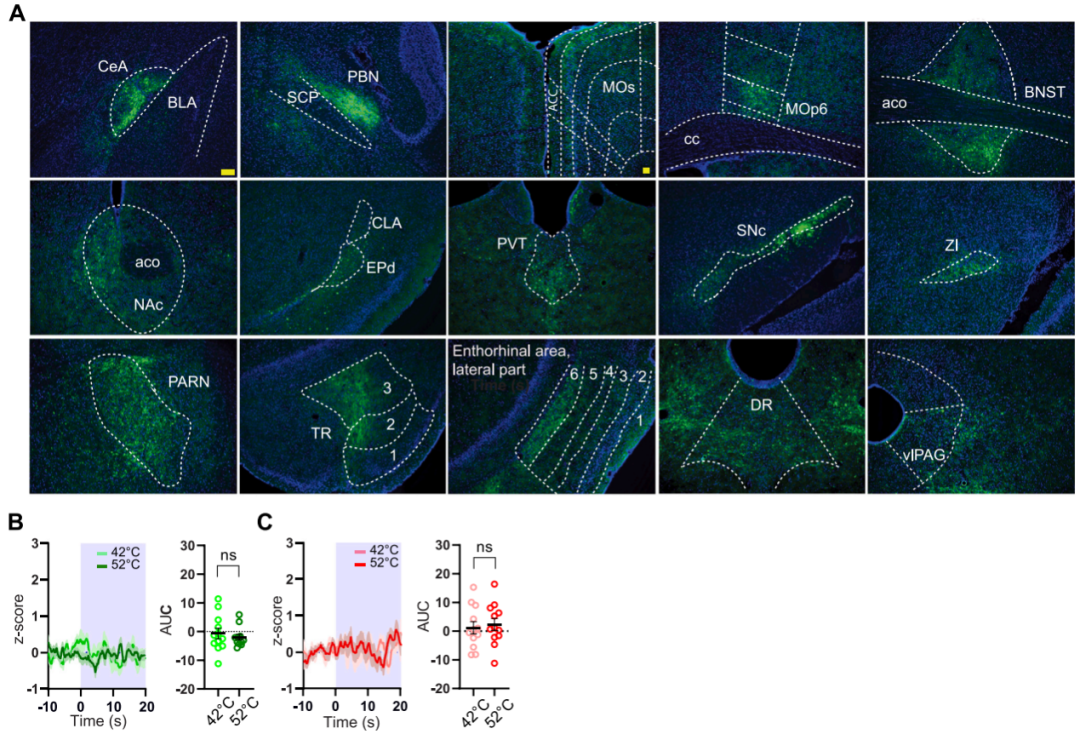
在证实CybSEP2可监测CGRPPBel→CeAl通路LDCV释放后,研究团队进一步将其应用于脑啡肽(内源性阿片肽之一,μ阿片受体(MOR)的内源性配体)能神经环路以验证其通用性。团队选择中央杏仁核脑啡肽能神经元(ENKCeAl)为研究对象,因其投射至外侧臂旁核(PBL)等情绪相关脑区。通过逆行病毒标记与光纤钙成像结合的方法,团队发现在高架平台测试中移除平台围壁诱发的恐高刺激可激活ENKCeAl→PBL神经元钙信号,恢复围壁后信号回落,提示该环路参与杏仁核对恐高相关信息的处理。有趣的是,ENKCeAl→PBL神经元的钙信号对足底电击(0.3 mA,2 s)或伤害性热刺激无显著响应,但在24小时记忆测试中被听觉(73 dB纯音)和情境线索强烈激活,表明ENKCeAl→PBL神经元特异性参与厌恶记忆提取,而非直接响应伤害性刺激。为在上述相同条件下监测肽能传递,团队向PenkCre/+小鼠(ENK阳性神经元中特异性表达Cre酶)CeAl单侧注射AAVDJ-DIO-CybSEP2(或对照病毒CybGam)并于PBL植入光纤。CMOS光纤光度记录显示,ENKCeAl→PBL神经元末端荧光强度在恐高情境和威胁条件反应下显著增强,但对伤害性刺激无响应,对照组无变化。以上结果证实,CybSEP2在清醒行为小鼠中可特异性监测内源性阿片肽释放,且ENKCeAl→PBL神经元的LDCV释放特异性参与厌恶刺激(如威胁条件反应和恐高情境)的信号传递。
图10. 行为小鼠中ENKCeAl→PBL末端内源性阿片肽释放的监测
图11. PenkCre/+小鼠中ENKCeAl神经元的投射及其对热刺激的活动响应
7、ENKCeAl神经元中的神经肽抑制负面情绪
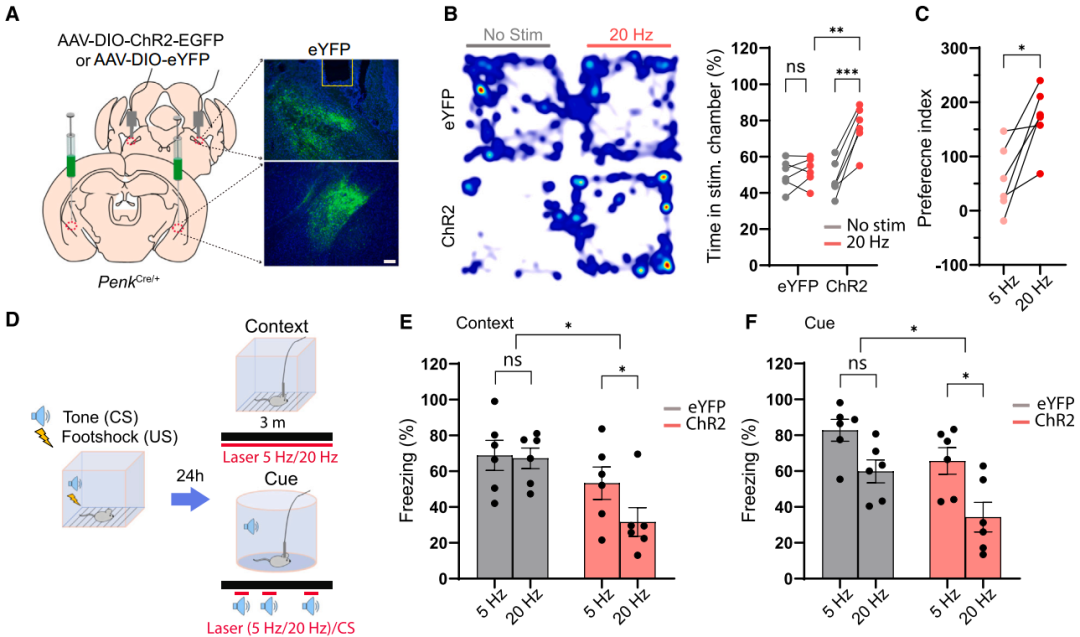
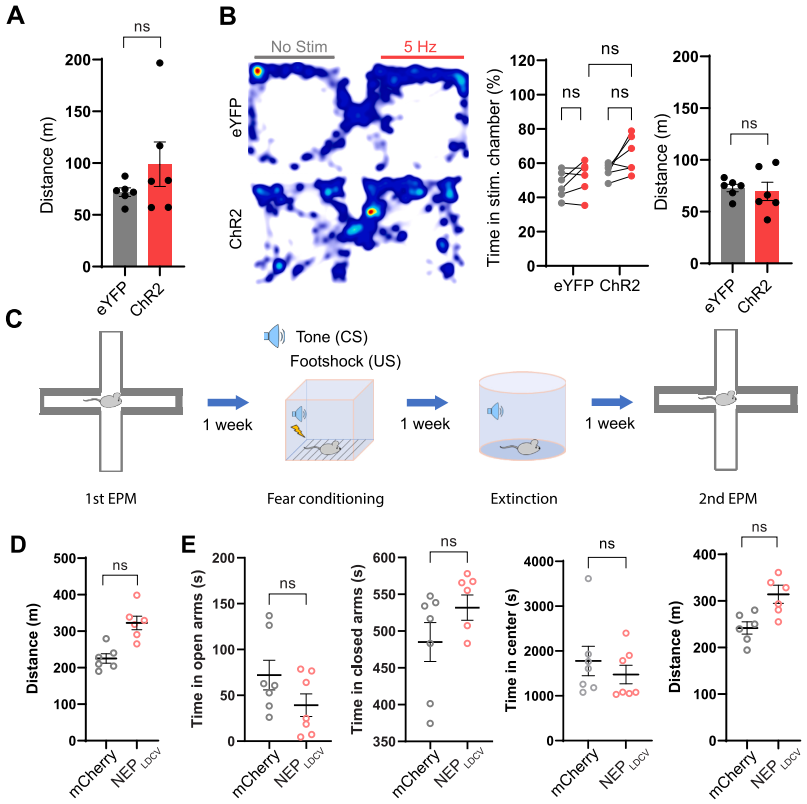
为进一步探究ENKCeAl神经元释放的神经肽对负面情绪的调控作用,研究人员在ENKCeAl神经元表达ChR2的PenkCre/+小鼠PBL区植入光纤,对ENKCeAl→PBL末端进行光遗传刺激,发现20 Hz刺激(而非 5 Hz)可诱导小鼠对光刺激配对箱室产生位置偏好,并抑制威胁条件化小鼠由情境和听觉条件刺激(CS)诱发的僵直行为。进一步向PenkCre/+小鼠CeAl区双侧注射NEPLDCV AAV以抑制神经肽释放后,威胁条件化测试前的高架十字迷宫(EPM)测试显示NEPLDCV组开放臂停留时间略减但与对照组相比无显著差异,而威胁条件化测试后其开放臂时间较对照组显著减少、封闭臂时间增加。且威胁条件化测试中,NEPLDCV组小鼠线索提取阶段僵直水平及威胁消退阶段僵直反应均显著高于对照组。这些结果表明ENKCeAl神经元在厌恶条件下释放的神经肽可抑制负面情绪。
图12. ENKCeAl→PBL末端的光遗传刺激介导正性效价并抑制条件性威胁反应
图13. ENKCeAl→PBL末端的光遗传刺激及NEPLDCV介导的神经肽释放抑制
总结
该研究开发的CybSEP2传感器与NEPLDCV沉默器为神经肽研究提供了突破性方案。现有基于GPCR的神经肽传感器存在无法定位释放位点、受体未鉴定及干扰内源性信号等局限,而CybSEP2可精准定位神经肽释放位点,通过神经肽特异性Cre驱动鼠系靶向LDCV实现多神经肽通用监测,且不干扰内源性肽能信号。配套开发的NEPLDCV通过靶向LDCV腔面的NEP酶,特异性降解LDCV内多种神经肽而不影响谷氨酸能快速传递,解决了单一神经肽基因敲除的补偿效应问题。功能研究发现,CGRPPBel→CeAl通路中神经肽而非谷氨酸介导厌恶刺激传递,ENKCeAl→PBL环路的神经肽释放可抑制负面情绪维持稳态。
研究同时指出了技术的局限性:pHluorin荧光蛋白可被mNeonGreen等新型蛋白优化以提升信噪比;CybSEP2无法区分共包装的具体神经肽种类,需与突触后传感器联用;NEPLDCV对多神经肽的降解机制及降解神经肽产生的小肽片段效应需进一步探究。该工作为解析肽能传递在情绪编码中的作用提供了关键工具,推动神经肽研究从快速突触传递的附属角色转向独立调控机制的深入探索。
总结图
我司提供的部分LDCV传感器和LDCV沉默器病毒产品,列表如下:


详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK