2025-06-16 阅读量:681
心肌纤维化的特征是心肌细胞外基质(ECM)蛋白的过度积聚和成分紊乱。它发生在多种心脏疾病中,并直接与心功能障碍和心律失常相关。心肌成纤维细胞(CFs)的活化及其向活性肌成纤维细胞的转化,是ECM过度产生和沉积的原因,这是病理性纤维化发生和发展的关键事件。探索有效的分子靶点以改善心脏病患者的心肌纤维化至关重要。
泛素化(Ubiquitination)作为一种蛋白翻译后修饰,对于维持和调节细胞稳态不可或缺,并在心血管疾病的病理生理过程中发挥着关键作用。E3连接酶(E3 ligases)作为对接蛋白,通过结合靶蛋白赋予泛素化特异性,随后这些靶蛋白被蛋白酶体降解。研究表明,E3连接酶在调控细胞增殖、分化和凋亡中发挥关键作用,因而与多种心脏疾病相关。
核斑点型POZ蛋白(Speckle-type POZ protein,SPOP)作为基于cullin 3的E3泛素连接酶复合物的底物衔接蛋白,通过特异性识别底物以实现其泛素化和蛋白酶体降解,在多种细胞过程中发挥关键作用。研究显示,SPOP选择性结合靶蛋白的底物结合共识(substrate-binding consensus,SBC)基序,促进底物蛋白的泛素化及随后的降解。值得注意的是,SPOP在扩张型心肌病患者中被证明存在显著上调。这可能暗示了SPOP在心脏疾病中的潜在功能。
激活的蛋白激酶C受体1(Receptor for activated C-kinase 1,RACK1)是WD40重复蛋白家族成员,通过与其他蛋白相互作用参与多种生物和病理过程。据报道,RACK1与Smad3的相互作用在肾小管上皮细胞和人肾小球系膜细胞中对I型胶原转录具有抑制作用,并在神经干细胞中激活转化生长因子-β(TGF-β)/Smad信号通路。
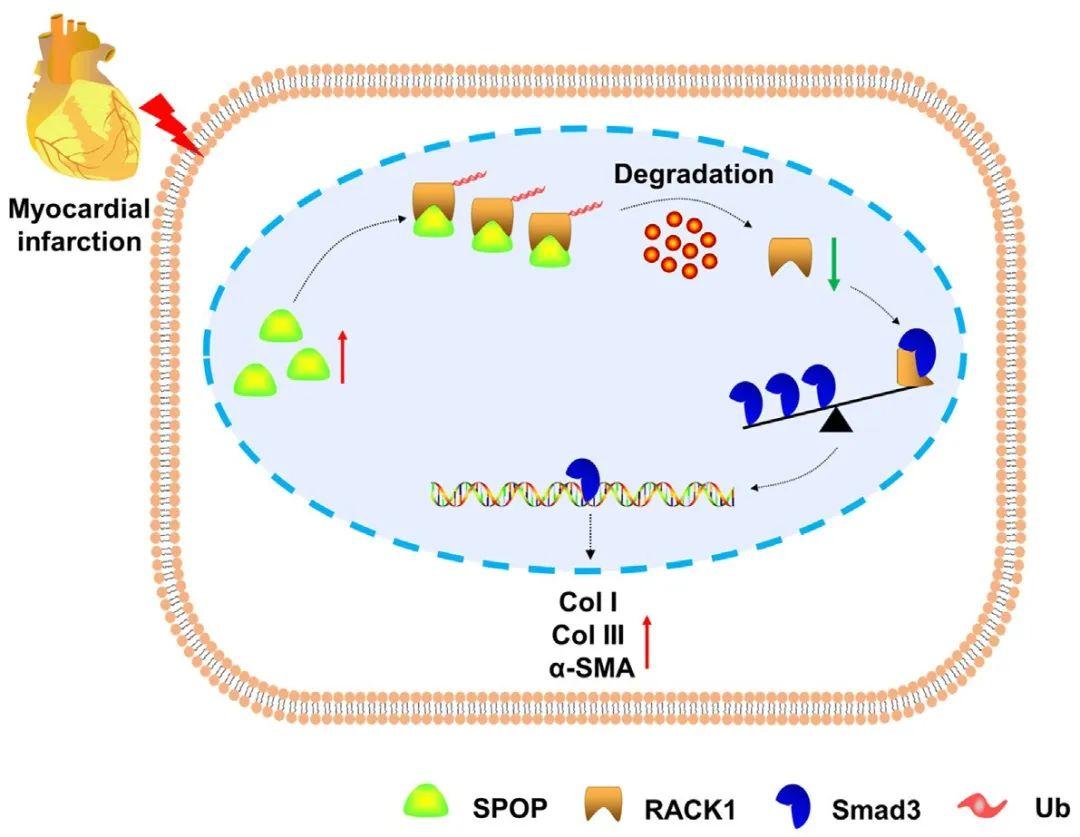
近期,哈尔滨医科大学吕延杰/潘振伟教授与上海工程技术大学单宏丽教授团队合作,联合在Cell Chemical Biology发表题为“Substrate-dependent interaction of SPOP and RACK1 aggravates cardiac fibrosis following myocardial infarction”的研究论文,在本研究中,作者证明了SPOP通过与RACK1相互作用并促进其泛素化和降解,从而促进CFs增殖、胶原蛋白产生和心肌纤维化。RACK1在心肌中作为SPOP的一种纤维化相关底物,其降解反过来导致由Smad3通路介导的CFs活化。综上所述,本研究表明,SPOP和RACK1作为治疗靶点,在干预纤维化相关心脏病的发展方面具有巨大潜力。

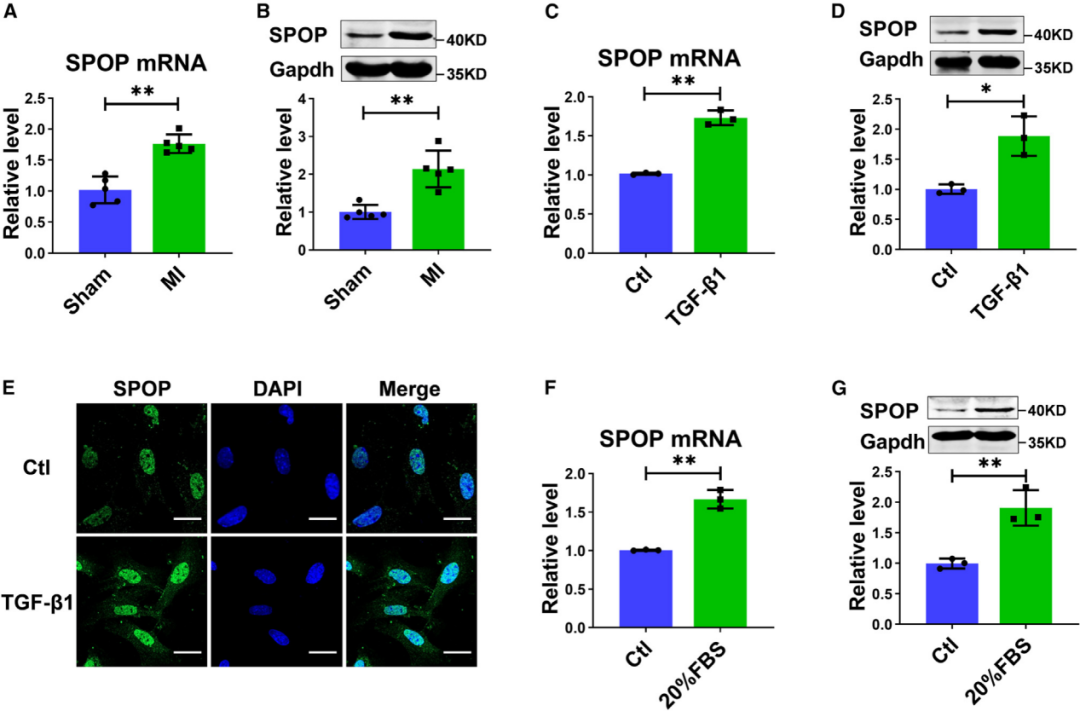
1.心肌纤维化组织和成纤维细胞中SPOP的表达
为阐明SPOP在心肌纤维化中的作用,研究人员分别在体内和体外检测了其在纤维化刺激下的表达变化。与假手术组相比,左前降支冠状动脉(LAD)结扎4周后的心肌梗死(MI)心脏梗死边缘区中,SPOP在mRNA和蛋白水平上的表达均增加。与此一致的是,在用TGF-β1(20 ng/mL)处理24小时的培养CFs中,SPOP在mRNA和蛋白水平上的表达也上调。此外,免疫荧光染色显示,无论在对照组还是TGF-β1处理条件下,SPOP主要分布在成纤维细胞的细胞核中。而且,20%胎牛血清(FBS)处理也增加了CFs中SPOP的表达。
图1.MI小鼠心肌纤维化组织和TGF-β1或20%血清处理的CFs中SPOP表达增加
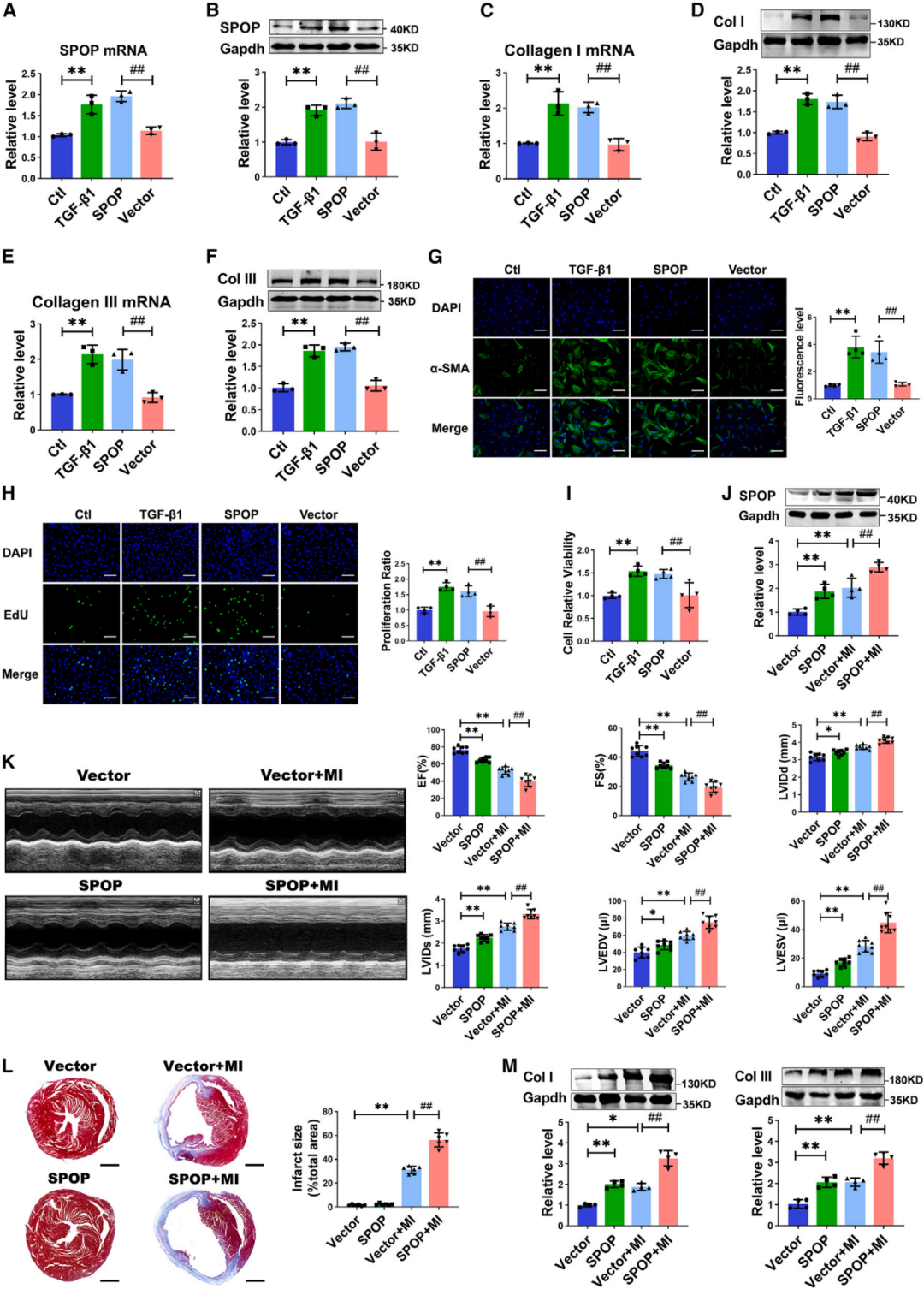
2.SPOP过表达促进CFs活化和心肌纤维化
为确定SPOP对CFs的影响,研究者在培养的CFs中转染SPOP过表达质粒,以观察胶原产生和细胞增殖情况。通过qRT-PCR和Western blot检测验证了SPOP过表达的效率。结果显示,SPOP的过表达显著增加了CFs中I型胶原(Col I)和III型胶原(Col III)的mRNA和蛋白水平,其效果与TGF-β1处理类似。SPOP过表达显著促进了α-平滑肌肌动蛋白(α-SMA)的表达,这是CFs活化[成纤维细胞向肌成纤维细胞转化(FMT)]的标志物。此外,通过EdU染色和MTT法检测发现,SPOP过表达促进了CFs增殖和细胞活力。这些数据表明,SPOP的上调激活了CFs,促进了胶原蛋白的产生和CFs增殖。
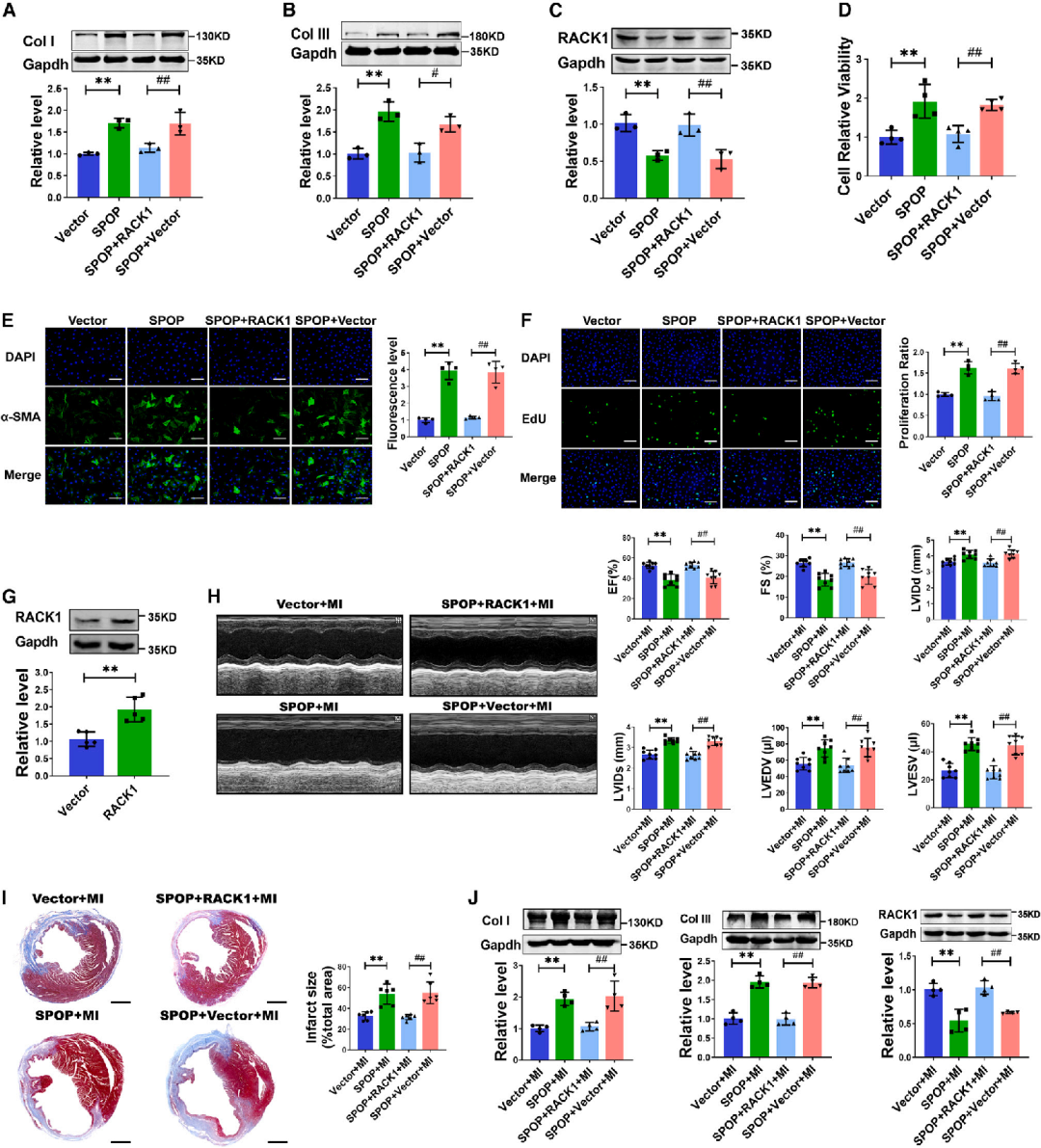
接着,研究人员在小鼠MI模型中验证SPOP对心肌纤维化的影响。小鼠予以尾静脉注射携带SPOP过表达质粒的慢病毒载体。注射慢病毒两周后,结扎LAD,并于四周后评估间质纤维化。结果显示,MI小鼠心肌中SPOP的蛋白水平显著升高,而过表达SPOP则使其进一步上调。值得注意的是,SPOP过表达加重了MI小鼠的心功能障碍,表现为射血分数(EF)和缩短分数(FS)进一步降低,以及左心室舒张末期内径(LVIDd)、左心室收缩末期内径(LVIDs)、左心室舒张末期容积(LVEDV)和左心室收缩末期容积(LVESV)增加。Masson三色染色显示,SPOP过表达加重了MI后的间质纤维化并增加了梗死面积。此外,SPOP过表达显著增加了Col I和Col III的蛋白水平。
图2.过表达SPOP对心肌纤维化的影响
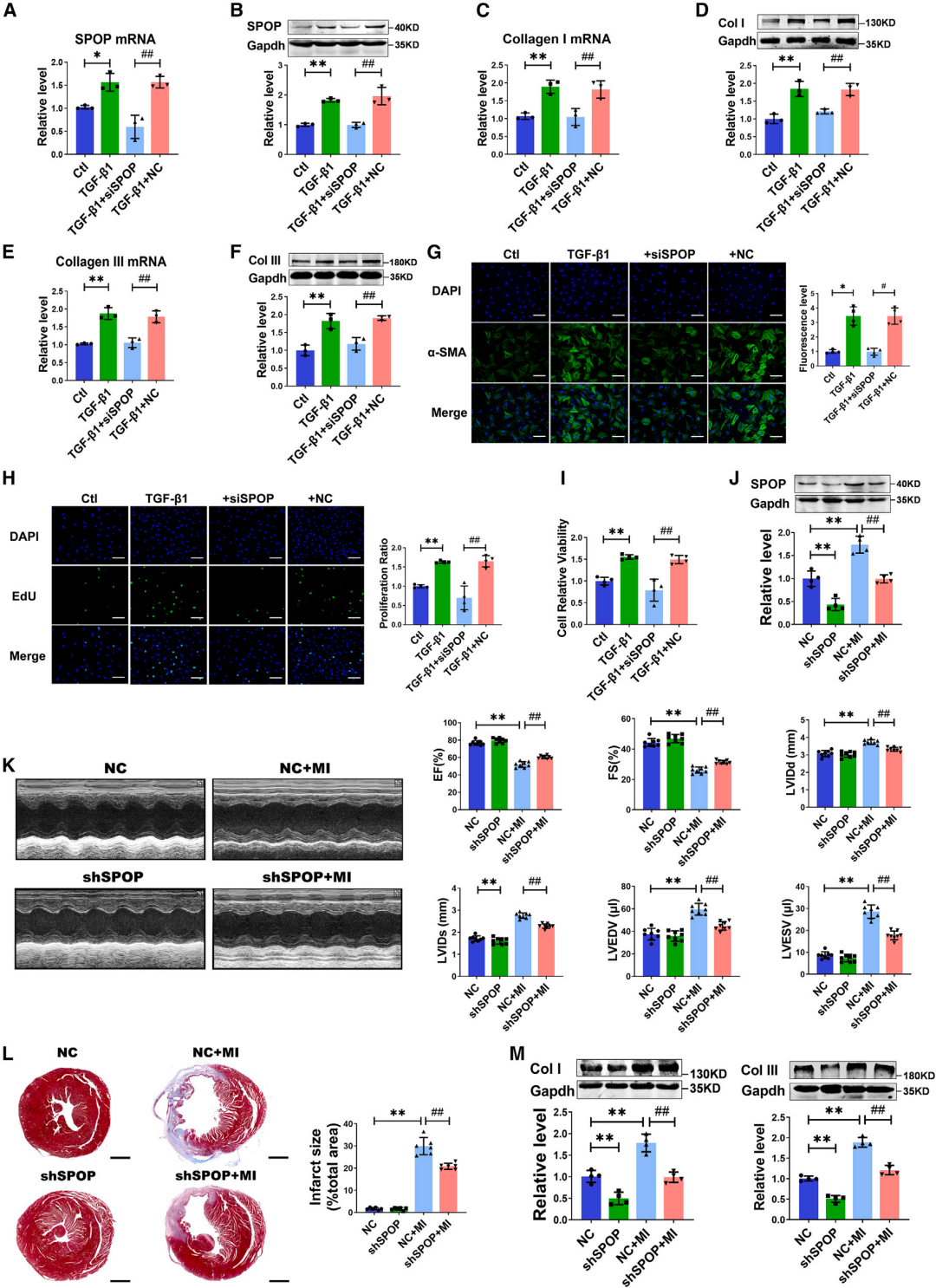
3.SPOP缺失减轻细胞活化和心肌纤维化
为进一步确认SPOP在CFs中的作用,研究者使用其两条siRNA(siRNA-1和siRNA-2)进行了SPOP功能缺失实验。siRNA-1和siRNA-2均在蛋白水平上显著降低了SPOP的表达。与SPOP过表达促进胶原表达的作用相反,siRNA敲低内源性SPOP抑制了CFs中Col I和Col III的表达。沉默SPOP显著抑制了TGF-β1在CFs中诱导的SPOP、Col I和Col III表达的增加。TGF-β1诱导的α-SMA表达、细胞增殖和细胞活力也因SPOP敲低而受到抑制。
接下来,作者探索了通过慢病毒携带的SPOP-shRNA敲低SPOP对MI小鼠心肌纤维化的影响。结果显示,给予SPOP-shRNA的小鼠心肌中SPOP蛋白表达被有效降低。超声心动图检查显示,SPOP缺失显著改善了MI后小鼠的心功能,表现为EF和FS增加,同时LVIDd、LVIDs、LVEDV和LVESV也得到改善。重要的是,Masson三色染色证明,敲低SPOP减少了MI心脏的胶原沉积和梗死面积。在SPOP-shRNA处理组中也观察到Col I和Col III蛋白水平的降低。
图3.抑制SPOP对心肌纤维化的影响
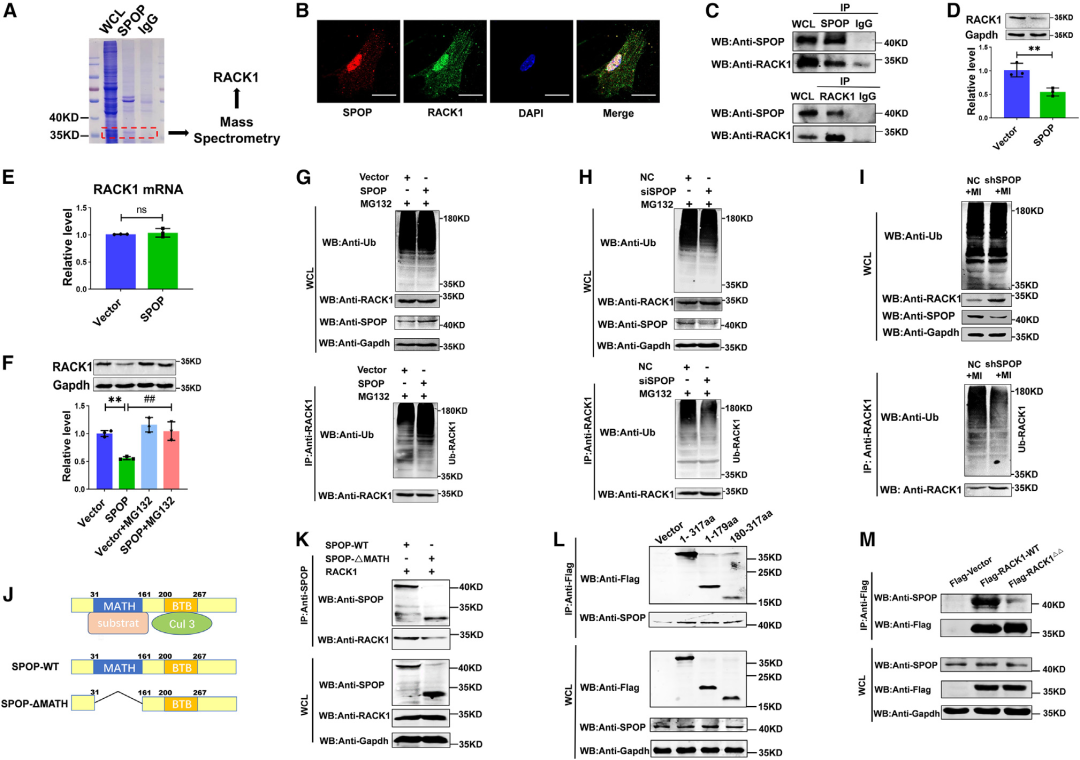
4.SPOP结合RACK1的SBC基序以促进其在CFs中的降解
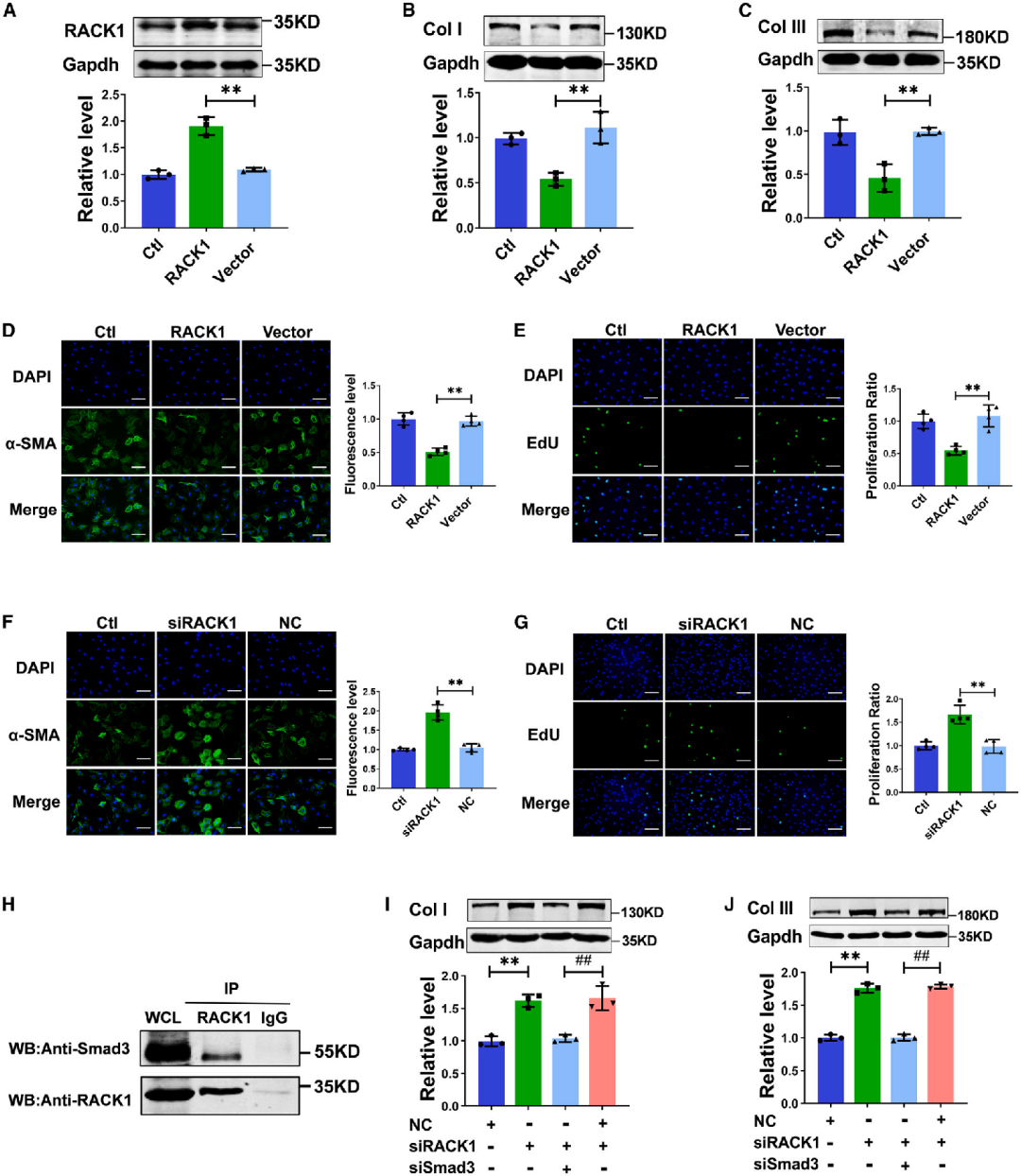
SPOP是识别底物的衔接蛋白,负责靶向底物并启动其泛素化及随后的蛋白酶体降解过程。为鉴定与SPOP相互作用的靶蛋白,研究人员在CFs中使用抗SPOP抗体进行免疫共沉淀(Co-IP),并通过质谱(MS)分析与SPOP结合的蛋白。考马斯亮蓝染色结果显示,IP组(SPOP组)中,分子量约为35 kD处呈现高强度条带,而该条带在IgG组中几乎检测不到。在308个沉淀蛋白中,RACK1因其亚细胞定位、生物学功能以及与SPOP的相互作用能力引起了作者注意。研究人员随后证实RACK1与SPOP在CFs的核仁中共定位,并能被SPOP抗体特异性沉淀,反之亦然。重要的是,RACK1拥有SPOP的结合位点[富含丝氨酸/苏氨酸(S/T)的基序],这对于其作为SPOP的底物进行后续泛素化至关重要。据报道,RACK1在肾小管上皮细胞和人肾小球系膜细胞中对Smad介导的Col I转录具有负向作用,并在神经干细胞中激活TGF-β/Smad信号通路。基于上述原因,RACK1被选为后续实验中SPOP的候选底物。
值得注意的是,过表达SPOP显著降低了CFs中RACK1的蛋白水平,但在mRNA水平未发现明显变化。泛素-蛋白酶体抑制剂MG132(5 μM,处理8小时)阻止了由SPOP过表达引起的RACK1蛋白水平下降。MG132处理的CFs中CO-IP实验(高分子量拖尾是泛素化蛋白的典型阳性信号)显示,SPOP过表达促进了RACK1的泛素化并下调其蛋白水平,而SPOP siRNA则抑制了RACK1的泛素化并上调了其蛋白水平。此外,SPOP缺失也抑制了MI小鼠心肌组织中RACK1的泛素化。这些结果表明SPOP能够与RACK1相互作用并促进其泛素化和降解。
SPOP包含两个结合结构域:位于N末端的底物结合结构域Meprin和TRAF同源(MATH)结构域,以及位于C末端的CUL3/Cullin3结合结构域Bric-a-brac/Tramtrack/Broad(BTB)结构域。为确定SPOP在RACK1上的结合结构域,作者构建了SPOP的MATH结构域缺失突变体(SPOP-ΔMATH)。293T细胞中Co-IP实验表明,全长SPOP(SPOP-WT)成功沉淀了RACK1,而SPOP-ΔMATH突变体则未能沉淀,表明SPOP通过其MATH结构域与RACK1结合。
富含S/T的基序存在于大量SPOP结合蛋白中,这对于底物与SPOP的结合尤为重要。SPOP的SBC基序(φ-π-S/T-S/T-S/T或π-φ-S/T-S/T-S/T,其中φ代表非极性残基,π代表极性残基)在已知的SPOP底物中已得到充分表征。据此,研究者分析了RACK1的氨基酸序列,发现了两个富含S/T的结合基序:94TGTTT98基序(第一个氨基酸T是苏氨酸,一种极性残基;第二个氨基酸G是甘氨酸,一种非极性残基)和275ISTSS279基序(第一个氨基酸I是异亮氨酸,一种非极性残基;第二个氨基酸S是丝氨酸,一种极性残基)作为潜在的SBC基序。为揭示这些区域对于SPOP识别RACK1是否不可或缺,作者构建了RACK1片段1(包含94TGTTT98基序的RACK1序列第1-179位氨基酸)、RACK1片段2(包含275ISTSS279基序的RACK1序列第180-317位氨基酸)以及两个富含S/T基序序列发生突变的RACK1突变体(Flag-RACK1△△),该突变体将SBC基序突变为丙氨酸A(94AAAAA98基序和275AAAAA279基序)。Co-IP数据显示,RACK1片段1(1-179aa)和片段2(180-317aa)在293T细胞中均能成功沉淀SPOP,而RACK1△△(RACK1 SBC丙氨酸A突变体)则失去了沉淀SPOP的能力。这些结果表明,RACK1上的94TGTTT98和275ISTSS279区域均负责与SPOP的结合,并且RACK1是SPOP调控CFs中泛素化和降解的底物。
图4.SPOP的MATH结构域与RACK1的SBC基序相互作用并促进其在CFs中的降解
5.RACK1介导SPOP在心肌纤维化中的功能
为评估RACK1是否参与SPOP诱导的CFs活化,研究人员证实了RACK1的过表达抑制了SPOP在CFs中诱导的胶原蛋白生成。SPOP诱导的细胞活力、α-SMA表达和细胞增殖也均被共转染RACK1过表达质粒所消除。
随后,研究者构建了携带RACK1基因的慢病毒载体(len-RACK1)。将len-RACK1注射到len-SPOP给药的MI小鼠体内,并评估心肌纤维化情况。结果显示,SPOP过表达对心功能的不利影响被RACK1的功能获得所挽救。Masson三色染色显示,过表达RACK1阻止了SPOP过表达在MI小鼠中引起的纤维化面积增加。给予len-RACK1消除了在感染len-SPOP的MI小鼠中Col I和Col III表达的增加。这些结果表明RACK1介导了SPOP在心肌纤维化中的作用。
图5.RACK1调节SPOP对心肌纤维化的影响
6.RACK1通过Smad3通路抑制CFs活化
研究人员随后检测了RACK1在CFs活化中的作用。首先,验证了RACK1的成功过表达。RACK1过表达抑制了Col I和Col III的mRNA和蛋白水平表达。此外,RACK1过表达显著抑制了α-SMA表达、细胞活力和CFs增殖,暗示了其抗纤维化潜力。
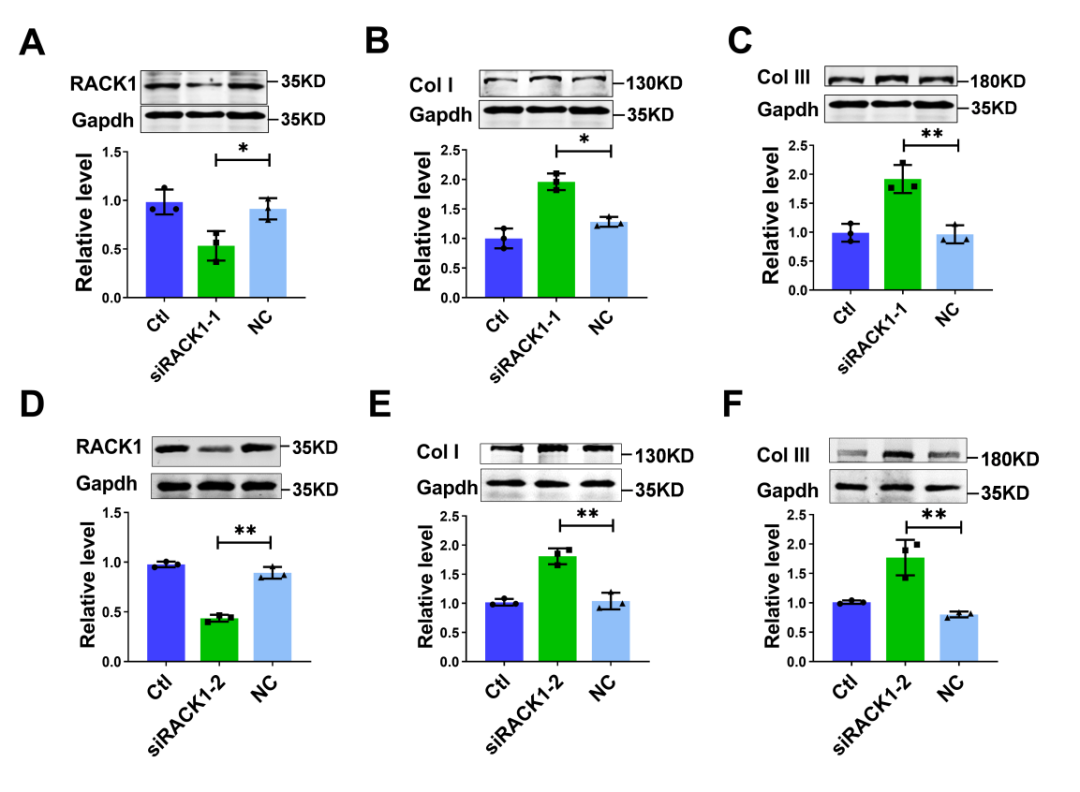
接下来,研究者通过siRNA(siRACK1-1和siRACK1-2)敲低RACK1探究了其对CFs的影响。在CFs中,沉默RACK1在mRNA和蛋白水平均促进了Col I和Col III的表达。敲低RACK1有效促进了成纤维细胞向肌成纤维细胞的转化,表现为α-SMA表达增加、细胞活力增强和细胞增殖加快。已有研究表明,在肾细胞中,RACK1是Smad3的结合伙伴,并负向调控Smad结合元件(SBE)和α2(I)胶原启动子序列的转录活性。作者随后研究了Smad3是否参与RACK1对CFs胶原生成的调控。抗RACK1抗体成功地免疫沉淀出了Smad3蛋白。此外,Smad3 siRNA消除了RACK1沉默对CFs胶原合成的促进作用。这些发现表明,RACK1对CFs活化的作用是由Smad3介导的,而Smad3是纤维化过程中的关键介质。
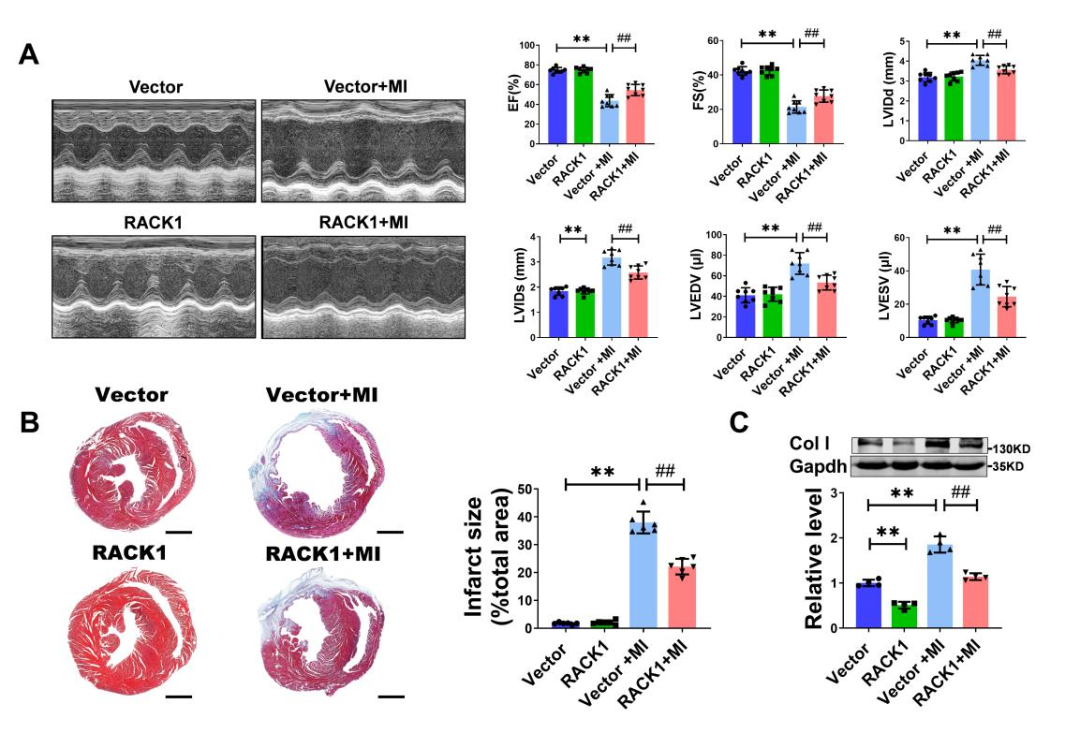
为更深入地研究RACK1是否影响心功能和纤维化,小鼠通过尾静脉注射携带RACK1基因的慢病毒载体。注射两周后,结扎LAD,并在MI后4周评估间质纤维化情况。结果显示,RACK1过表达显著改善了MI小鼠的心功能,表现为EF和FS增加,LVIDd、LVIDs、LVEDV和LVESV减小。重要的是,RACK1减少了胶原合成,减轻了间质纤维化,并缩小了MI后的梗死面积。
图6.RACK1通过Smad3抑制CFs活化
图7.敲低RACK1对Col I和Col III蛋白表达的影响
图8.过表达RACK1对心功能和纤维化的影响
7.SPOP在人CFs活化中发挥相似功能
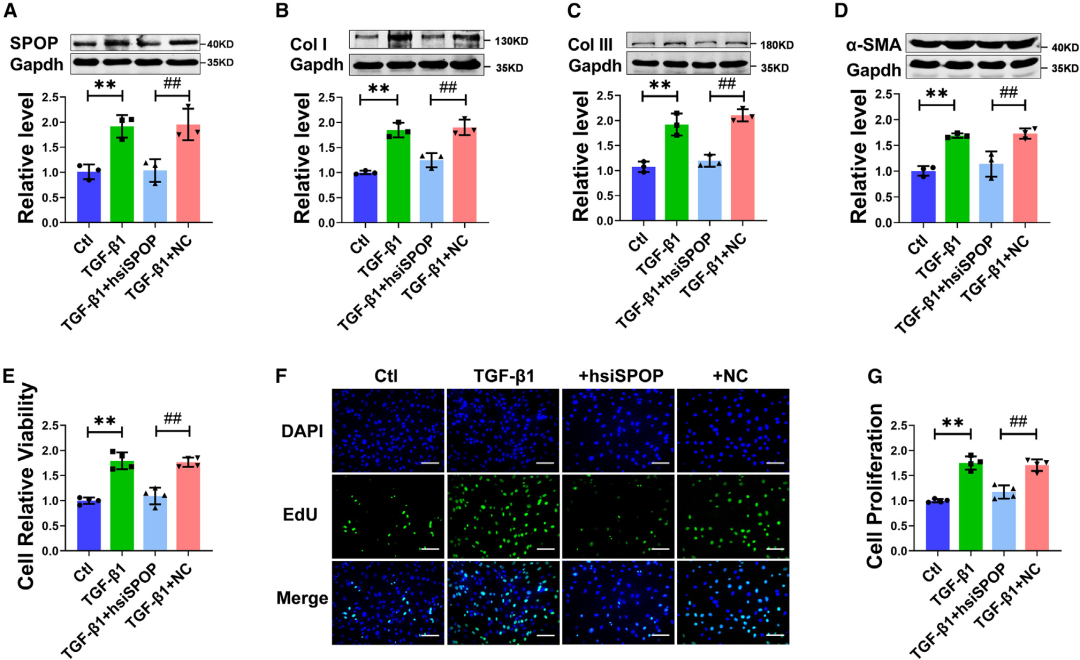
最后,作者研究了SPOP在人CFs中的作用。一致地,TGF-β1刺激后SPOP的蛋白水平升高。靶向人SPOP的siRNA(hsiSPOP)降低了经TGF-β1处理的人CFs中SPOP、Col-I、Col-III以及α-SMA的表达。此外,沉默SPOP抑制了TGF-β1诱导的人CFs的细胞活力和增殖。这些发现凸显了SPOP作为人类纤维化疾病治疗靶点的潜力。
图9.沉默SPOP抑制TGF-β1诱导的人CFs活化
总结与局限
本研究的主要发现是:
(1)SPOP在小鼠缺血诱导的心肌纤维化组织以及TGF-β1诱导的CFs纤维化表型中均表达上调;过表达SPOP促进胶原生成和心脏间质纤维化,并恶化心功能;而敲低SPOP则表现出相反的效果。
(2)SPOP与RACK1结合,促进其泛素化及随后的降解,从而增加了由Smad3介导的CFs增殖和胶原合成。
(3)RACK1通过其富含S/T的基序与SPOP的MATH结构域结合,被SPOP识别并靶向。本研究证实SPOP通过结合RACK1(泛素化介导降解的底物蛋白)而加剧了缺血诱导的心肌纤维化,进而导致Smad3介导的CFs活化。
总体而言,E3泛素连接酶复合体衔接蛋白SPOP通过增强其底物蛋白RACK1的泛素化介导降解,促进了心肌纤维化的发展。该研究推动了对心肌纤维化分子机制的进一步认识,并为纤维化相关心脏疾病提供了策略与靶点。
研究局限性:尽管本研究证明了SPOP在心肌纤维化中的调控作用,但该工作仍存在一些局限性。为了进一步确认SPOP在心肌纤维化中的促纤维化功能,有必要在研究中采用CFs特异性的SPOP敲除或转基因小鼠。本研究不能排除其他底物/机制或其他类型细胞(如心肌细胞和/或内皮细胞)参与SPOP在心肌纤维化中的调控。最后,若能在人类心肌纤维化中证实SPOP的功能,则将进一步加强本研究的意义。
模式图:SPOP与RACK1相互作用加剧心肌纤维化
通讯作者介绍:
吕延杰,教授,博士生导师,中国药理学会心血管药理专业委员会名誉主任委员、黑龙江省药理学会副理事长,主要从事心血管疾病的基础和药理学科研工作,研究方向为离子通道和心血管疾病,干细胞在心脏疾病中的应用,非编码RNA(微小RNAs和长链非编码RNAs)在心血管系统疾病中的病理生理作用和调控机制。主持国家自然科学基金重点项目等研究课题;获教育部自然科学一等奖、黑龙江省政府等省部级科技奖励10余项;编写国家规划教材3部;以第一/通讯作者在Circulation、Circulation Research等期刊发表SCI论文50余篇。
潘振伟,男,中共党员,教授,博士生导师,教育部青年长江.学者特聘教授,哈尔滨医科大学药学院药理教研室教授,现任哈尔滨医科大学基础医学院院长。二级教授/国家高层次人才/黑龙江省B类人才。黑龙江省医学科学院北方转化医学研究合作中心主任。研究方向为心脏疾病及代谢疾病的分子机制与防治策略,在Circulation、Circulation Research、Journal of the American College of Cardiology、The Journal of Clinical Investigation、Nature Communications等杂志发表论文60余篇。主持科技部国家重点研发计划课题2项、国家自然基金重点项目1项、国家自然基金面上项目4项、教育部新世纪人才计划1项、黑龙江省杰出青年基金1项。获中国药理学会施维雅优秀青年工作者奖、中国药学会青年生物药物奖、黑龙江省科技进步二等奖(第一完成人)。2017年被评为黑龙江省劳动模范称号。受邀多次在心血管领域学术会议如ISHR国际心脏病大会、海峡两岸心血管会议、南方心血管疾病会议等做学术报告。
单宏丽,上海工程技术大学,化学化工学院,教授,享有国务院政府特殊津贴。承担多项国家自然科学基金面上项目、黑龙江省自然科学基金重点项目、黑龙江省杰出青年科学基金项目、及国家重点基础研究发展计划(973项目)等。以通讯作者身份在Autophagy、Nat Commun、Theranostics等发表多篇SCI论文。研究方向:1.心血管药理学2.肿瘤药理学。
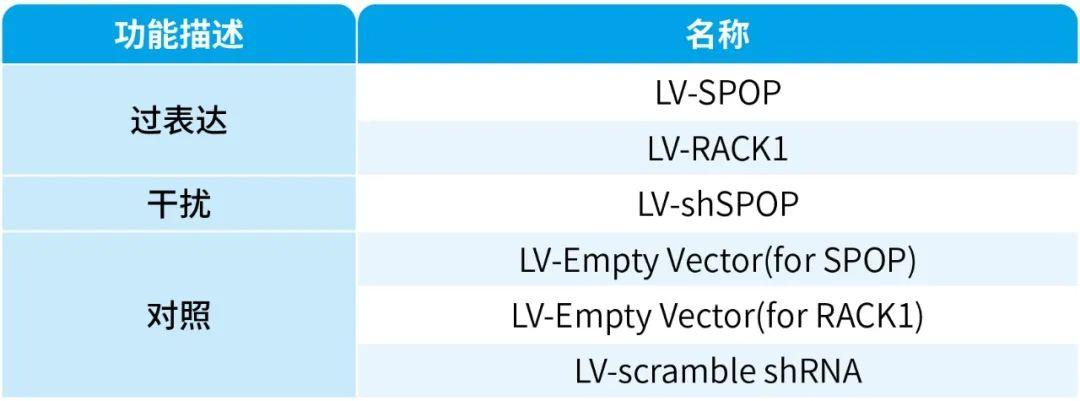
本文使用的病毒产品,列表如下:
枢密科技已开发一系列慢病毒现货产品,可提供基因下调、基因过表达、基因敲入/敲除、功能扰动、钙信号检测等现货及包装定制服务。质量稳定,周期短,欢迎咨询!

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK