2025-06-03 阅读量:1347
表观遗传编辑(Epigenetic editing)已发展成为一种在体外及体内调控基因表达的强有力手段,能够在不改变基础DNA序列的前提下,通过对基因表达进行调控来实现治疗效果。其核心机制是诱导位于启动子区域的CpG二核苷酸位点发生DNA甲基化,从而将基因锁定在沉默状态,且这种沉默状态具有持久性,能够通过DNA甲基转移酶DNMT1在细胞分裂过程中得以稳定传递[DNMT1识别由DNA复制产生的半甲基化状态,并将甲基基团重新添加到新合成的胞嘧啶上]。与依赖于单链DNA断裂(碱基编辑和先导编辑)或双链DNA断裂(CRISPR-Cas9核酸酶编辑)的基因编辑方法相比,靶向表观遗传编辑不会破坏DNA序列的完整性,从而避免了潜在的基因毒性风险,是一种极具前景的基因沉默(靶向甲基化)或激活(靶向去甲基化)策略。
在体外实验中,利用可编程表观遗传编辑器(EEs)已成功在人类细胞中实现了持久的基因沉默,沉默状态可维持数月之久。这些表观遗传编辑器由DNA甲基转移酶和基于KRAB的转录抑制结构域组成,它们与DNA结合结构域融合,形成单一或多个融合蛋白从而发挥作用。尽管之前的研究已在小鼠体内证实了表观遗传编辑能够持久沉默肝脏中内源性小鼠Pcsk9基因[前蛋白转化酶枯草杆菌蛋白酶/kexin 9型,其编码蛋白是肝脏中调控低密度脂蛋白胆固醇(LDL-C)代谢的关键因子],但要将表观遗传编辑作为潜在的临床应用,还需在非人灵长类动物(NHPs)中进一步验证其活性、持久性和安全性。此外,尽管基因编辑和碱基编辑方法已在临床前物种和人类中展示了对治疗靶点的抑制效果,但目前尚未有研究发表关于在体内逆转这些DNA序列变化的方法,这需要识别新的DNA靶向基团(即新的引导RNA,gRNA)来实现。而相比之下,由于表观遗传编辑后的基础DNA序列未发生改变,理论上可利用相同的靶向DNA结合结构域,在体内相同基因组位点的先前沉默组织中,部署旨在去除CpG甲基标记的表观遗传激活剂,从而实现编辑的可逆性。
2025年2月,来自美国生物科技公司Chroma Medicine的研发团队在国际医学期刊Nature Medicine上发表了题为“A potent epigenetic editor targeting human PCSK9 for durable reduction of low-density lipoprotein cholesterol levels”的研究论文,研究人员开发了一种靶向人类PCSK9基因的EE,旨在通过体内表观遗传编辑实现LDL-C水平的持久降低。实验结果显示,通过脂质纳米颗粒包裹编码该EE的mRNA进行单次给药,足以在转基因小鼠中实现近乎完全的人类PCSK9沉默,且这种沉默状态至少可持续1年,并在部分肝切除诱导的肝脏再生后仍能完全保持。此外,研究人员利用靶向表观遗传激活剂对PCSK9基因座进行去甲基化处理,成功逆转了已沉默PCSK9基因小鼠的基因状态,证实了表观遗传编辑的可逆性。在食蟹猴中,单次给药EE可显著且持久地使循环PCSK9蛋白水平降低约90%,同时LDL-C水平降低约70%。这些发现有力地证明了体内持久且可逆的表观遗传编辑的治疗潜力,并为开发基于EE的高胆固醇血症治疗方案提供了重要支持。
枢密科技研发团队凭借着深厚的技术积累,已熟练掌握多种前沿基因编辑技术,可提供表观遗传编辑、CRISPR/Cas9基因编辑、碱基编辑(Base editor,BE)、先导编辑(Prime editor,PE)、PASTE技术以及CRISPRa/CRISPRi技术等相关服务,为您的科学研究提供强大支持!详情见文末。
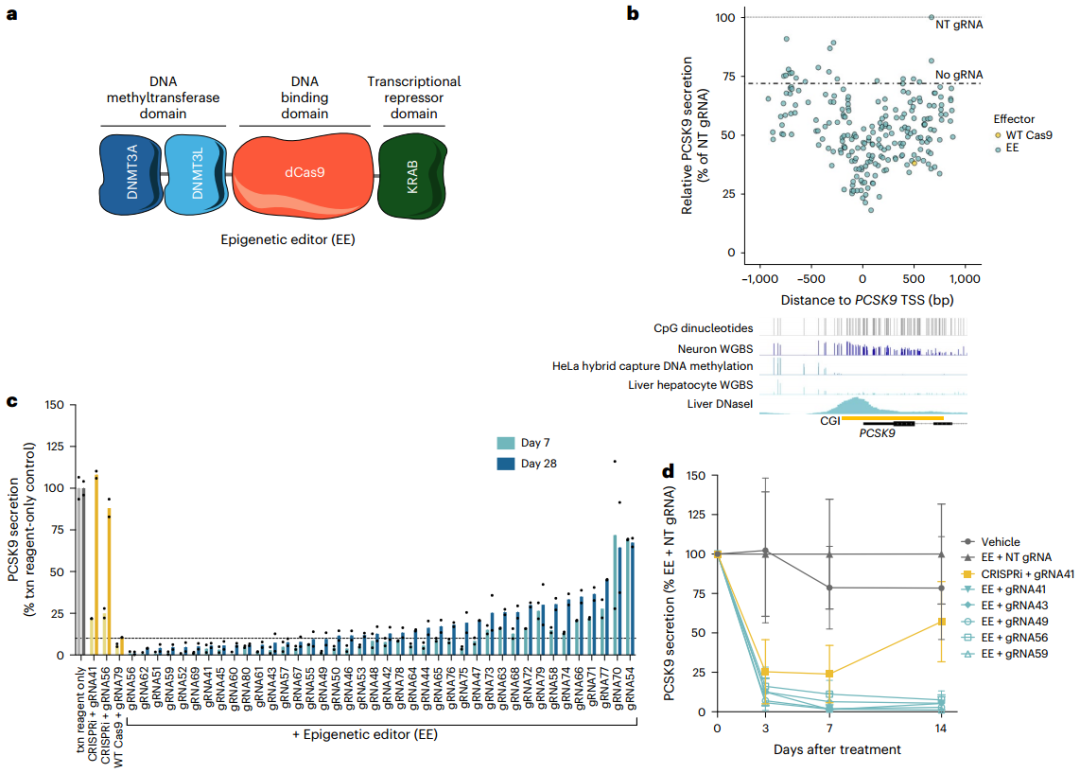
1、高效靶向PCSK9的EE的鉴定
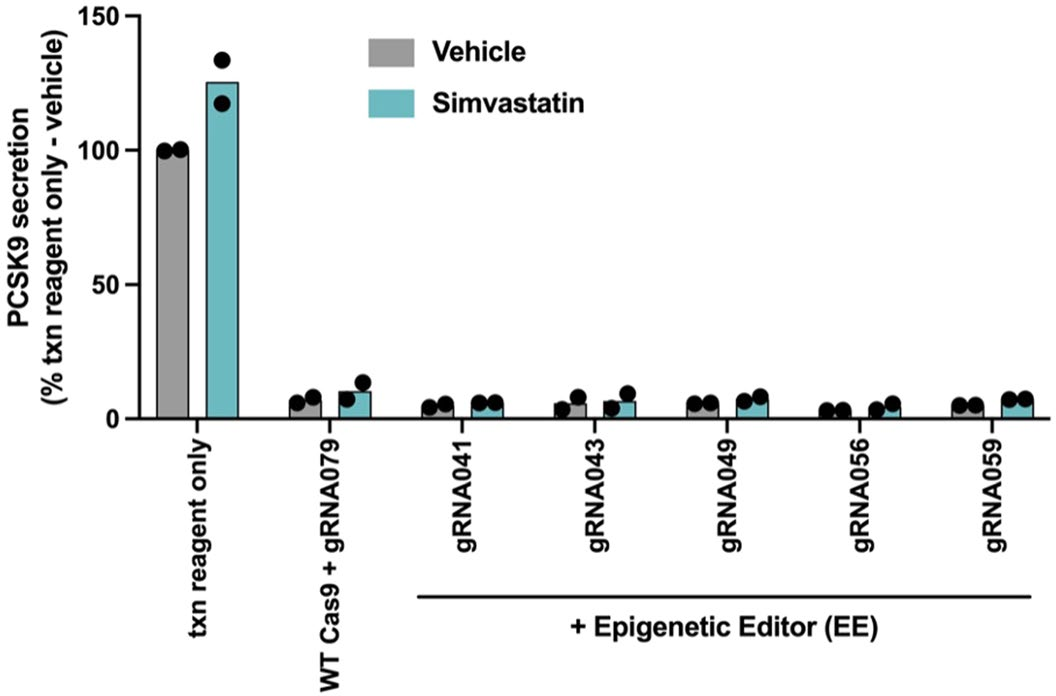
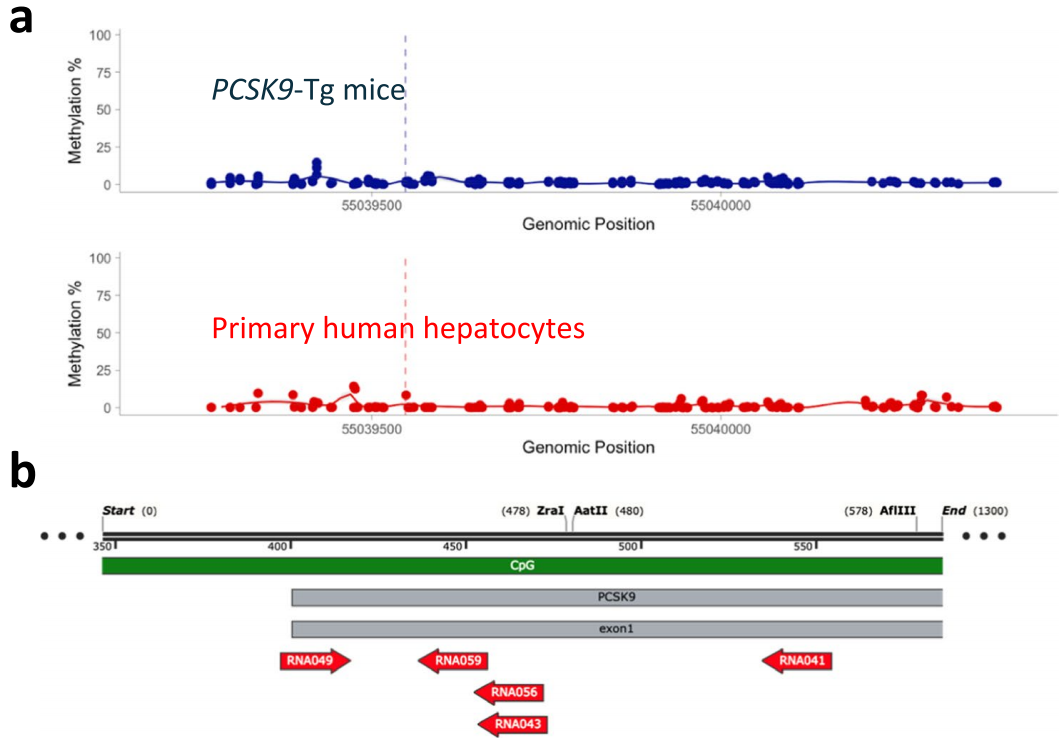
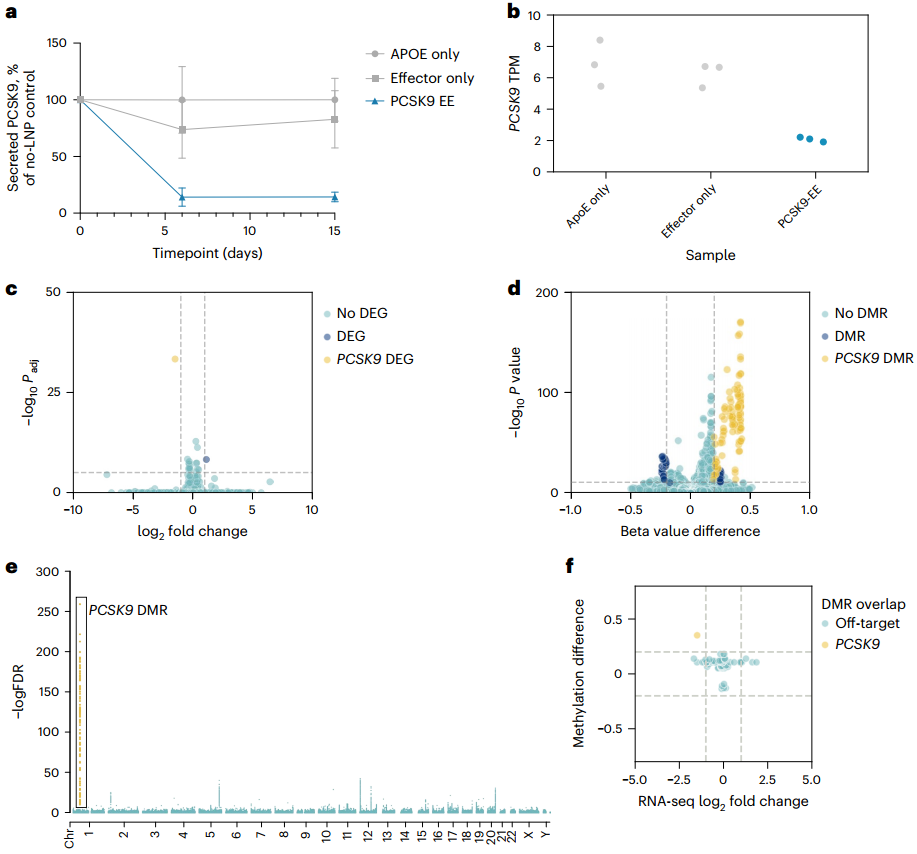
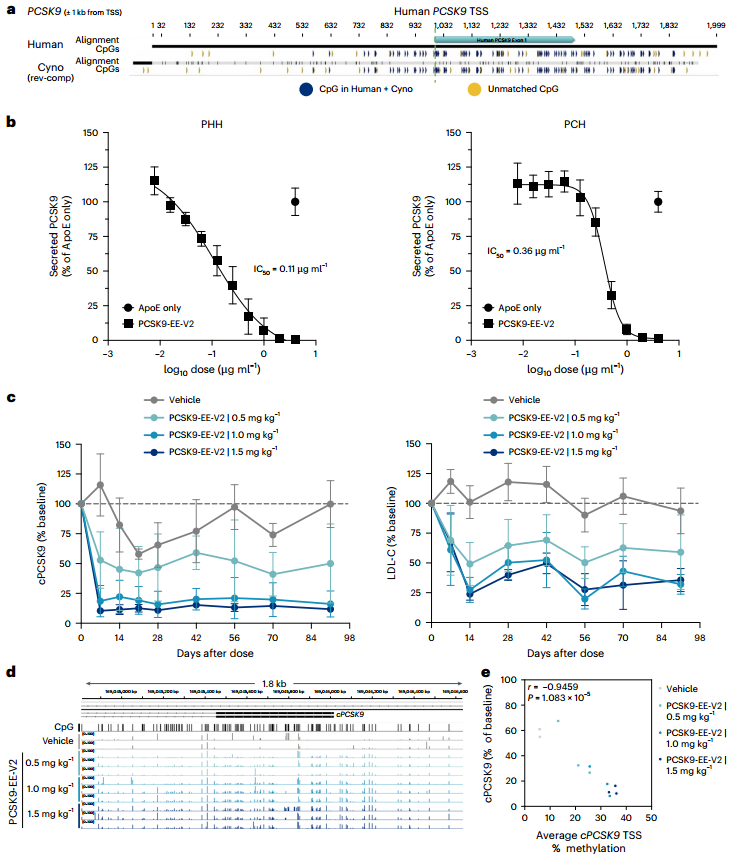
为评估基于DNA甲基化方法沉默人类PCSK9基因的能力,研究人员首先设计了一种EE,由DNMT3A(DNA甲基转移酶3A)、DNMT3L(DNA甲基转移酶3L)和KRAB转录抑制结构域与无催化活性的化脓性链球菌Cas9(dCas9,即失活型Cas9)融合而成。接着,他们通过在HeLa细胞(源自人类宫颈癌细胞的永生细胞系)中瞬时共转染EE表达质粒与编码个体gRNA表达盒的DNA片段,进行了gRNA筛选。这些DNA片段覆盖了人类PCSK9基因座,范围约为转录起始位点(TSS)上下游约1 kb。结果发现多个gRNA可显著降低PCSK9水平(抑制率高达80%),且活性最强的gRNA最靠近TSS。通过将体外合成的编码EE的mRNA与化学合成gRNA按2:1质量比共转染HeLa细胞,验证了初筛的前40个gRNA的活性,发现多数有效gRNA可将分泌型PCSK9降至与野生型Cas9核酸酶阳性对照相当水平,抑制效果可持续28天,而缺乏DNA甲基转移酶结构域的CRISPR干扰(CRISPRi)对照虽有效果但不持久。为了评估EE在原代人肝细胞(PHHs)中沉默PCSK9的能力,研究人员选择了在HeLa细胞中表现最活跃且持久的gRNA,并确保这些gRNA在人类基因组中仅与PCSK9基因座匹配,并在食蟹猴PCSK9基因座中有同源序列,以便后续在NHPs中进行测试。实验结果表明,即使在添加他汀类药物后,这些gRNA仍能维持对PCSK9分泌的抑制,表明表观遗传编辑在药物干预下依然有效。最后,为保障构建体表达并模拟体内递药,将EE mRNA与筛选的gRNA制成脂质纳米粒(LNPs),在APOE3(重组人载脂蛋白E3)辅助下经低密度脂蛋白受体(LDLR)途径递送至PHHs。结果显示,含EE mRNA及候选gRNA的LNPs可快速且持续抑制PCSK9分泌至少14天,而CRISPRi对照的抑制效果短暂,符合其瞬时沉默特性。以上数据表明,短暂应用EE可在体外培养的PHHs中高效且持久地降低PCSK9蛋白水平。
图1. 靶向人类PCSK9的EEs在永生化细胞和PHHs中的体外活性
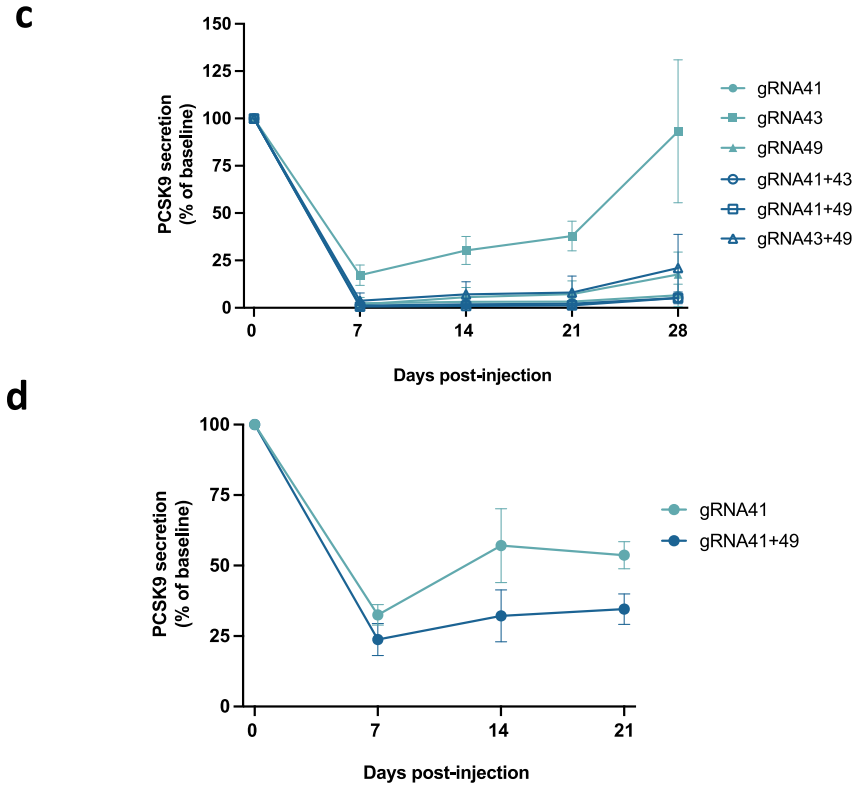
为了评估候选gRNA在体内的活性和效力,研究人员在表达人类PCSK9基因的转基因小鼠(PCSK9-Tg)中进行了实验,这些小鼠循环PCSK9水平与人类相似,且DNA甲基化模式与PHHs一致。研究人员将筛选出的gRNA(gRNA41、gRNA43、gRNA49)与EE mRNA制成LNPs,以0.75 mg/kg接近饱和的剂量单次给药后,发现特定的单个gRNA(gRNA41)和双gRNA组合(gRNA41+gRNA49)可显著降低PCSK9-Tg中循环PCSK9水平。在0.2 mg/kg亚饱和剂量下,双gRNA组合(gRNA41+gRNA9)沉默效果优于单gRNA(gRNA41),因此选定EE mRNA/双gRNA组合(称为PCSK9-EE)用于后续研究。
图2. 人类PCSK9 EE在小鼠体内的活性
2、PCSK9-EE的特异性
接下来,研究人员通过检测基因表达和DNA甲基化的全局变化,对PCSK9-EE在PHHs中潜在的脱靶表观遗传编辑进行了评估。降低的PCSK9蛋白和转录水平证明了PCSK9-EE有效的靶向活性。为检测因调控基因转录的元件(如启动子和增强子区域)发生脱靶甲基化而可能导致的基因表达变化,研究人员进行了深度RNA测序(RNA-seq)。结果显示,PCSK9是受PCSK9-EE影响最显著的基因,与仅用EE处理的细胞相比,仅有低表达且肝细胞中甲基化无变化的ENSG00000285976基因有轻微改变,其余基因无显著变化。进一步地,研究人员通过杂交捕获约400万个CpG位点来评估甲基化情况,与仅用EE处理的细胞相比,PCSK9-EE处理使PCSK9位点的CpG甲基化大幅增加,而在潜在的脱靶位点上检测到的CpG甲基化增幅较小,且这些增加并未导致RNA-seq检测到的基因表达的显著变化。为了更全面地评估PCSK9-EE引起的脱靶CpG甲基化,研究人员对超过3000万基因组CpG进行了全基因组甲基化测序(WGMS)。结果显示,甲基化变化最显著且影响最大的区域特异性地集中在PCSK9基因上,在WGMS确定的差异甲基化区域(DMR)20 kb范围内,没有其他基因同时出现甲基化和基因表达的显著改变。此外,研究人员还对至少在一项甲基化检测中存在显著变化的DMRs的CpG甲基化情况,以及基因表达显著变化基因的TSS 20 kb内区域进行了分析,发现这些DMRs附近基因多为低表达或无表达变化。综合以上结果,充分证实了PCSK9-EE具有高度特异性,脱靶甲基化程度极低,且未对基因表达产生功能性影响。
图3. PHHs中高活性人类PCSK9 EE的特异性分析
3、PCSK9-EE对小鼠的影响
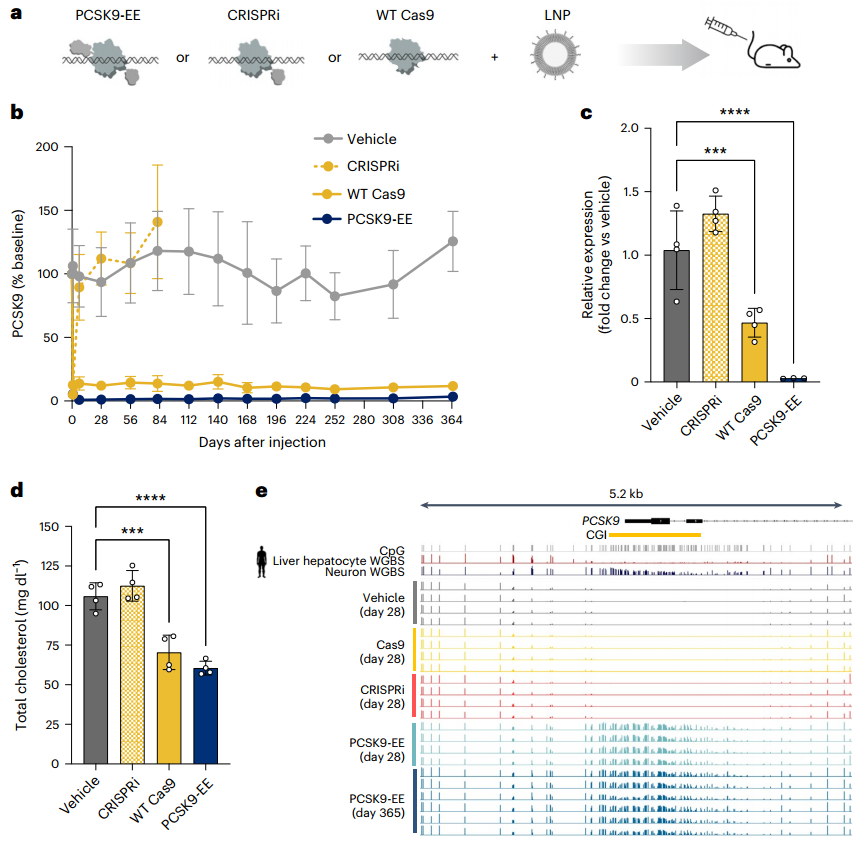
研究人员进一步评估了PCSK9-EE作为体内一次性降低PCSK9水平疗法的潜力,他们将PCSK9-EE制成LNPs,以药理饱和剂量(3 mg/kg)对PCSK9-Tg小鼠给药,并以施用靶向PCSK9的CRISPRi和野生型Cas9(WT Cas9)作为对照,分别用于评估短暂和持久的基因沉默效果。实验结果显示,CRISPRi处理使小鼠循环PCSK9水平迅速大幅降低,但7天内恢复至基线水平;WT Cas9核酸酶处理可使循环PCSK9水平降低约90%,并且这种降低效果在1年内持续存在;PCSK9-EE表现优异,实现了循环PCSK9水平近乎完全(>98%)的降低,效果同样至少维持1年,同时肝内PCSK9转录水平大幅下降,且与血浆胆固醇水平的降低相关。为探究PCSK9-EE在体内抑制PCSK9的分子机制,研究人员在给药后1个月采集的小鼠肝脏样本中,通过杂交捕获法检测了PCSK9基因座的CpG甲基化情况。结果显示,PCSK9-Tg小鼠在基线时PCSK9启动子区域呈低甲基化状态,与肝细胞中PCSK9的活跃转录状态一致。而PCSK9-EE的瞬时表达在给药后28天导致TSS中多个CpG位点的强烈甲基化,并且这种甲基化的特征和丰度与PCSK9-EE给药1年后的小鼠肝脏样本非常相似。而CRISPRi和WT Cas9核酸酶处理没有改变PCSK9基因座的CpG甲基化,这与它们的作用机制一致。
图4. PCSK9沉默的体内持久性及其对肝脏DNA甲基化的影响
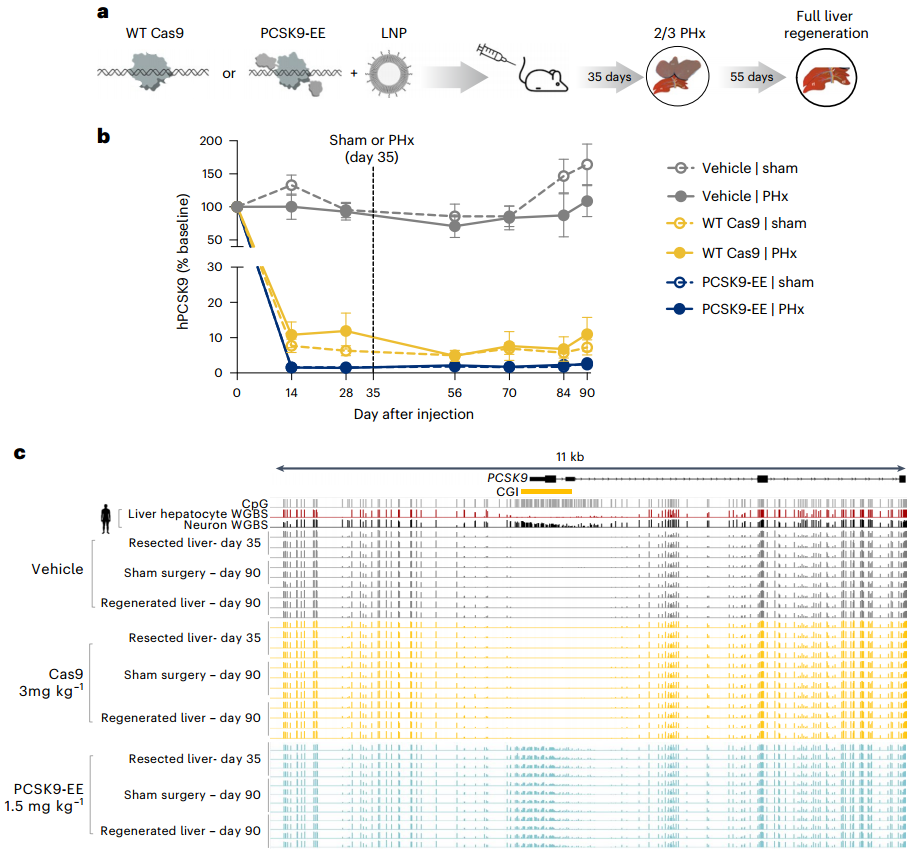
为了进一步确认表观遗传编辑在快速分裂的肝细胞中的持久性和维持性,研究人员利用部分肝切除(PHx)小鼠模型进行实验。结果显示,无论是PCSK9-EE还是WT Cas9处理的PCSK9-Tg小鼠,在进行三分之二肝切除手术后,循环PCSK9水平的显著降低效果都得以完全维持。对接受PHx手术的小鼠肝脏样本中PCSK9基因座的甲基化标记进行监测,结果显示其表观遗传学特征与假手术小鼠肝脏样本及肝切除小鼠切除的肝叶几乎完全一致。这些结果表明,表观遗传编辑在稳态肝脏和再生肝脏中都具有持久性,并且能够通过细胞分裂得以维持。
图5. PCSK9沉默在三分之二肝切除术后的体内持久性及其对肝脏DNA甲基化的影响
4、PCSK9-EE效应的可逆性
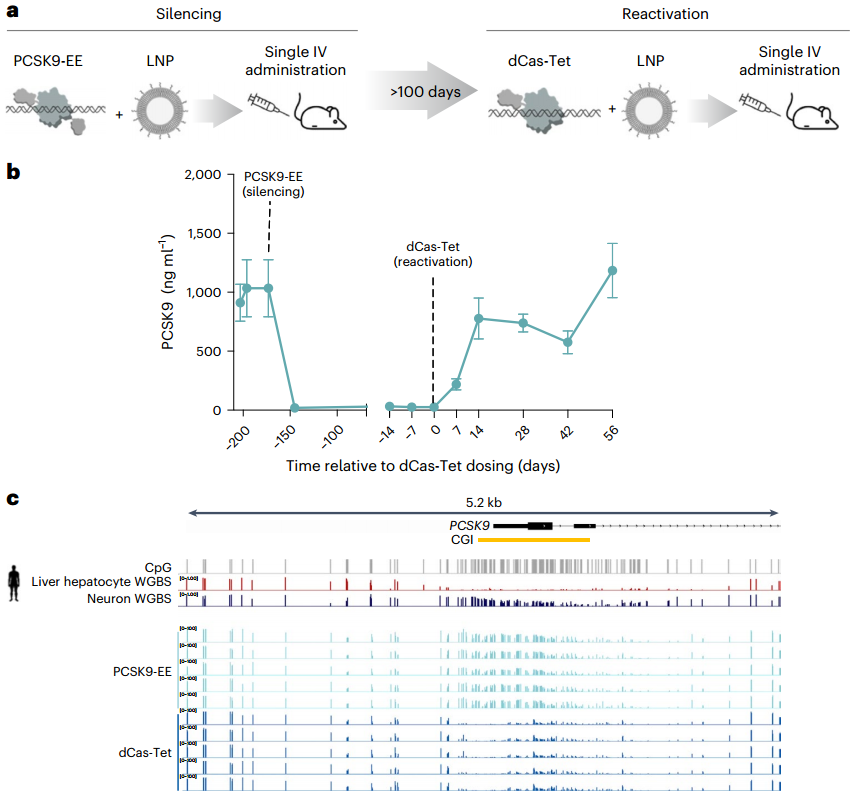
为评估PCSK9基因座表观遗传编辑的可逆性,研究团队设计了由化脓链球菌dCas9与TET1(双加氧酶,靶向诱导DNA去甲基化)催化结构域融合的表观遗传激活剂dCas-Tet,并在已通过PCSK9-EE沉默PCSK9的PCSK9-Tg小鼠中进行测试。由于PCSK9-EE仅改变DNA甲基化而不改变DNA序列,他们采用与沉默PCSK9基因座相同的gRNA组合(gRNA41+gRNA49),对编码dCas-Tet的mRNA的作用进行了评估。首先对5只PCSK9-Tg小鼠进行PCSK9-EE处理(1×1.5 mg/kg或2×0.75 mg/kg),使血浆PCSK9水平显著降低。在PCSK9被抑制173天后,研究人员给这些小鼠单次注射了含有dCas-Tet和gRNA41+gRNA49的LNPs。结果显示,使用PCSK9表观遗传激活剂处理后,小鼠血浆中的PCSK9水平在两周内几乎完全恢复正常(约为基线水平的90%),并且这种状态维持了8周,之后对动物实施安乐以收集肝脏样本。通过靶向甲基化分析,研究人员发现,与PCSK9-EE处理的小鼠相比,接受表观遗传激活剂处理的小鼠肝脏中PCSK9基因座的CpG甲基化水平总体降低,但略高于PHHs或对照处理的PCSK9-Tg小鼠中内源性PCSK9基因座的CpG甲基化水平。这一结果表明,通过表观遗传激活剂,PCSK9基因座的沉默状态可以被有效逆转,且逆转效果在一段时间内保持稳定。
图6. 利用PCSK9表观遗传激活剂验证PCSK9-EE作用的体内可逆性
5、PCSK9-EE在食蟹猴中的效果
最后,研究人员针对将LNPs递送基因组药物从啮齿动物向更高级物种转化时面临的一项关键挑战进行了探讨,即如何确保有效载荷在耐受剂量下具有足够的效力以实现期望的药理学效果。为此,他们基于前期筛选确定的gRNA41/gRNA49/mRNA组合(重量比0.5:0.5:1)设计了EE的优化版本PCSK9-EE-V2。序列分析显示,人类与食蟹猴PCSK9基因TSS上下游1 kb区域具有高度序列同源性(93.7%),且109个CpG位点中有84个高度保守;PCSK9-EE-V2所选用的每个gRNA的靶向区域在食蟹猴中均完全保守。为了验证该编辑器在食蟹猴PCSK9基因座上的活性和效力,研究团队用包裹PCSK9-EE-V2的LNPs分别处理PHHs和食蟹猴肝细胞(PCHs)。结果显示,PCSK9-EE-V2可完全抑制PCHs中PCSK9的分泌,但其效力较PHHs低约3倍。表明人类与食蟹猴在PCSK9表达调控机制上高度保守。
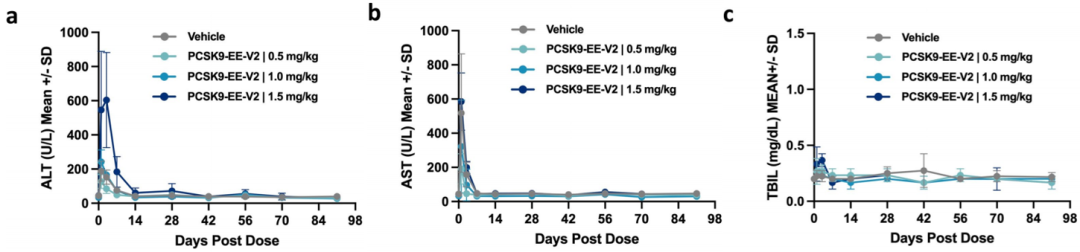
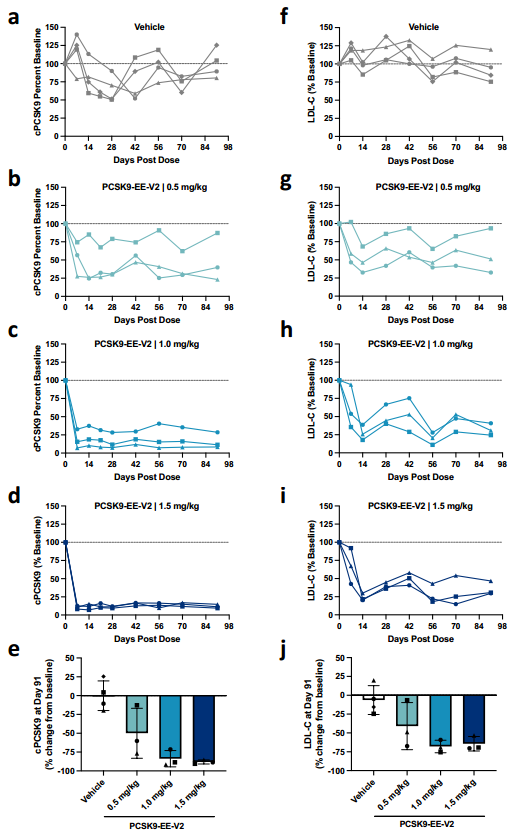
为了评估PCSK9-EE-V2在NHPs中的活性,研究人员在食蟹猴中进行了剂量-反应研究,每种剂量(0.5、1.0和1.5 mg/kg)测试了三只动物,同时还有四只接受对照处理的动物。单次静脉输注含有PCSK9-EE-V2的LNPs可迅速降低循环PCSK9水平,并至少维持3个月,与输注前基线值相比,PCSK9的平均降低幅度呈剂量依赖性,分别为50%、84%和89%,LDL-C的降低幅度分别为40%、68%和64%。在1 mg/kg和1.5 mg/kg剂量组之间,PCSK9或LDL-C的降低没有显著差异,表明在NHPs中,1 mg/kg的PCSK9-EE-V2已达到最大药理学反应。在给药后1天、3天和7天进行肝脏安全性监测,发现丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)和总胆红素血浆水平短暂升高,但在第14天恢复到基线水平。
为了证实循环PCSK9水平的变化与PCSK9基因座CpG甲基化增加有关,研究人员在第24天对接受PCSK9-EE-V2处理的所有食蟹猴以及两只接受对照处理的动物进行了肝脏活检。结果显示,食蟹猴中短暂应用PCSK9-EE-V2后,TSS区域多个CpG位点甲基化显著增加。gRNA结合位点周围500 bp基因组区域的CpG甲基化平均水平呈剂量依赖性升高(20.0%、30.5%、35.0%),显著高于对照处理组的5.9%,且与血浆PCSK9水平强相关。尽管在这样的研究中预期会有动物间的差异性,但在0.5 mg/kg组中,有一只动物在PCSK9基因座的甲基化程度要低得多,血浆PCSK9和LDL-C的变化也很小。可能是该猴子对LNP药物的肝脏摄取较低、内体逃逸减少和/或EE mRNA的翻译减少,或者EE蛋白的核定位减少,导致了该猴子CpG甲基化的降低。
图7. 人类PCSK9 EE在体外PCHs和食蟹猴体内的活性
图8. 食蟹猴体内人类PCSK9 EE的肝脏安全性监测
图9. 人类PCSK9 EE在食蟹猴个体体内的活性研究
总结
本研究充分展现了表观遗传编辑在体内调控基因表达的治疗潜力。研究团队开发的靶向人类PCSK9的EE,无需造成DNA单链或双链断裂,就能在PCSK9基因座诱导CpG甲基化,在PCSK9-Tg小鼠体内近乎完全抑制循环PCSK9水平,效果与腺嘌呤碱基编辑、CRISPR-Cas9等基因编辑技术相当,且经优化后在食蟹猴中也实现了循环PCSK9约90%的降低,显著降低LDL-C水平达70%左右,在小鼠中其沉默效果至少可持续1年,为高胆固醇血症的单剂量治疗提供了可能,疗效有望超越需长期给药的PCSK9单克隆抗体和小干扰RNA疗法。
相较于传统基因编辑技术,表观遗传编辑不改变DNA序列,避免了DNA双链断裂引发的染色体异常风险,虽存在少量脱靶甲基化,但未导致基因表达显著改变,且在肝细胞分裂过程中靶向甲基化状态稳定维持。此外,利用融合去甲基化结构域的靶向试剂,可实现表观遗传编辑的可逆性,为特定场景下的基因表达调控提供了灵活策略。
不过,该PCSK9靶向EE在进入临床测试前,仍需进一步评估其疗效、耐受性和安全性,包括药物的药代动力学、药效学特征、体内分布及潜在毒理效应等。总体而言,这种具有持久性、特异性和可逆性的PCSK9靶向EE,有望成为一种“一劳永逸”的治疗方法,革新LDL-C降低治疗模式,同时也为难以坚持长期治疗的患者带来终身心血管风险降低的新希望,彰显了表观遗传编辑在体内基因调控治疗领域的广阔前景。
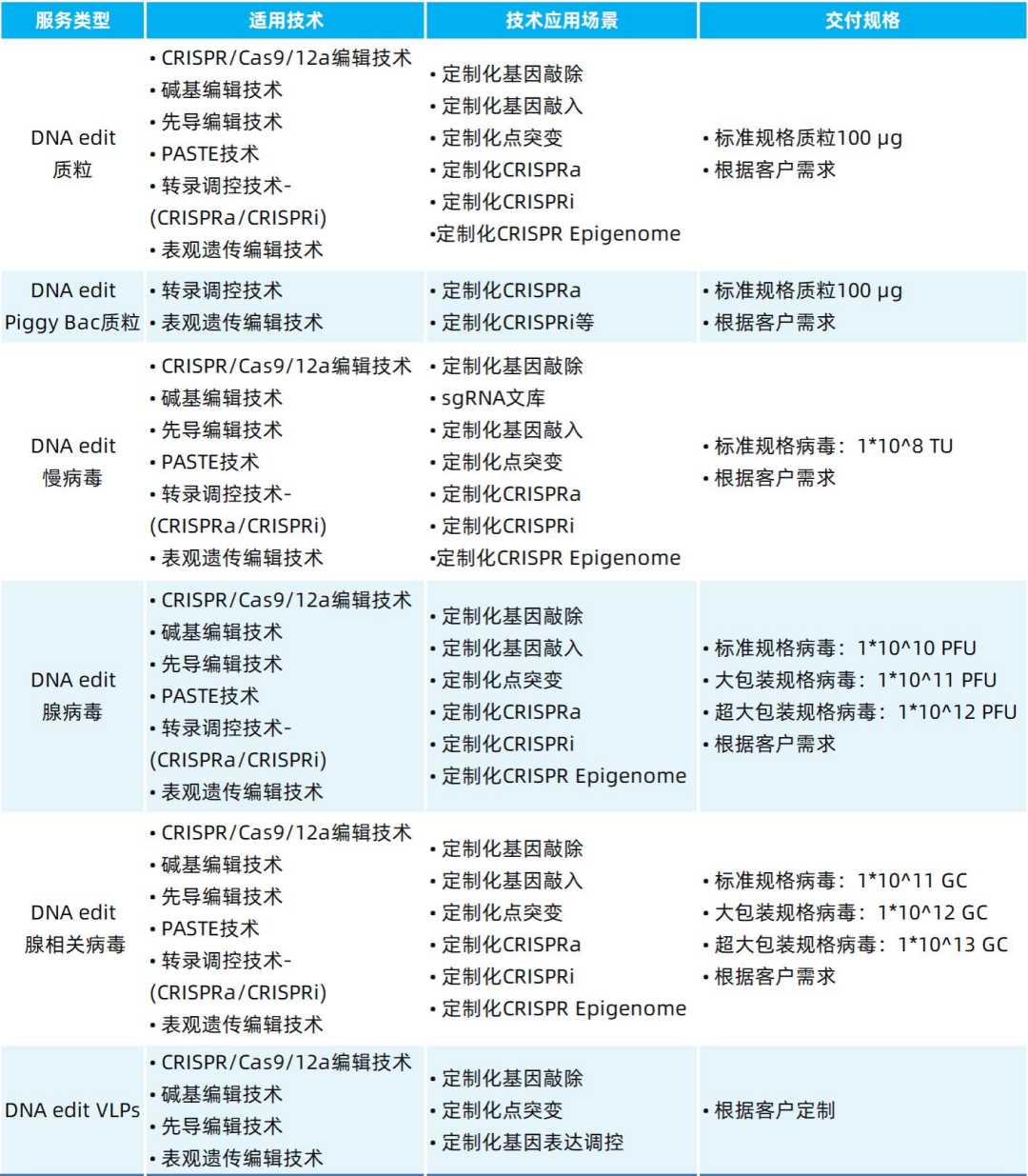
我司可提供包括表观遗传编辑在内的多种基因编辑递送工具,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK