2025-05-19 阅读量:1759
神经肽(NPs)是神经系统中广泛存在的一类修饰神经活动、调节脑状态并控制血流的小分子蛋白。神经元除了释放谷氨酸和GABA等快速作用神经递质(NTs)外,还会合成并释放NPs。与小分子NTs不同,NPs被认为会释放到突触外空间,并通过蛋白水解和扩散(范围从100微米到毫米)清除,从而影响神经元,产生持久的调节效应。尽管全面理解触发NPs从神经元释放的条件及其释放的时空范围,对从分子、细胞、环路和网络水平理解NPs的作用及其对动物行为状态的影响起决定性作用,但目前相关认知仍存在缺失。
在所有已知NPs中,阿片系统是功能最多样化且临床相关性最强的家族。阿片受体家族包含不同的受体亚型——κ、δ和μ阿片受体(分别为κOR、δOR和μOR)以及伤害感受受体,这些受体可被至少20种具有不同亲和力和选择性的内源性阿片肽激活,从而进一步激活抑制性Gi/o型G蛋白,最终导致表达受体的神经元兴奋性降低和NTs分泌减少。阿片肽及其受体广泛分布于大脑皮层和皮层下区域,阿片肽多样性被认为对调节疼痛、奖赏、物质滥用/依赖和应激等复杂行为及生理过程至关重要。靶向这些受体的阿片类药物用于治疗剧痛,但其长期使用可能导致成瘾和过量风险。最新研究尝试将阿片受体作为焦虑、抑郁和成瘾的潜在治疗靶点,但部分进展因缺乏体内高分辨率研究内源性NPs释放的方法而受阻。
长期以来,NPs系统(尤其是阿片系统)的研究极具挑战性,原因在于缺乏时空维度的灵敏实验工具,而这类工具对于在特定神经环路中精确解析NPs信号的复杂性和多样性不可或缺。内源性阿片肽结构相似,与不同阿片受体结合的选择性,相对低于某些NPs分子与其同源受体的结合选择性。生理相关的神经元NPs释放被认为难以触发,且释放浓度可能比经典NTs低几个数量级(纳摩尔级vs微摩尔级甚至亚毫摩尔级),这使得在离体和体内环境中探究触发内源性肽释放的条件并测量释放浓度极为困难,进而导致调控阿片NPs释放的过程难以被研究。近期技术进步已开始揭示阿片信号的解剖学和时空特征:转录组学研究记录了皮层中阿片肽-受体对在不同细胞类型中的分布,突显了阿片信号在介导神经环路跨细胞通讯中的重要功能;通过将光触发笼状脑啡肽的光释放与脑片中肽诱发电流的电生理测量相结合,揭示了肽扩散和清除的特征;在体内,利用高速微透析技术已检测到光遗传学驱动的肽释放。尽管取得这些进展,以亚秒级和亚区域分辨率量化与行为相关的内源性阿片肽释放仍具挑战性。
为填补技术空白,美国加州大学戴维斯分校(曾经工作单位)Tian Lin教授、加州大学圣地亚哥分校Matthew R.Banghart教授和华盛顿大学Michael R.Bruchas教授团队合作,联合在《Nature Neuroscience》期刊(IF=21.2)发表题为“Unlocking opioid neuropeptide dynamics with genetically encoded biosensors”研究论文,作者基于κOR、δOR和μOR开发了一类基因编码荧光探针——κLight、δLight与μLight,阐明了内源性阿片信号在大脑中的时空动态,为阿片NPs动力学研究提供了创新工具。研究人员利用这些探针系统评估了配体结合诱导的三种受体构象变化,从而确定了14种阿片肽和8种阿片类药物的结合特异性及效能效价。在急性海马脑片中,使用κLight确定了可触发内源性阿片肽释放的电生理参数,并利用光激活型肽量化了强啡肽的扩散速率。通过光遗传学刺激阿片肽释放,研究者在体内检测到了环路特异性的内源性阿片信号。最后,利用这些探针,作者揭示了清醒行为小鼠伏隔核(NAc)内,恐惧和奖赏条件下以亚区域特异性方式发生的快速阿片肽释放。

1.阿片生物探针的设计及改造
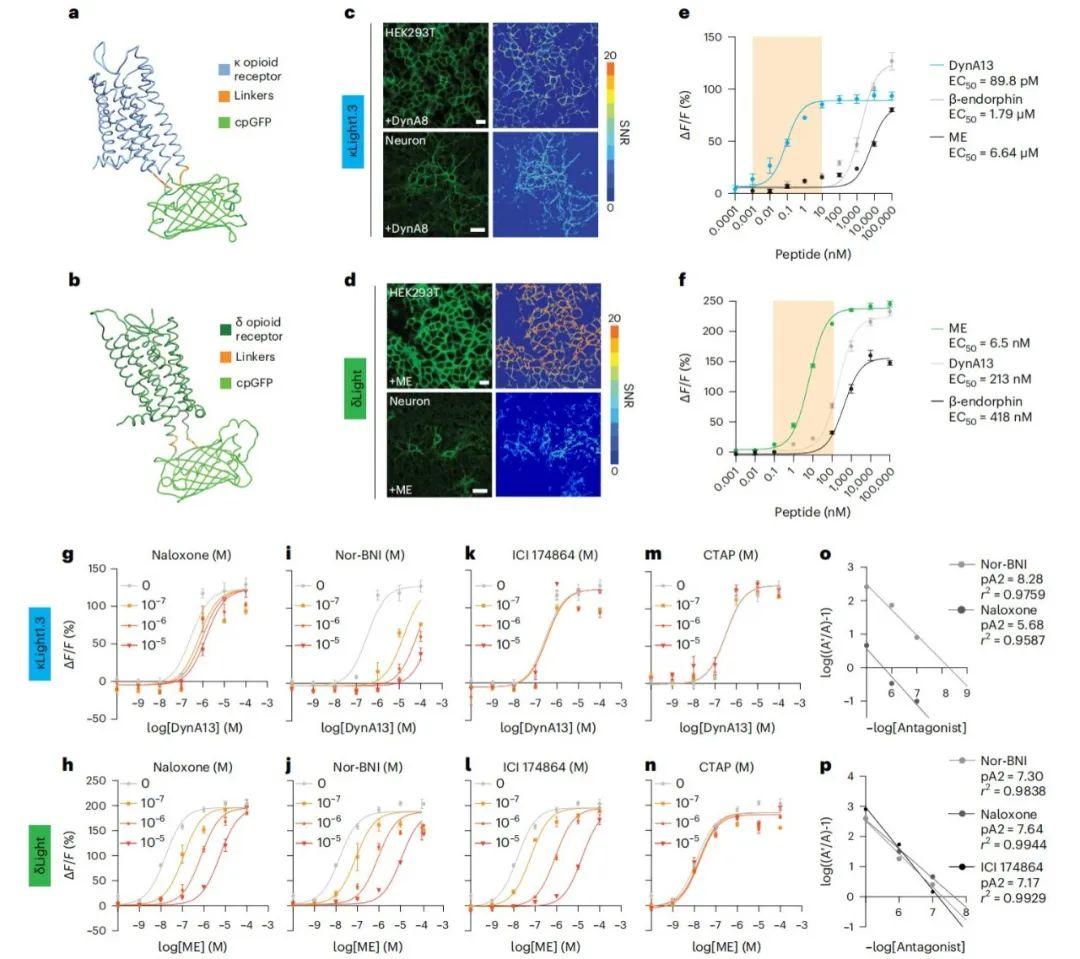
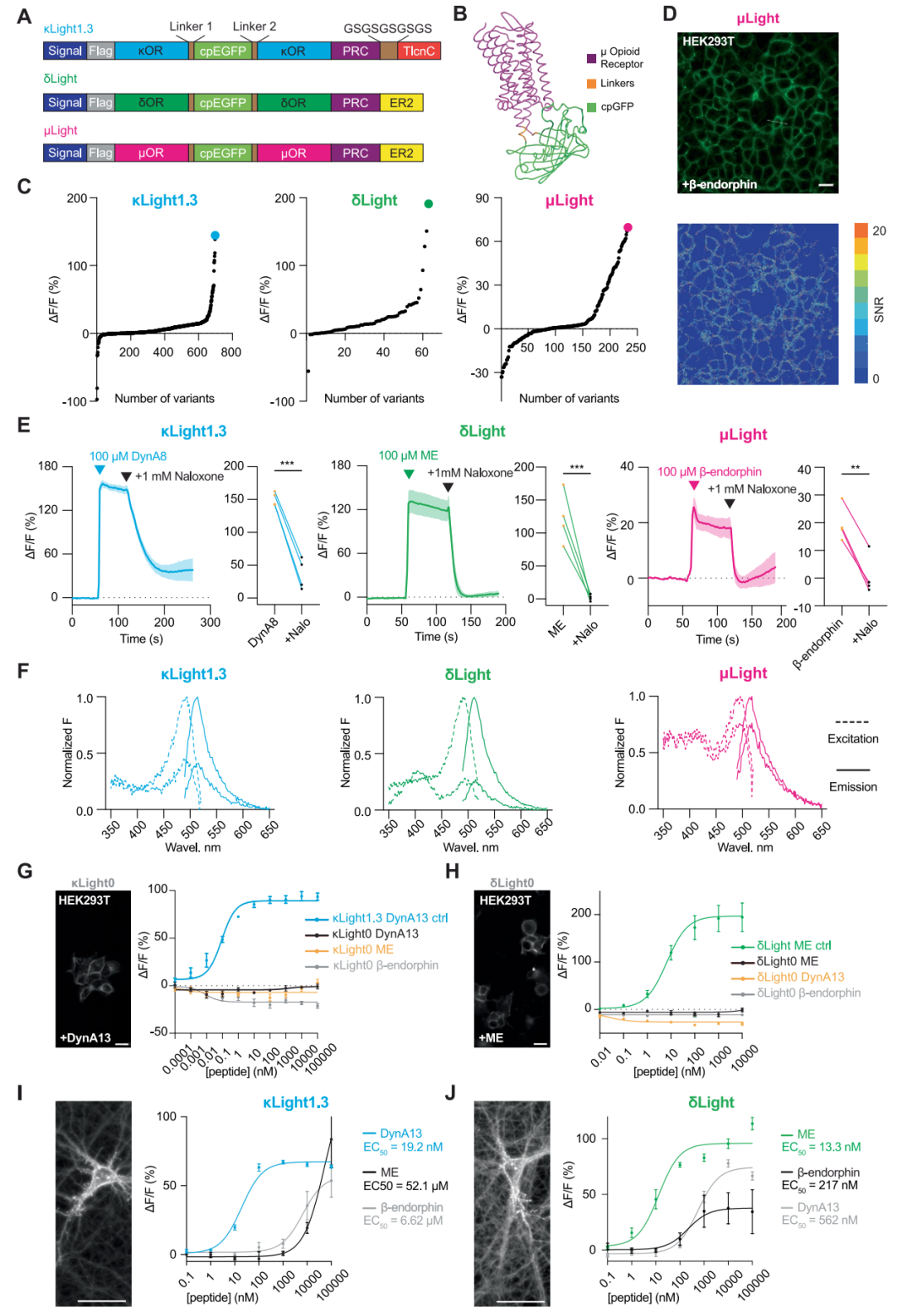
研究人员通过将人κOR胞内第三环(ICL3)的R257至跨膜结构域6(TM6)的R6.24、人δOR ICL3的S247至TM6的K6.24、以及人μOR TM6的S6.23至K6.24之间的氨基酸替换为环状排列绿色荧光蛋白(cpGFP),分别构建了κLight、δLight和μLight生物探针。通过筛选连接子(Linker)组合,作者对各探针的动态范围进行了优化:共测试了698种κLight变体对U50488(高选择性激活κOR)的响应、64种δLight变体对甲硫氨酸脑啡肽(ME)的响应,以及233种μLight变体对DAMGO(人工合成脑啡肽类似物,μ-OR高选择性激动剂)的响应。为增强膜定位能力,在κLight C端融合了端脑素标签(TlcnC tag),并连接GS序列与近端限制聚集标签(PRC tag);δLight和μLight C端融合了内质网(ER)输出基序(FCYENEV,ER2),并连接GS序列与PRC tag。由此获得改进型κLight1.3、δLight1和μLight1。此外,通过突变κOR和δOR结合口袋的D3.32以减弱配体结合能力,构建了对照探针κLight0和δLight0。
在哺乳动物HEK293T细胞(人胚肾细胞衍生细胞)和离体神经元培养体系中瞬时表达时,κLight1.3、δLight和μLight均表现出良好的膜定位。三种探针可分别被内源性受体激动剂(100μM)——强啡肽A1-8(DynA8)、ME和β-内啡肽特异性激活(κLight1.3在HEK细胞中的信噪比SNR=7.5±0.45,神经元中为5.6±0.2;δLight在HEK中SNR=16±0.62,神经元中为8.9±0.43;μLight在HEK中SNR=4.7±0.26)。纳洛酮(人工合成的阿片受体广谱拮抗剂,1 mM)阻断了三种受体的配体诱导响应(κLight1.3在神经元中的荧光变化ΔF/F=151%±5.1%;δLight在神经元中的荧光变化ΔF/F=123%±19.4%;μLight在神经元中的荧光变化ΔF/F=19.6%±3.2%)。
为消除瞬时转染导致的短暂表达引发的响应差异,研究人员构建了稳定表达κLight1.3、δLight和μLight的HEK293T细胞系。通过该模型,验证了内源性阿片肽对探针的交叉激活特性:首先,三种探针的激发峰均位于495 nm,发射峰位于515 nm;其次,原位滴定显示三种探针均可被三种内源性阿片肽激活,但效能与强度存在显著差异。κLight1.3对强啡肽A1-13(DynA13)的半数最大效应浓度(EC50)为89.8 pM,较β-内啡肽和ME高出三个数量级,但在高浓度(>10μM)时,其对β-内啡肽的荧光响应最强(ΔF/F:β-内啡肽=126.9%±8.6%;DynA13=93.6%±3.9%;ME=80.3%±1.8%)。δLight对ME的EC50为6.5 nM,较DynA13和β-内啡肽高两个数量级,但荧光响应幅度更大(ΔF/F:ME=246.1%±4.6%;DynA13=232.6%±6.8%;β-内啡肽=147.9%±4.1%)。携带结合口袋突变的对照探针(κLight0和δLight0)未显示明显响应。为进一步检测神经元中κLight1.3、δLight和μLight的选择性,研究人员利用AAV9载体在hSyn启动子驱动下表达三种探针,并感染分离的海马神经元,原位滴定结果显示,κLight1.3和δLight的选择性与HEK293T细胞系中一致,但μLight对三种内源性阿片肽的响应效能相近,提示需进一步优化。综上,在生理浓度范围(pM-100 nM)内,κLight1.3和δLight对内源性阿片肽具有高选择性和灵敏度。
进一步评估了κLight1.3和δLight对拮抗剂的选择性。稳定表达探针的HEK293T细胞系中原位滴定显示,纳洛酮(100 nM至10μM)可剂量依赖性右移DynA13(κLight)和ME(δLight)的EC50曲线,对δLight的抑制强度是κLight的两倍(pA2值:δLight=7.64,κLight=5.68);κOR选择性拮抗剂去甲二丙吗啡(Nor-BNI)对κLight的阻断效力略高于δLight(pA2=8.28 vs 7.3)。δOR选择性拮抗剂ICI 174864可有效抑制δLight(pA2=7.17),但对κLight无影响;μOR选择性拮抗剂CTAP对两种探针均无拮抗作用。
图1. 阿片探针的设计与改造
图2. 阿片探针的筛选与表征
2.阿片生物探针的选择性和药理学研究
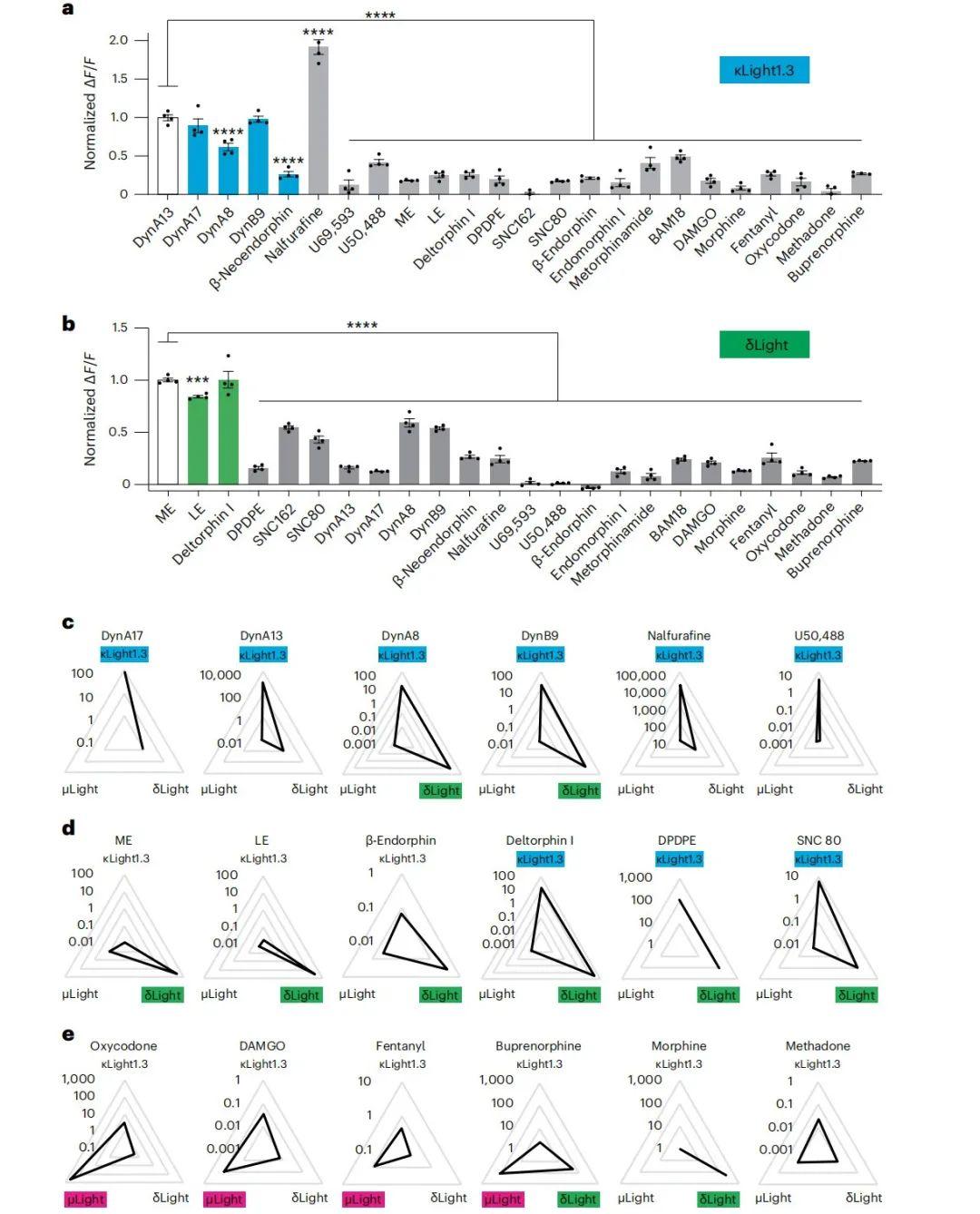
随后,研究者使用低浓度(10 nM)的多种内源性和合成配体,评估它们诱导探针荧光变化的响应顺序。研究发现,κOR选择性内源性肽(如强啡肽)在κLight探针上引发的荧光变化显著大于δOR或µOR选择性配体。在强啡肽家族中,短链形式的DynA8对κLight的激活作用低于DynA13。值得注意的是,合成κOR激动剂纳呋拉芬(nalfurafine)引发的荧光变化几乎是强啡肽的两倍。对于δLight探针,脑啡肽和δOR选择性激动剂的响应更强;例如,δLight的激活中,deltorphin I(选择性δOR激动剂)与甲硫氨酸脑啡肽(ME)和亮氨酸脑啡肽(LE)具有相似的效力。靶向µOR的内源性阿片肽或激动剂[如β-内啡肽、内吗啡肽(内源性高选择性μOR激动剂)、metorphamide(来自牛脑的μOR激动剂阿片八肽)和BAM18(牛肾上腺髓质中分离出的内源性阿片肽)]对κLight1.3和δLight也表现出不同程度的激活,但其效应远弱于κOR或δOR特异性肽。此外,κOR激动剂U50488和U69593选择性激活κLight而非δLight,而δOR激动剂SNC80和SNC162则优先激活δLight,这进一步验证了探针对受体特异性小分子激动剂的选择性。
研究人员通过雷达图分析了受体选择性配体对各探针的比例常数(s-slope),s-slope结合了动态范围(ΔF/Fmax)与EC50,定义为ΔF/Fmax/EC50,可综合反映药物对探针响应的效能和效价。结果显示,长链强啡肽对κLight1.3的激活效价高于短链形式,后者对δLight也有一定活性。纳呋拉芬和U50488对κLight1.3表现出高选择性。脑啡肽(ME和LE)及β-内啡肽对δLight高度特异,而deltorphin I和DPDPE(δOR激动剂)对κLight1.3和δLight的s-slope相近。尽管SNC80对κLight1.3的效能较低,但其s-slope在κLight1.3上略高于δLight。值得注意的是,µLight对吗啡无响应,而吗啡在κLight1.3和δLight中引起轻微荧光增强;相反,美沙酮(μOR完全激动剂,但非选择性)对三种探针均有相似效价,丁丙诺啡(μOR部分激动剂)虽激活三者但对µLight和δLight效价更高。其他µOR选择性合成药物(如DAMGO、芬太尼和羟考酮)对µLight的s-slope显著高于κLight1.3和δLight。值得注意的是,羟考酮和丁丙诺啡抑制而非增强µLight荧光,因此其s-slope基于ΔF/Fmax绝对值计算。
图3. κLight和δLight的药理学表征
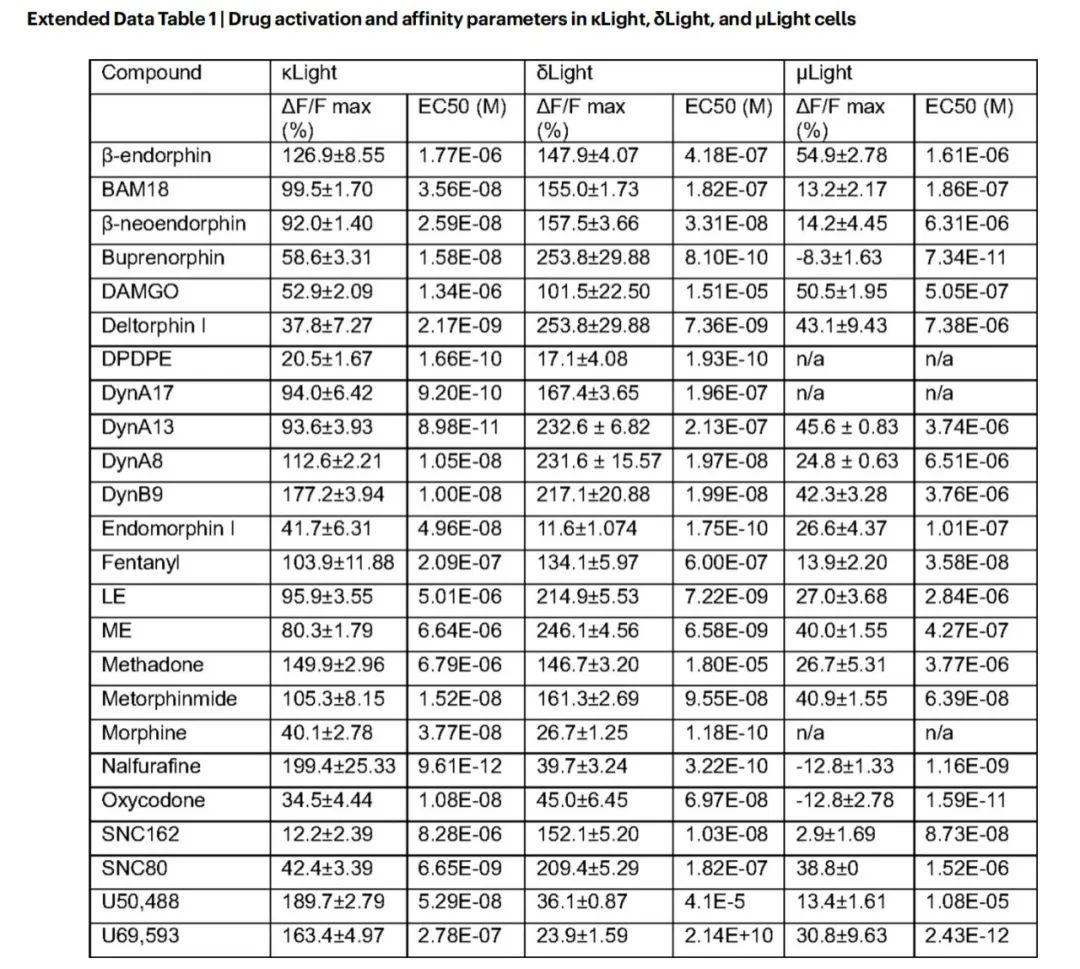
表1. 药物在k Light、δLight和μLight细胞中的激活和亲和力参数
3.利用κLight成像技术追踪强啡肽在脑组织的扩散
为研究κLight能否通过光解笼(photo-uncaging)技术报告脑组织中阿片肽的体积传递(volume transmission),研究人员首先比较了不同κLight变体的动态范围和敏感性。将携带κLight1.x(包括1.2a、1.2b、1.2c和1.3变体)的AAV9-hSyn病毒注射至C57小鼠幼崽(出生后0-3天)的背侧纹状体(dStr),并在表达3周后制备脑片。成像时,将光激活型DynA8(CYD8)灌注于脑片,使用355 nm激光(50 ms闪光,作用面积3,800μm²)进行光解笼,同时用473 nm LED激发κLight荧光。结果显示,κLight1.3的响应幅度最大(ΔF/F=11%±1.4%),其次是κLight1.2a(9.09%±0.81%)、κLight1.2c(6.84%±0.65%)和κLight1.2b(5.1%±0.51%)。纳洛酮完全阻断了光解笼引发的荧光变化(ΔF/F=0.5%±0.1%),证实该变化源于配体依赖性探针激活,而非紫外光干扰。尽管κLight1.3的ΔF/F最高,但其信号衰减较慢(tauoff=202.1 s,而tauoff:κLight1.2a = 179.7 s、κLight1.2b = 246.1 s、κLight1.2c = 165.0 s),可能因其对强啡肽的高亲和力导致解离延迟。
为验证κLight表达是否影响内源性阿片受体功能,研究者选用衰减较快的κLight1.2a进行海马电生理实验。将编码κLight1.2a或GFP对照的AAV病毒注射至C57幼鼠海马,3周后制备急性切片。通过记录CA1区锥体细胞的抑制性突触后电流(IPSC),评估DynA8光解笼对表达μOR、δOR的小清蛋白(PV)中间神经元突触传递的调控(虽然Dyn A8的主要靶标是κOR,但它也与µOR和δOR结合)。结果显示,355 nm激光(5 ms闪光)可快速、功率依赖性地抑制IPSC幅度,且κLight1.2a表达组与GFP对照组的抑制程度和恢复时程无显著差异,表明探针未显著缓冲配体从而干扰内源性阿片受体激活。
接下来,研究者进一步测量DynA8的时空扩散:将AAV1-hSyn-κLight1.2a注射至dStr,3周后使用聚焦的355 nm激光(25μm直径光斑)快速光解笼微量DynA8,并在125μm范围内监测探针激活。发现ΔF/F峰值随时间和距解笼位点距离的增加而降低。通过分析荧光信号的空间分布和半峰宽,计算出DynA8在dStr的有效扩散系数(D*)为1.4±0.4μm²/s(n=7切片,来自4只小鼠),表明DynA8在释放后数秒内可扩散至100μm外的受体。
4.通过电刺激实现强啡肽释放的双光子成像
长期以来,确定能有效触发脑组织内源性阿片肽释放的电刺激参数一直存在挑战。因此,作者研究了κLight能否在离体条件下检测电刺激诱导的内源性阿片肽释放。首先,通过引入来源于催产素探针MTRIAOT的接头序列CYKIWRNFKGK(接头1)和SVISKAKIRTV(接头2),提升了κLight1.3的基础荧光强度。这一新变体命名为κLight1.3a,其动态范围与原版相似(κLight1.3为155%±11.6%,κLight1.3a为152%±29.5%,P=0.92,非配对t检验),但基础亮度为原版2倍多(κLight1.3为25±0.08,κLight1.3a为61.8±7.6,P=0.0075,非配对t检验)。为验证κLight1.3a的选择性是否保留,研究人员在海马神经元培养体系中通过原位滴定实验测试了其对DynA13、ME和β-内啡肽的响应。结果显示,κLight1.3a对DynA13具有显著选择性。免疫反应研究表明,齿状回颗粒细胞中储存着丰富的强啡肽,而CA3区的强啡肽动力学与应激行为模式相关,且强啡肽可通过抑制兴奋性神经传递阻碍海马长时程增强的诱导。研究者通过联合注射AAV1-CAG-DIO-κLight1.3a和AAV1-hSyn-Cre病毒,在CA3区实现了κLight1.3a稀疏表达。表达3周后,双光子成像显示CA3区和齿状回神经元被明亮标记,基底状态下可见清晰神经突起,且视野内响应信号呈现空间分布特征(齿状回颗粒细胞与CA3区锥体细胞间存在兴奋性突触连接)。
接下来,研究人员通过局部电刺激电极评估了CA3区不同电刺激参数对κLight1.3a响应的影响。50 Hz、持续1秒的电刺激串(刺激间隔0.5秒)引发了持续荧光增强,刺激终止后信号快速衰减。刺激次数与最大荧光响应呈正相关(15次刺激:14.3%±2.4%;10次刺激:8.39%±1.9%;5次刺激:4.28%±0.6%;1次刺激:2.12%±3.3%)。加入κOR拮抗剂nor-BNI(100μM)后,15次刺激引发的响应显著减弱(ΔF/F=1.57%±1.2%),证实荧光升高源于内源性肽激活。而δOR拮抗剂ICI 174864(100μM)虽降低响应,但无统计学显著性(ΔF/F=6.44%±0.3%)。
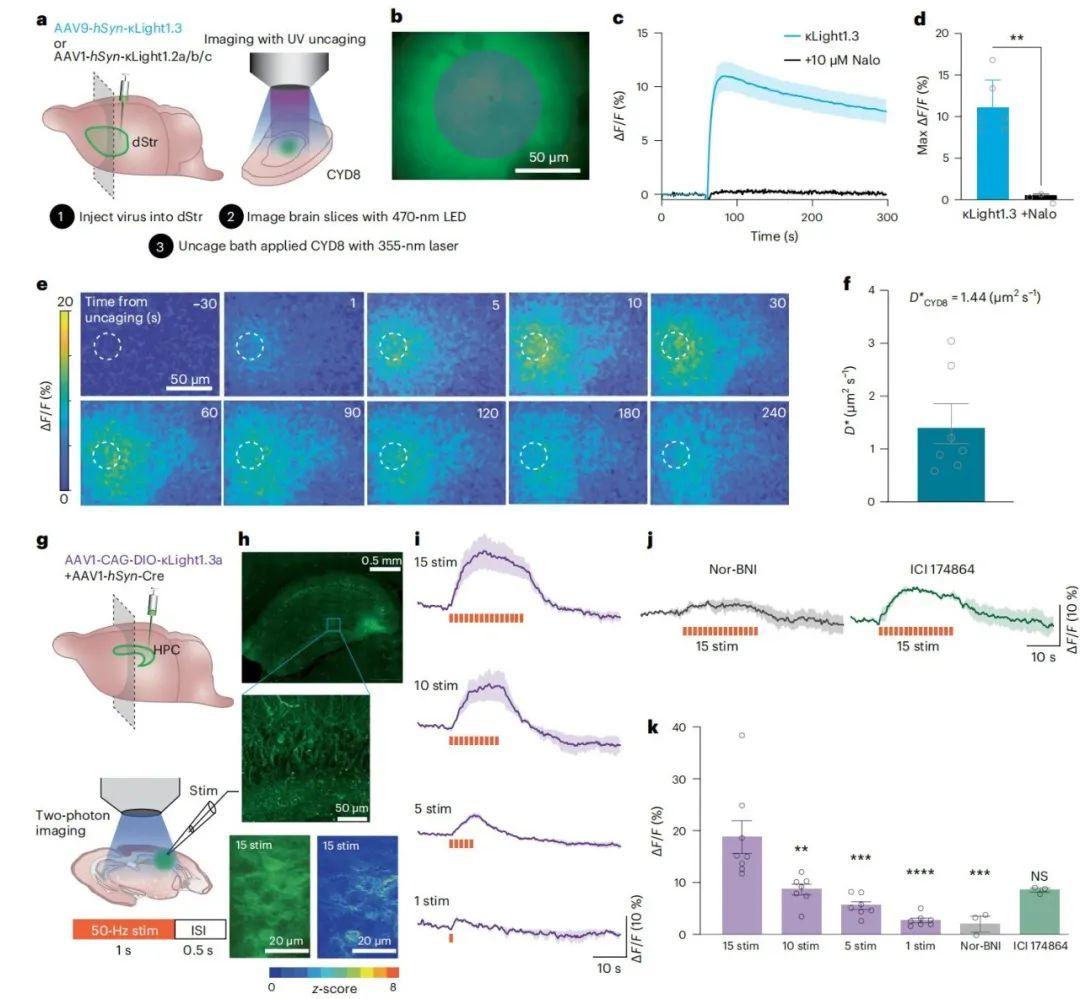
图4.κLight1.3在急性脑片中的表征
5.在体探究受体选择性阿片配体的效应
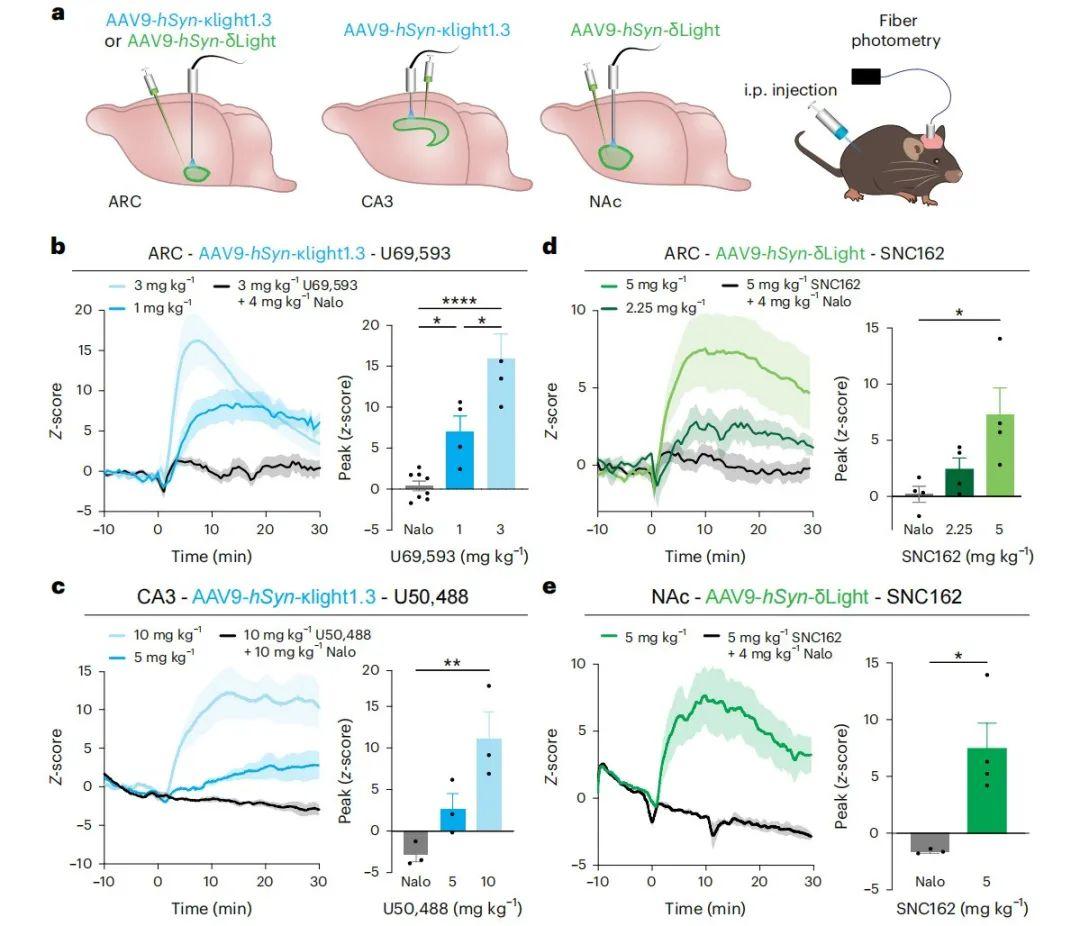
研究人员进一步验证κLight与δLight能否通过系统性给予外源性小分子药物在活体中被激活。通过向富含κOR与δOR的下丘脑弓状核(ARC)、海马CA3区及伏隔核(NAc)注射编码κLight1.3/δLight或对照κLight0/δLight0的AAV9-hSyn病毒,并在各注射位点上方植入光纤插芯。随后利用光纤光度法记录腹腔注射阿片受体选择性配体时κLight与δLight的荧光变化。结果显示,系统性给药均引发剂量依赖性的荧光增强,且该效应可被非选择性阿片受体拮抗剂纳洛酮阻断。在ARC区,κOR选择性激动剂U69593注射后数分钟内即引发κLight1.3的显著荧光升高(1毫克/千克体重:z分数峰值=7.0±1.9;3毫克/千克体重:z分数峰值=15.9±3.05)。联合注射纳洛酮(4毫克/千克体重)可大幅抑制U69593(3毫克/千克体重)的效应(U69593+纳洛酮组z分数峰值=0.39±0.59)。在CA3区,κOR选择性激动剂U50488同样以剂量依赖性方式激活κLight1.3(5毫克/千克体重:z分数峰值=2.68±1.8;10毫克/千克体重:z分数峰值=11.1±3.2),且该响应可被纳洛酮完全阻断(10毫克/千克体重U50488+10毫克/千克体重纳洛酮组z分数峰值=-2.86±0.83)。在ARC区,δOR选择性激动剂SNC162诱导δLight荧光升高(2.25毫克/千克体重:z分数峰值=2.4±1.0;5毫克/千克体重:z分数峰值=7.28±2.4),联合给予纳洛酮(4毫克/千克体重)可消除此效应(5毫克/千克体重SNC162+纳洛酮组z分数峰值=0.19±0.72)。在NAc区,SNC162(5毫克/千克体重)同样引发δLight荧光响应(z分数峰值=7.45±2.20),而纳洛酮(4毫克/千克体重)可完全阻断该现象(SNC162+纳洛酮组z分数峰值=-1.66±0.11)。值得注意的是,当非功能突变探针κLight0或δLight0在ARC、CA3及NAc区表达时,未观察到激动剂诱导的荧光变化。上述结果表明,两种探针在活体内可被受体特异性激动剂准确激活,并具备良好的动态范围、充分的表达水平及光纤信号对齐特性,为后续光遗传学与行为学实验奠定了基础。
图5.利用κLight和δLight成像能力,实现体内药物药理学动态追踪
6.通过神经环路特异性光刺激监测强啡肽释放
尽管光遗传学技术已被广泛用于触发神经调质释放及神经活动,但在活体内直接监测光遗传学刺激诱导的肽类释放——尤其是以高时间分辨率的环路特异性方式——尚未实现光学测量。NAc富含强啡肽,既往研究证实靶向NAc壳区(NAcSh)的Dyn-κOR系统可调节奖赏与厌恶行为。此外,已有工作通过光遗传-透析联用技术在NAcSh成功监测光遗传诱发的强啡肽释放。基底外侧杏仁核(BLA)向NAcSh发出密集且功能性的谷氨酸能投射(兴奋性投射),且这些末梢对Dyn-κOR的调控敏感。因此,研究人员探究κLight能否在BLA至NAcSh的投射通路中监测光刺激诱导的体内释放。
为在κOR表达神经元上检测强啡肽信号,研究者向κOR-Cre小鼠的NAcSh注射AAV5-CAG-DIO-κLight1.3a并植入光纤。部分小鼠的BLA区还注射红光敏感视蛋白ChRimson(AAV5-DIO-EF1a-ChRimson-tdTomato),未表达ChRimson的小鼠作为阴性对照以排除光刺激对κLight1.3a荧光的伪影干扰。首先验证κLight1.3a对激动剂U50488的响应。腹腔注射U50488(10毫克/千克体重)可快速、持续且显著升高κLight1.3a荧光;而预给予短效可逆性κOR拮抗剂JNJ-67953964(aticaprant,3毫克/千克体重)后该效应显著减弱(峰值标准化值:P=0.034;曲线下面积标准化值:P=0.0138;配对t检验),证实了κLight1.3a在体响应的选择性。
随后,作者测试κLight1.3a能否监测谷氨酸能BLA末梢刺激诱发的NAcSh内源性强啡肽释放。1秒、20 Hz、5 ms脉宽的刺激首先引发短暂伪影,随后κLight1.3荧光显著升高。值得注意的是,无论BLA是否表达ChRimson,所有动物均出现相同程度的刺激伪影;但仅在BLA表达ChRimson的动物中观察到κLight1.3a荧光的后续升高(P<0.0001,韦尔奇t检验),表明该升高源于BLA末梢刺激诱发的强啡肽释放。为确定最佳刺激参数,研究人员在同一实验中对刺激次数(1-5次)、激光强度(0.5-5 mW)及刺激时长(1-30秒)进行随机组合测试。意外发现,1秒光刺激引发的κLight1.3a激活最强,而伪影幅度(荧光最低值)保持恒定(P=0.0082,Brown-Forsythe与韦尔奇ANOVA检验),故后续实验均采用1秒、20 Hz、5 ms脉宽参数。
进一步验证BLA末梢刺激诱发κLight1.3a激活的药理学选择性。预注射溶剂(vehicle)或aticaprant(3毫克/千克体重,腹腔注射)后进行10次BLA末梢刺激并监测荧光变化,发现κOR拮抗显著降低刺激诱发的κLight1.3a活性(峰值标准化值:P=0.0365;曲线下面积标准化值:P<0.0001;配对t检验)。假设该效应源于拮抗剂阻断内源性强啡肽与κLight1.3a结合,则κOR激动剂U50488应通过占据结合位点产生类似抑制。注射溶剂或U50488(10毫克/千克体重,腹腔注射)后,发现U50488同样显著减弱刺激诱发的κLight1.3a激活(峰值标准化值:P=0.0022;曲线下面积标准化值:P=0.0072;配对t检验),提示U50488与内源性强啡肽竞争结合κLight1.3a。
最后,为确认κLight1.3活性是否特异性响应强啡肽,研究人员在强啡肽基因敲除(DYN-KO)小鼠及野生型(WT)对照小鼠中重复BLA末梢刺激实验。外源性激动剂U50488(10毫克/千克体重)在两类小鼠中引发相似的κLight1.3激活;而BLA刺激仅在WT小鼠中显著升高κLight1.3活性,DYN-KO动物中该效应显著减弱。综上,这些结果证明κLight可在环路特异性水平上结合光遗传学技术实现末梢刺激诱导的强啡肽释放的触发与测量。
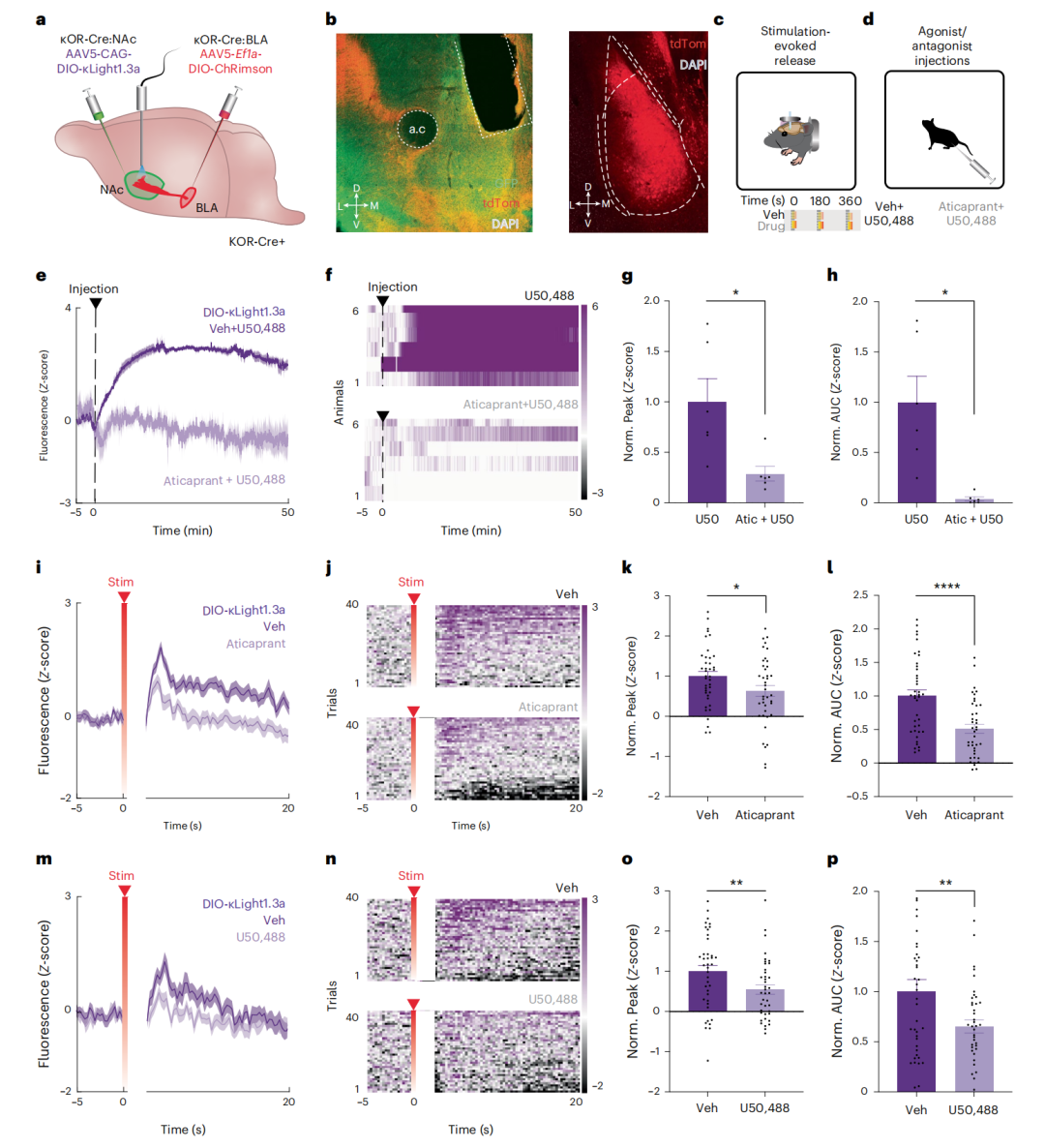
图6.利用κLight1.3a成像光遗传刺激强啡肽释放
7.在体监测行为触发的内源性阿片肽释放
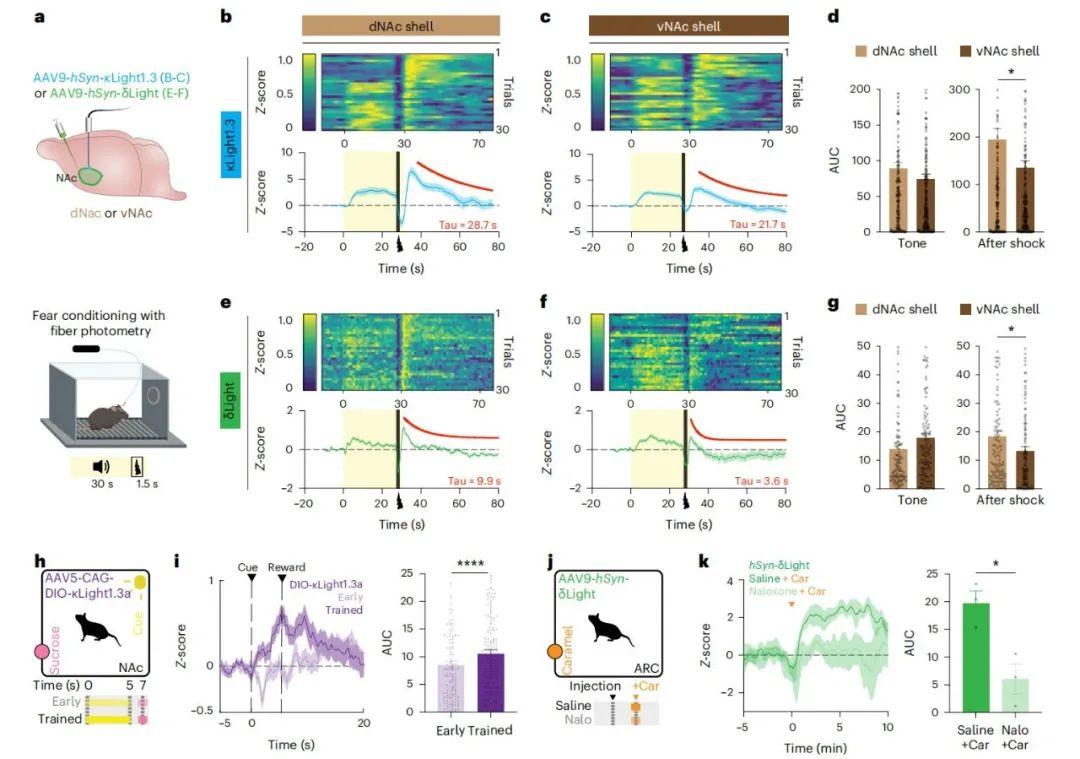
成功监测光遗传学诱发的强啡肽释放后,研究者进一步利用κLight与δLight在恐惧诱导与奖赏条件下监测行为动物的阿片肽动态信号。既往研究指出,NAcSh腹侧(vNAc)与背侧(dNAc)亚区的强啡肽神经元分别参与厌恶与奖赏行为调控。此外,已有研究通过光遗传-透析联用技术实现vNAc与dNAc亚区特异性强啡肽及脑啡肽释放的测量。本研究旨在验证κLight1.3与δLight在恐惧学习过程中监测NAc亚区特异性阿片肽释放的实用性。于是,研究人员向dNAc与vNAc注射AAV9-hSyn-κLight1.3或AAV9-hSyn-δLight并植入光纤,术后3周进行听觉恐惧条件反射实验(30次30秒音调刺激,结尾伴随1.5秒足底电击,0.5 mA),记录肽类瞬时信号。κLight信号显示,音调启动后dNAc与vNAc荧光强度迅速上升并在音调持续期间维持高位,电击起始时小幅下降,随后足底电击引发大幅荧光升高,约40秒后逐渐恢复基线(dNAc衰减时间常数Tau=28.7 s,vNAc Tau=21.7 s)。通过单次试验曲线下面积(AUC)分析亚区间差异发现,音调诱发的AUC在dNAc与vNAc间无显著差异,但电击后响应AUC在dNAc显著高于vNAc(dNAc AUC=194±24,vNAc AUC=135±15,P=0.0355,非配对t检验)。对照组表达κLight0时未观察到恐惧学习期间的荧光变化。
dNAc区δLight信号显示,音调触发短暂荧光升高后逐渐回落至基线,而足底电击引发大幅荧光升高并在10秒内快速衰减(dNAc Tau=9.9 s,vNAc Tau=3.6 s)。尽管vNAc音调诱发AUC略高于dNAc,但差异不显著;电击诱发AUC在dNAc仍显著更高(dNAc AUC=18±1.8,vNAc AUC=13±1.4,P=0.0276,非配对t检验)。对照组δLight0对音调与电击的荧光响应显著减弱。上述数据表明,κLight与δLight可准确反映恐惧学习过程中内源性阿片肽释放的亚区差异。值得注意的是,κLight的电击后信号在早期试验中幅度更大、持续时间更长,且随试验次数增加,响应逐渐从电击转移至音调,而δLight未呈现此模式,提示强啡肽等阿片肽可能动态追踪NAcSh的恐惧状态。
为探究κLight监测奖赏触发内源性强啡肽释放的效用,研究者在NAc记录κLight1.3a对巴甫洛夫条件反射的响应。向κOR-Cre小鼠NAc注射AAV5-CAG-DIO-κLight1.3a并进行经典奖赏训练,发现早期试验中奖赏递送未引发荧光升高,但随训练推进,动物奖赏消耗增加后,奖赏递送与消耗期间κLight1.3a荧光显著升高(早期AUC=8.4±0.739,训练后AUC=10.51±0.77,P<0.0001,配对t检验),这些结果表明NAcSh强啡肽神经元亚群参与奖赏强化。
同步监测ARC区δLight在小鼠获取焦糖奖赏时的荧光变化。生理盐水组焦糖获取后δLight信号升高,而预注射纳洛酮(4毫克/千克体重)可阻断此效应(生理盐水AUC=20±2.3,纳洛酮AUC=6±2.7,P=0.0197,非配对t检验)。对照组δLight0在两种条件下均无响应。综上,κLight与δLight可全程追踪厌恶与奖赏行为中内源性阿片肽释放的动态变化。
图7.厌恶和奖赏行为期间强啡肽和脑啡肽动力学成像
总结
本研究开发并表征了基因编码阿片受体探针,实现多种实验场景下阿片肽的高分辨率动态追踪。基于G蛋白偶联受体(GPCR)的探针已成为监测清醒动物神经调质信号的重要工具,早期应用于生物胺与乙酰胆碱检测,近年逐步扩展至催产素、食欲素等NPs。阿片系统的广泛生理意义使得此类探针的开发成为神经科学工具库的关键补充。
本研究进一步验证了κLight与δLight在追踪奖赏与厌恶行为触发的内源性阿片肽快速动态释放中的应用潜力,并揭示脑区亚区域的信号差异。总体而言,κLight与δLight能够响应包括多种强啡肽形式及脑啡肽在内的大部分内源性阿片NPs。然而,阿片受体与肽类的交叉反应性导致探针特异性受限——由于多数脑区富含多种阿片NPs,探针难以可靠区分激活其信号的具体肽类。尽管通过强啡肽基因敲除(DYN-KO)动物的实验数据表明κLight对内源性强啡肽监测具有较高特异性,但未来仍需结合结构分析与工程化改造进一步降低交叉反应性。
此类阿片探针有望广泛应用于探究内源性阿片肽信号在疼痛、应激、奖赏及药物成瘾等生理与病理状态中的作用机制。通过监测行为动物中环路特异性的肽类释放,可能揭示阿片系统在行为状态转换与关联学习中的新功能;通过光遗传学操控或行为学刺激触发阿片肽的离散释放事件,同步进行实时监测,有助于解析不同药理、行为或疾病状态下阿片释放的异质性。尽管药理学、光药理学与光遗传学已极大推动了阿片受体信号研究,但这些探针将研究焦点从受体激活的下游效应转向内源性NPs释放对大脑复杂功能的调控,为深入理解阿片系统的时空动态提供了全新视角。
我司可提供κLight、δLight病毒产品,列表如下:


详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK