2025-05-12 阅读量:1729
一、技术简介
膜片钳(Patch Clamp)技术是一种高精度的电生理学检测手段,通过将玻璃微电极与细胞膜形成高阻抗封接,能够精确测量细胞膜上的离子通道电流和膜电位变化。该技术由德国科学家Erwin Neher和Bert Sakmann于1976年首次在青蛙肌细胞上成功应用,并因此荣获1991年诺贝尔生理学或医学奖。
膜片钳技术的核心优势在于其极高的灵敏度和分辨率。它能够直接记录单个离子通道的电流活动,灵敏度可达皮安(pA)级别,甚至可以捕捉到毫秒级的电流变化。因此,膜片钳技术是离子通道研究的金标准。这项技术不仅为研究细胞信号传导机制提供了重要工具,还推动了神经科学、心血管生理学、细胞生物学和药物研发等多个领域的重大进展。
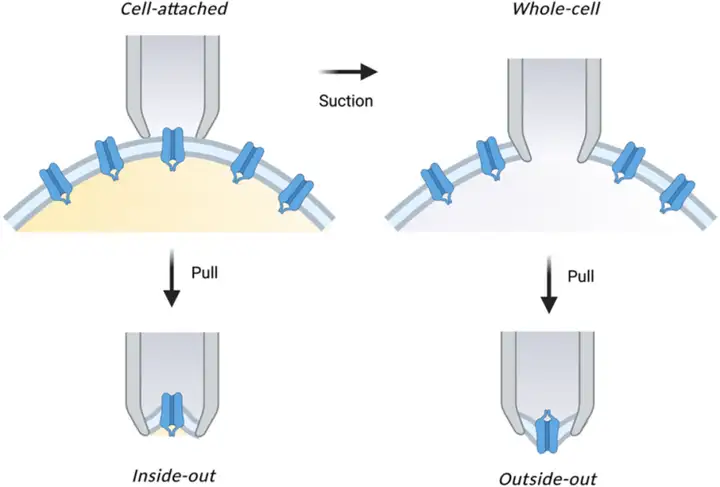
膜片钳技术根据研究目的不同可分为四种基本记录模式:
细胞贴附式(Cell-Attached Patch)
细胞贴附式记录是通过将玻璃微电极靠近细胞表面并轻轻接触,施加轻微负压形成高阻抗封接,从而记录膜片上离子通道的活动。此模式保持细胞膜的完整性,不影响细胞内环境,适合研究离子通道的天然调控机制。
全细胞记录(Whole-Cell Recording)
全细胞记录从细胞贴附模式开始,继续施加负压使电极尖端下的细胞膜破裂,电极内液与细胞内液连通。这种模式可以记录整个细胞膜上所有通道的总电流,广泛应用于药物筛选和细胞电生理特性研究。
内面向外式(Inside-Out Patch)
内面向外式记录是在细胞贴附模式下,形成高阻抗封接后,快速将电极从细胞膜上移开,使附着在电极尖端的细胞膜形成囊泡。将囊泡暴露于低钙溶液中,其外表面破裂,形成内面向外的记录模式,便于研究细胞内信使物质对通道的调控。
外面向外式(Outside-Out Patch)
外面向外式记录从全细胞记录模式开始,轻轻将电极从细胞膜上“拔下”,使电极尖端的细胞膜重新融合。此时细胞膜的外侧面暴露于电极尖端外,形成外面向外的记录模式,适合研究细胞外配体或药物对通道的影响。
膜片钳的基本记录模式(Hamza, Atcha et al., Current opinion in solid state & materials science, 2021.)
二、技术原理
膜片钳技术的核心在于其独特的高阻封接机制和精密的电流检测系统。基本原理是通过玻璃微电极(尖端直径通常为1~2微米)与细胞膜之间形成高达10⁹欧姆的电阻封接,使电极尖端吸附的一小片细胞膜(面积仅几平方微米)在电学上与周围膜区域完全隔离。这种电学隔离是记录单个离子通道微弱电流(皮安级)的关键前提。
三、技术应用
1.神经系统研究
神经元电生理特性:记录神经元的动作电位、突触后电流(EPSC和IPSC),研究神经信号的传递机制。
神经环路功能:结合光遗传学或化学遗传学等技术,研究特定神经环路的功能。
2.心血管系统研究
心肌细胞离子通道:检测心肌细胞中的hERG、Nav1.5和Cav1.2等离子通道,研究心脏节律控制。
药物心脏毒性评估:通过检测药物对hERG通道的抑制作用,评估药物的心脏毒性。
细胞膜离子通道功能:研究细胞膜上各种离子通道的电流特性、电压依赖性和激活机制。
细胞内信号传导:通过内面向外式记录,研究细胞内信使物质对离子通道的调控。
药物作用机制:检测化合物对离子通道的活性影响,筛选具有潜在药理活性的化合物。
药物安全性评估:评估药物对细胞膜离子通道和膜电位的影响,预测药物的毒副作用。
分泌细胞研究:通过膜电容测量,研究分泌细胞的活动,如胰岛素分泌。
疾病机制研究:分析病理状态下细胞电生理特性的变化,探索疾病发生机制。
四、服务内容及流程
1.培养细胞膜片钳记录系统
(1)可检测的细胞样本包括:分离培养的原代神经元,经瞬时转染表达外源通道蛋白的HEK293/CHO细胞,以及各种稳定表达特定通道蛋白的稳转细胞系。
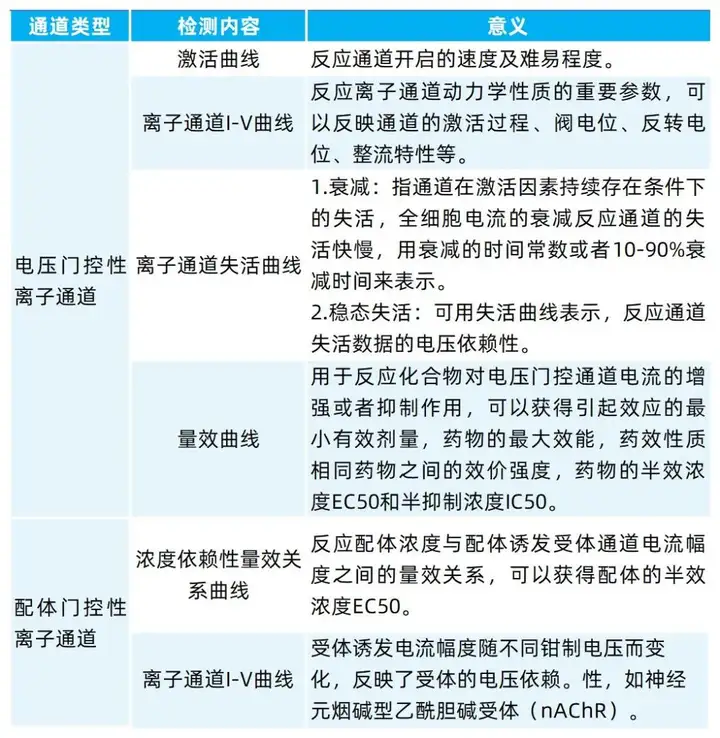
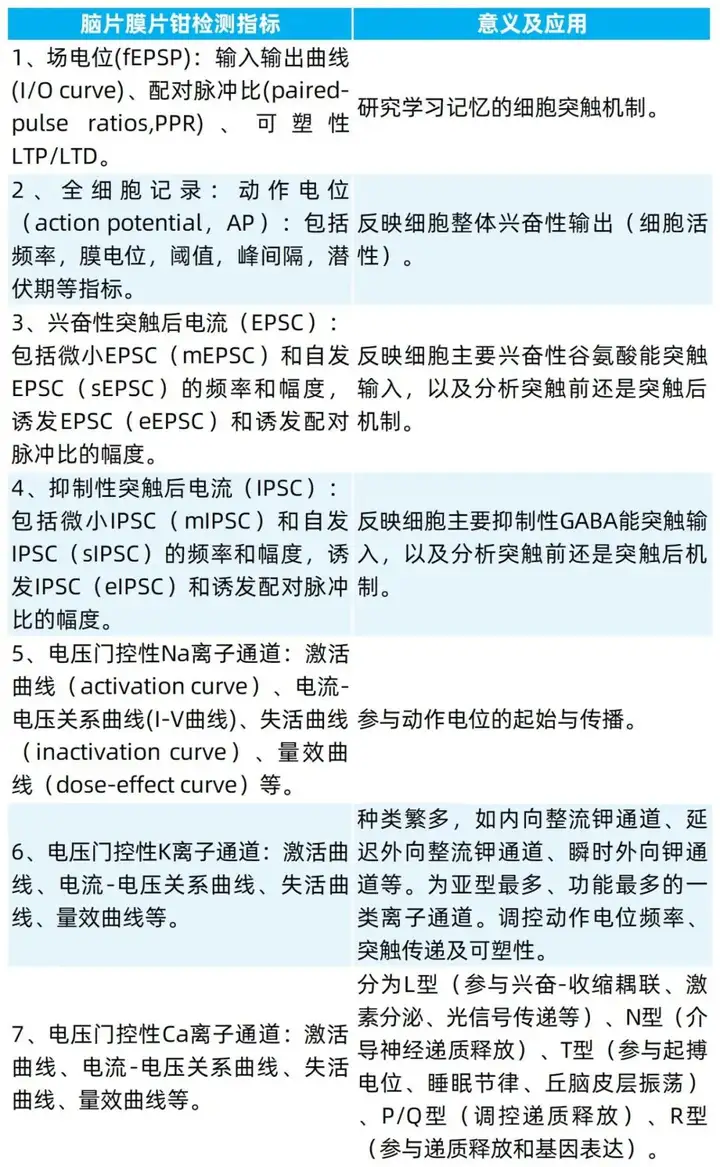
(2)检测指标
(3)我司可用的稳转细胞系
电压门控:hERG(HEK293)、hKv4.3(CHO-K1)、hKv7.1(CHO-K1)、hKir2.1(CHO-K1)、hCav1.2(HEK293)、hNav1.5(HEK293)、hNav1.8(CHO-K1);
配体门控:GABA(CHO-K1)、nAChR(CHO-K1)、5-HT(CHO-K1)。
(1)植入单通道电极记录目标脑区局部场电位(LFP);
(2)植入多通道电极记录目标脑区的局部场电位(LFP)及单细胞放电(Spikes);
(3)睡眠脑电图(EEG)/肌电图(EMG);
(4)癫痫放电;
(5)腹部肌电。
客户需提供的内容/材料:
(1)详细的实验需求及参考资料;
(2)实验模型/样本,保证样本质量;
(3)分析需求。
公司提供:
(1)检测报告;
(2)原始数据。
五、数据展示
1.体外培养细胞记录案例
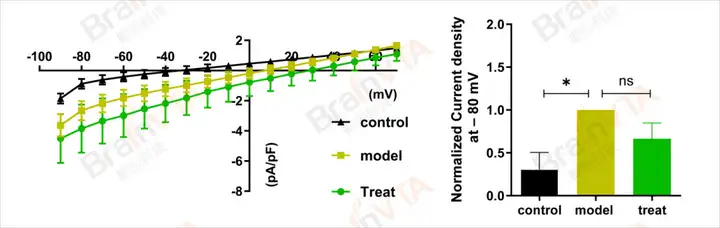
图1:通过电压斜坡记录BV2细胞(小胶质细胞系)的离子通道电流,结合膜电容计算电流密度,并绘制电流密度-电压(I-V)关系曲线
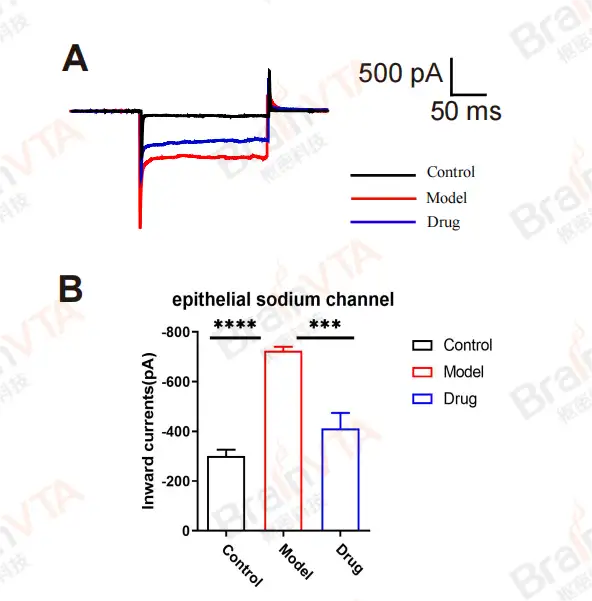
图2:应用全细胞膜片钳技术记录上皮细胞Na+通道内向电流
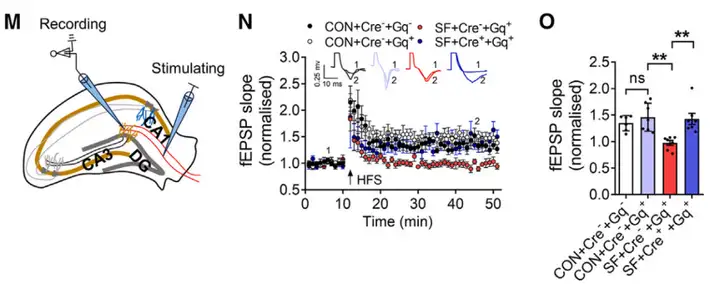
图3:海马CA1区锥体细胞胞体的全细胞膜片钳记录(He Q, Ji L, Wang Y, et al,. Cell Metab, 2024. 客户文章)
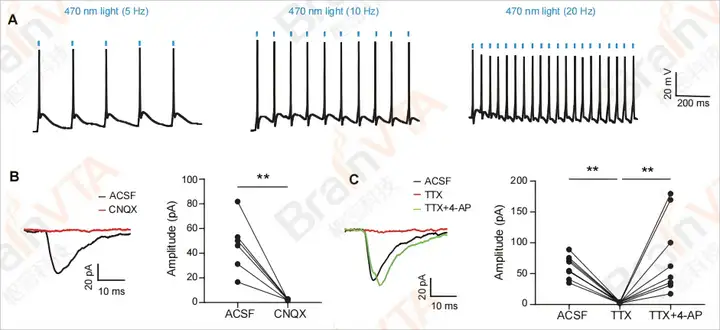
图4:动作电位(APs)及光诱发电位/电流的全细胞记录
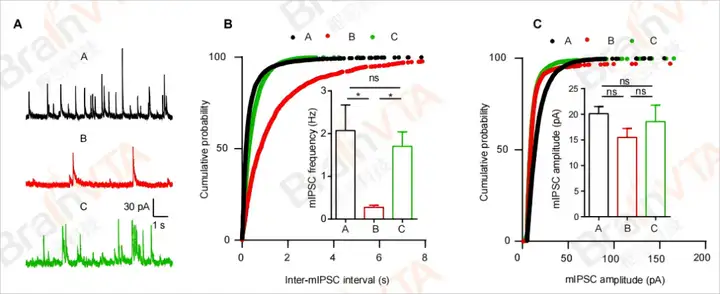
图5:自发抑制性突触后电流(sIPSCs)的全细胞记录
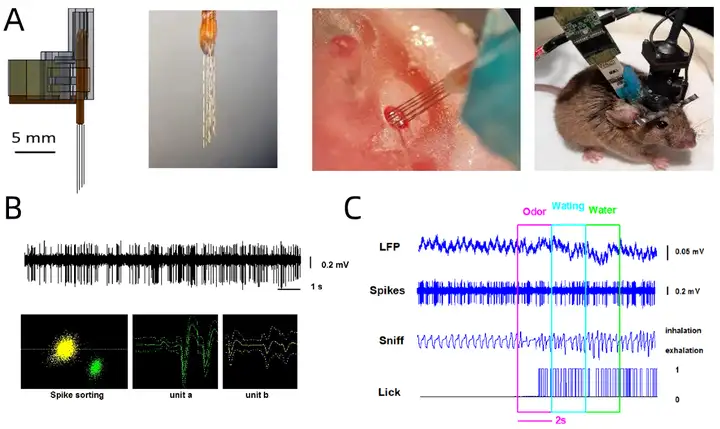
图6:(A)在动物特定脑区植入多通道电极。(B)细胞外记录的原始电信号图及从中分选得到的两个单单位放电波形图。(C)同步记录到的局部场电位(LFP)、动作电位(Spikes)、呼吸(Sniff)、舔水(Lick)信号图。
图7:脑电功能频谱、脑电、肌电、α波、δ波、θ波以及睡眠-觉醒状态典型图
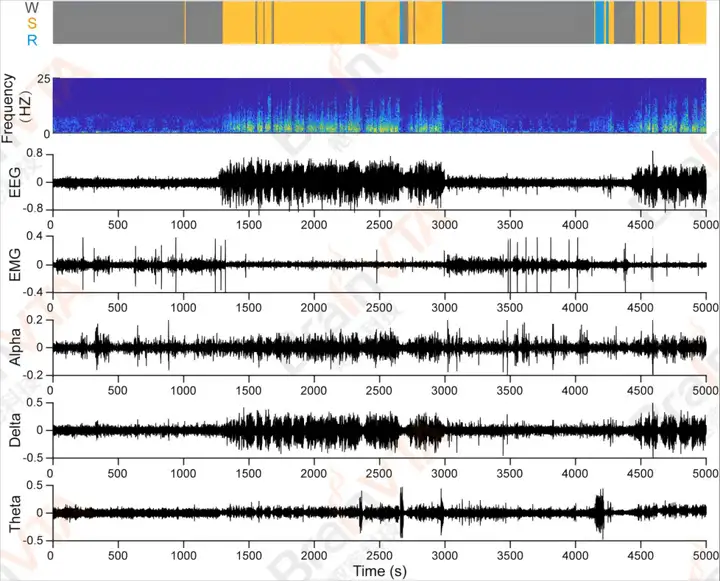
图8:动物癫痫模型脑电检测与分析(Kätzel D, Nicholson E, Schorge S, et al., Nat Commun, 2014.)

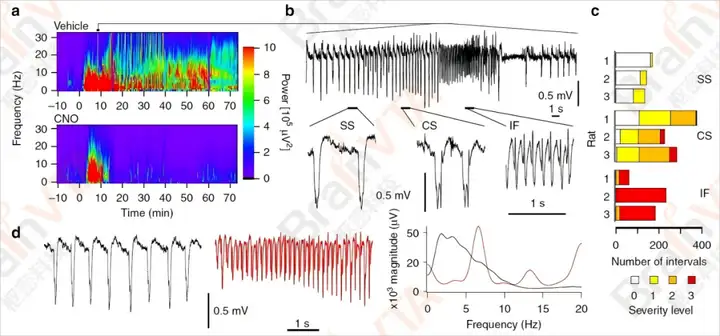
详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK