2025-04-24 阅读量:1016
神经元通过响应和产生多种跨膜电压动态来处理和传递信息。这些膜电位变化在幅度和时间尺度上具有多样性,因细胞类型而异,并在亚细胞区域间传播。例如,在哺乳动物兴奋性神经元中,动作电位(Action Potentials, APs)与突触传递事件在电生理特性上呈现显著差异:动作电位具有约100 mV的幅值,持续时间通常短于5毫秒;而由单个突触囊泡释放介导的单一突触传递事件(unitary synaptic transmission event),当在胞体处记录时,其幅值通常低于5 mV,但时程可延长至数十毫秒。此外,这些单一事件在健康大脑的信息处理中至关重要,同时也是疾病中突触功能障碍的敏感标志。当在没有AP触发的情况下自发释放时,单个突触事件被称为微小兴奋性突触后电位(mEPSPs)。测量mEPSPs的频率或相应的微小兴奋性突触后电流(mEPSCs)可以揭示培养神经元(包括人类干细胞衍生的神经元)的突触前或突触后功能缺陷。然而,迄今为止,mEPSPs或mEPSCs的测量只能通过膜片钳电生理学实现,这种方法本质上通量较低,成为表征疾病突变的突触效应或筛选纠正药物的限速因素。在过去十年中,遗传编码电压指示剂(GEVIs)取得了显著进展,目前在小鼠大脑中对APs和阈下事件进行单次试验成像已成为常规操作。然而,对于mEPSPs的可靠单次试验检测尚未实现。
来自斯坦福大学的Michael Z. Lin在Neuron上发表了一篇题为“A fast and responsive voltage indicator with enhanced sensitivity for unitary synaptic events”的研究论文。该文介绍了新型GEVI——ASAP5的开发,其在静息膜电位附近的激活动力学和响应灵敏度显著增强,能够更准确地检测APs发放和阈下活动。ASAP5在体内检测APs时,信噪比(SNR)高于以往的GEVIs,并且在单次双光子试验中成功检测到对感觉刺激的分级和阈下反应。在培养的大鼠或人类神经元中,ASAP5能够检测到向心传播的突触事件,并且可以检测到低至1 mV的兴奋性突触后电位(EPSPs)。通过对整个树突的自发EPSPs进行成像,作者发现EPSPs幅度在传播过程中呈指数衰减,且起始点的幅度通常随距胞体距离的增加而增加。这些结果将电压成像的应用扩展到量子响应领域,且适用于人类神经元,为在疾病中对神经元功能障碍进行高通量、高内涵的表征提供了可能。
枢密科技重磅推出升级版电压探针工具——AAV-hSyn-ASAP5-Kv2.1-WPRE!该探针基于尖端光学技术,具备快速响应和高灵敏度特性,能精准捕捉单个突触事件,在多种成像模式下均表现出色,为神经科学研究提供强大支持。选择枢密科技,开启神经电压检测新纪元!
1、ASAP5的性能优化与表征
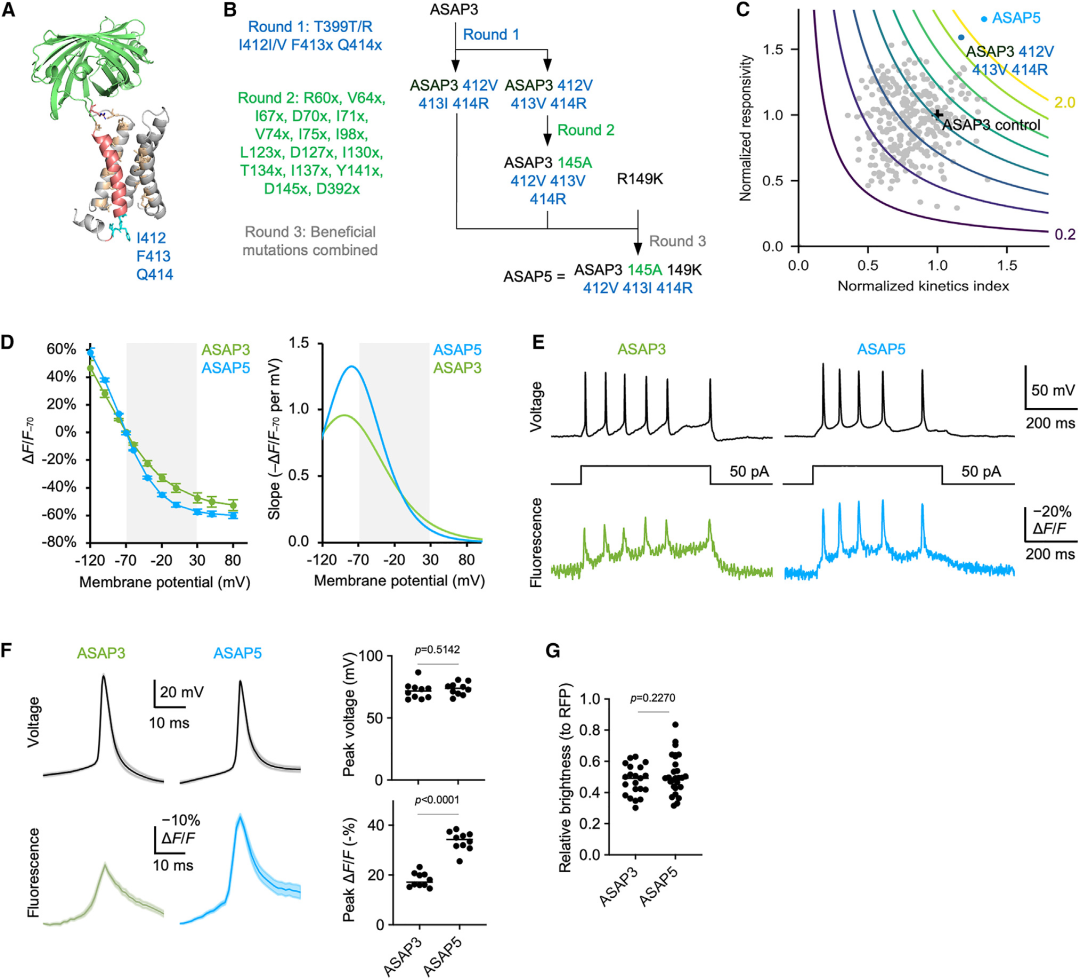
为了开发出更灵敏、响应更快的GEVIs,研究人员以ASAP3为基础,通过一系列优化策略成功开发出新型GEVI——ASAP5。在以往对ASAP3和ASAP4进行的突变筛选中,研究人员发现T399、I412、F413和Q414位点的保守突变能够调节电压调谐和激活动力学。由于这些位点预计会与脂质双层接触,研究人员首先设计了一个包含324个突变体的文库,这些突变体在F413和Q414位点上进行了9×9种氨基酸的组合突变,并结合了T399T/R和I412I/V突变。通过优化这些位点的氨基酸组合,研究人员希望通过优化ASAP3与周围脂质环境之间的相互作用,降低S4(电压感应元件)电压感应螺旋移动的能量障碍,从而提升灵敏度和动力学性能。为了筛选出性能更优的传感器,研究人员搭建了一个能够以高时间分辨率测量传感器荧光在-70-0 mV之间近乎瞬时电压跃变变化的平台。借助该平台,研究人员在第一轮筛选中将稳态荧光变化(ΔFsteady/F₀)与一个动力学指数相乘,对ASAP3的突变体进行排名。这个动力学指数反映了在6.66 ms内达到的完整响应的比例,以此估算对APs的相对响应。最终筛选出了ASAP3 I412V F413V Q414R(ASAP3 VVR)和ASAP3 I412V F413I Q414R(ASAP3 VIR)。在第二轮筛选中,研究人员对ASAP3 VVR中与电压感应S4螺旋接触的16个位点进行了所有可能的氨基酸突变,构建了第二个包含320个突变体的文库。这一轮筛选确定了D145A和D145C作为性能更优的突变体。最终,通过膜片钳电生理记录测试了8种D145A/C与附近连接突变R149K在ASAP3 VVR和ASAP3 VIR中的组合,筛选出了对APs样波形响应最大的突变体ASAP3 VIR D145A R149K,将其命名为ASAP5。
在性能测试中,与早期ASAP家族的GEVIs——ASAP3、JEDI-1P和JEDI-2P相比,ASAP5在从-70 mV去极化至30 mV时荧光下降了57%,灵敏度提升了20%(相较于ASAP3)。其荧光-电压(F-V)曲线在静息膜电位(-70 mV)处的斜率更陡,F-V转换比率达到每毫伏1.3%,显著高于其他几类GEVIs(相比之下,ASAP3为0.9%,JEDI-1P为0.9%,JEDI-2P为0.7%)。激活和去激活动力学表征实验显示,ASAP5是ASAP家族中激活和去激活速度最快的成员。在实际应用测试中,ASAP5对2 ms的动作电位波形的响应幅度比JEDI-1P或JEDI-2P高出约40%,在注入电流的大鼠海马神经元中,ASAP5的荧光信号与电生理响应在阈下和阈上成分上表现出良好的一致性,且对电流诱发的APs的荧光响应幅度较ASAP3提升2倍。这些结果表明,ASAP5不仅在灵敏度和动力学上优于前代GEVIs,还能够在实际神经元活动中提供更准确的电压信号检测。
图1. ASAP5的蛋白质工程和生物物理特性
2、ASAP5在单光子照射下的体内性能
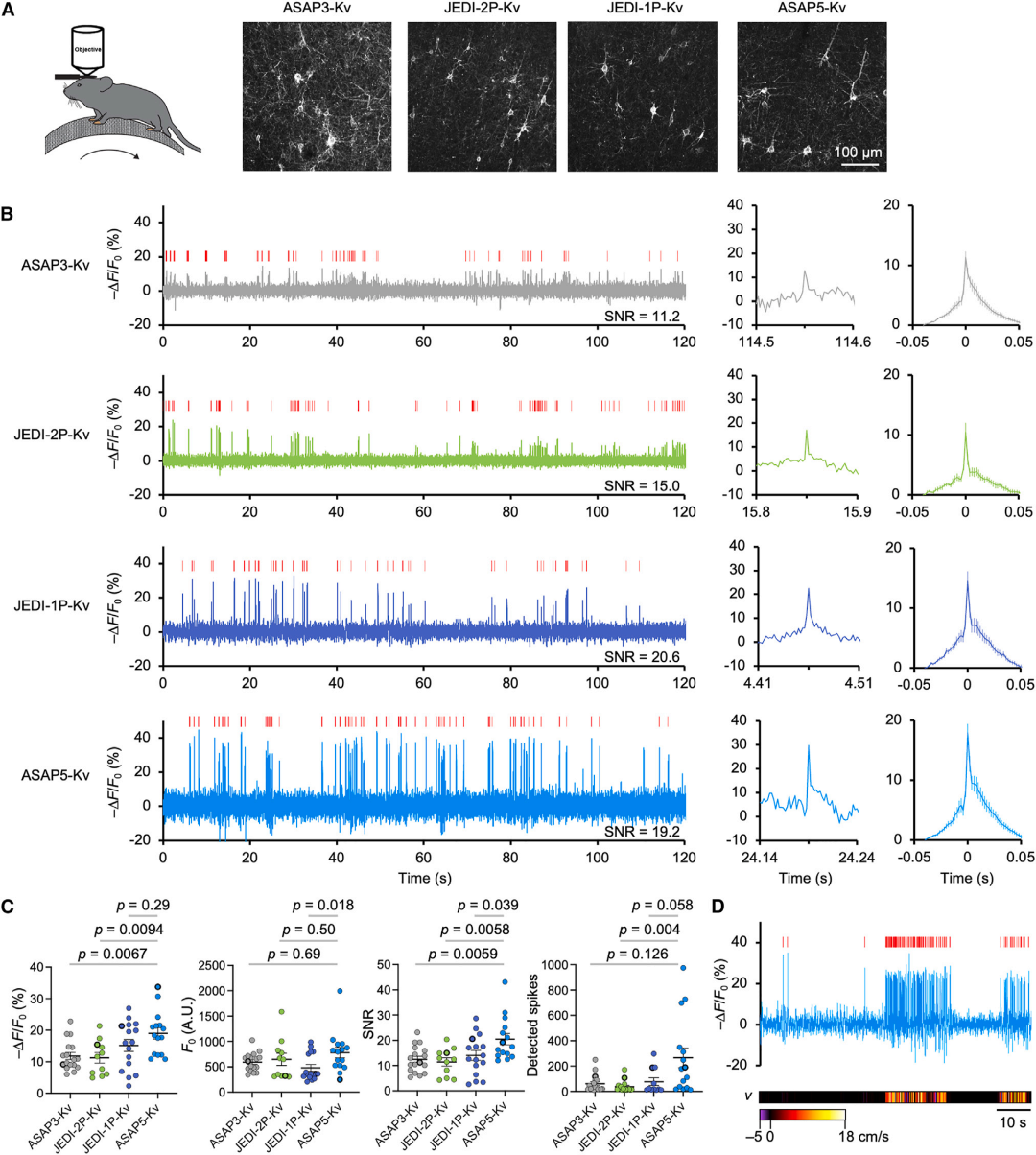
研究人员在清醒行为小鼠中测试了ASAP5的性能,并与其他GEVIs在单光子照射下的表现进行了比较。实验通过共注射CaMKIIa-cre腺相关病毒(AAV)和cre依赖的AAV载体[分别表达ASAP3-Kv、JEDI-1P-Kv、JEDI-2P-Kv或ASAP5-Kv,Kv代表Kv2.1钾通道的近端保留与聚集信号,可促进蛋白在胞体区域的富集。]来实现运动皮层神经元的稀疏标记。利用光学窗口和sCMOS相机(一种科学级互补金属氧化物半导体相机,用于高灵敏度和高速成像)以500 fps(帧/秒)的速度成像,检测到与APs幅度和持续时间相符的光学尖峰信号,其中ASAP5-Kv在APs检测中展现出显著更高的SNR,优于其他GEVIs。在一些神经元中,ASAP5-Kv的光学尖峰信号与小鼠的跑步行为相关,这与运动皮层锥体神经元的APs特征一致。此外,研究人员在小鼠海马区对比了ASAP5-Kv和ASAP3-Kv,发现ASAP5-Kv的SNR比ASAP3-Kv高出80%。在斑马鱼视顶盖神经元中,ASAP5-Kv同样在单光子光片显微镜下展现出比ASAP3-Kv更高的SNR。
研究还发现,ASAP5-Kv相较于ASAP3-Kv和JEDI-2P-Kv更高的单AP SNR主要来源于更大的相对荧光变化(ΔF/F₀),而非亮度提升;而与JEDI-1P相比,ASAP5-Kv的SNR优势则归因于更高的基线亮度(F₀)。这表明,通过提高相对荧光变化或基线亮度中的任何一个参数,都可以在光子噪声限制条件下提升SNR,因为SNR与ΔF/√F₀相关,等同于ΔF/F₀×√F₀。简言之,ASAP5结合了JEDI-1P更大的ΔF/F₀和ASAP3及JEDI-2P更高的亮度,从而在单光子成像中实现了比以往GEVIs更高的SNR。
图2. ASAP5在单光子照射下的体内性能比较
3、果蝇中分级电位和APs的单次试验成像
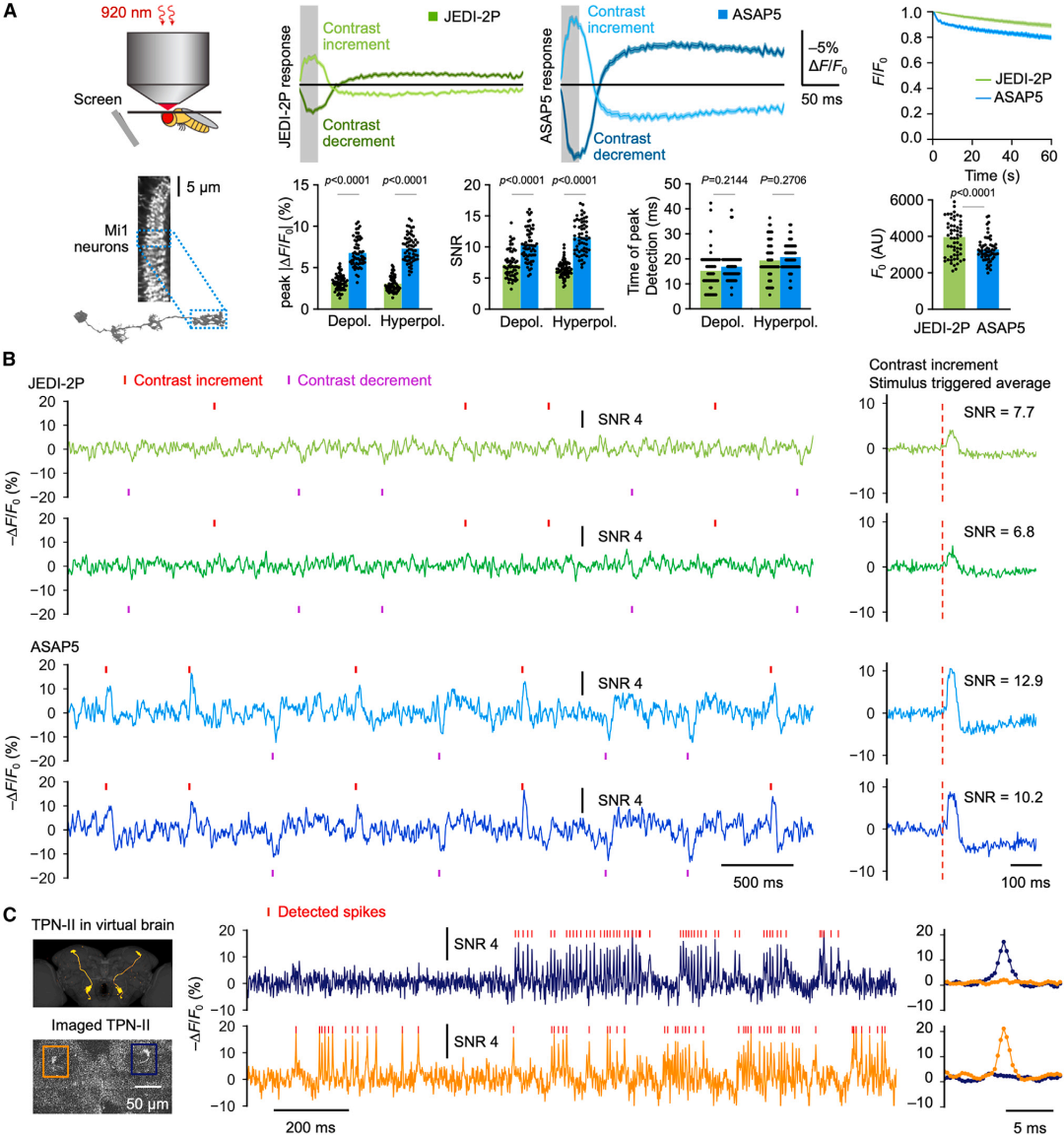
研究人员进一步验证了ASAP5在果蝇中的应用表现。研究结果表明,ASAP5在双光子成像条件下,对果蝇Mi1神经元(参与视觉信息的处理)的去极化和超极化反应的检测能力显著优于JEDI-2P。具体而言,ASAP5的响应幅度比JEDI-2P高出约100%,SNR高出60%,而JEDI-2P的基线亮度则高出20%,且光稳定性略好。此外,ASAP5在L2神经元(大脑皮层第2层中的神经元)中也表现出更高的响应幅度。值得注意的是,ASAP5首次在果蝇中实现了单次试验对分级反应和APs的成像。在Mi1神经元中,ASAP5能够清晰地报告由视觉刺激引发的兴奋性和抑制性分级电位,而JEDI-2P由于SNR较低,难以区分这些信号。此外,ASAP5在两边对称的温度投射神经元(TPN-II)中成功检测到APs,通过采用779 fps的共振振镜扫描或3.3 kHz的声光偏转器(AOD)基础的随机访问扫描,均实现了相似的SNR以及对每个尖峰的多次测量。AOD的快速任意位置激发能力使得研究人员能够在3.3 kHz下同时记录两个TPN-II神经元的活动,并发现它们以不相关的方式发放APs,这与它们接收的独立输入一致。以上结果表明,ASAP5在果蝇中实现了对分级电位和APs的单次试验成像,其灵敏度和信噪比显著优于前代GEVIs。
图3. 果蝇中分级电位和APs的单次试验成像
图4. 采用不同成像方式对L2分级电位和TPN-II APs进行单次试验成像
4、小鼠中APs和阈下电位的单次试验成像
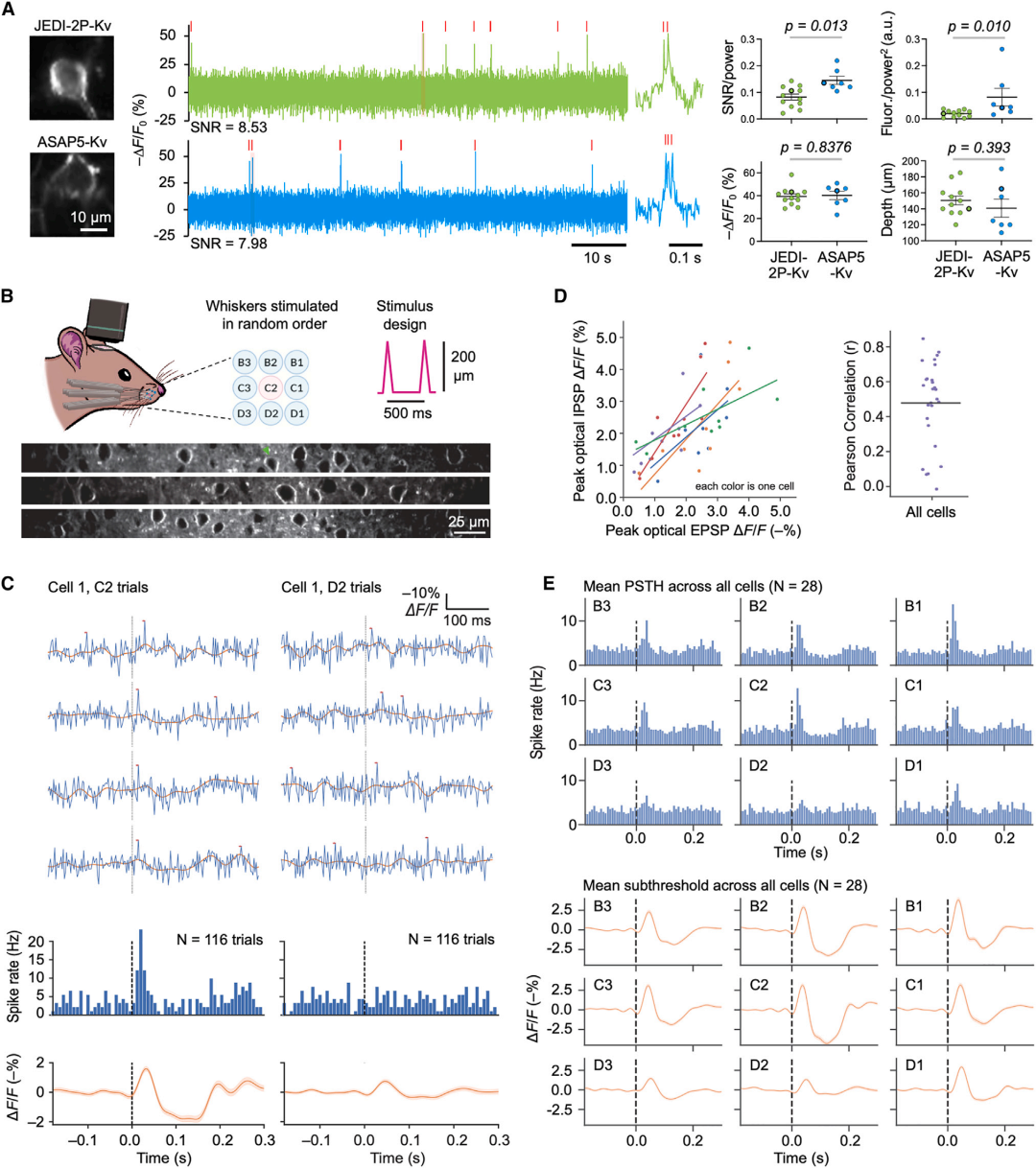
接下来研究人员在小鼠皮层的锥体神经元中,比较了ASAP5-Kv和JEDI-2P-Kv在双光子照射下的表现。以500 fps记录的ASAP5-Kv和JEDI-2P-Kv的光学尖峰在响应幅度上相似,但ASAP5-Kv展现出更高的亮度和SNR。这与在果蝇Mi1视觉神经元中对ASAP5和JEDI-2P的观察结果不同,因此作者推测这两种指示剂的相对亮度可能取决于是否存在细胞体定位标签或实验系统的差异。值得注意的是,ASAP-5-Kv和JEDI-2P-Kv在双光子照射下均展现出优异的光稳定性,在一次实验中,ASAP5-Kv以500 fps的速度连续记录电压信号超过1小时,期间SNR未出现明显下降。为了更精确地测量体内光学尖峰的宽度,研究人员利用超快速局部体积激发(ULoVE)随机访问双光子显微镜技术,以7142 fps的高采样率记录小鼠视觉皮层第2/3层的单个ASAP5-Kv表达锥体神经元。高采样率使得APs事件能够被细分为缓慢上升的总和阶段和快速的阈后尖峰阶段,其快速光学尖峰的半高全宽(FWHM)在亚毫秒到2毫秒之间,显示出ASAP5的快速动力学。
此外,研究人员还利用ASAP5-Kv在小鼠运动皮层中进行了多单位电压成像,通过随机访问双光子显微镜从多个三维位置记录神经元活动。在稀疏标记的条件下,研究人员能够以450 fps同时记录分布在-85至-278 μm深度的9个神经元细胞体的活动,并观察到个体神经元在长时间尺度上的放电率与运动之间的对比关系。这些结果表明,随机访问双光子电压成像可以从二维扩展到三维,并且与以往的工作相比,可以增加记录的细胞数量。研究人员还利用ASAP5-Kv研究了小鼠桶状皮层L2/3锥体神经元对胡须刺激的选择性反应。在清醒小鼠的桶状皮层中,通过随机顺序刺激小鼠9根胡须,研究人员发现,特定胡须的刺激能够引发强烈的EPSPs和尖峰频率,而其他胡须则不能。值得注意的是,早期EPSPs和APs后均伴随延迟的光学超极化信号,证实了抑制性突触后电位(IPSPs)的存在。单细胞水平分析表明,胡须诱发的光学EPSPs与IPSPs幅度呈显著相关性,这与感觉信息处理中兴奋-抑制精细平衡的理论预测一致。多视野成像进一步揭示了EPSPs、IPSPs及APs均具有清晰的体感拓扑映射特征。以上结果不仅拓展了ASAP家族探针检测阈下EPSPs的已有发现,更首次实现了IPSPs的光学检测,证实ASAP5可用于研究EPSPs与IPSPs间的调控关系和时序特性。
图5. 清醒小鼠中阈上和阈下活动的单次试验双光子成像
图6. ASAP5-Kv在小鼠体内的持续和多单位双光子电压成像
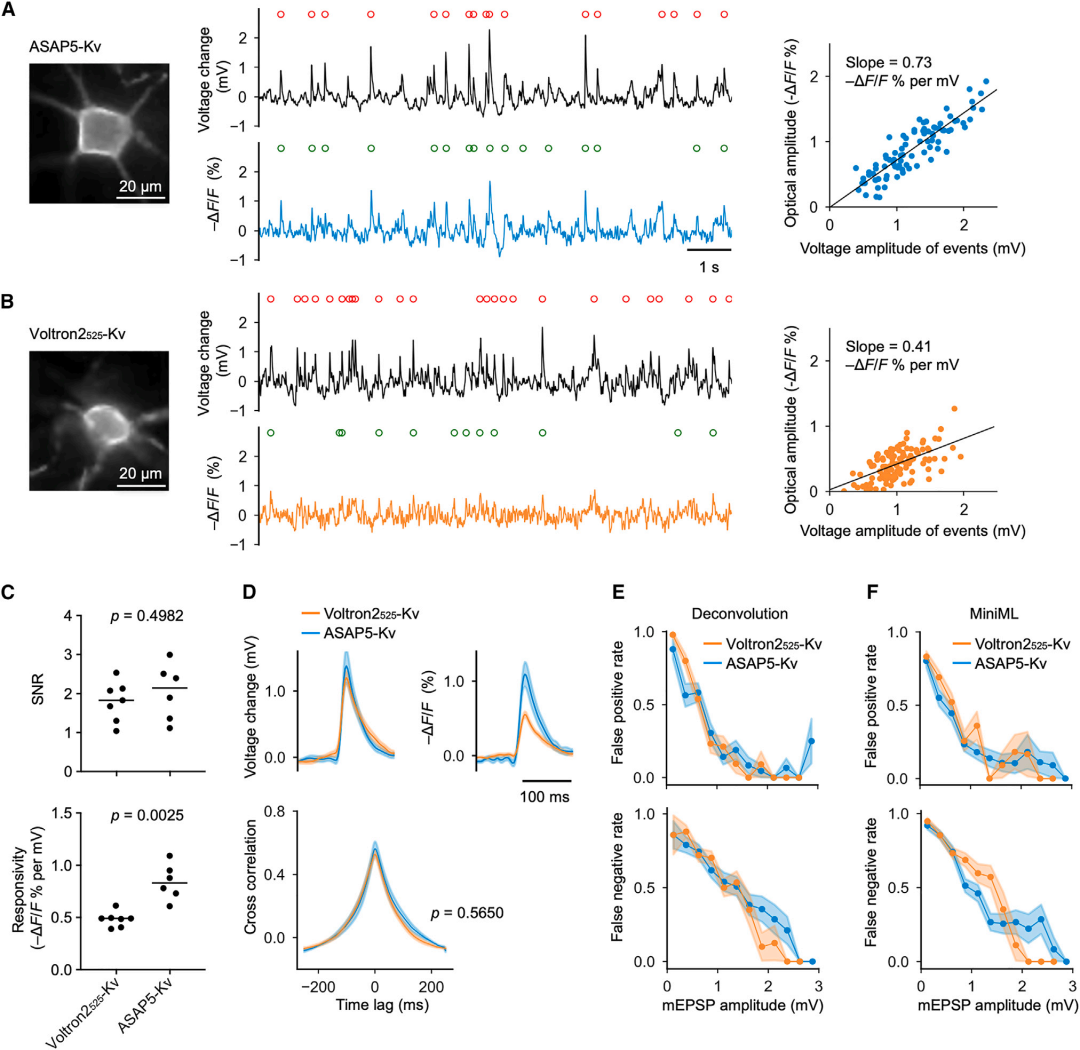
5、培养大鼠神经元中mEPSPs的光学检测
在培养的大鼠神经元中,研究人员利用ASAP5-Kv和Voltron2525-Kv(结合了JaneliaFluor525荧光团的Voltron2)对比检mEPSPs的能力。实验中,研究人员在河豚.毒素(TTX)和苦毒素(PTX)存在的情况下进行荧光成像和全细胞电生理记录,以去除APs和抑制性电位。尽管Voltron2525-Kv的亮度是ASAP5-Kv的4.1倍(调整滤光片效率后),但两者在检测mEPSPs时的SNR相似。这是因为ASAP5-Kv的电压响应灵敏度更高(-0.83%/mV,相比之下Voltron2525-Kv为-0.48%/mV),且SNR与响应幅度呈线性相关,而仅与亮度的平方根成正比。在检测到的mEPSPs的光学波形方面,ASAP5-Kv和Voltron2525-Kv表现出了相似的形状,并且两者的光学记录与电生理记录之间的交叉相关图也十分相似,这表明两种系统在动力学特性上并无显著差异。在产生相似SNR的激发速率下,ASAP5-Kv和Voltron2525-Kv展现出了类似的光稳定性。
此外,研究人员还比较了两种系统的假阳性(FP)率和假阴性(FN)率,发现它们在0-3 mV的mEPSPs振幅范围内表现相似,在振幅>1 mV时,两种传感器报告的mEPSPs FP率<20%。为了验证比较结果的可靠性,研究人员还使用了机器学习算法miniML来检测光学mEPSPs。该算法在经过电生理和光学记录配对片段的训练,或者仅经过电生理记录的训练后,用于检测光学mEPSPs。在这些分析中,ASAP5-Kv和Voltron2525-Kv再次展现出相似的FP和FN率。综合来看,ASAP5-Kv和Voltron2525-Kv均适用于在标准光照条件(46 mW/mm2)下,检测培养神经元细胞体处的单毫伏级自发突触事件。在这两种系统之间,ASAP5-Kv的优势在于其完全遗传编码,无需添加化学染料。
图7. 培养的大鼠海马神经元中mEPSPs的光学检测
6、树突上传播的突触输入记录
在研究ASAP5-Kv对突触输入传播的检测能力时,研究人员通过成像技术观察了培养神经元中突触信号从树突向胞体的传播过程。他们观察到与低幅度EPSPs相关的低幅度ASAP5瞬态信号出现在胞体中,并且与APs有明显区别。这些胞体中的ASAP5信号与一个主要树突中的较大荧光瞬态信号相关,但与另一个主要树突无关,进一步证实这些信号并非反向传播的APs。这些瞬态信号在向胞体传播时呈现出明显的向心衰减。接下来,研究人员在含有TTX和PTX的皮层神经元中成像泛膜ASAP5(即在细胞整个膜表面均匀表达的ASAP5),以研究mEPSPs的初始位置与其初始和最终幅度之间的关系。对于每个mEPSP,将信号幅度最高的位置定义为事件的起始点,并测量相应的胞体信号。研究首先探究了同一mEPSP事件在起始点处的电压幅度(VD)或在胞体处的电压幅度(VS),与这两个位置之间的距离(dDS)存在怎样的相关性。结果发现,在单个样本以及大多数神经元中,VD与dDS呈正相关,而VS与dDS呈负相关。因此,衰减系数ADS=VD/VS与dDS呈正相关。这些结果表明,树突输入点与胞体之间的距离越大,初始电压信号越大,胞体处的电压信号越小,传播过程中的衰减越高。这些观察结果与以往在脑片中的电生理测量结果一致。
此外,研究人员还利用ASAP5-Kv直接测量了沿树突多个点的电压变化,以绘制空间衰减图。他们发现,mEPSPs的幅度在传播过程中呈指数衰减,其衰减系数与突触输入点到胞体的距离相关。通过拟合指数函数,他们测得的长度常数平均为90 μm。这些信号可被CNQX(GluA受体阻断剂)抑制,表明其由GluA受体介导。此外,在未使用通道阻断剂的培养大鼠皮层神经元中,无论是泛膜ASAP5还是体细胞定位ASAP5-kv,均发现神经元对之间表现出共享的激活输入,并检测到了类似IPSPs的事件。这些结果表明,ASAP5-Kv不仅能够检测到单个毫伏级的mEPSPs,还能用于研究EPSPs的被动和主动传播,以及IPSPs的影响。这种能力使得ASAP5-Kv成为研究神经元树突信号处理和突触功能的强大工具。
图8. 树突-胞体传播的mEPSPs电压成像
7、人类神经元网络活动与单突触事件的记录
为探索ASAP5是否能够将电压成像技术在人类神经元中的应用拓展到EPSPs的检测,研究人员利用已有的方案将人类胚胎干细胞(ES)分化为神经元,并通过慢病毒转导引入ASAP5-Kv,随后以400 fps的速度进行了单光子成像。结果显示,ASAP5-Kv能够清晰地检测到人类诱导神经元(hiNs)之间的相关活动:两个神经元中均出现EPSPs;一个神经元中出现AP而另一个神经元中出现相应的EPSP;或者两个神经元中均出现APs。此外,通过降低成像速度至100 fps,能够获得更大的视野范围(FOV),同时观察多达8个hiNs中相关联的APs和EPSPs。
研究人员推测ASAP5-Kv可用于检测hiNs中的mEPSPs。由于疾病相关突变会导致突触发育异常或囊泡释放概率变化,进而影响mEPSPs或mEPSCs的频率,而这些表型在hiNs和啮齿动物神经元之间可能存在差异,因此研究人类诱导神经元显得尤为重要。鉴于大多数关于人类诱导神经元突触活动的研究主要通过体细胞电压钳记录来检测mEPSCs,而非mEPSPs,研究人员将体细胞的电流钳记录和电压钳记录分别与TTX和PTX结合使用,目的是仅使谷氨酸能够以自发量子化的形式释放。结果显示,mEPSCs和mEPSPs的检测频率相似,并且在GluA受体阻断剂CNQX存在时不会出现,表明这些是兴奋性突触事件。最终,研究人员通过同时进行电流钳记录和ASAP5-Kv成像,发现ASAP5-Kv能够检测到低至1 mV的mEPSPs,且示例神经元的平均ΔF/F₀为每毫伏去极化-0.67%。这表明ASAP5-Kv能够高效检测培养的人类诱导神经元中的mEPSPs,成功捕捉突触量子事件。
图9. ASAP5-Kv对诱导的人神经元电活动的表征
结论
ASAP5是一种新型GEVI,具有0.78 ms的快速起始动力学和更高的灵敏度,能够在体内单次试验中检测到细胞体的EPSPs和IPSPs,以及在培养神经元中展现出对1 mV信号的响应能力。与JEDI-2P和JEDI-1P相比,ASAP5在体内检测尖峰活动时表现出更高的SNR,并且在培养神经元中检测mEPSPs时与Voltron2相当。ASAP5在多种成像模式下表现出色,包括果蝇神经元中分级电位和APs的单次试验双光子成像,小鼠运动皮层中多个三维位置的APs记录,以及小鼠桶状皮层中EPSPs和IPSPs的成像。尤为重要的是,ASAP5能够在人类神经元中进行光学记录,检测到单个突触事件,这一功能此前只能通过膜片钳电生理学实现。ASAP5还能够在神经元网络中检测到多个神经元之间的协调APs和EPSPs,这是多电极阵列(MEAs)无法实现的。ASAP5在单光子和双光子激发下均展现出优越的性能,适用于深层组织成像和减少背景信号。其高响应性增强了对mEPSPs的检测能力,为研究神经元的树突整合和突触功能提供了新的工具。此外,ASAP5的高通量特性使其能够在培养的干细胞衍生人类神经元中实现突触和网络功能的高通量表征,为研究神经精神疾病和筛选改善突触功能的药物提供了新的可能性。
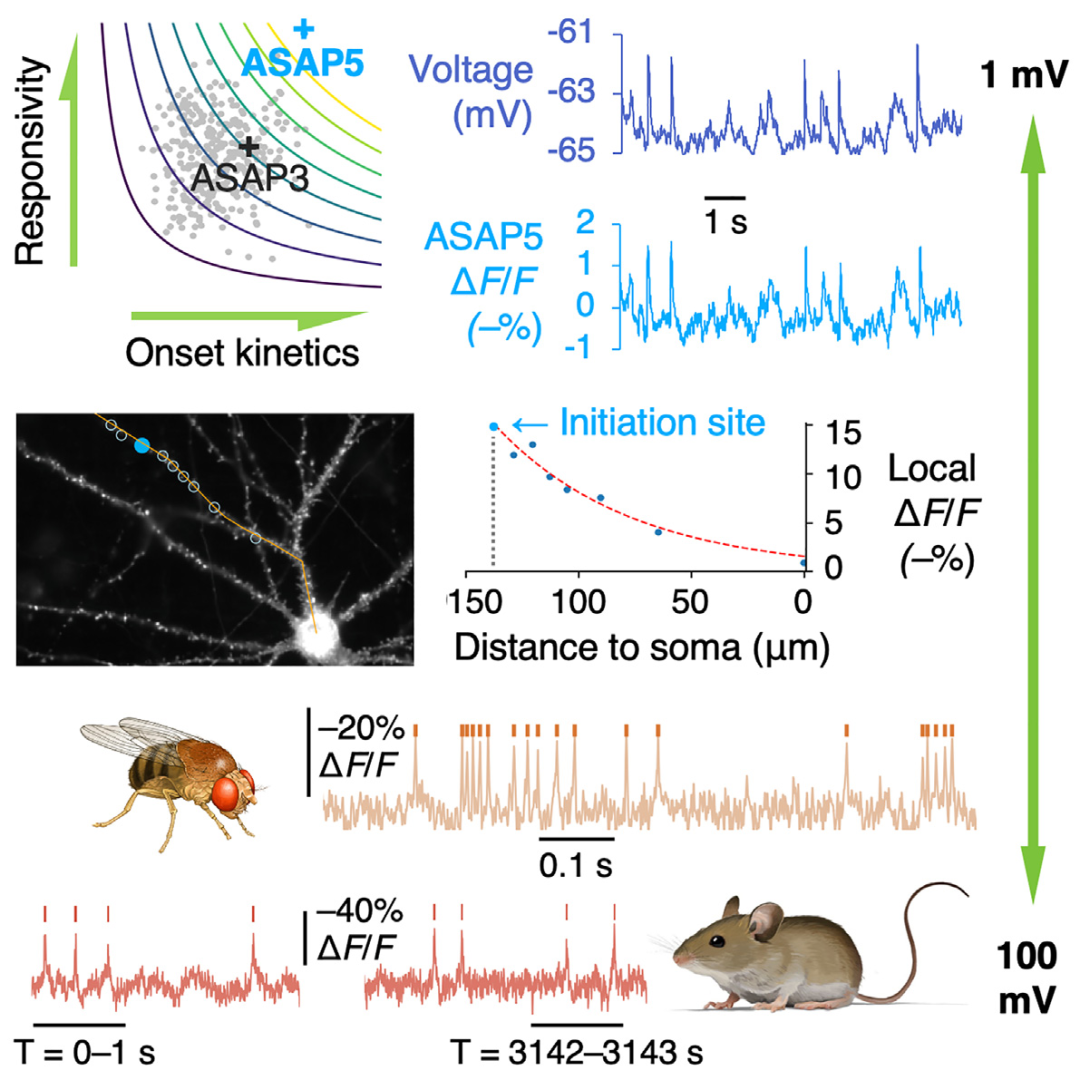
图10. 总结图

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK