2025-05-06 阅读量:2125
慢性痛是临床上常见的慢性疾病,严重危害人类的身心健康和生活质量。近年来,以初级运动皮层(M1)为核心的神经调控技术成为治疗顽固性慢性痛的前沿手段,M1也被认为是位于神经系统最高位的疼痛神经调控靶点。然而,感觉系统的痛觉敏化如何引起运动皮层的功能改变,运动皮层又是怎样调控疼痛的持续慢性化,一直悬而未解。
2025年4月15日,空军军医大学基础医学院神经生物学教研室罗层教授/武胜昔教授团队在神经科学顶刊《Neuron》(神经元)在线发表题为“A sensory-motor-sensory circuit underlies antinociception ignited by primary motor cortex in mice”的研究论文。该研究从感觉-运动互作的角度揭示了初级运动皮层调控慢性疼痛的环路新机制,阐明了重复经颅磁刺激(rTMS)靶向初级运动皮层的神经调控策略治疗慢性疼痛的细胞功能基础。
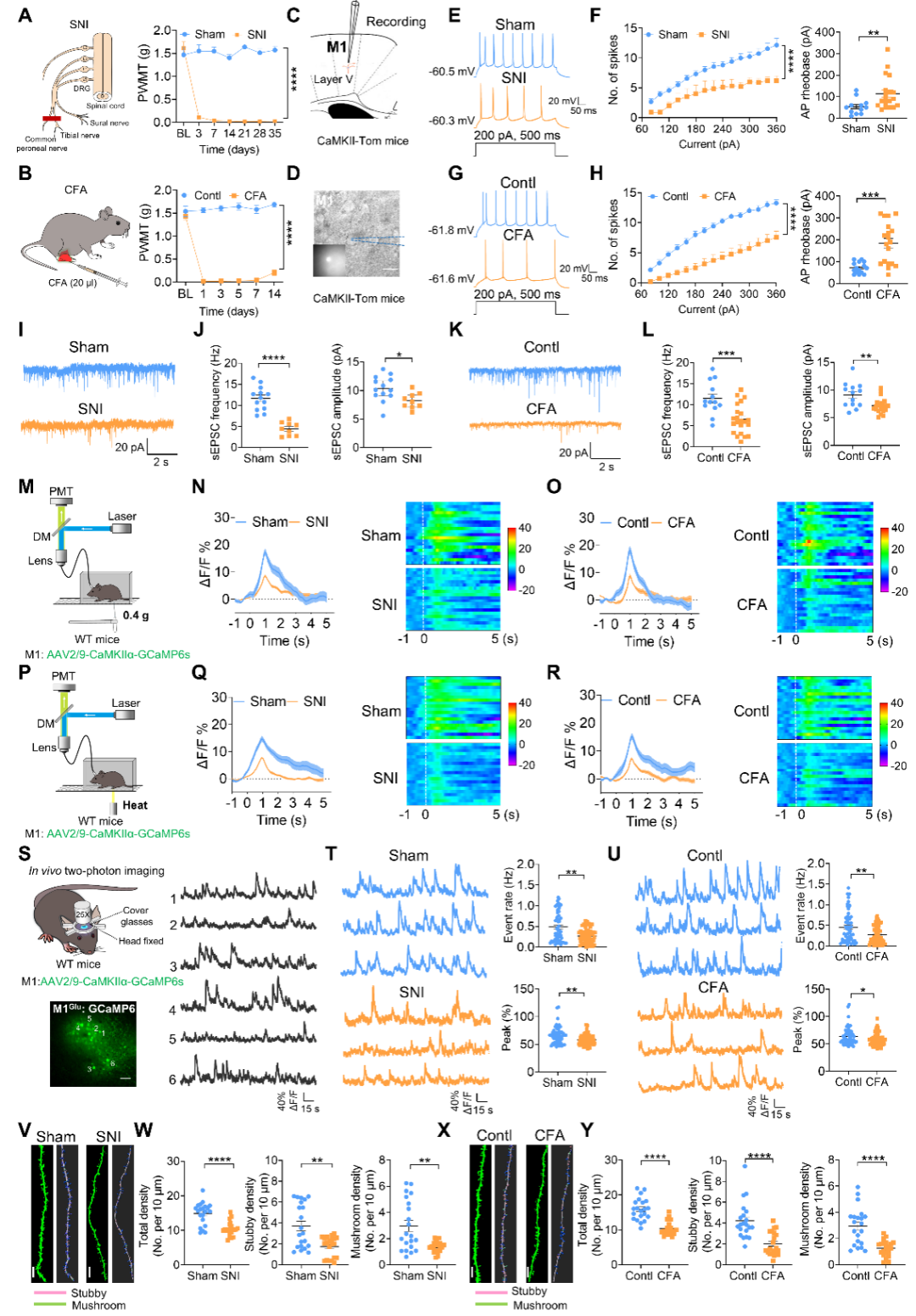
为了观察痛觉敏化会引起M1锥体神经元产生怎样的可塑性改变,研究团队采用电生理技术对M1谷氨酸能锥体神经元(M1Glu)进行记录,结果显示在神经病理性痛(坐骨神经分支损伤SNI)或炎性痛(完全弗氏佐剂CFA)状态下,M1Glu神经元表现出放电频率降低、基强度升高,兴奋性突触后电流幅度、频率下降等的可塑性改变。进一步采用在体光纤记录和双光子钙成像分别在群体神经元水平和单个神经元水平上对M1Glu神经元的钙活动进行检测,结果发现与对照组相比,M1Glu锥体神经元对不同刺激诱发的钙信号显著降低。以上结果提示在慢性痛状态下,M1Glu神经元的功能可塑性显著降低。我们进一步采用稀疏标记的方法检测了M1Glu锥体神经元树突棘的变化,结果显示慢性痛状态下其树突棘密度降低,尤其是短粗型、蘑菇型树突棘密度显著降低。上述结果表明,慢性疼痛导致M1锥体神经元发生了功能和结构的可塑性改变。(图1)
图1. 慢性疼痛导致M1锥体神经元功能可塑性降低和树突棘密度减少
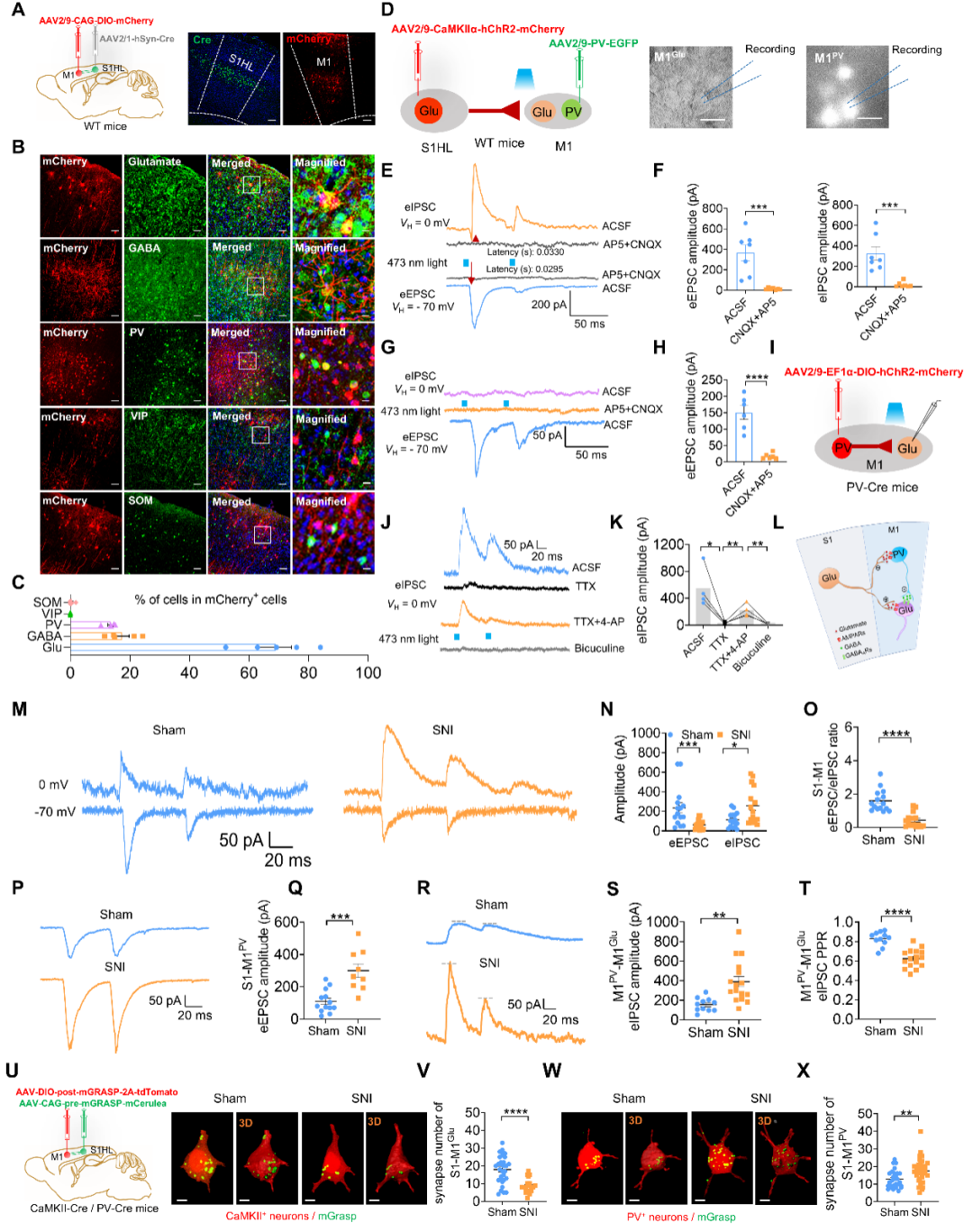
那么疼痛敏化是怎样导致M1Glu锥体神经元可塑性降低的?研究发现M1接收作为整合疼痛信息高级中枢的S1(初级躯体感觉皮层)的大量投射,然而疼痛状态下,S1发生怎样的变化,其是否影响M1的可塑性改变并不清楚。研究结果发现S1Glu神经元在结构和功能上分别与M1Glu和M1PV神经元形成突触联系,即形成S1Glu→M1PV→Glu微环路。光遗传结合电生理的方法对S1-M1微环路功能的改变进行了检测,结果显示在慢性疼痛状态下,S1Glu神经元兴奋性显著升高,导致M1PV神经元放电增加引起对M1Glu神经元的前馈抑制增强,从而导致M1Glu神经元可塑性的下降;进一步采用mGrasp的方法(哺乳动物GFP重构跨突触配对标记技术,用于标记特定神经元间的直接突触连接)从结构层面对S1-M1突触联系进行检测,发现慢性疼痛导致S1Glu-M1Glu突触形成个数显著降低,而S1Glu-M1PV突触形成个数显著升高。以上结果提示慢性疼痛状态通过诱发S1与M1的兴奋-抑制失衡,进而导致M1Glu神经元产生了功能可塑性的降低。(图2)
图2. S1Glu→M1PV→Glu局部微环路在慢性疼痛状态下呈现兴奋-抑制失衡
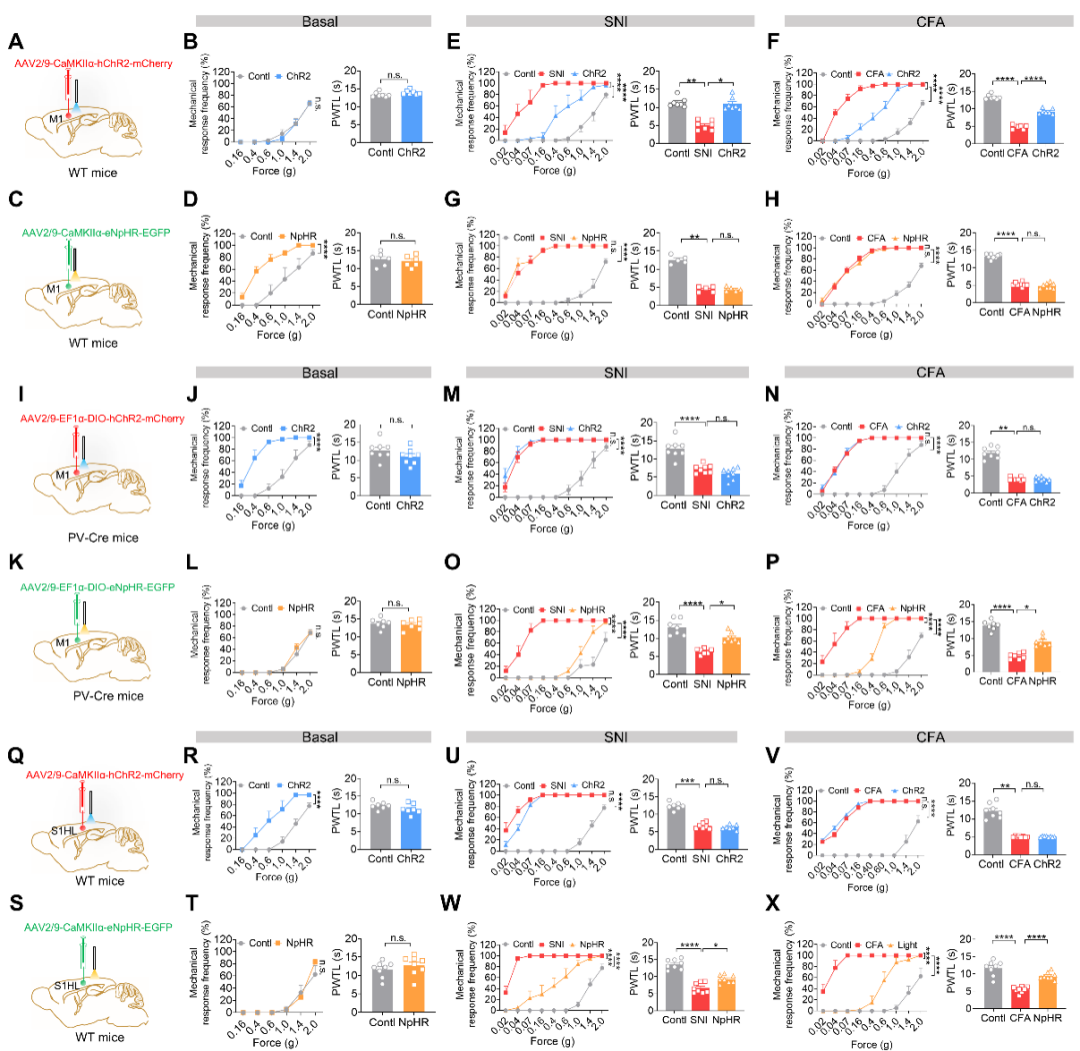
那么S1Glu→M1PV→Glu微环路对疼痛的调控作用是怎样的?研究团队采用光遗传结合行为学的方法发现,在正常生理状态下,光遗传激活M1Glu神经元对小鼠的机械痛阈值及热痛阈值没有影响,而光遗传抑制M1Glu神经元使小鼠产生痛觉过敏;而在慢性痛状态下,光遗传兴奋M1Glu神经元或产生显著的缓解疼痛的作用,而抑制M1Glu神经元对SNI/CFA诱致的痛阈值的下降没有影响。与之形成鲜明对比的是,在正常生理状态下,光遗传激活M1PV或S1Glu神经元,小鼠产生痛觉敏化,而光遗传抑制M1PV或S1Glu神经元对小鼠机械痛阈值及热痛阈值并无显著影响;而在慢性痛状态下,光遗传抑制M1PV或S1Glu神经元显著抑制慢性疼痛,光遗传兴奋M1PV或S1Glu神经元对SNI/CFA诱致的痛阈值的下降没有影响。(图3)
图3. 光遗传调控M1Glu、M1PV或S1Glu神经元对慢性疼痛的影响
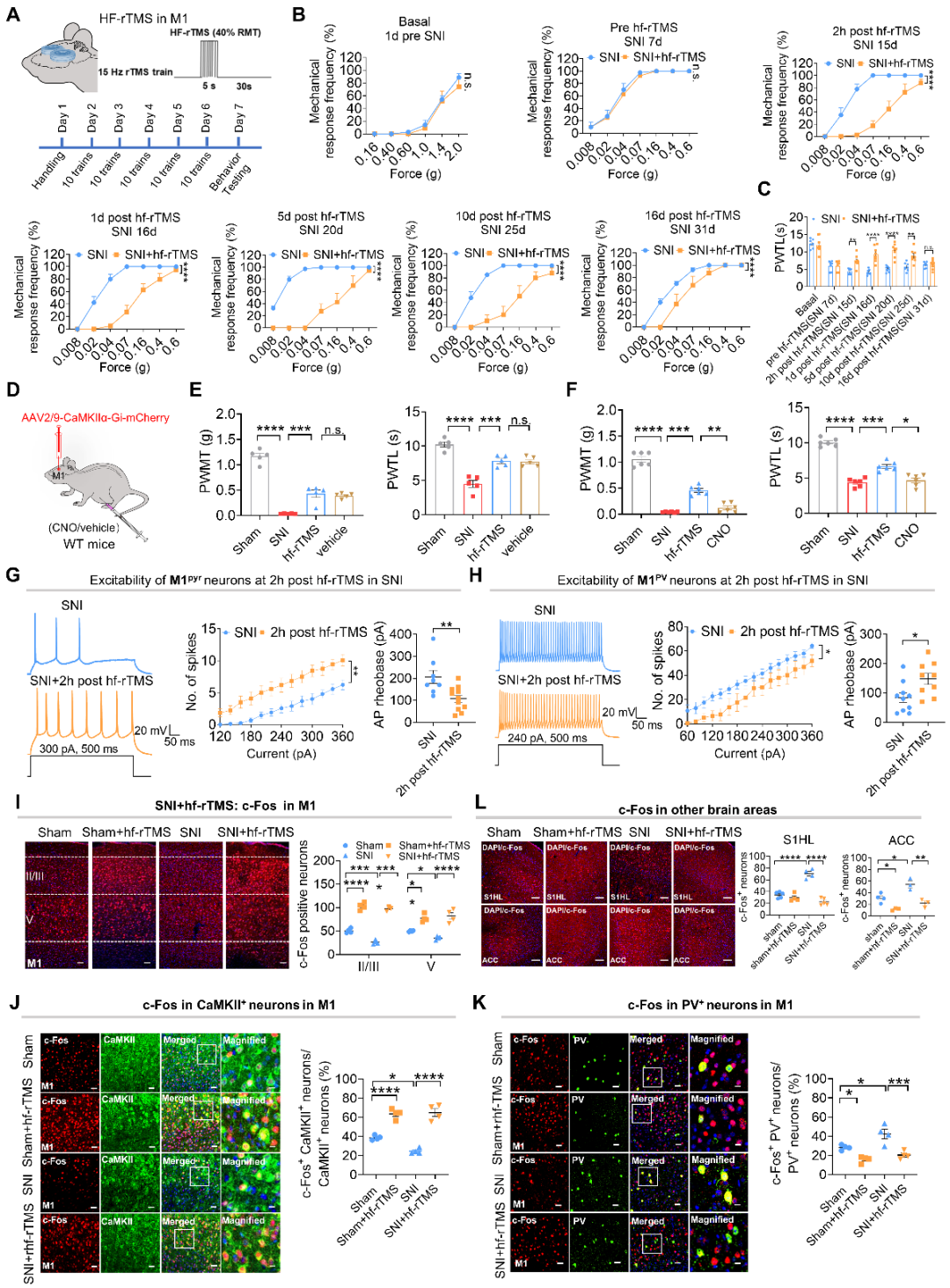
大量临床研究报道靶向M1经颅磁刺激对顽固性疼痛有着良好的治疗效果,然而细胞功能机制尚不清楚。研究团队进一步采用重复经颅磁刺激(rTMS)的方法激活M1,发现高频经颅磁刺激可以显著缓解SNI诱致的神经病理性痛和CFA诱致的炎性痛。鉴于rTMS产生的磁场可能会扩散到M1邻近的脑区,我们使用化学遗传学方法抑制M1Glu神经元的活动可以显著抑制rTMS产生的抑痛作用,提示M1Glu神经元在高频rTMS镇痛中的重要作用。进一步细胞机制的结果发现:在慢性痛状态下,电生理及c-Fos染色结果均显示:高频rTMS可显著反转SNI诱致的M1Glu神经元兴奋性的降低以及M1PV神经元兴奋性的升高;慢性痛诱致的S1Glu神经元的超兴奋也被显著抑制。以上结果提示rTMS通过纠正S1-M1兴奋-抑制失衡,从而产生缓解疼痛的效果。(图4)
图4. rTMS通过激活M1纠正S1-M1兴奋-抑制失衡缓解疼痛
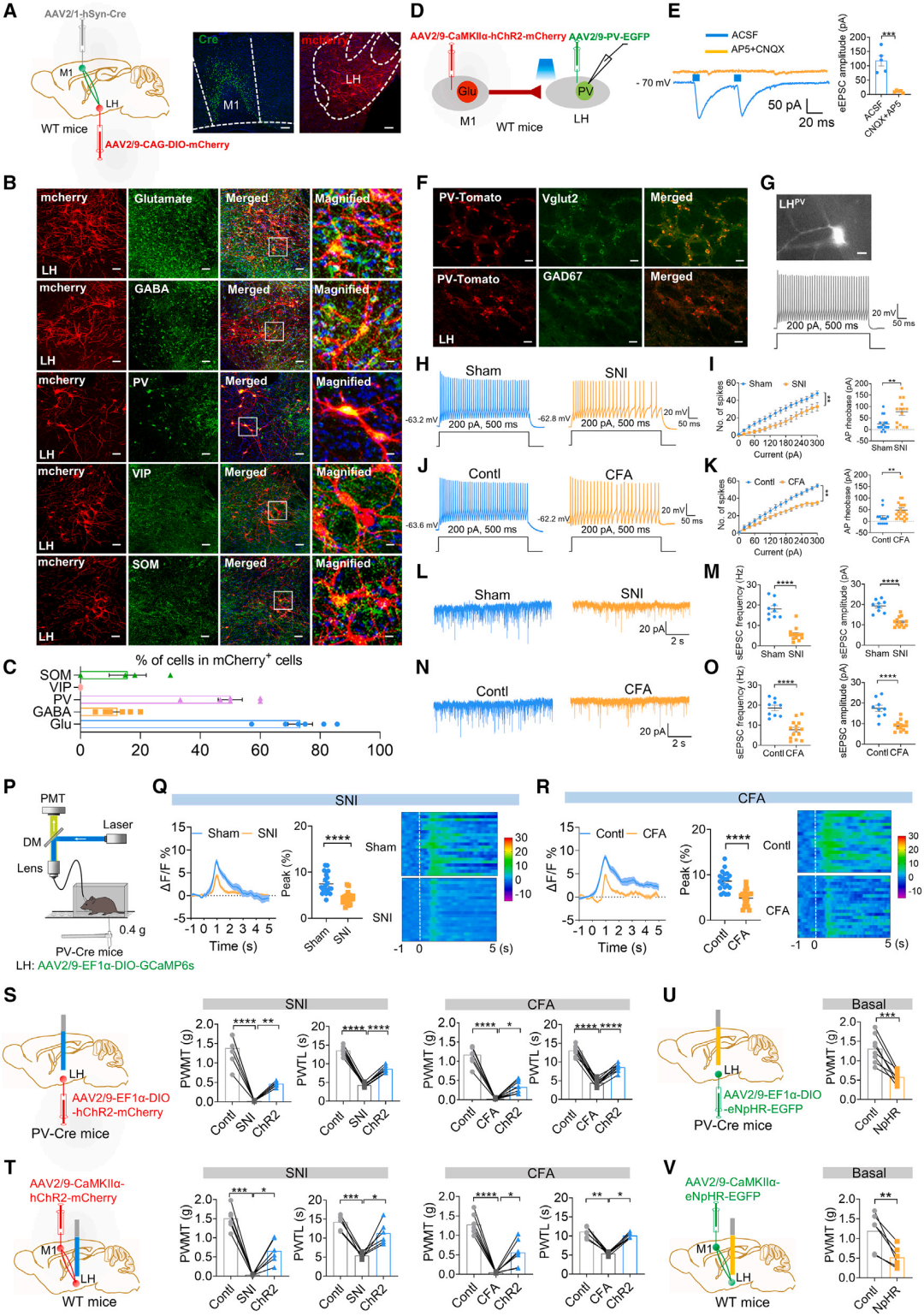
那么M1通过怎样的神经环路调控疼痛信息呢?团队对M1输出脑区进行了全脑筛查。其中,由于LH(外侧下丘脑)作为整合机体多种功能的重要脑区,因此引起了研究团队的注意。团队进一步通过病毒示踪、光/化学遗传、光纤钙成像、痛行为检测等方法发现,M1Glu和LHPV神经元之间形成了结构和功能上突触联系。有趣的是,这些LHPV神经元虽表现出典型的GABA能神经元的快速放电特征,然而荧光原位杂交(FISH)染色显示其仅与vglut2高度共定位,但与GAD67不共定位,提示分布在LH的这种神经元簇是一种特殊的谷氨酸能PV神经元群。在慢性疼痛状态下,LHPV的功能及结构可塑性均显著降低。进一步采用光遗传激活LHPV神经元或M1Glu-LHPV环路,均可显著减轻SNI后的机械性痛觉过敏与CFA后的热痛觉过敏。(图5)
图5. M1Glu-LHPV环路调控慢性疼痛
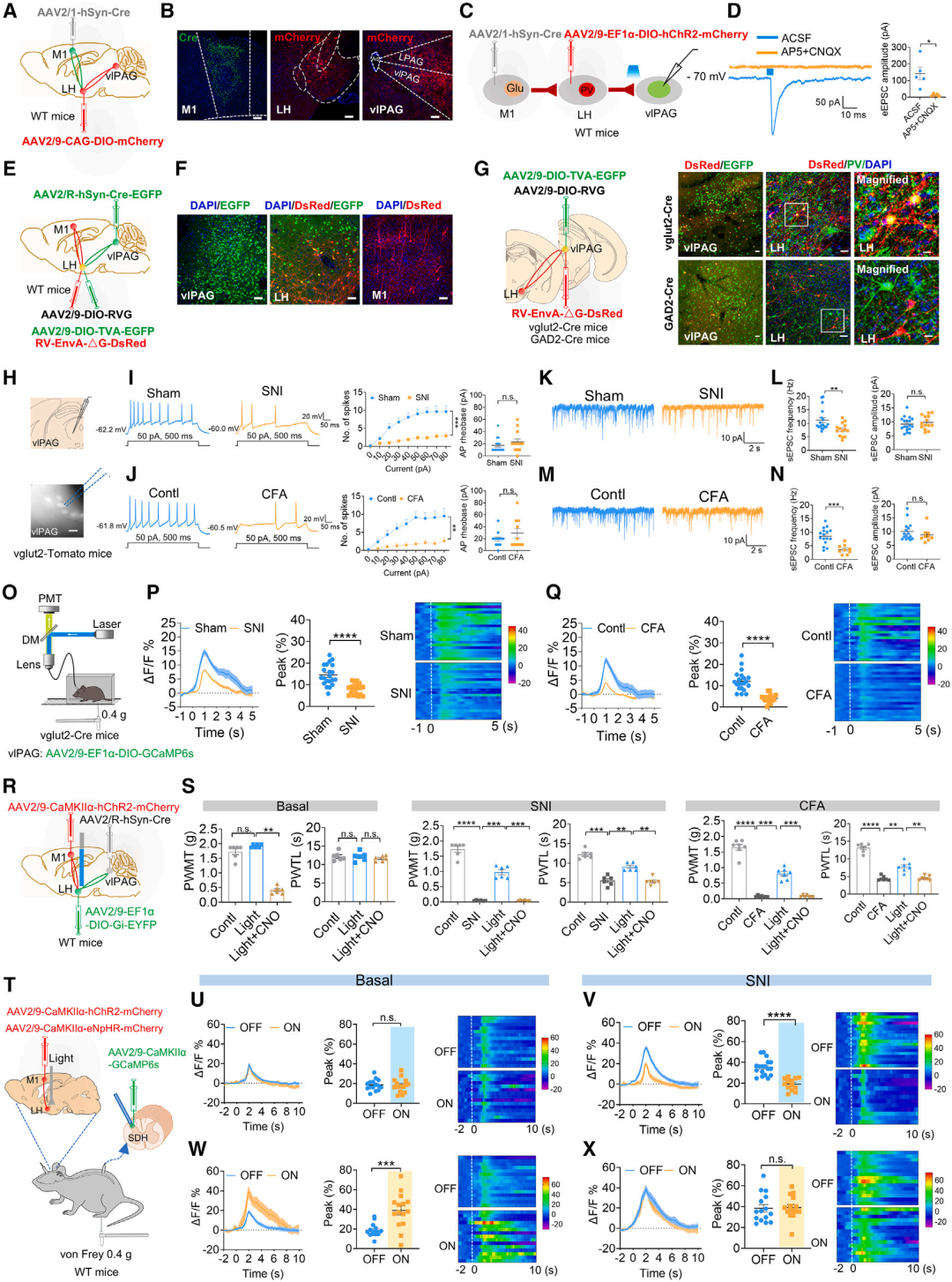
那么,M1Glu-LHPV环路是通过怎样的top-down通路实现疼痛下行调控的呢?团队证实了M1Glu-LHPV神经元与vlPAGGlu神经元形成单突触联系。光、化学遗传结合行为学结果发现化学遗传学抑制LH-vlPAG环路显著反转光遗传激活M1Glu-LHPV环路产生的抗伤害效应。以上结果提示M1Glu-LHPV-vlPAGGlu通路在调节慢性伤害感受性超敏反应中的关键作用。既往研究显示,vlPAG→RVM→SDH通路抑制痛觉传递。进一步采用药理学结合行为学结果发现SDH鞘内置管给予五羟色胺受体拮抗剂BRL44408可显著抑制光遗传激活LHPV-vlPAGGlu环路产生的镇痛作用。最后采用光遗传学对M1-LH-vlPAG环路进行调控,并运用活体脊髓光纤记录检测调控该环路是否对脊髓痛信息的传入产生影响。结果显示在慢性痛状态下,光遗传激活M1Glu-LHPV或LHPV-vlPAG环路可以显著抑制外周刺激诱发的脊髓痛信息增强。而抑制M1Glu-LHPV或LHPV-vlPAG环路导致生理状态下脊髓痛信息的传入显著增强。以上结果表明M1与LH形成突触联系通过PAG-RVM-SDH产生疼痛下行抑制的调控作用。(图6)
图6. M1Glu-LHPV环路通过vlPAG下行抑制系统调控疼痛
结论
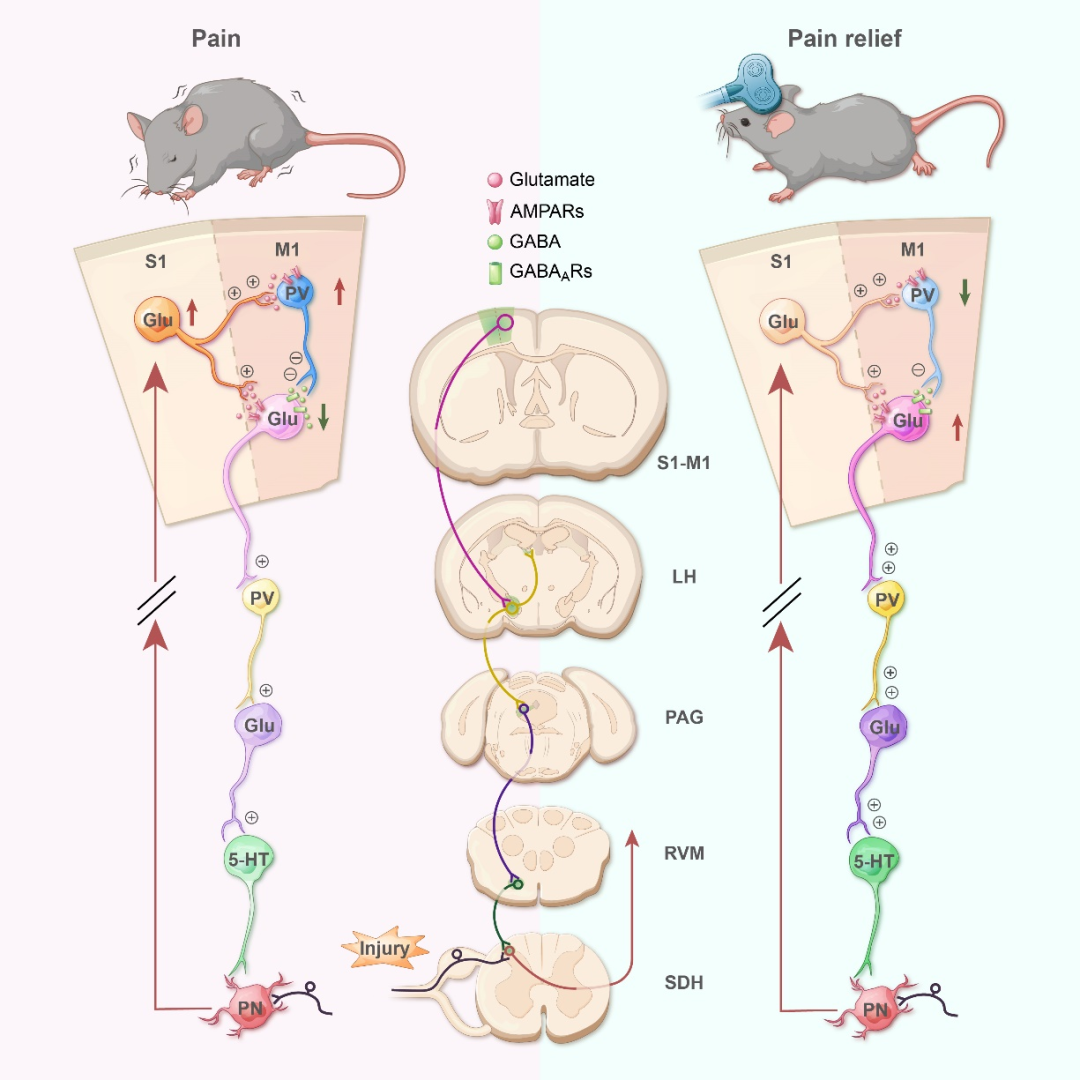
综上所述,病理状态下,持续涌入的痛信息诱致S1-M1微环路出现兴奋-抑制稳态失衡,引发M1传出活动减少,致使其通过LHPV神经元启动PAG下行抑制系统的能力减弱,加剧痛敏。而通过rTMS靶向刺激M1则可有效逆转这一兴奋-抑制失衡状态,修复M1锥体神经元的功能异常,从而恢复启动下行抑制系统的能力,达到缓解疼痛的效果。本研究提出了初级运动皮层调控慢性疼痛的非运动功能新思路,揭示了其下行调控痛感觉的环路新机制,为研发和优化靶向运动皮层治疗顽固性慢性痛的神经调控方案提供了重要科学依据和理论指导。(图7)
图7. 总结
罗层教授、武胜昔教授为本文的通讯作者。王菲博士后、田志成主治医师、丁慧博士为本文的共同第一作者。杨新江硕士、王福东医师、纪若馨硕士在本文中做出了重要贡献。研究工作得到了国家自然科学基金项目、科技创新2030-脑科学与类脑研究重大项目、国家重点研发计划、陕西省创新团队项目、西京创新研究院联合基金的资助。
课题组合照
通讯作者介绍:
罗层教授长期从事慢性痛与情感障碍共病的神经机制与干预新策略研究,通过多学科交叉、多技术融合的研究策略,开展了持续深入的探索,取得了系列创新性发现和研究成果。在Neuron、Nature Communications、Journal of Clinical Investigation、Advanced Science等国际权威期刊发表多篇高影响力学术论文,并受邀在Trends in Neurosciences、Pharmacology & Therapeutics发表特邀综述,相关研究成果获省部级等奖项。获得国家自然科学基金重点项目、科技创新2030-脑科学与类脑研究重大项目课题、国家重点研发计划课题等资助。兼任国际权威期刊Pain副主编、Mol Pain、Neurosci Bull编委等学术任职。
武胜昔教授长期从事高级脑功能的机理解析与调控技术研究,采用多学科交叉、多技术融合的研究策略,开展了深入的研究,取得了系列创新性发现和研究成果。共发表SCI 论文150篇,其中通讯作者论文85篇,论文发表在Nature Neuroscience、Neuron、Science Advances、Advanced Science等国际权威期刊。研究成果获国家科技进步一等奖、陕西省科学技术奖等奖项。先后承担国家自然科学基金创新研究群体项目、重大项目及重点项目,科技创新2030-脑科学与类脑研究重大项目等22项。 兼任中国神经科学学会常务理事、全军神经生物学专委会主委、陕西省脑科学与类脑智能科技创新战略联盟理事长等。
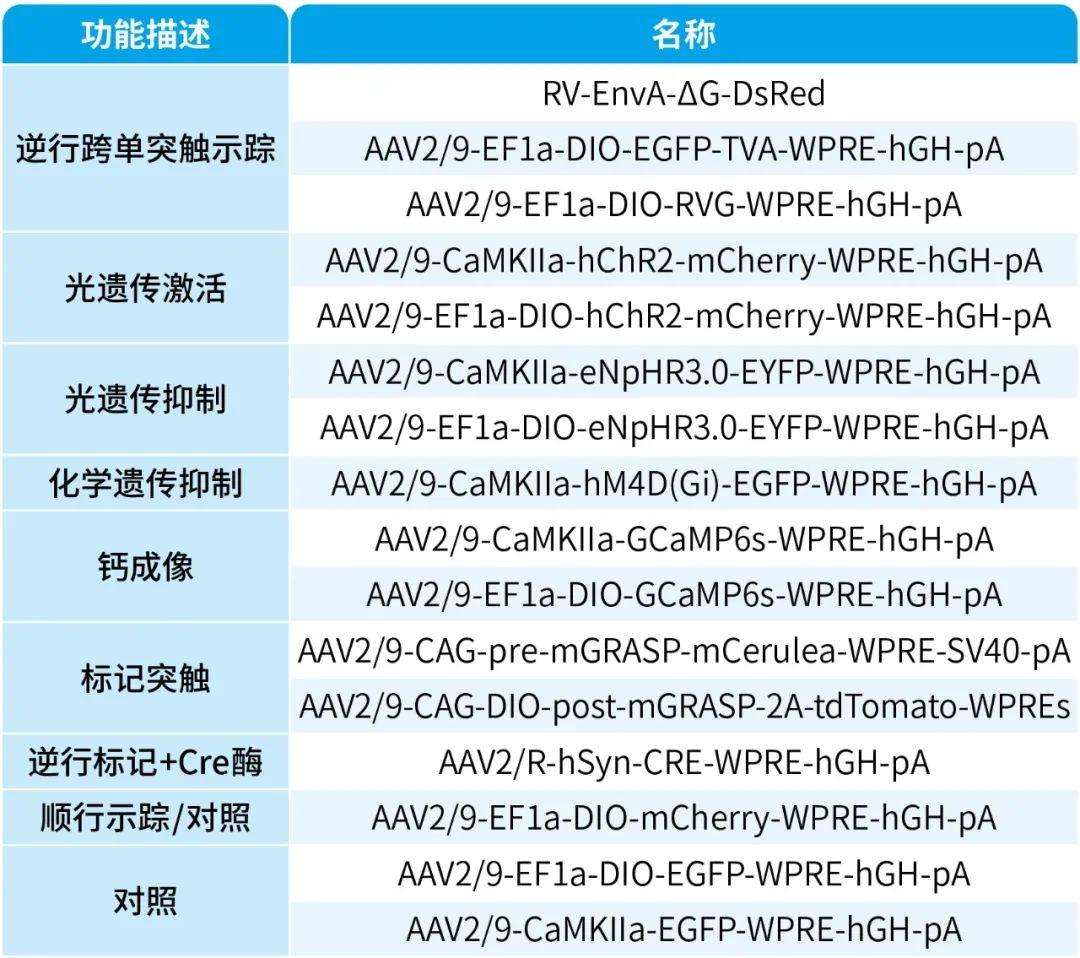
本文使用的来自枢密科技的病毒产品,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK