2025-04-24 阅读量:817
骨关节炎(Osteoarthritis,OA)是一种与关节软骨退变、软骨下骨硬化及骨赘形成相关的退行性关节疾病,也是全球范围内最常见的关节病变。根据世界卫生组织的调查,全球约10%的人口患有不同程度的OA。此外,OA、心血管疾病与肿瘤被列为当今威胁人类健康的三大致死因素。OA的危险因素包括高龄、女性、既往关节损伤、肥胖、遗传易感性和先天畸形等。此外,线粒体功能障碍、氧化应激及自噬水平降低可能改变软骨细胞功能,促进分解代谢过程并在合成代谢过程中引发细胞死亡。因此,深入理解OA发生发展的具体分子机制对改善预后和开发有效疗法至关重要。
近年来多项研究表明,广泛存在于人类转录组中的非编码RNA(包括环状RNA,circRNA)参与人类疾病的发生发展。与线性RNAs不同,circRNAs具有共价闭合的连续结构,无5’端帽或3’端多聚腺苷酸尾,是一类新型非编码RNA。由于其独特结构,circRNAs稳定性高,主要分布于细胞质,且具有高度物种保守性。目前已有多种circRNAs被证实与OA相关,这些circRNAs通过参与抵抗氧化应激、抑制细胞凋亡等多条通路对软骨细胞发挥保护作用,进而延缓关节软骨退变。然而,针对关节软骨中circRNAs的研究仍较有限,未来通过深入探索软骨细胞中未知circRNAs的功能,有望为OA治疗提供新思路。
在调控circRNAs的众多机制中,自噬调控引起了作者的关注,因为自噬活性减弱是OA进展的重要诱因。自噬是清除受损或功能异常的大分子及细胞器的过程,作为一种细胞稳态机制,在能量与营养调控中发挥重要作用。在细胞水平,自噬失调会导致氧化应激紊乱、基因表达异常及细胞死亡异常。因此,鉴定对自噬具有重要调控作用的分子靶点可能通过改善软骨细胞自噬为OA治疗提供益处。研究表明,circRNAs是癌症、代谢性疾病及脑血管疾病中自噬相关调控网络的关键调节因子。基于此,作者推测circRNAs对自噬的调控也可能参与OA进程。
CircFOXO3(has_circ_0006404,mmu_circ_0002207)是新发现的来源于母体基因叉头框转录因子O3(FOXO3)的circRNA,参与调控细胞凋亡和细胞周期。在肿瘤细胞中,FOXO3蛋白与circFOXO3结合,抑制FOXO3与E3泛素蛋白连接酶MDM2的结合,促进FOXO3蛋白富集,从而诱导肿瘤细胞凋亡。研究显示,OA进展常伴随自噬活性减弱及由此引发的细胞凋亡水平升高,FOXO3参与自噬调控,但circFOXO3在软骨细胞中的作用尚未明确。此外,circFOXO3在多种组织中参与自噬调控,并在肿瘤中影响自噬过程,但其是否通过自噬机制调控OA进展仍未知。
近期,上海交通大学医学院附属第九人民医院骨科王晓庆主任医师、杨飞副主任医师团队在《Cell Death & Disease》期刊发表题为“CircFOXO3 protects against osteoarthritis by targeting its parental gene FOXO3 and activating PI3K/AKT-mediated autophagy”研究论文。作者旨在探讨circFOXO3在OA进展中的作用,并阐明其潜在的分子机制。通过蛋白质印迹(WB)、免疫荧光(IF)、RNA免疫沉淀(RIP)、逆转录定量PCR(RT-qPCR)和荧光原位杂交(FISH)等技术,研究人员评估了circFOXO3在OA中的功能及其与下游mRNA靶标FOXO3的相互作用。通过WB、透射电镜(TEM)、IF和免疫组化(IHC),在体内外检测了circFOXO3的上调及自噬流变化。此外,利用OA小鼠模型在体内验证了circFOXO3在OA发病机制中的作用。本研究发现,OA软骨组织中circFOXO3的表达降低,与细胞过度凋亡及细胞外基质(ECM)合成与分解代谢失衡直接相关。机制上,circFOXO3通过靶向其母体基因FOXO3并激活自噬在软骨中发挥作用。关节腔内注射慢病毒过表达circFOXO3可缓解小鼠模型的OA症状。综上,本研究结果揭示了circFOXO3在OA进展中的关键作用:circFOXO3过表达可能通过激活FOXO3和自噬来减轻软骨细胞凋亡并促进ECM的合成代谢,为OA治疗提供了一种潜在有效的新策略。

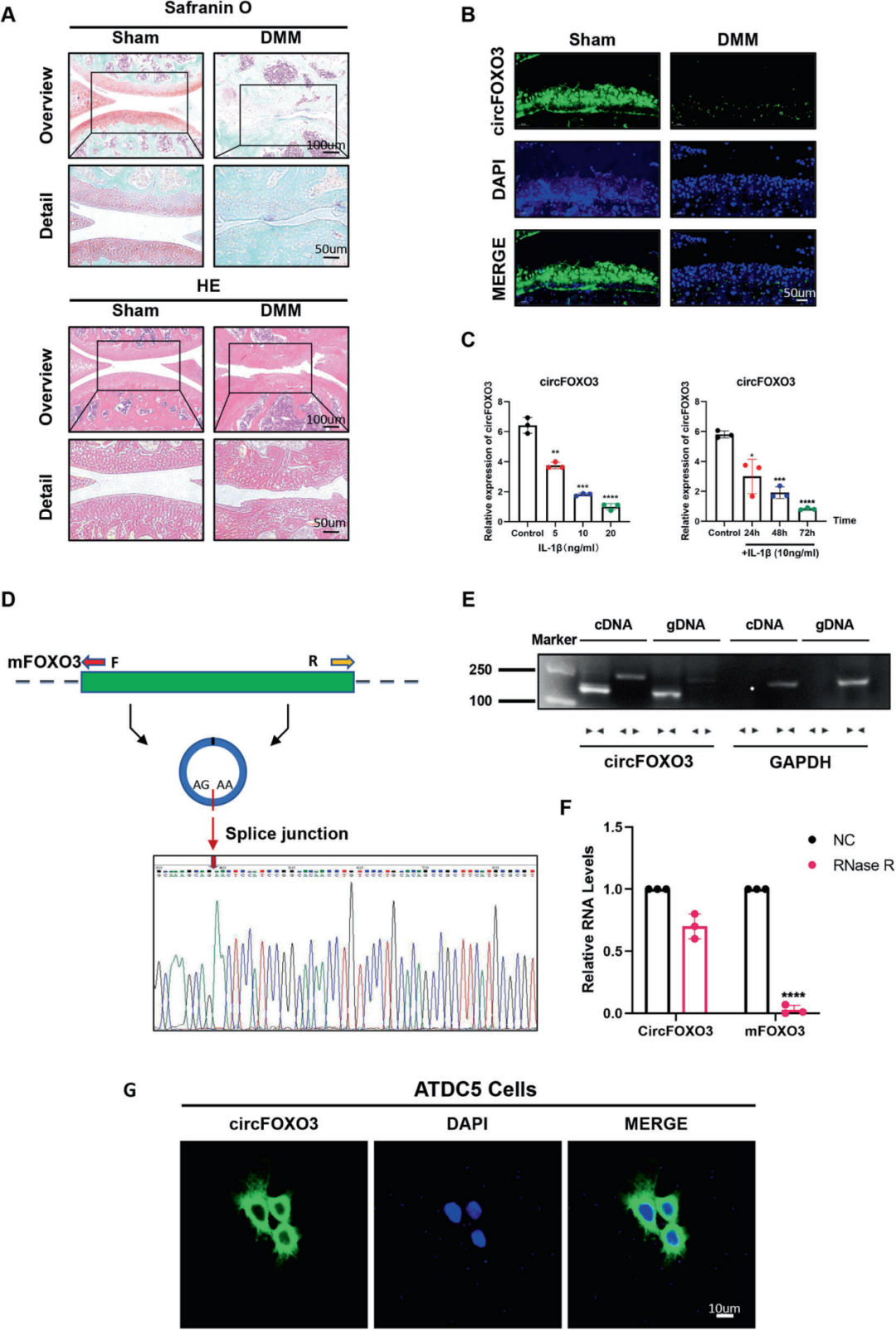
1.circFOXO3在OA小鼠软骨组织中表达下调且主要定位于细胞质
研究人员通过内侧半月板失稳(DMM)手术构建了OA小鼠模型,并检测软骨组织中circFOXO3的表达水平。首先,术后8周的番红O-快绿染色及H&E染色结果显示,与假手术组小鼠相比,OA小鼠关节软骨中蛋白聚糖染色(红色)减少且表面粗糙,提示软骨基质退变。此外,软骨切片的RNA荧光原位杂交(RNA-FISH)显示,OA小鼠软骨细胞中circFOXO3表达降低与软骨退变程度增加相关。考虑到关节损伤与关节炎及炎症程度的相关性,作者推测circFOXO3的表达水平在炎症环境中也可能降低。通过RT-qPCR分析验证了这一假设:与对照组相比,无论使用不同浓度白细胞介素-1β(IL-1β,细胞内关键的促炎细胞因子)处理ATDC5(小鼠成软骨细胞系,IL-1β刺激模拟OA)24 h,还是以10 ng/mL IL-1β处理不同时间,circFOXO3表达水平均显著下调。综上,这些结果表明circFOXO3表达与OA严重程度呈负相关。
通过circBase数据库获取的circFOXO3序列(mmu_circ_0002207)与FOXO3 mRNA序列比对显示,circFOXO3由其母体基因第2号外显子环化形成,Sanger测序进一步证实其头尾剪接特征。然而,头尾剪接可能由反式剪接或基因组重排产生。为排除这两种可能性,研究者设计会聚引物扩增FOXO3 mRNA,发散引物扩增circFOXO3。结果显示,circFOXO3仅能被发散引物扩增,且仅存在于cDNA而非基因组DNA(gDNA)中;而FOXO3 mRNA可通过会聚引物在cDNA和gDNA中均被扩增。此外,经RNase R消化处理后,FOXO3 mRNA水平较对照组显著下降,但circFOXO3因其共价闭合环状结构对RNase R处理具有抵抗性。RNA-FISH实验表明,circFOXO3主要定位于细胞质而非细胞核。综上,这些结果提示circFOXO3表达随OA及炎症进展而下调,且主要分布于细胞质,表明其可能在调控OA进程中发挥作用。
图1. circFOXO3在OA小鼠软骨组织中呈低表达,主要定位于细胞质
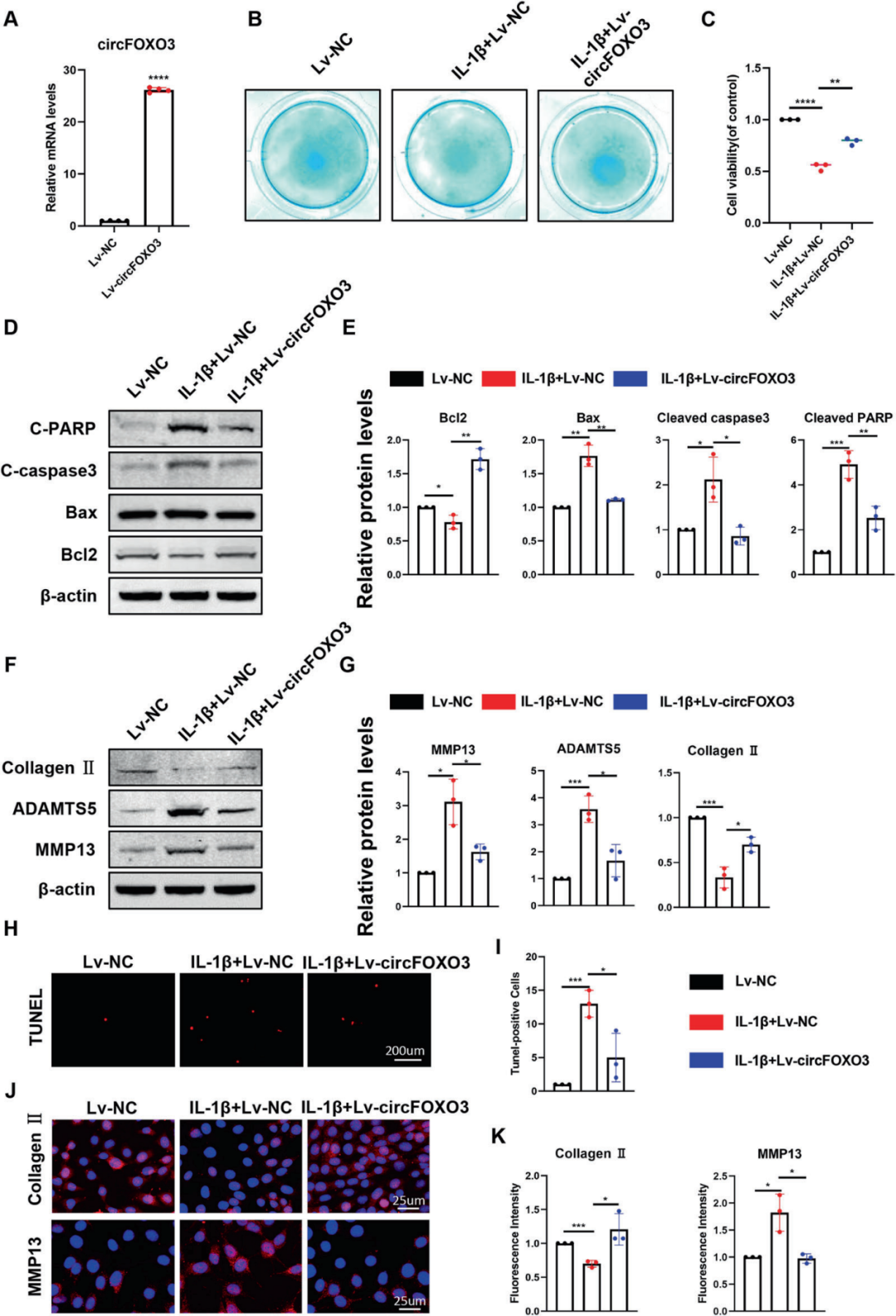
2.circFOXO3调控ATDC5细胞活力、凋亡及ECM代谢
为探究circFOXO3在调控基质降解酶和细胞凋亡中的作用,研究人员通过靶向circFOXO3的小干扰RNA(siRNA)特异性敲低ATDC5细胞中的circFOXO3,RT-qPCR证实了circFOXO3敲低成功。进一步通过高密度细胞培养和阿利新蓝染色评估发现circFOXO3抑制组蛋白聚糖合成较对照组减少,表明ATDC5细胞功能紊乱。随后采用CCK-8法检测circFOXO3对ATDC5细胞活力的影响,结果显示circFOXO3表达敲低降低了软骨细胞活力。OA是与细胞凋亡密切相关的疾病,因此作者进一步研究了circFOXO3抑制对IL-1β诱导的ATDC5细胞凋亡的影响。结果显示,circFOXO3抑制显著增强Cleaved PARP、Cleaved caspase-3和BAX的表达,而BCL-2在敲低组中表达下调。TUNEL染色(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法)进一步验证了circFOXO3对细胞凋亡的调控作用。研究还发现,circFOXO3缺陷显著下调II型胶原表达,而基质分解酶MMP13和ADAMTS5的蛋白水平在敲低组中显著上调。这些数据表明circFOXO3敲低促进ATDC5细胞的凋亡和分解代谢。
为深入探究circFOXO3的治疗效应,研究者构建过表达病毒(慢病毒)并感染ATDC5细胞以增强circFOXO3表达(RT-qPCR验证高效过表达)。功能获得实验中阿利新蓝染色评估显示IL-1β刺激导致的蛋白聚糖合成减少被circFOXO3过表达逆转;CCK-8检测显示circFOXO3过表达提高了ATDC5细胞活力;Western blot和IF结果显示,IL-1β处理促进BAX、Cleaved caspase-3、Cleaved PARP、MMP13和ADAMTS5的表达,同时降低BCL-2和II型胶原表达,而circFOXO3过表达拮抗了IL-1β的效应;TUNEL染色也显示circFOXO3过表达对细胞凋亡具有挽救作用。综上,这些结果表明circFOXO3通过调控软骨细胞增殖、凋亡和ECM代谢发挥抗OA保护作用。
图2. 过表达circFOXO3对ATDC5细胞活力、凋亡和ECM代谢的影响
3.下游分子FOXO3调控ATDC5细胞凋亡及ECM代谢
为进一步探究下游靶向分子FOXO3在OA中的作用,研究人员通过靶向FOXO3 mRNA的siRNA及过表达慢病毒,特异性敲低或过表达ATDC5细胞中的FOXO3。RT-qPCR和Western blotting结果显示,与对照组相比,FOXO3在mRNA和蛋白水平均被成功敲低或过表达。CCK-8检测发现,敲低或过表达FOXO3分别降低或提高细胞活力。此外,si-FOXO3处理的ATDC5细胞中蛋白聚糖合成较对照组急剧减少;IL-1β诱导的蛋白聚糖合成减少被FOXO3过表达逆转。Western blot结果显示,FOXO3敲低上调凋亡相关蛋白(BAX、Cleaved caspase-3和Cleaved PARP)的表达并下调BCL-2的表达,而FOXO3过表达显著逆转了IL-1β模拟的效应。表明FOXO3调控软骨细胞凋亡。TUNEL染色也证实了FOXO3对细胞凋亡的调控作用。此外,Western blot和IF结果显示,FOXO3介导了ECM的降解。
4.circFOXO3调控OA具有FOXO3依赖性
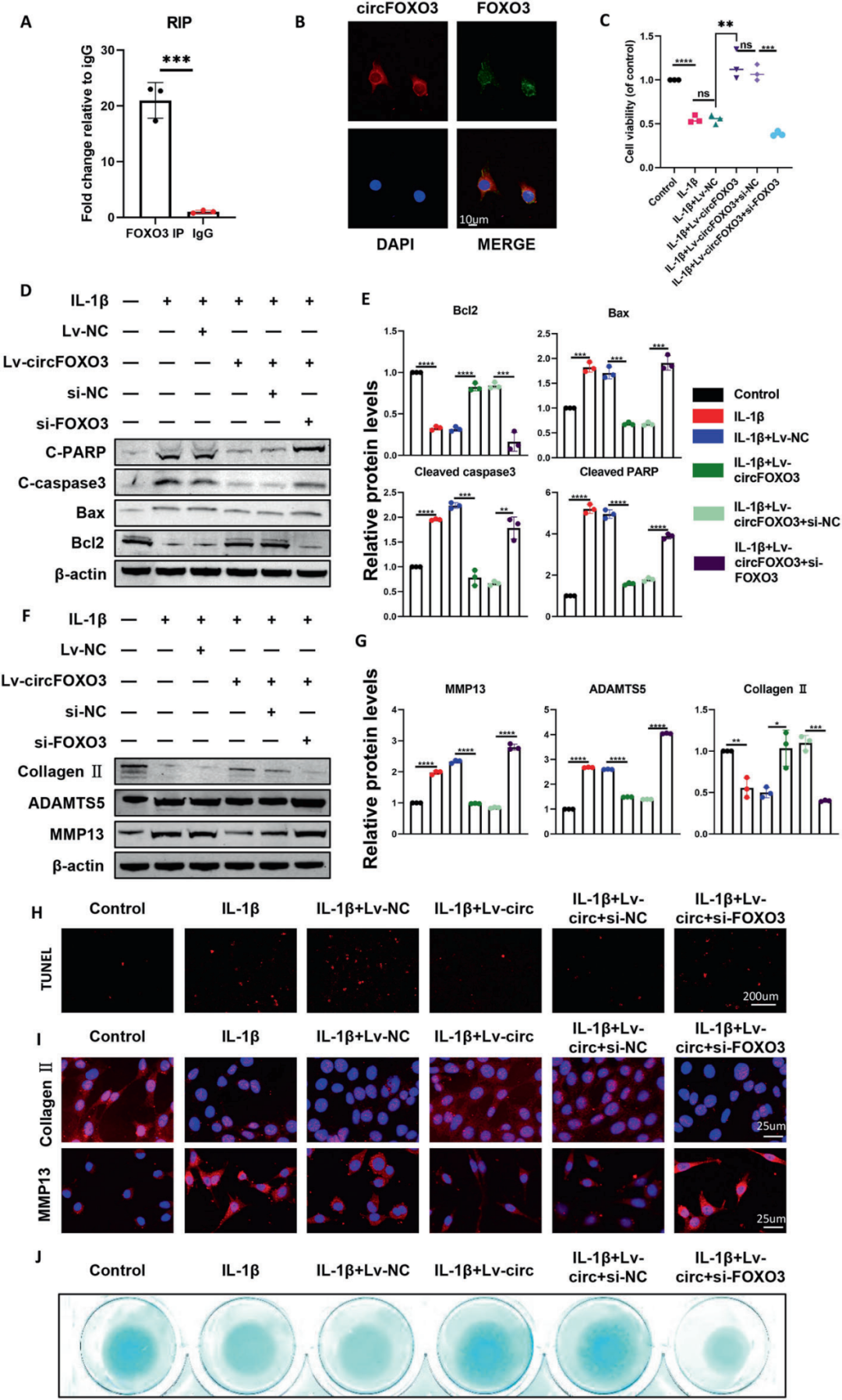
由于circFOXO3在细胞质中含量丰富且稳定,作者进一步探究circFOXO3对细胞代谢的调控是否通过其它基因(如circFOXO3的母体基因FOXO3)实现。如预期结果所示,RIP实验表明circFOXO3可被抗FOXO3抗体下拉。ATDC5细胞中的RNA-蛋白共定位分析(RNA-FISH实验+IF分析)进一步验证了FOXO3与circFOXO3的相互作用。
为深入验证circFOXO3是否通过与FOXO3相互作用在OA中发挥功能,在ATDC5细胞中共感染Lv-circFOXO3和si-FOXO3。结果显示,circFOXO3过表达挽救了IL-1β引起的细胞活力下降,然而这种挽救效应被同时敲低FOXO3所逆转。与单独表达Lv-circFOXO3的细胞相比,共感染Lv-circFOXO3和si-FOXO3的细胞中BAX、Cleaved caspase-3和Cleaved PARP蛋白水平显著升高,而BCL-2水平降低。
在ECM代谢方面,与单独过表达circFOXO3的细胞相比,共感染Lv-circFOXO3和si-FOXO3的细胞中MMP13和ADAMTS5蛋白水平显著升高,II型胶原蛋白水平降低。TUNEL染色结果显示,circFOXO3过表达对细胞凋亡的挽救作用被FOXO3敲低所逆转。IF分析也表明,与单独过表达circFOXO3组相比,circFOXO3过表达联合FOXO3敲低组中II型胶原表达下降且MMP13水平升高。此外,高密度细胞培养后蛋白聚糖合成分析的结论与上述结果一致。综上所述,这些结果表明,circFOXO3通过靶向FOXO3调控细胞凋亡和ECM代谢。
图3. circFOXO3对OA的调控是FOXO3依赖性的
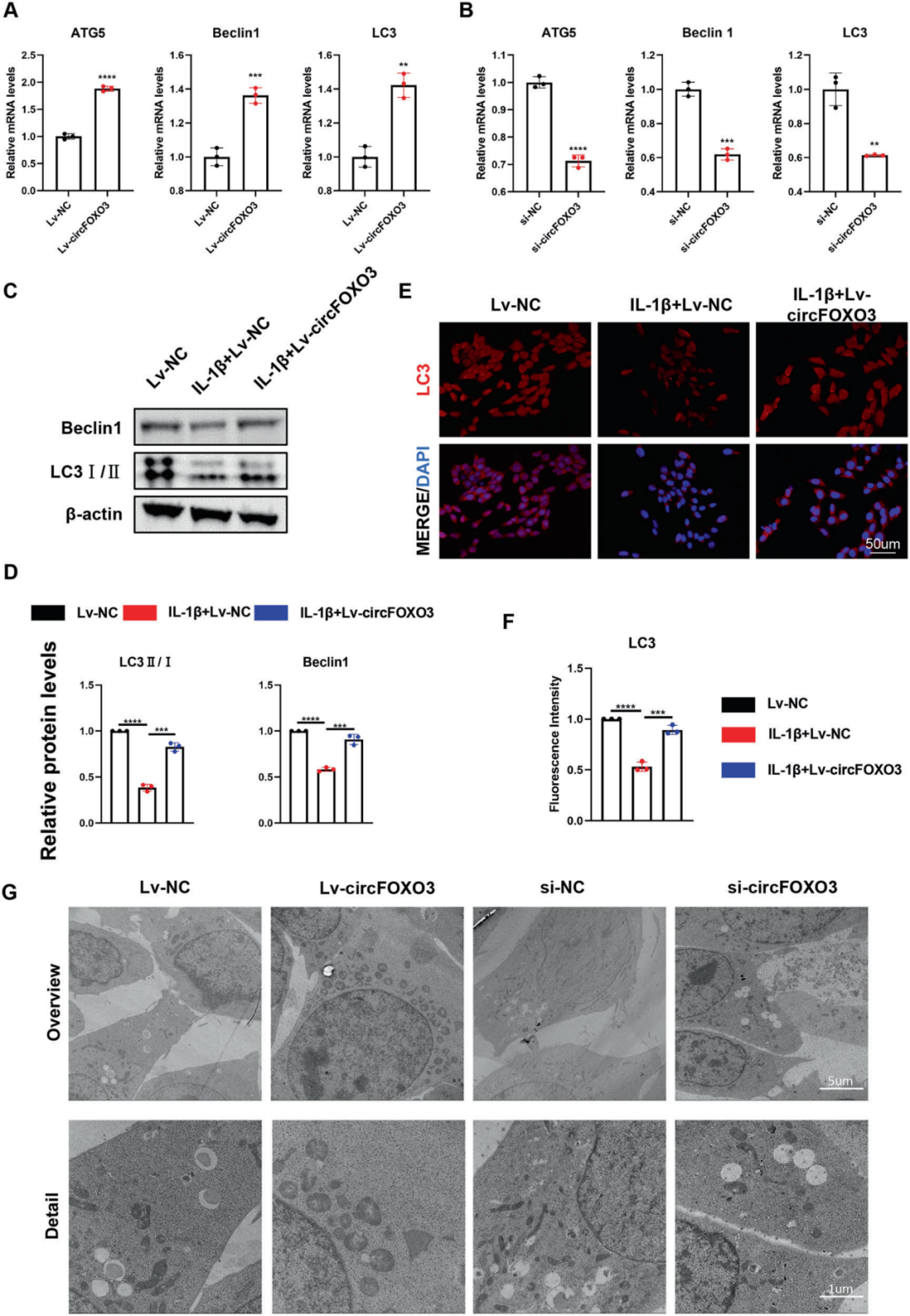
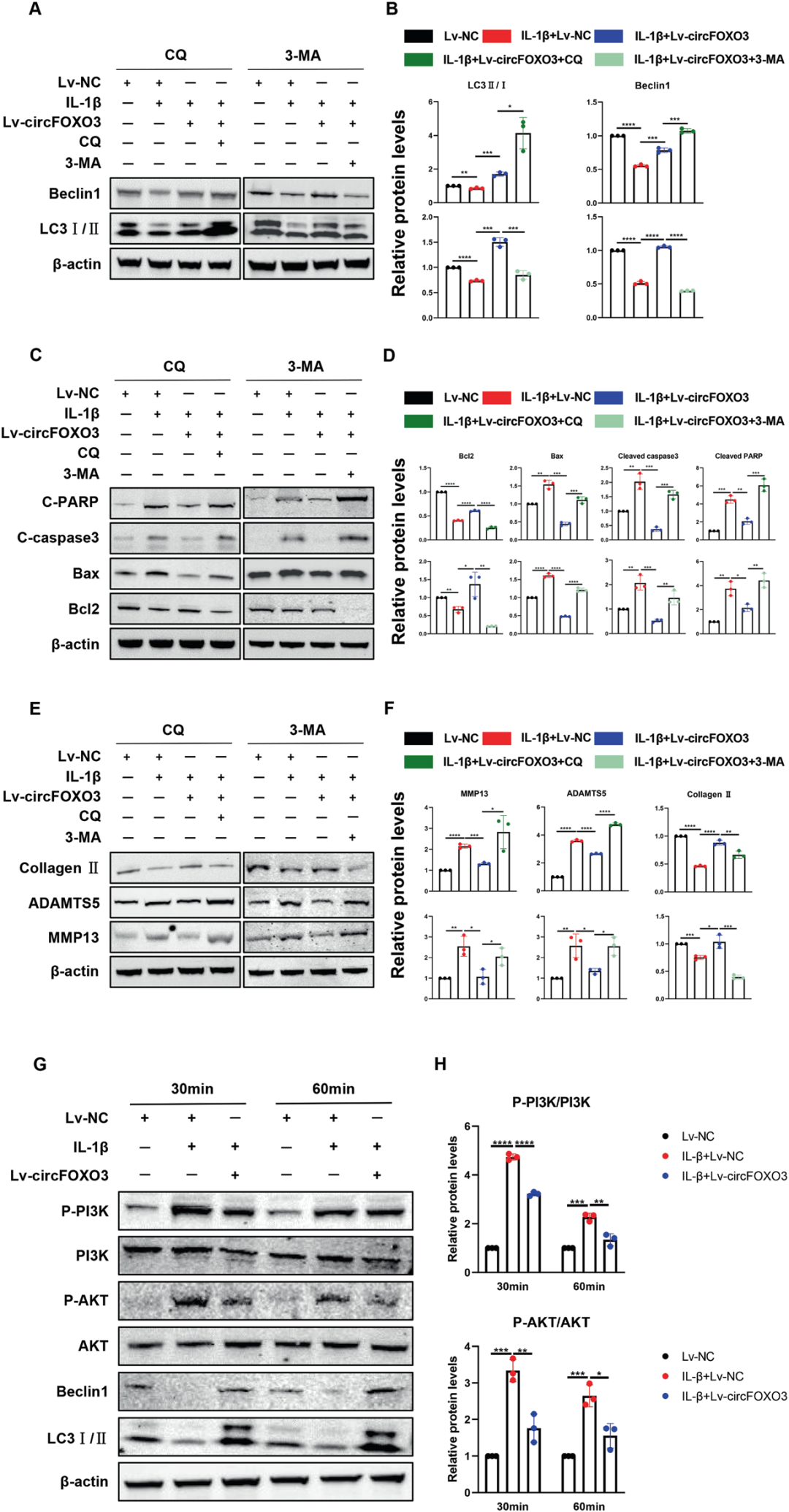
5.circFOXO3增强IL-1β处理ATDC5细胞自噬
接下来,研究人员探究circFOXO3在OA中的作用是否通过调控自噬实现。通过RT-qPCR发现,与对照组相比,Lv-circFOXO3处理的ATDC5细胞自噬标志物(包括ATG5、Beclin1和LC3)表达显著升高;Western blotting和LC3 IF染色也显示LC3II及Beclin1表达上调。透射电镜(TEM)证实,与对照组相比,Lv-circFOXO3增加了自噬相关囊泡的数量。相反,敲低circFOXO3不仅下调自噬标志物的表达水平,且减少了自噬相关囊泡的形成。这些结果表明,circFOXO3的抗凋亡活性及调控ECM代谢的功能可能与促进自噬相关。
图4. circFOXO3促进IL-1β处理ATDC5细胞自噬
6.circFOXO3通过自噬灵敏调节IL-1β诱导的ATDC5细胞关节炎表型
研究者推测circFOXO3可能通过调节自噬活性参与调控软骨细胞凋亡和ECM稳态。为验证这一假设,研究人员分别使用自噬抑制剂3-甲基腺嘌呤[3-MA,通过抑制磷脂酰肌醇3-激酶(PI3K)阻断自噬体形成]和氯喹(CQ,抑制自噬体-溶酶体融合)处理ATDC5细胞,检测细胞凋亡和ECM代谢标志物水平。结果显示,与对照组相比,circFOXO3过表达显著提高了Beclin1蛋白水平和LC3II/LC3I比值,再次证实其具有调控自噬的作用。值得注意的是,circFOXO3对IL-1β诱导的自噬抑制的挽救效应在加入自噬抑制剂后被逆转。当自噬抑制剂存在时,circFOXO3对IL-1β诱导的凋亡标志物(包括BAX、Cleaved caspase-3、Cleaved PARP和BCL-2)及ECM代谢标志物(包括Collagen II、MMP13和ADAMTS5)水平的调节能力较对照组显著降低。这些结果表明circFOXO3对软骨细胞的保护作用依赖于其增强自噬的功能。
图5. circFOXO3通过自噬灵敏调控IL-1β诱导的ATDC5细胞关节炎表型
7.circFOXO3过表达通过抑制PI3K/蛋白激酶B(AKT)通路上调自噬活性
为探究circFOXO3调控自噬的分子机制,作者分析了不同处理时间下PI3K/AKT通路相关蛋白的表达水平。结果显示,与对照组相比,IL-1β(10 ng/mL)处理在30分钟至1小时内以时间依赖性方式显著提高了磷酸化PI3K(p-PI3K)/总PI3K(PI3K)和磷酸化AKT(p-AKT)/总AKT(AKT)的比值。然而,circFOXO3的过表达在炎症环境下显著抑制了p-PI3K和p-AKT的激活,提示circFOXO3对自噬的调控可能通过部分抑制p-AKT的激活实现。此外,在10 ng/mL IL-1β处理30分钟至1小时的ATDC5细胞中,LC3II/LC3I比值降低、Beclin1的降解显著增加,而circFOXO3的过表达逆转了这两种自噬标志物的表达变化,表明抑制PI3K/AKT通路是circFOXO3诱导自噬的关键机制。
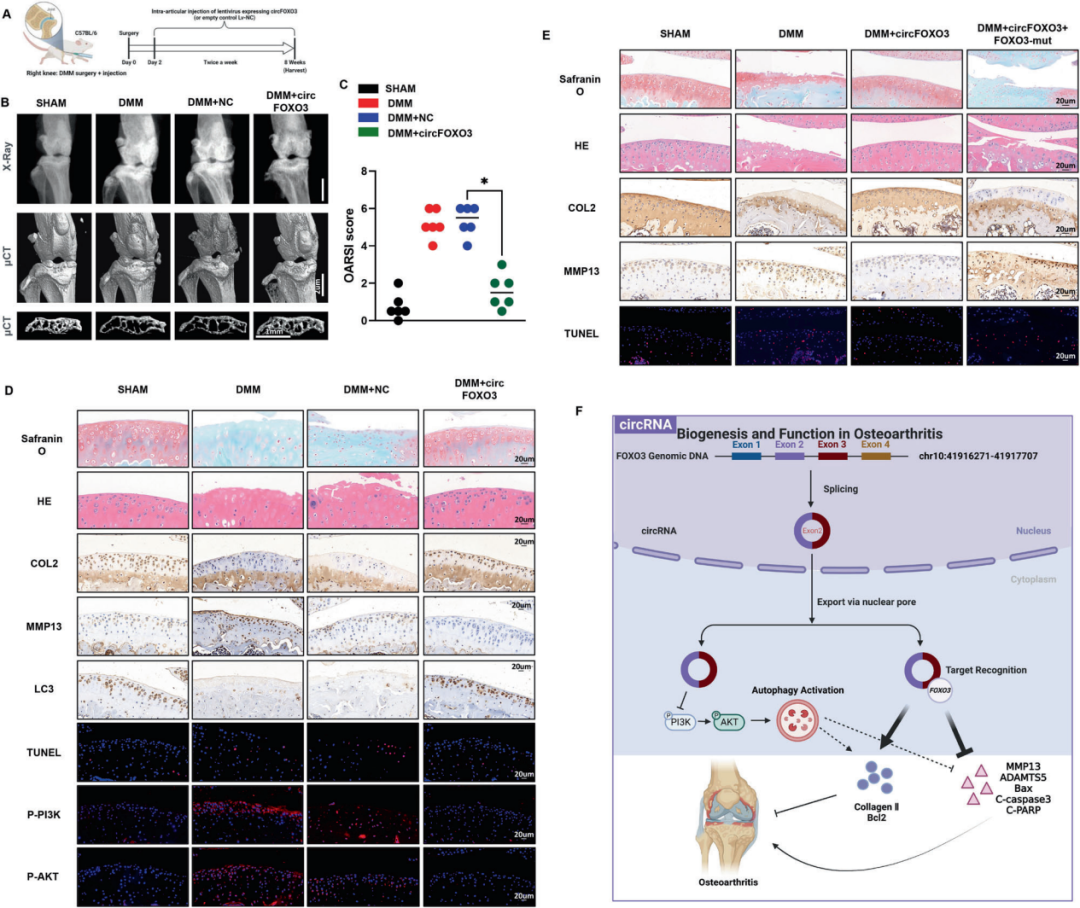
8.circFOXO3基因治疗在小鼠OA模型中维持关节软骨完整性
上述机制提示circFOXO3可能具有治疗OA的潜力。为评估其疗效,本研究通过构建小鼠DMM OA模型,并利用过表达circFOXO3的慢病毒载体进行体内实验。DMM术后两天,向小鼠关节腔内注射circFOXO3过表达慢病毒,术后八周通过H&E染色、番红O-快绿染色及OARSI(国际骨关节炎研究学会)评分评估软骨破坏程度。Micro-CT因其相较于X射线的优势,被广泛用于骨组织三维重建,可直观测量骨密度、骨形态及骨小梁结构等参数。三维重建图像显示,OA小鼠骨赘数量较假手术组增加,而circFOXO3关节腔注射显著减少骨赘形成。此外,circFOXO3注射组软骨下骨体积部分增加。研究人员进一步依据H&E染色、番红O-快绿染色结果进行OARSI评分。结果显示,Lv-circFOXO3组评分相较于空载病毒组显著降低。上述结果表明circFOXO3慢病毒注射显著改善DMM诱导的OA小鼠关节软骨表面结构。
IHC和TUNEL染色结果显示,与空载病毒组相比,Lv-circFOXO3注射减轻了OA小鼠软骨基质的退行性改变,包括抑制凋亡(TUNEL染色阳性减少)和分解代谢反应(MMP13表达下调),并增加ECM成分(II型胶原蛋白表达升高)。通过LC3B IHC分析进一步证实,circFOXO3对OA进展的调控部分依赖于体内自噬机制。IF分析还证明,circFOXO3抑制了OA小鼠PI3K/AKT信号通路。以上结果表明,关节腔内递送circFOXO3可通过维持软骨完整性成为OA治疗的潜在策略。
最后,通过体内实验验证circFOXO3对OA的调控是否依赖于FOXO3。H&E和番红O-快绿染色显示,过表达circFOXO3慢病毒注射后关节面软骨层显著增厚,而同时敲低FOXO3削弱了这一效应。IHC结果显示,Lv-circFOXO3注射降低了软骨细胞中MMP13表达并增加Collagen II水平,而FOXO3的同步敲低则减少Collagen II并升高MMP13。此外,TUNEL染色显示的细胞凋亡变化与体外实验结果一致。综上,circFOXO3通过依赖FOXO3的机制维持软骨ECM合成代谢并抑制分解代谢,从而缓解OA进展。
图6. 小鼠OA模型中,circFOXO3基因治疗可保护关节软骨的完整性
结论与局限
本研究揭示了一条新的信号通路——circFOXO3/FOXO3通路,该通路可能通过维持软骨ECM稳态、调控软骨细胞凋亡与增殖来发挥OA保护作用。因此,circFOXO3的过表达有望成为治疗OA的潜在治疗策略。此外,本研究为未来探索circRNA作为OA治疗靶点及深入解析其作用机制奠定了基础。
本研究也存在一定局限性。正如其他研究所述,若能构建circFOXO3转基因小鼠而非简单地向小鼠关节腔内注射过表达慢病毒,结论将更具说服力。不过,本文中研究方法仍可通过改进药物递送方式(如采用外泌体或水凝胶包裹circRNA分子)来提升效果——这是实现治疗性物质稳定递送的常用策略。其次,在细胞实验中使用了ATDC5细胞系而非原代软骨细胞。但ATDC5细胞系作为评估体外软骨形成的细胞模型已被广泛应用。当培养基中添加ITS[胰岛素(Insulin)、转铁蛋白(Transferrin)和硒(Selenium)的复合补充剂]后,该细胞系可形成软骨结节样细胞聚集体,并产生特异性蛋白聚糖和II型胶原蛋白——这些正是软骨细胞的典型分子标志物。因此,ATDC5细胞为研究软骨分化提供了良好模型。此外,ATDC5细胞近年来已被众多OA研究作为细胞实验工具,在最大限度减少动物使用量的同时仍具备良好的软骨细胞特性。
需要指出的是,虽然本研究证实circFOXO3通过调控自噬可能在OA发生发展中起关键作用,但本研究结果并不排除其它与circFOXO3相互作用的分子参与自噬激活的可能性。相关研究指出,circFOXO3可通过与哺乳动物雷帕霉素靶蛋白(mTOR)及E2F1相互作用抑制mTOR复合体1活性,从而促进自噬。这一机制可能也参与了circFOXO3对OA的调控。为深入解析circFOXO3通过激活自噬改善OA的作用机制,后续研究应着重探索与circFOXO3及自噬功能相关的其他分子。
本研究由国家自然科学基金(项目编号:81871791)和上海市自然科学基金(项目编号:19ZR1429100)资助完成。
通讯作者介绍:
王晓庆,主任医师、医学博士,博士和硕士研究生导师。在上海交通大学医学院附属第九人民医院骨科长期从事临床诊疗与科研工作。主要研究方向涵盖骨关节损伤修复、骨折畸形愈合及骨不连矫形治疗、人工关节术后并发症(如无菌性松动、感染)的防治,及骨关节炎发病机制探索。以第一作者或通讯作者身份发表论文20余篇,其中SCI收录10余篇。现主持国家重点研发计划专项课题1项,曾主持完成国家自然科学基金青年项目1项、面上项目2项及上海市卫生局课题1项,并作为核心成员参与国家自然科学基金课题2项。
本文使用的病毒产品列表如下:
枢密科技已开发一系列慢病毒现货产品,可提供基因下调、基因过表达、基因敲入/敲除、功能扰动、钙信号检测等现货产品及包装定制服务。

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK