2025-04-21 阅读量:1583
骨代谢是一个动态过程,传统上认为这一过程受体液中激素分泌的调控。在老年或病理状态下,骨代谢稳态被打破,导致骨质疏松症的发生,这是骨骼衰老的常见标志。尽管目前已有多种治疗骨质疏松的方法,但由于对成骨关键调控因子的了解有限,骨质疏松症仍无法完全治愈。近年来的研究表明,大脑在精细调控骨代谢中发挥着重要作用。骨骼被丰富的感觉神经支配,这些神经将信号传递至大脑,使大脑能够通过骨骼内感受机制感知骨代谢状态,并通过反馈调节成骨。交感神经系统在骨代谢中扮演重要角色,通过影响成骨细胞和破骨细胞来调节骨形成和骨吸收。此外,激素相互作用(如瘦素)对这一过程也至关重要。然而,骨骼向大脑传递信号以调控骨代谢的神经内分泌机制仍不清楚。
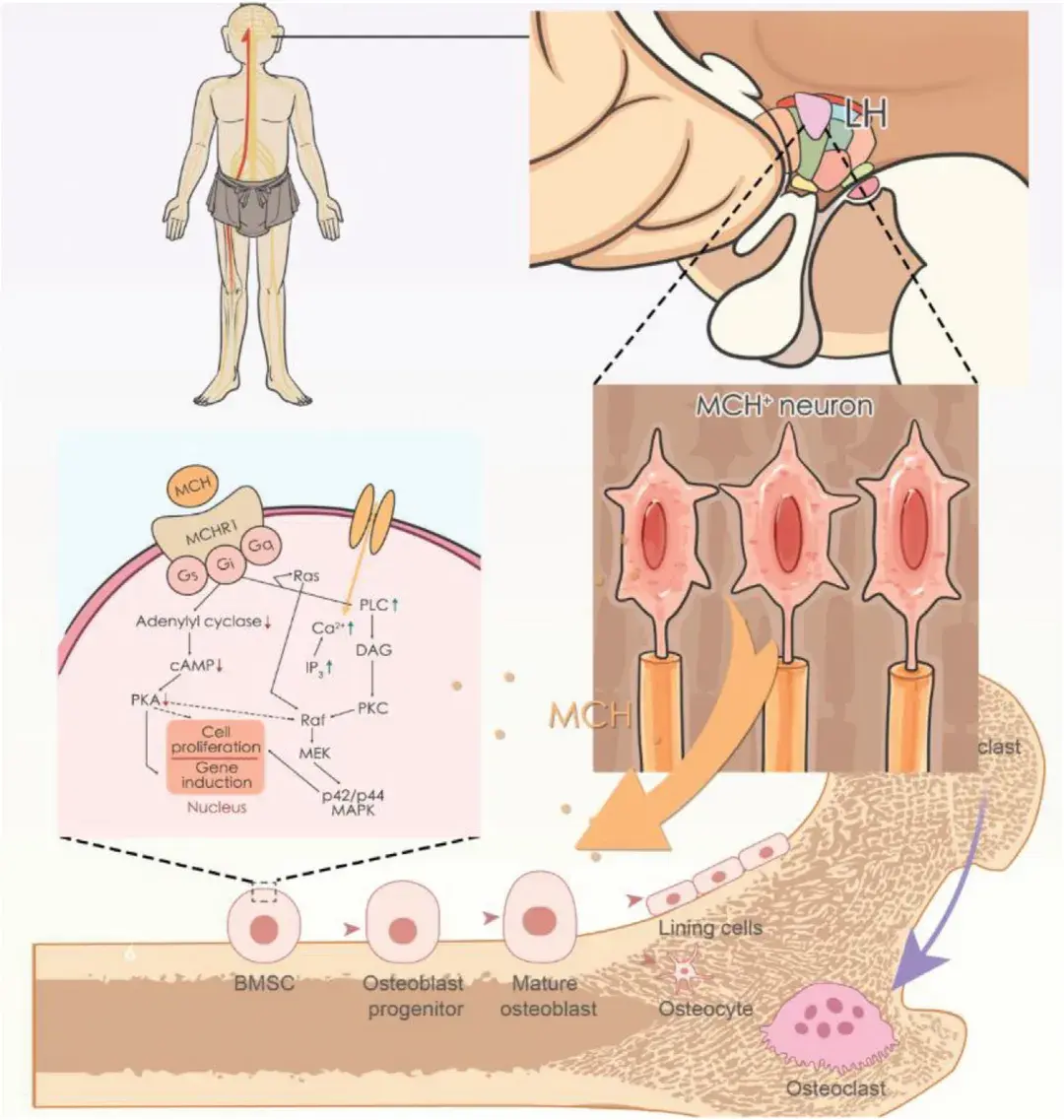
下丘脑作为中枢调控枢纽,接收来自前脑的信息,调节全身代谢并维持稳态。它通过协调自主神经系统和调控激素活性,在维持代谢稳态中发挥主导作用。外侧下丘脑(LH)是下丘脑的关键部分,通过分泌食欲素(orexin)和黑色素浓缩激素(MCH)等激素调节能量代谢。食欲素已被证明可通过激活LH中的食欲素受体2(OX2R)调节骨稳态和骨量,但MCH在骨代谢中的作用尚未阐明。除了交感神经系统之外,能够整合骨骼内感受信号并调控骨组织的神经内分泌环路及其分子机制仍知之甚少。
中南大学湘雅医院朱剑熹主治医师团队在Advanced Science期刊上发表的文章“Targeting MCH Neuroendocrine Circuit in Lateral Hypothalamus to Protect Against Skeletal Senescence”发现了一个直接控制骨生成的中枢神经内分泌环路。该研究通过病毒示踪技术发现,LH中表达MCH(而非食欲素)的神经元直接与骨骼相连,其活性在骨质疏松状态下显著降低。进一步利用化学遗传病毒和转基因小鼠模型操控这些神经元后发现,激活LH中的MCH神经元可显著促进成骨和加速骨组织再生,而抑制这些神经元则减少成骨。单细胞测序显示,抑制LH中的MCH神经元会降低骨髓间充质干细胞(BMSCs,主要存在于骨髓基质中)的成骨分化能力,并诱导细胞衰老。机制上,MCH通过激活MCH受体1(MCHR1)和蛋白激酶A(PKA)信号通路促进BMSCs分化,诱导成骨。总之,本研究阐明了一条新的神经内分泌通路,揭示了LH中MCH神经元通过分泌MCH促进BMSCs分化,从而调控骨代谢和成骨的作用机制。靶向LH中的MCH通路有望成为防治骨骼衰老的有效治疗策略。
1、骨与LH中的MCH神经元存在连接
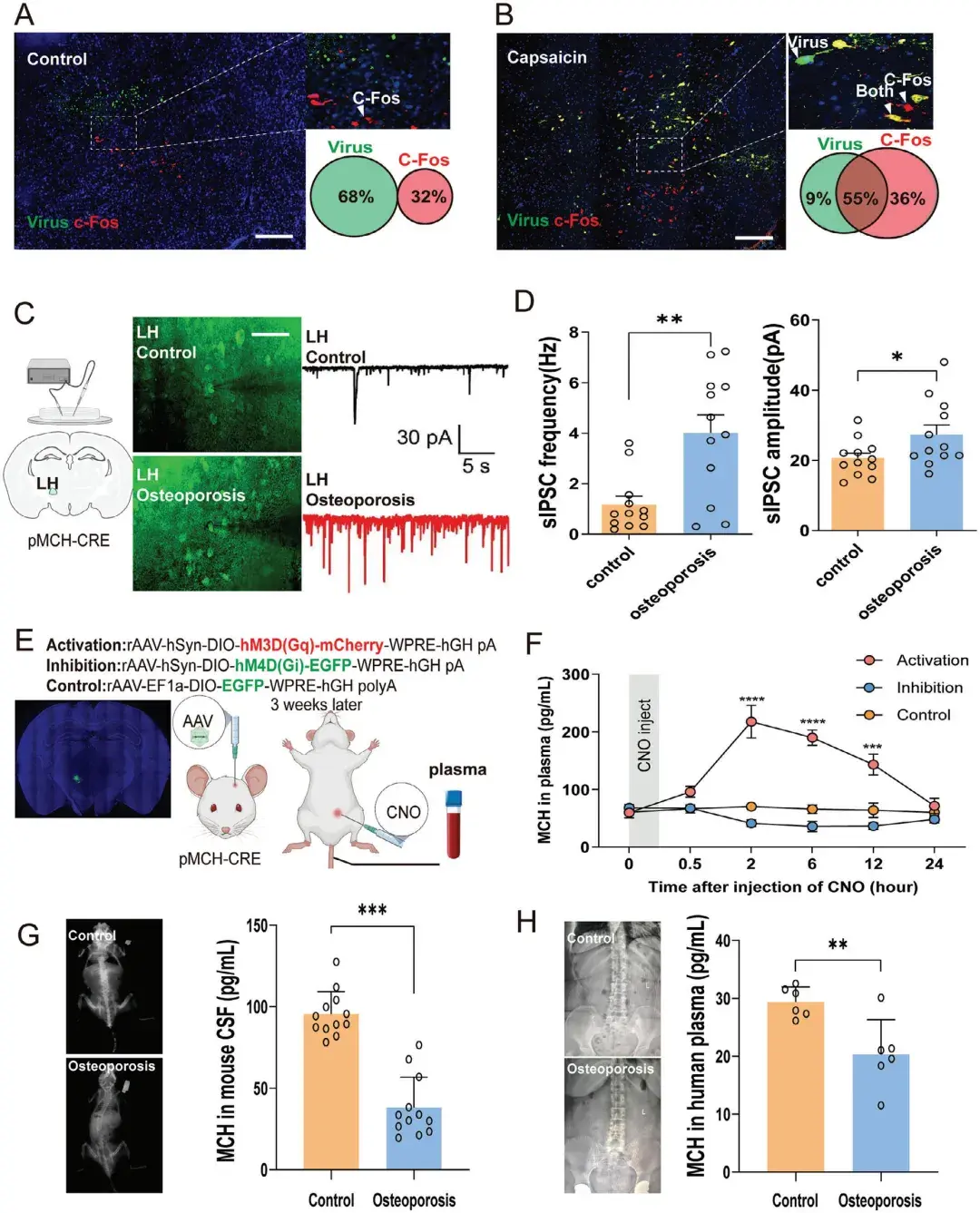
为明确参与骨量调节的中枢神经元群体,作者首先鉴定了与骨存在直接连接的神经元。作者将携带增强型绿色荧光蛋白(EGFP)的单纯疱疹病毒(HSV-129)注射到成年雄性小鼠的骨髓中,实现了对接受骨源性信号的中枢神经元的顺行跨突触标记。结果显示,在注射后7天,LH的特定区域(前囟后2.00 mm、中线旁开1.37 mm、深度4.65 mm)内出现了一簇EGFP阳性的神经元。为进一步明确这些神经元的亚型,作者对这些EGFP阳性神经元进行了共染色,发现其中大部分与MCH共定位,而与orexin或囊泡谷氨酸转运蛋白2(Vglut2)共染色的神经元比例较低。具体而言,MCH、orexin和Vglut2与病毒的共定位比例分别为24.5%、2.3%和3.9%(以黄色荧光在所有荧光信号中的百分比为标准)。这些结果表明,骨与LH中特定的MCH神经元之间存在跨突触连接,揭示了一条新的调节骨量的神经通路。
2、LH中MCH神经元的活性与成骨作用相关
为探索LH中MCH神经元的活性是否与骨相关并影响成骨作用,作者首先利用c-Fos[即刻早期基因,其表达产物在神经元受到刺激时能够迅速上调,常被用作神经元激活的标记物]染色技术检测了LH中MCH神经元在骨刺激后的快速激活情况。通过在小鼠骨髓中使用辣椒素或生理盐水(对照)来快速刺激中枢反应,发现辣椒素刺激组的小鼠LH中c-Fos和HSV双阳性细胞数量明显高于对照组。为深入探究不同骨量状态下LH中MCH神经元的活动,研究使用年龄诱导的骨质疏松小鼠,通过膜片钳实验记录了LH中MCH神经元的自发抑制性突触后电流(sIPSCs)。由于sIPSCs反映了神经元网络中自发释放的抑制性神经递质(如GABA)引发的突触后电流,因此可用于指示神经元的抑制状态。结果显示,与对照组相比,骨质疏松组小鼠LH中MCH神经元的sIPSCs幅度显著增加,提示其神经活动受抑。
此外,研究还利用腺相关病毒(AAV)结合化学遗传学技术激活或抑制pMCH-Cre小鼠(能够特异性地在MCH神经元中表达Cre重组酶)LH中的MCH神经元,发现激活这些神经元后约2 h,MCH可迅速释放到血液循环中,且血浆中MCH浓度达到峰值(200 pg/mL)。而化学遗传抑制组或对照组未观察到MCH水平的显著变化。为了进一步描述MCH在外周骨代谢中的作用,作者还检测了骨质疏松小鼠脑脊液(CSF)中的MCH水平,结果显示,与对照组小鼠相比,骨质疏松小鼠CSF中的MCH水平显著降低(从约90 pg/mL降至约40 pg/mL)。与此同时,作者对骨质疏松症患者的血浆MCH水平进行了评估,并观察到与健康对照组相比,其血浆MCH浓度显著下降(从约30 pg/mL降至约20 pg/mL)。这些结果表明LH中MCH神经元的活性与骨密度密切相关,且在这些神经元受到刺激时,MCH会释放进入血液循环。
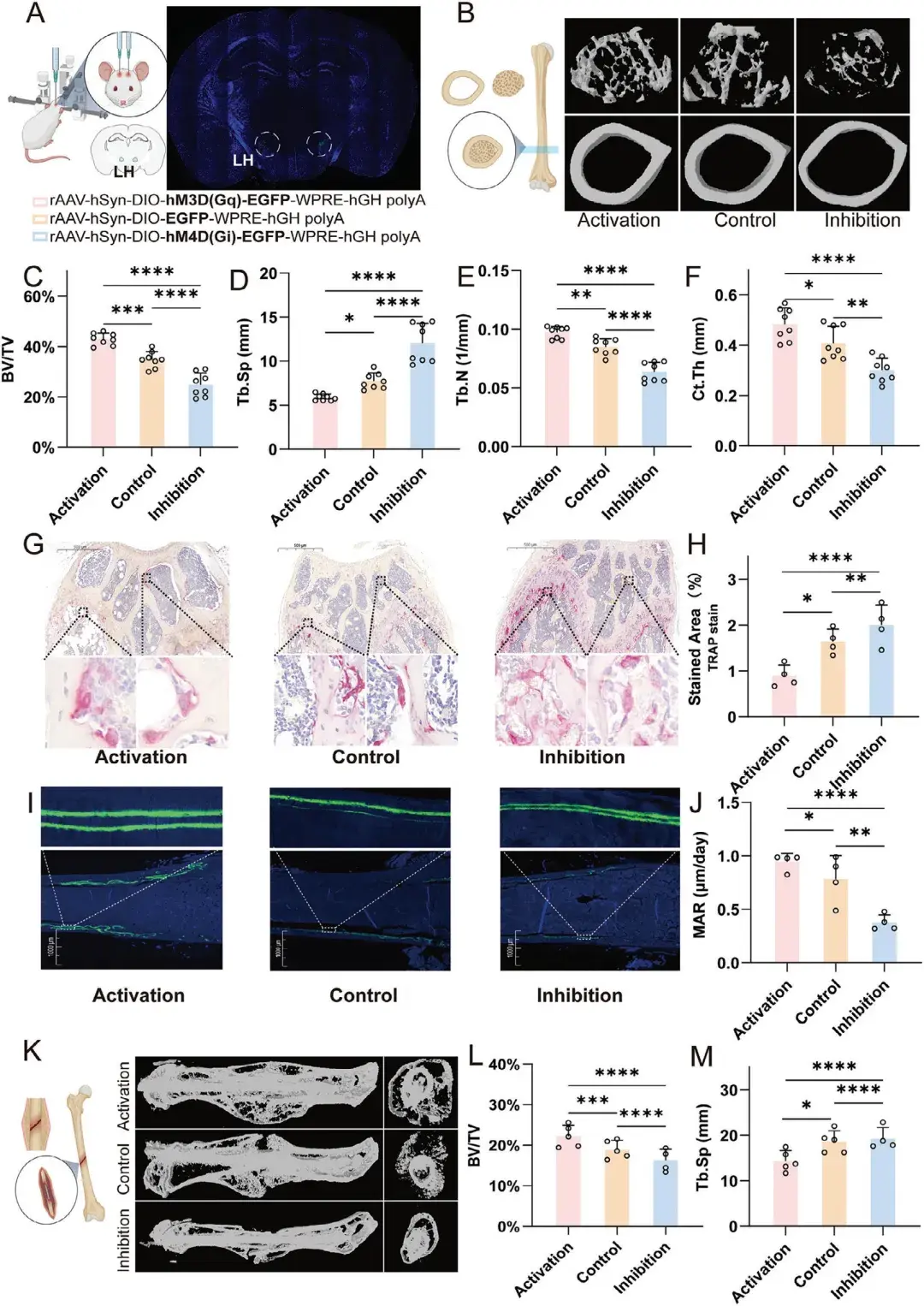
3、激活LH中的MCH神经元诱导成骨并抵御骨骼衰老,抑制则诱导骨质疏松和BMSCs衰老
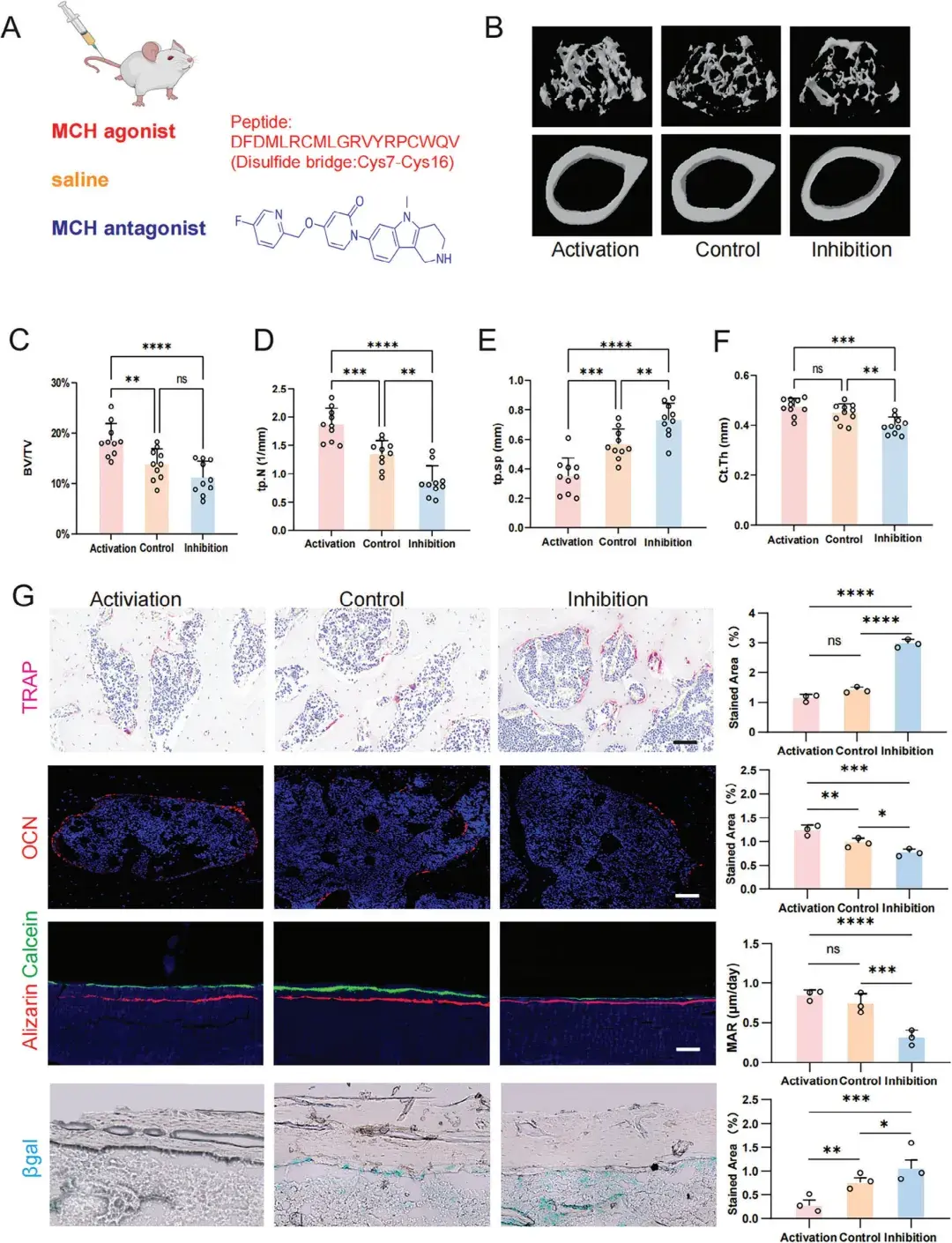
为探究LH中MCH神经元在成骨和骨再生中的作用,作者构建了两种动物模型,分别是年龄诱导的骨质疏松模型和老年骨折修复模型。在骨质疏松模型中,作者对18个月大的pMCH-Cre小鼠(已表现出年龄诱导的骨质疏松)LH中的MCH神经元进行了化学遗传学激活,通过微计算机断层扫描(Micro-CT)分析了股骨远端的骨小梁和皮质骨。结果显示,激活组的骨小梁体积分数(骨体积/组织体积,BV/TV)显著高于对照组和抑制组(分别为20%、15%和10%)。此外,激活组的骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)和连接密度(Conn.Dn)较对照组和抑制组部分恢复。为评估MCH神经元激活后的骨吸收和骨形成状态,作者分别进行了抗酒石酸酸性磷酸酶(TRAP)染色和体内钙黄绿素标记。TRAP染色结果显示,激活组的骨小梁中TRAP阳性细胞数量较对照组和抑制组减少,表明骨吸收降低。而体内钙黄绿素标记显示,激活组的新骨形成速率高于对照组和抑制组。
在老年骨折修复模型中,作者采用三点弯曲技术制造可控骨折,并通过髓内钉进行内固定。利用该骨折模型,旨在检测LH中MCH神经元激活后的新生骨形成和骨折修复情况。首先,作者通过Micro-CT分析骨折后4周的骨折愈合处骨痂形成情况。结果显示,与对照组和抑制组相比,MCH激活组的骨折修复效果更好,骨痂形成量更大。与年龄诱导的骨质疏松模型一致,化学遗传学激活后,BV/TV显著增大,Tb.Sp显著降低,表明骨痂形成质量更好。综合这两种动物模型的结果表明,激活LH中的MCH神经元能够显著促进成骨作用,并有效抵御骨骼衰老。
图2. 激活LH中的MCH神经元诱导成骨
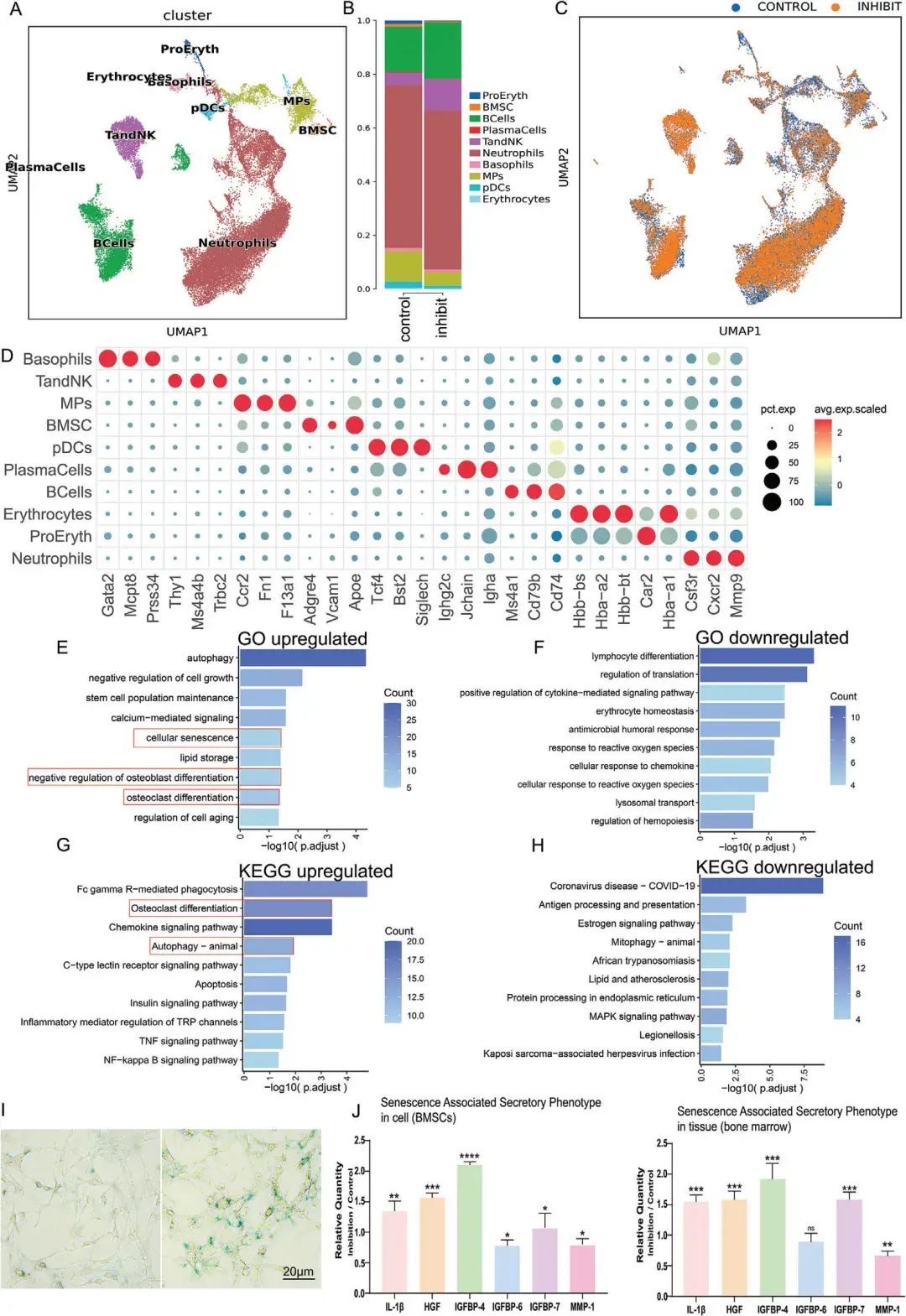
为进一步阐明参与其中的主要细胞类型和信号通路,作者采用化学遗传学方法抑制LH中的MCH神经元,并进一步开展了单细胞RNA测序(scRNA-seq)。研究发现,化学遗传学抑制MCH神经元会导致BMSCs比例下降。基因本体论(GO)分析表明,BMSCs中与细胞衰老、成骨细胞分化负向调控和破骨细胞分化相关的基因表达上调,而与淋巴细胞分化相关的基因表达下调。此外,京都基因和基因组百科全书(KEGG)通路分析显示,在MCH神经元抑制组中,与骨吸收相关的多个通路出现上调,包括破骨细胞分化和自噬过程。相反,诸如雌激素信号通路和线粒体自噬等通路则表现出下调。在对分离的BMSCs进行进一步分析时,作者发现,在MCH神经元抑制组中,β-半乳糖苷酶(β-gal,其活性可指示细胞的衰老状态)活性显著增加。此外,与对照组相比,抑制组中衰老相关分泌表型[SASP,以分泌炎症细胞因子、生长因子和蛋白酶为特征,已知其对衰老过程及与年龄相关的疾病有促进作用]的表达显著上调。这些结果表明,在LH中化学遗传学抑制MCH神经元的活性,能够特异性地减弱BMSCs的活性,诱导其衰老。
图3. 抑制LH中的MCH神经元可减弱BMSCs活性
4、MCH通过PKA信号诱导BMSCs成骨分化
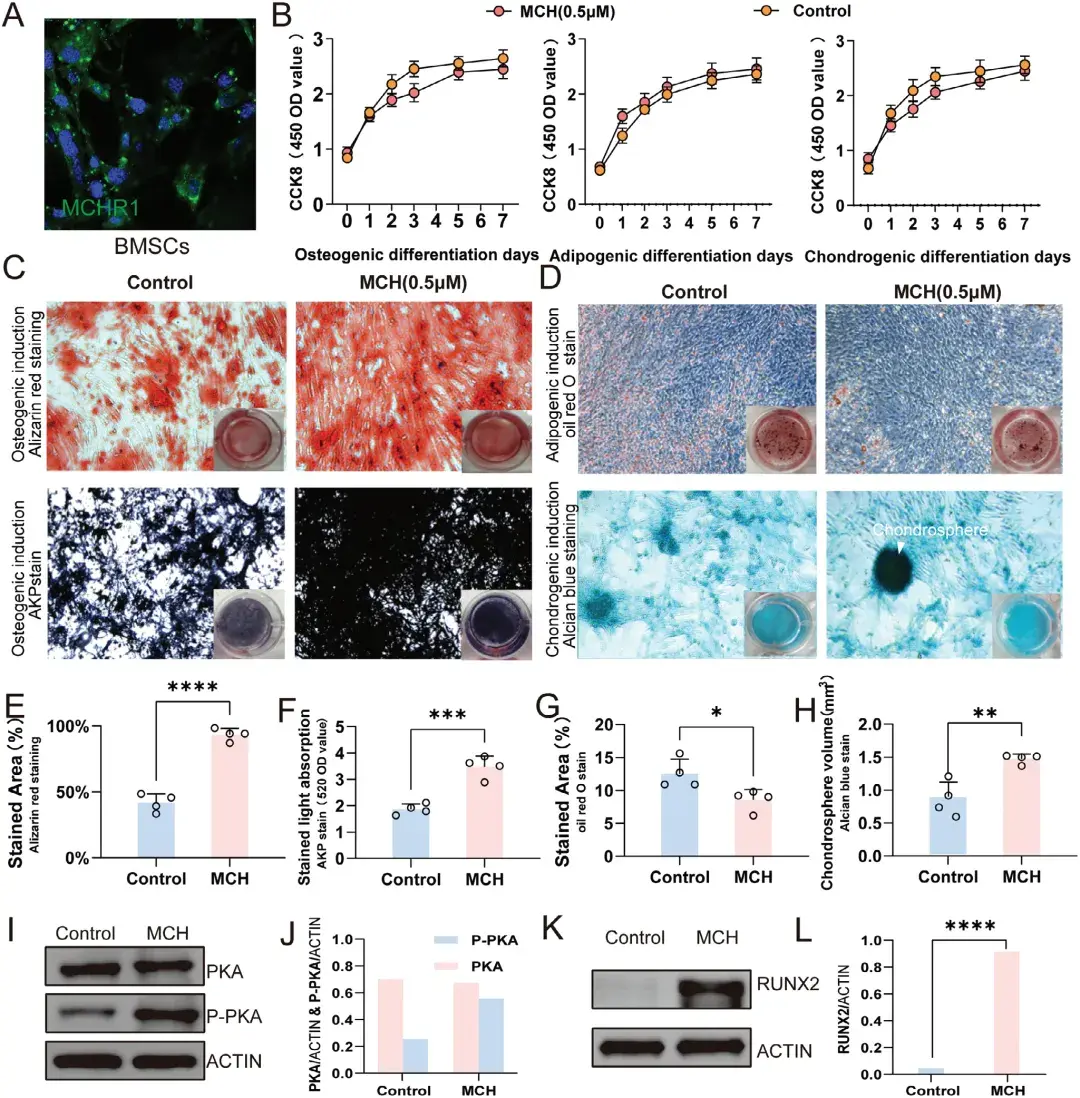
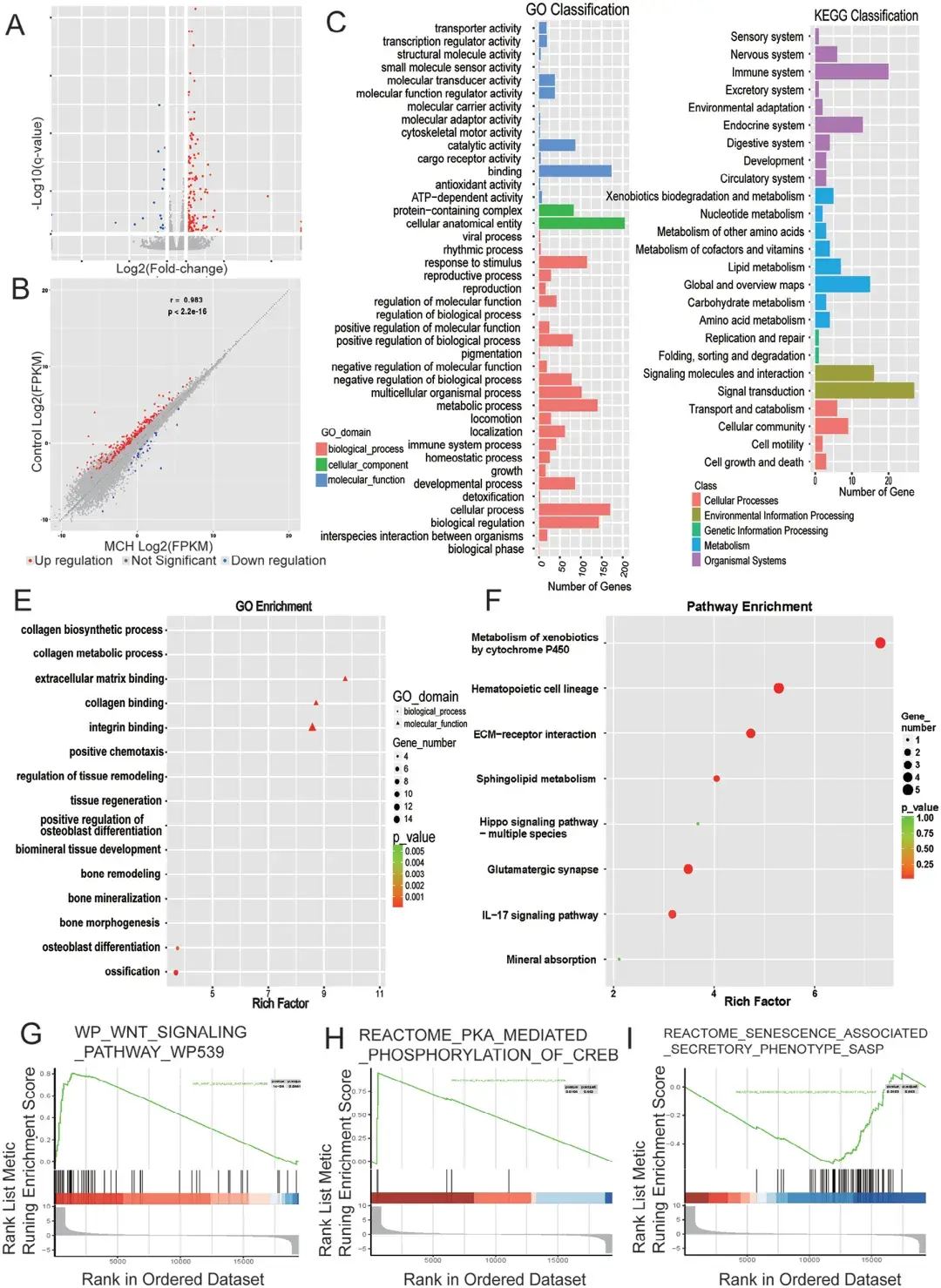
前面已证实LH中的MCH神经元在化学遗传学刺激下能够将MCH释放到循环系统中,于是作者提出假设:当MCH通过循环系统到达骨组织区域后,可通过激活局部MCH受体直接诱导成骨作用。首先,作者测试了MCH受体在不同细胞类型上的表达,包括BMSCs和破骨细胞。通过免疫染色发现MCHR1特异性表达于BMSCs上。随后,作者检测了MCH对BMSCs增殖和分化的影响,以CCK8(用于评估细胞增殖和毒性)作为指标,结果发现0.5 μm MCH处理对BMSCs的成骨、成脂和成软骨分化有轻微影响。接着,作者通过茜素红(Alizarin Red)和碱性磷酸酶(AKP)染色检测了MCH对BMSCs成骨分化的影响。结果显示,经MCH处理的BMSCs的成骨潜力显著高于对照组,表现为钙结节沉积量的增加。此外,为了测试MCH对BMSCs成脂和成软骨分化潜力的影响,作者分别进行了油红O和阿利新蓝染色。结果表明,与对照组相比,MCH处理的BMSCs成脂分化潜力降低,而成软骨分化潜力增加。为揭示MCH作用的信号通路,作者检测了PKA通路的激活情况。蛋白质印迹分析(WB)显示,MCH处理后,BMSCs中磷酸化PKA水平显著上调。同时,成骨关键转录因子runx2的表达也随着MCH处理而上调。这些结果表明,MCH通过MCHR1/PKA信号通路诱导BMSCs的成骨分化。
图4. MCH通过PKA信号通路诱导BMSCs成骨分化
5、MCH激活BMSCs成骨作用并抑制衰老通路
为揭示MCH处理诱导BMSCs成骨分化背后的分子机制,作者采用了先进的高通量mRNA测序技术。经过9天成骨诱导后,对经MCH处理和未经MCH处理的BMSCs进行mRNA测序。研究发现,MCH处理的BMSCs中共有212个基因上调,31个基因下调。其中,碱性磷酸酶和整合素家族蛋白显示出显著的上调,这些基因在骨代谢和细胞黏附中发挥重要作用,进一步证实了MCH的成骨潜力。此外,GO富集分析显示,MCH处理显著影响了包括骨骼系统发育、骨化、整合素复合物形成、骨矿化和Wnt蛋白结合等骨形成通路,同时抑制了RNA聚合酶II转录活性的负向调控和细胞凋亡等通路。KEGG通路富集分析进一步表明,MCH处理显著上调了TGF-β、Wnt、Hippo和甲状旁腺激素等成骨相关信号通路,而与细胞衰老和破骨细胞分化相关的通路则下调。为深化理解并消除单独分析上调和下调基因可能带来的歧义,作者选取了与骨形成密切相关的三条通路,进行了更为集中的基因集富集分析(GSEA)。GSEA进一步验证了Wnt和PKA信号通路在MCH处理组中的显著上调,而SASP信号通路则明显下调。以上结果揭示了MCH处理能够触发一系列生物通路的级联反应,从而促进BMSCs的成骨分化,为理解骨形成与再生背后的分子机制开辟了新的视野。
图5. MCH激活BMSCs的成骨并抑制衰老通路
6、激活MCHR1可减轻小鼠骨骼衰老
为进一步探讨MCHR1信号在骨骼衰老中的作用及其治疗潜力,作者通过静脉注射MCHR1激动剂(MCH TFA)和拮抗剂(ALB-127158a)或生理盐水(对照组)处理诱导骨质疏松的老年小鼠模型。结果显示,与对照组相比,MCH激动剂处理的小鼠骨量显著增加,表现为BV/TV、Tb.N增加,Tb.Sp降低,而皮质骨厚度(Ct.Th)未见显著差异。相反,MCH拮抗剂处理的小鼠Tb.N和Ct.Th降低,Tb.Sp增大。这些结果表明,MCH激动剂显著减轻了骨质疏松症小鼠模型中的骨丢失。
为了确定MCH激动剂是否激活骨重建,作者评估了骨形成和骨吸收的标志。结果显示,MCH激动剂处理的小鼠破骨细胞活性降低(TRAP阳性细胞减少),成骨细胞活性增加[OCN(骨形成的标志物)阳性细胞增加],骨形成率提高[矿化沉积速率(MAR)增大]。而MCH拮抗剂处理的小鼠中,OCN水平降低,MAR减小,TRAP阳性细胞增加,表明与对照组相比,骨形成减少,骨吸收增加。进一步的β-gal染色结果显示,MCH激动剂处理的小鼠骨髓和骨小梁区域的β-gal阳性细胞显著减少,而MCH拮抗剂处理的小鼠则表现出β-gal阳性细胞增加。以上结果表明,MCH激动剂通过激活成骨作用和抑制破骨作用来减轻小鼠的骨骼衰老。
结论
该研究通过多维度的实验设计,揭示了LH中MCH神经元在骨代谢和衰老中的重要作用。作者提出了一个工作模型:LH中的MCH神经元作为骨内感受和骨量神经内分泌调节的中心,通过感觉神经跨突触接收来自骨的信号,以监测骨密度。同时,当受到感觉信号刺激时,LH中的MCH神经元会将MCH分泌到循环中,通过MCHR1/PKA信号通路,加速BMSCs的成骨分化。研究证实,LH中的中枢肽类激素MCH在功能上能够控制骨内感受,并在上行神经信号的作用下局部诱导成骨。这一发现不仅为理解骨骼代谢的神经内分泌调控机制提供了新的视角,还为开发基于MCH通路的骨骼疾病治疗策略奠定了基础。未来,若能在人类中验证这一机制,靶向LH中的MCH神经元则有望成为治疗骨质疏松等骨骼疾病的新途径。
中南大学湘雅医院郭斌为论文的第一作者,中南大学湘雅医院朱剑熹主治医师为论文的通讯作者。该工作获得国家自然科学基金项目、湖南省卫生健康委项目、中南大学创新驱动项目等项目的支持。
通讯作者介绍:
朱剑熹,现任职于中南大学湘雅医院骨科副研究员,主治医师。中国医师协会骨科医师分会会员,国际华人骨研学会会员,多种国际研究杂志审稿人。主持国家自然科学基金2项,国家重点研发计划项目骨干,主持湖南省自然科学基金项目1项,参与国家.级项目5项,美国NIH课题2项,参编专著3本。发表学术SCI论文20余篇,其中包括J Clin Invest(第一作者,影响因子14.383),eLife(第一作者,影响因子8.18)等。主攻股骨头坏死与关节退行性疾病的发病机制和预防。擅长人工关节置换术和截骨矫形术。
本文使用的病毒产品均来自枢密科技,列表如下:


了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK