2025-04-07 阅读量:1159
撰文|余雨媚
审阅|曹君利
随着现代医学的飞速发展,手术治疗已成为众多疾病的重要干预手段。然而,部分手术导致的组织和神经损伤引起的持续痛觉输入会使中枢神经系统神经元或神经环路发生异常适应性改变,从而使急性损伤向慢性疼痛过渡,这种改变又被称为急性疼痛慢性化。然而,参与这一转变的关键脑区及其神经机制尚未阐明。
2025年3月19日,徐州医科大学麻醉学重点实验室的丁海雷教授、曹君利教授和安述明教授研究团队在《Cell》子刊《Current Biology》上发表了一篇题为“An accumbal microcircuit for the transition from acute to chronic pain”的研究论文。该研究从伏隔核(nucleus accumbens, NAc)的亚区特异性微环路和分子水平揭示了急性疼痛慢性化的调控机制,并指出对这一微环路的早期干预可能为急性疼痛慢性化提供一种新的治疗策略。
1、神经损伤会导致NAcS和NAcC神经元兴奋性呈时相依赖性改变
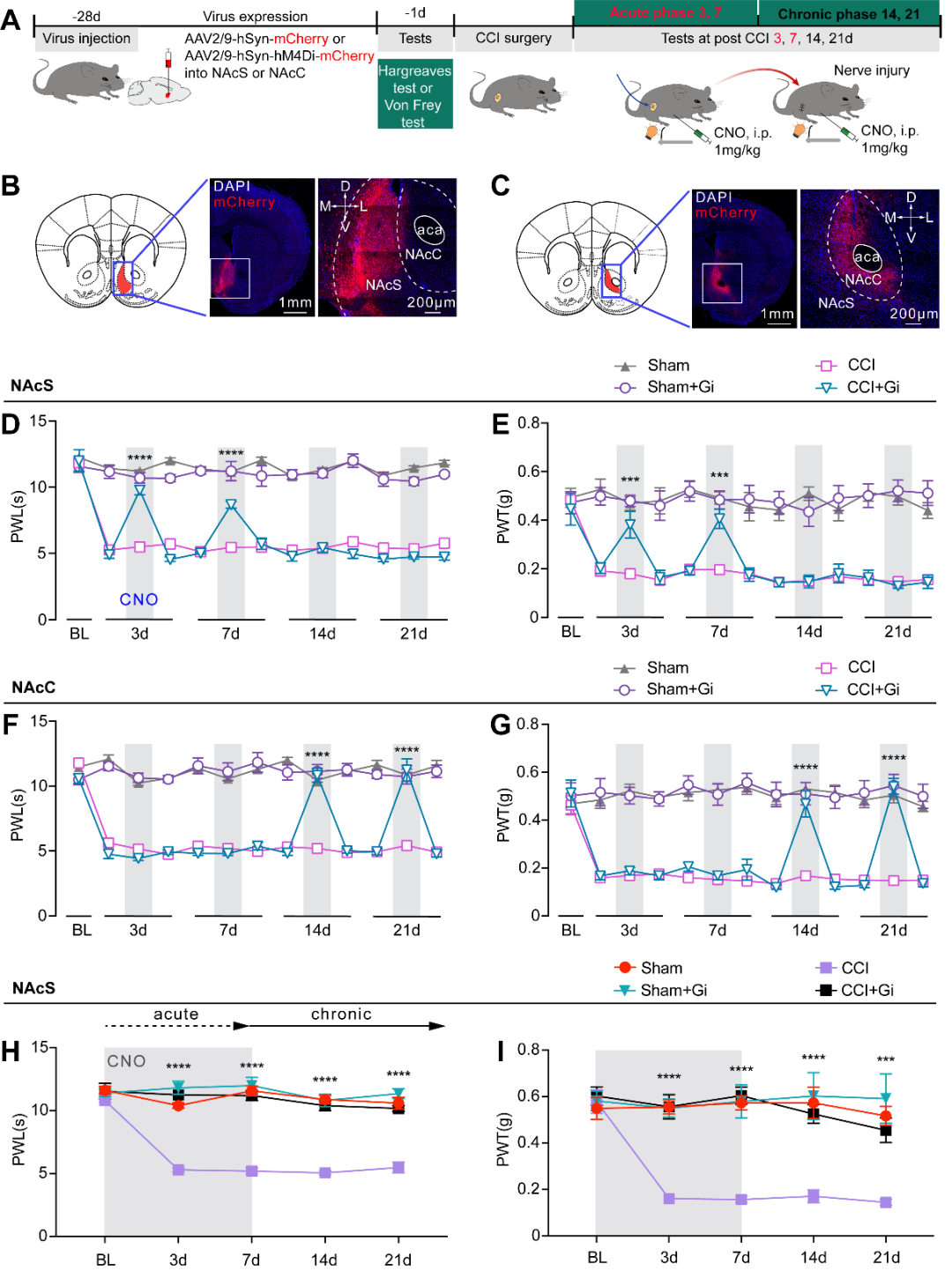
2、在疼痛急性期持续抑制NAcS神经元可阻止急性疼痛慢性化
图2. 在CCI模型急性期持续抑制NAcS神经元可以阻止疼痛慢性化(图源:Yu YM, et al., Curr Biol, 2025)
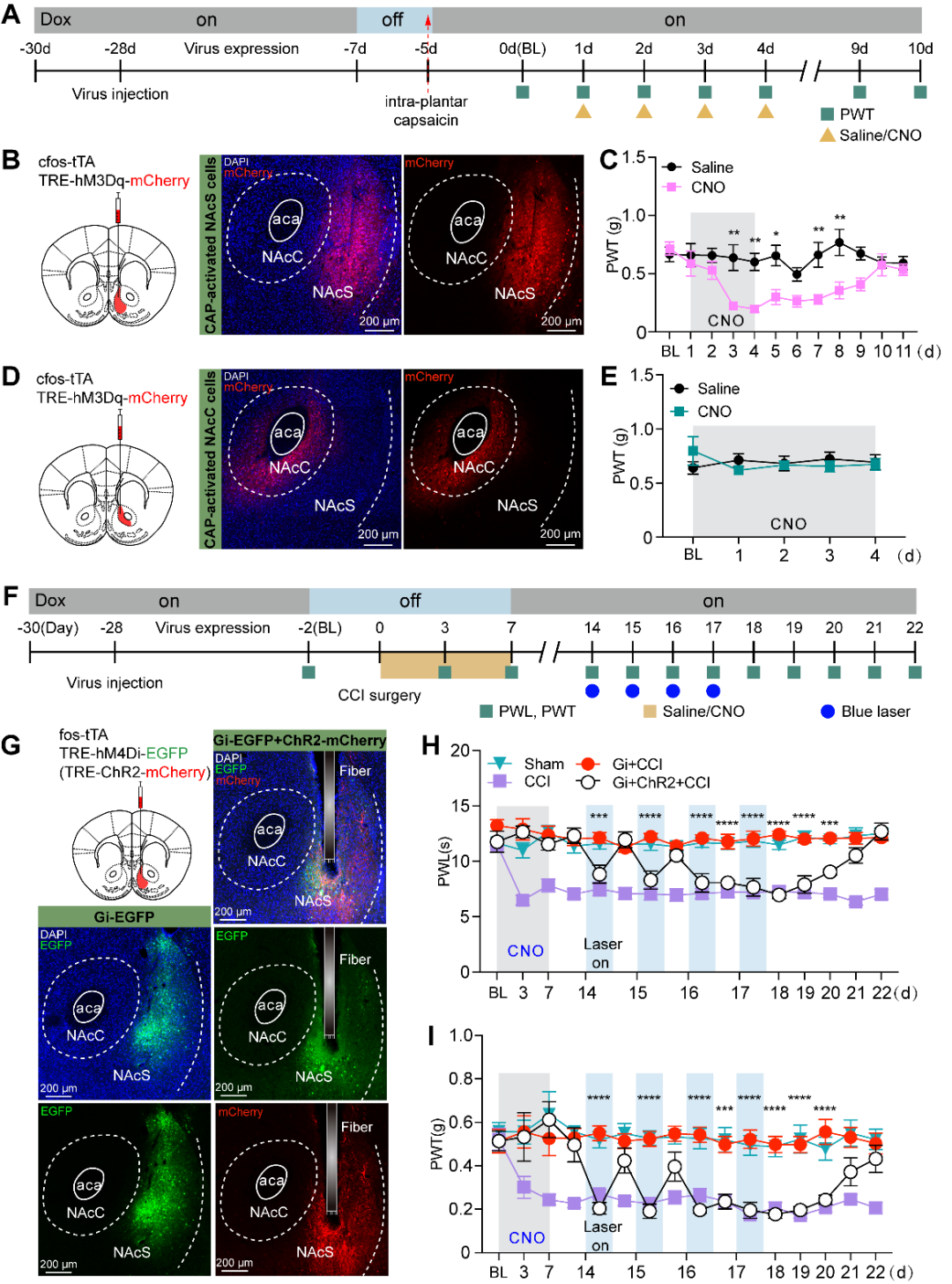
3、损伤早期激活的NAcS神经元在急性疼痛慢性化过程中发挥关键作用
图3. 激活急性疼痛标记的NAcS神经元可再次诱发疼痛(图源:Yu YM, et al., Curr Biol, 2025)
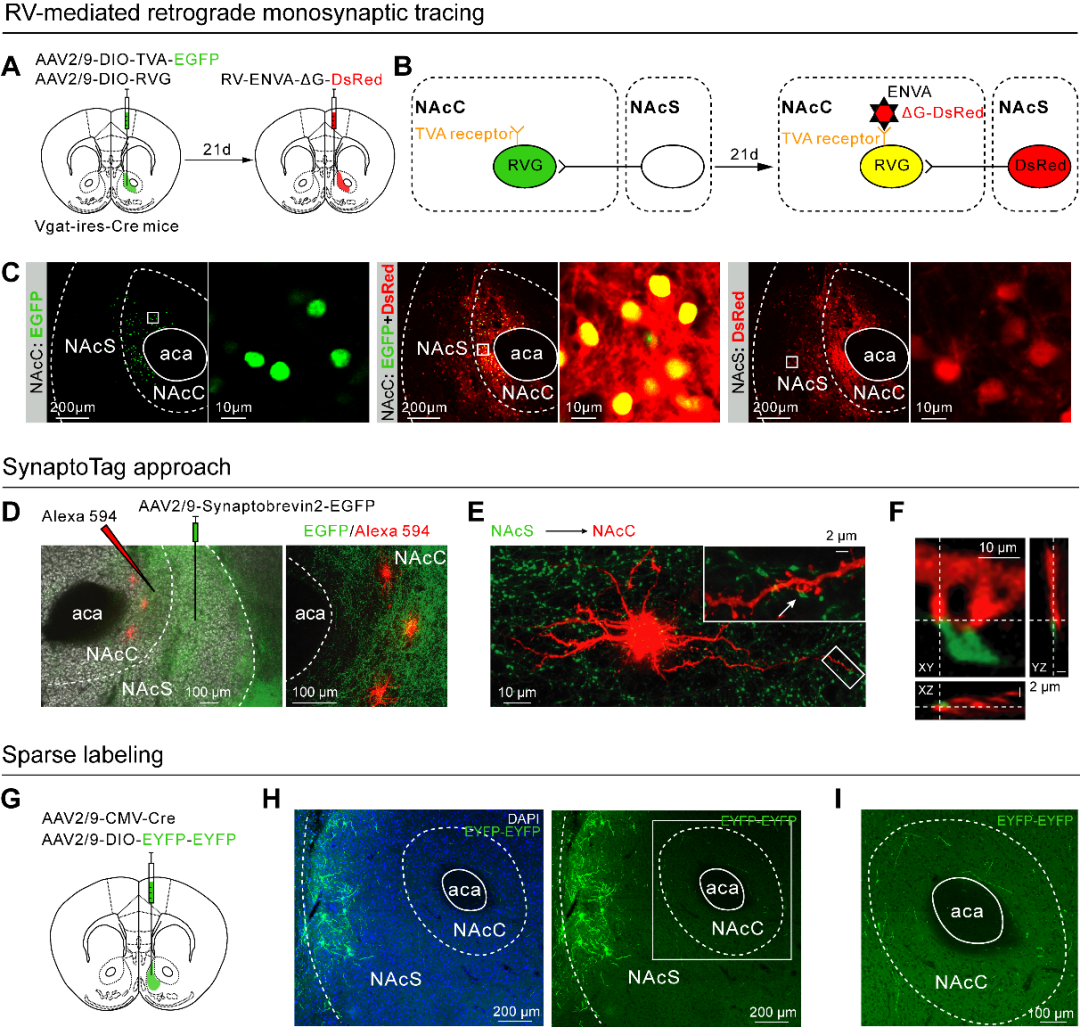
4、NAcS-NAcC微环路调控急性疼痛慢性化
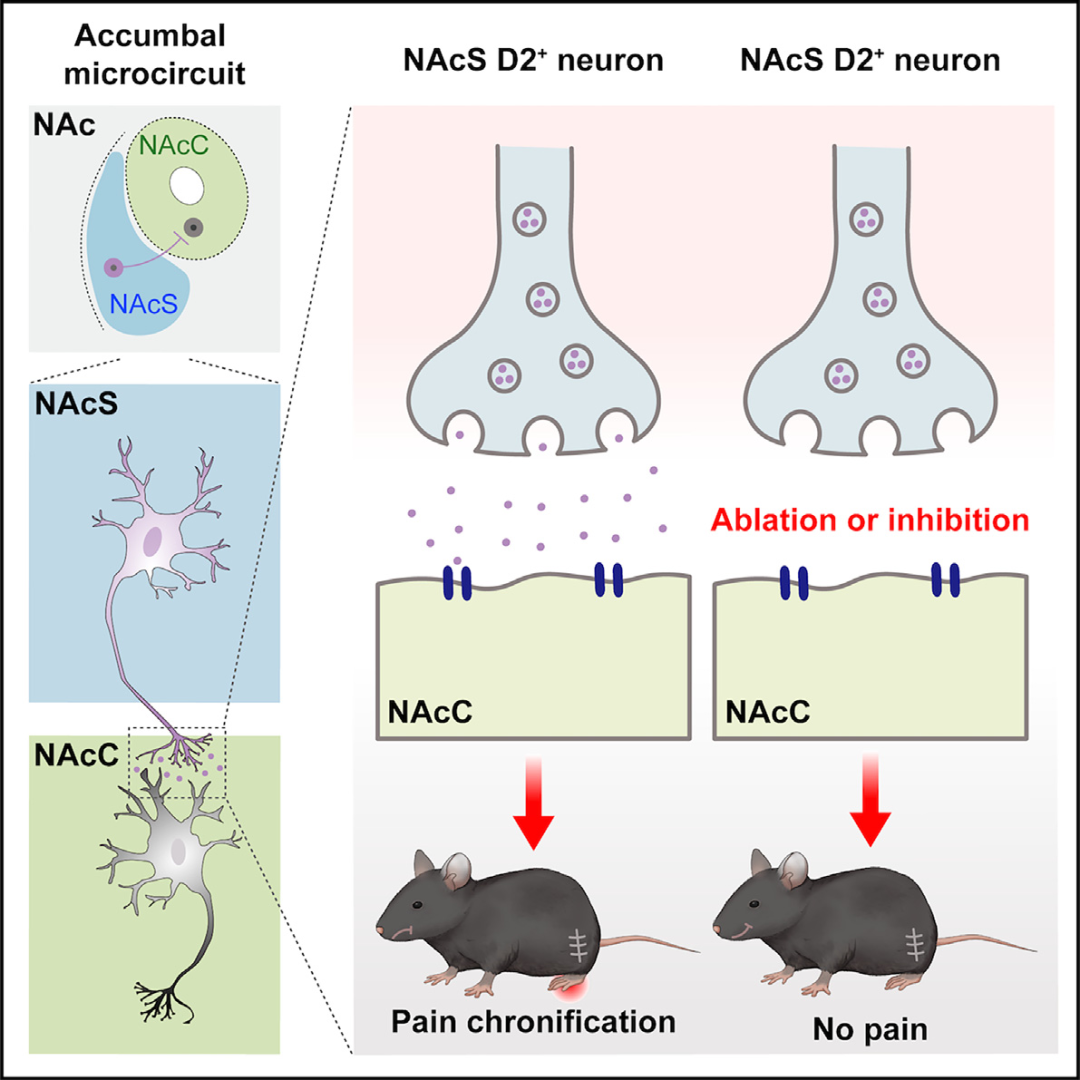
本研究发现NAcS中投射至和非投射至NAcC的神经元均可以参与神经病理性疼痛急性期的痛觉调控,但是只有投射至NAcC的神经元参与急性疼痛慢性化的调控。当机体出现急性损伤时,NAcS首先被急性疼痛激活,当疼痛信号从NAcS过渡到NAcC时,疼痛慢性化就发生了。作者用化学遗传学的方法在CCI急性期持续抑制NAcS投射至NAcC的神经元时,发现疼痛可以被终止在急性期,疼痛慢性化的进程被阻断。这一结果说明疼痛信号从NAcS到NAcC的过渡是疼痛慢性化发展的必要条件,也进一步提示疼痛慢性化过程是一个复杂的病理过程,涉及多个脑区或同一脑区的多个亚区。
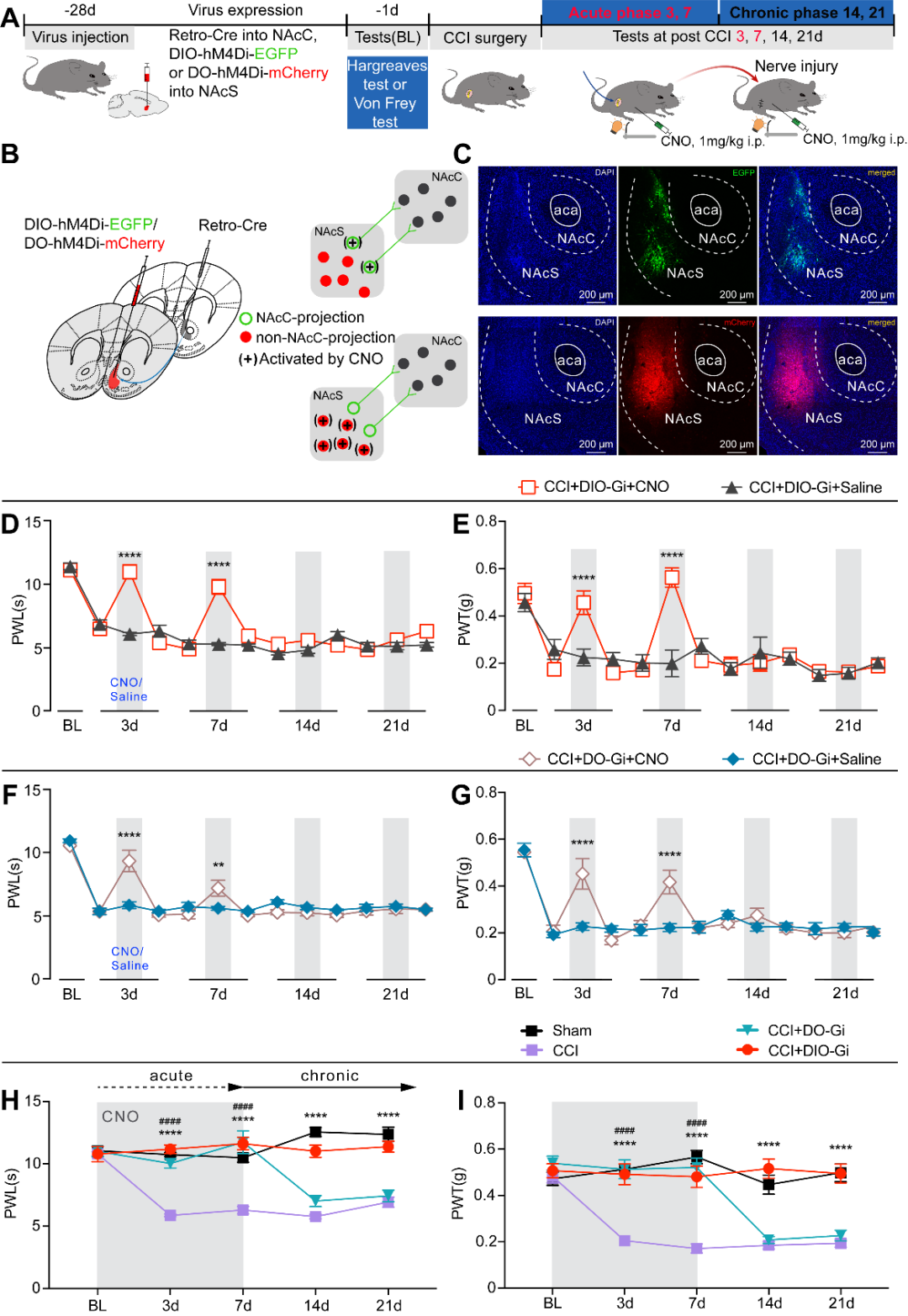
图5. NAcS中投射和非投射至NAcC的神经元在疼痛处理中的作用不同(图源:Yu YM, et al., Curr Biol, 2025)
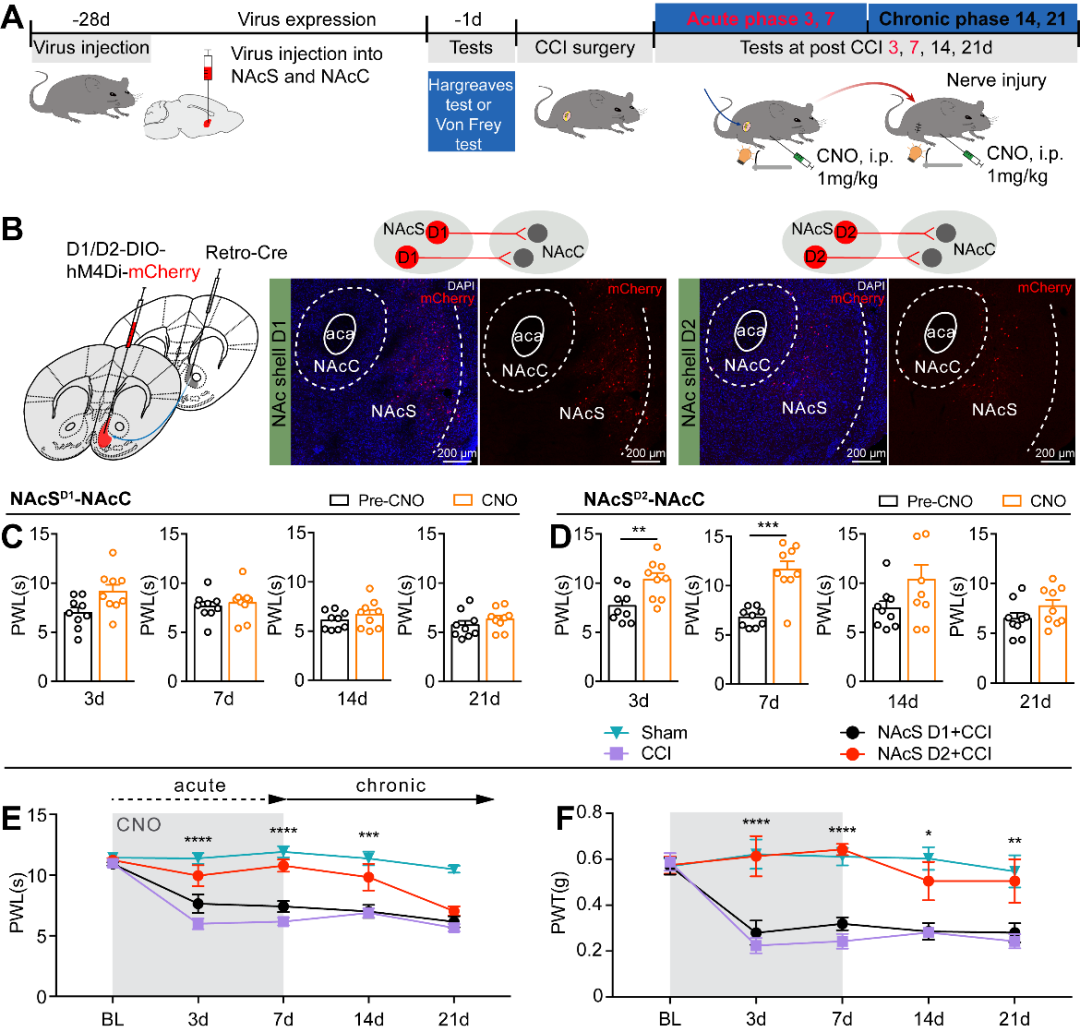
图6. 抑制NAcSD2-NAcC微环路可以阻止急性疼痛慢性化(图源:Yu YM, et al., Curr Biol, 2025)
结论
徐州医科大学麻醉学院余雨媚博士、夏荪晖博士和许政博士为论文第一作者,徐州医科大学麻醉学院丁海雷教授、曹君利教授和安述明教授为论文共同通讯作者。该工作获得国家科技创新2030-重大项目、国家自然科学基金、国家重点研发计划项目、江苏省双创团队领军人才项目等基金支持。
通讯作者介绍:
丁海雷,教授,博士生导师。现任徐州医科大学麻醉学院教授,主要从事疼痛的神经生物学机制与麻醉药物的神经毒性机制等方面的基础和临床研究。主持国家自然科学基金2项、江苏省高校自然科学基金2项、江苏省科技厅面上项目1项,已发表近40篇SCI论文,其中以通讯作者发表SCI论文12篇,论文发表在Curr Biol、Mol Psychiatry、Biological Psychiatry、Br J Anaesth、Neuropsychopharmacology等期刊杂志,其中中科院一区杂志8篇;已授权专利1项;作为参与人获得江苏省科技进步二等奖3项(排名第四、六),江苏省医学科技奖二等奖1项(排名第六)。
曹君利,博士、二级教授、博士生导师,现任徐州医科大学副校长、麻醉学院院长、江苏省麻醉学重点实验室主任、江苏省麻醉临床医学中心主任、江苏省“科教兴卫”工程麻醉学重点学科带头人;入选教育部“长江/学者”特聘教授、国家百千万人才工程人才和国家有突出贡献中青年专家、国务院特殊津贴专家、江苏省“333工程”第一层次培养对象、省双创人才和双创团队带头人;获得省“科教兴卫”杰出人才、省有突出贡献中青年专家、省侨界杰出人物、省优秀留学回国人员、中华医学会麻醉学杰出研究奖等荣誉称号。个人先后获得国家自然科学基金多项,其中重点项目和国际合作重点项目各1项,省部级科研课题多项,获得江苏省科技进步一等奖、江苏省科技进步二等奖、教育部高等学校科学研究优秀成果奖(自然科学)二等奖、江苏省医学科技奖二等奖、江苏省科技进步一、二等奖、教育部高等学校科学研究优秀成果奖(自然科学)二等奖、江苏省医学科技奖二等奖,入选首届中国百篇最具影响的优秀国际学术论文和2017、2019年两次入选中华医学百篇优秀论文。
安述明,博士,教授,博士生导师,江苏省特聘教授。华东师范大学硕士,2013年在德国美因茨大学取得博士学位。2014-2018年先后在瑞典于默奥大学、美国加州大学伯克利分校进行博士后研究。2019加入徐州医科大学麻醉学重点实验室,目前主要从事睡眠与精神疾病之间关系的神经机制研究。主持国家和江苏省自然科学基金面上项目,江苏省高等学校基础科学研究项目。以第一作者或通讯作者(含共同)在Journal of Clinical Investigation,Nature communications,Current Biology,Journal of Neuroscience,Neurobiology of Stress和Cerebral Cortex等期刊杂志发表论文。
通讯作者:丁海雷教授(左),曹君利教授(中),安述明教授(右)(图片提供自:丁海雷教授/曹君利教授/安述明教授团队)
第一作者:
内容来自徐州医科大学麻醉学院公众号
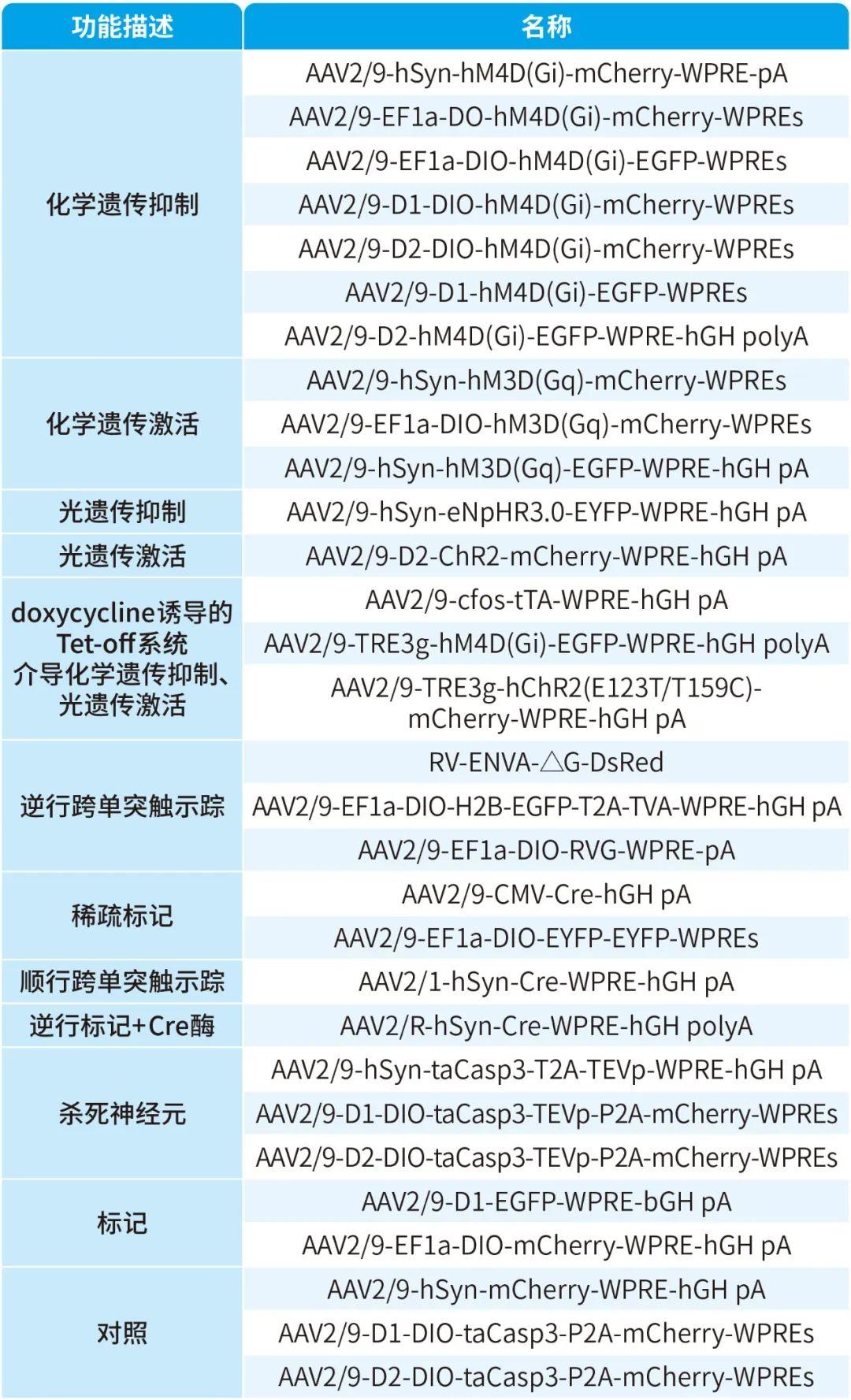
本文使用的来自枢密科技的病毒产品,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK