2025-04-21 阅读量:1086
糖尿病(Diabetes mellitus,DM)正因多种伴随并发症(包括糖尿病肾病、心肌病、神经病变和视网膜病变)而成为全球主要的死亡原因。糖尿病心肌病(Diabetic Cardiomyopathy,DCM)以心室重构和间质纤维化为特征,并最终导致心力衰竭。其发病率高,但发病机制尚未完全阐明,治疗手段也有限。近期研究发现DCM中的心肌损伤与心肌纤维化相关,这种不可逆的病理改变会破坏正常组织结构,使心功能从代偿期转为失代偿期。DM患者心脏磁共振成像显示对比增强T1时间缩短,且右心室活检标本中间质纤维化程度与射血分数呈负相关。尽管具有重要临床意义,DM相关心肌纤维化的病理机制仍不明确。
心肌成纤维细胞(Cardiac Fibroblasts,CFs)的异常增殖和分化被认为是DM心肌纤维化的关键因素。DM心脏中过量的细胞因子(尤其是转化生长因子β(TGF-β))可通过诱导成纤维细胞向肌成纤维细胞分化而激活其功能,表现为收缩蛋白(如α-平滑肌肌动蛋白(α-SMA))和细胞外基质(ECM)相关蛋白表达增加。此外,研究表明高糖(HG)可诱导I型和II型TGF-β受体(激活素受体样激酶ALK5和ALK1)的激活和内吞,从而增强下游R-SMADs信号传导。然而,关于HG如何具体促进TGF-β信号传导及后续成纤维细胞激活的机制仍需深入研究。
CD147(Cluster of Differentiation 147,分化簇147)是免疫球蛋白超家族成员,这种跨膜糖蛋白在多种癌症中表达上调。高度糖基化的CD147能有效刺激基质金属蛋白酶生成,促进肿瘤生长、侵袭和转移,已成为多种癌症的潜在治疗靶点。研究显示,CD147在心肌梗死、炎症性心肌病和扩张型心肌病患者左心室(LV)中表达上调。研究表明CD147可能参与肝脏和肾脏等器官的肌成纤维细胞分化和纤维化进程,但其在DCM病理性纤维化中的作用及机制仍待阐明。
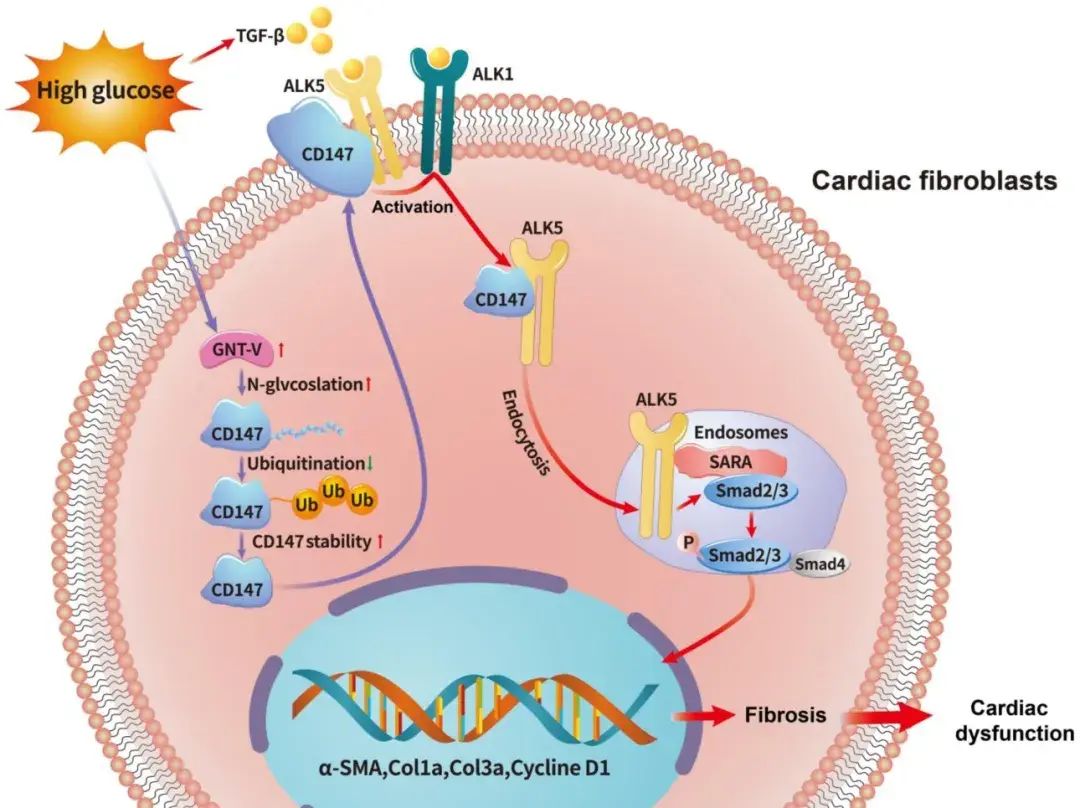
近期,空军军医大学唐都医院心血管内科李妍主任医师/胡健强副主任医师团队在《International Journal of Biological Sciences》期刊发表了题为“N-glycosylation-mediated CD147 accumulation induces cardiac fibrosis in the diabetic heart through ALK5 activation”的研究论文。该研究发现:DM小鼠心肌组织和DM患者右心房样本中CD147显著上调,并伴随心脏重构和心功能损伤;AAV9介导的心脏特异性CD147沉默减轻DM小鼠心肌纤维化并改善心功能。体外实验进一步显示CD147敲低显著抑制HG诱导CFs的活化和增殖。机制上,CD147直接结合I型TGF-β受体(ALK5),促进ALK5激活和内吞,从而诱导SMAD2/3磷酸化和核转位。此外,HG微环境通过增强GNT-V介导的N-糖基化,抑制泛素-蛋白酶体途径介导的CD147降解。值得注意的是,心脏特异性CD147过表达可在正常小鼠中模拟DM诱导的心肌纤维化及相关心功能障碍。综上,本研究揭示N-糖基化介导的CD147蓄积诱导CFs持续活化,为DCM相关心肌纤维化提供了新的治疗靶点。
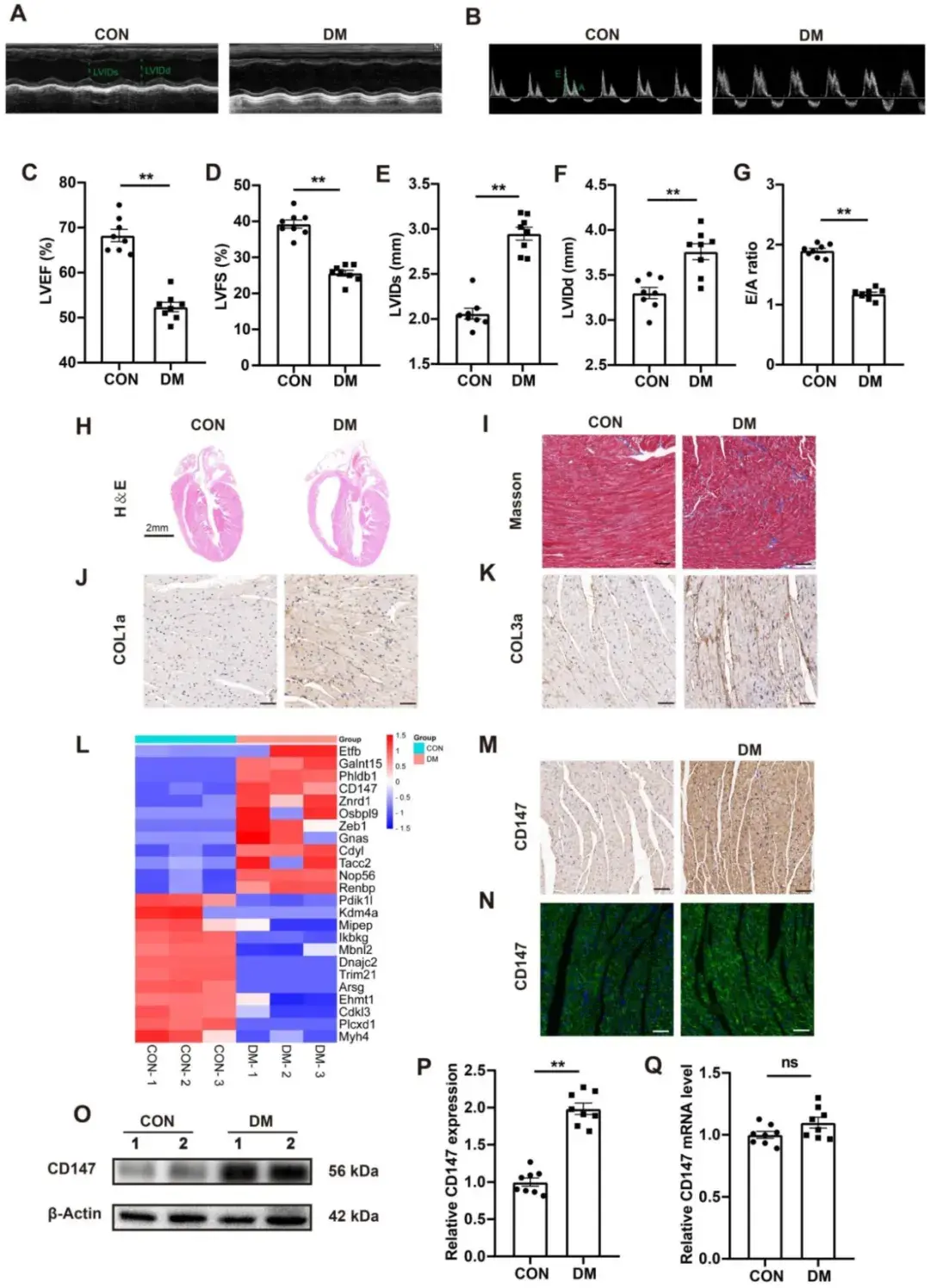
1、STZ诱导DM小鼠心脏表现出过度的胶原沉积和CD147表达上调
与对照组小鼠相比,STZ诱导的DM小鼠(连续5天腹腔注射0.1 g/kg体重链脲佐菌素,随机血糖>16.6 mmol/L的小鼠被视为DM模型成功建立)在注射STZ 3个月后血糖水平显著升高,而体重和葡萄糖耐量显著下降。超声心动图显示,STZ注射小鼠心功能明显受损,表现为左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)降低,左心室收缩末期内径(LVIDs)和左心室舒张末期内径(LVIDd)增大。此外,多普勒超声心动图二尖瓣血流模式分析显示DM小鼠存在舒张功能障碍,E/A比值(二尖瓣血流频谱)较对照组降低。心肌纤维化是DCM的主要病理特征。HE和Masson三色染色分析显示,与对照组相比,DM小鼠心肌间质纤维化范围更广、心腔更大。免疫组化染色和Western blotting进一步证实DM小鼠心肌组织中胶原蛋白(I型胶原COL1a和III型胶原COL3a)沉积显著增加。定量蛋白组学分析显示,DM小鼠心脏中跨膜糖蛋白CD147表达上调。免疫组化和免疫荧光(IF)染色结果验证了这一发现。Western blotting也显示DM小鼠心肌组织及HG刺激的原代CFs中CD147蛋白表达升高。但实时荧光定量PCR显示,无论在组织或细胞水平,CD147的mRNA表达量均无显著差异。
图1. STZ诱导的DM小鼠心脏表现出过度的胶原沉积和CD147表达上调
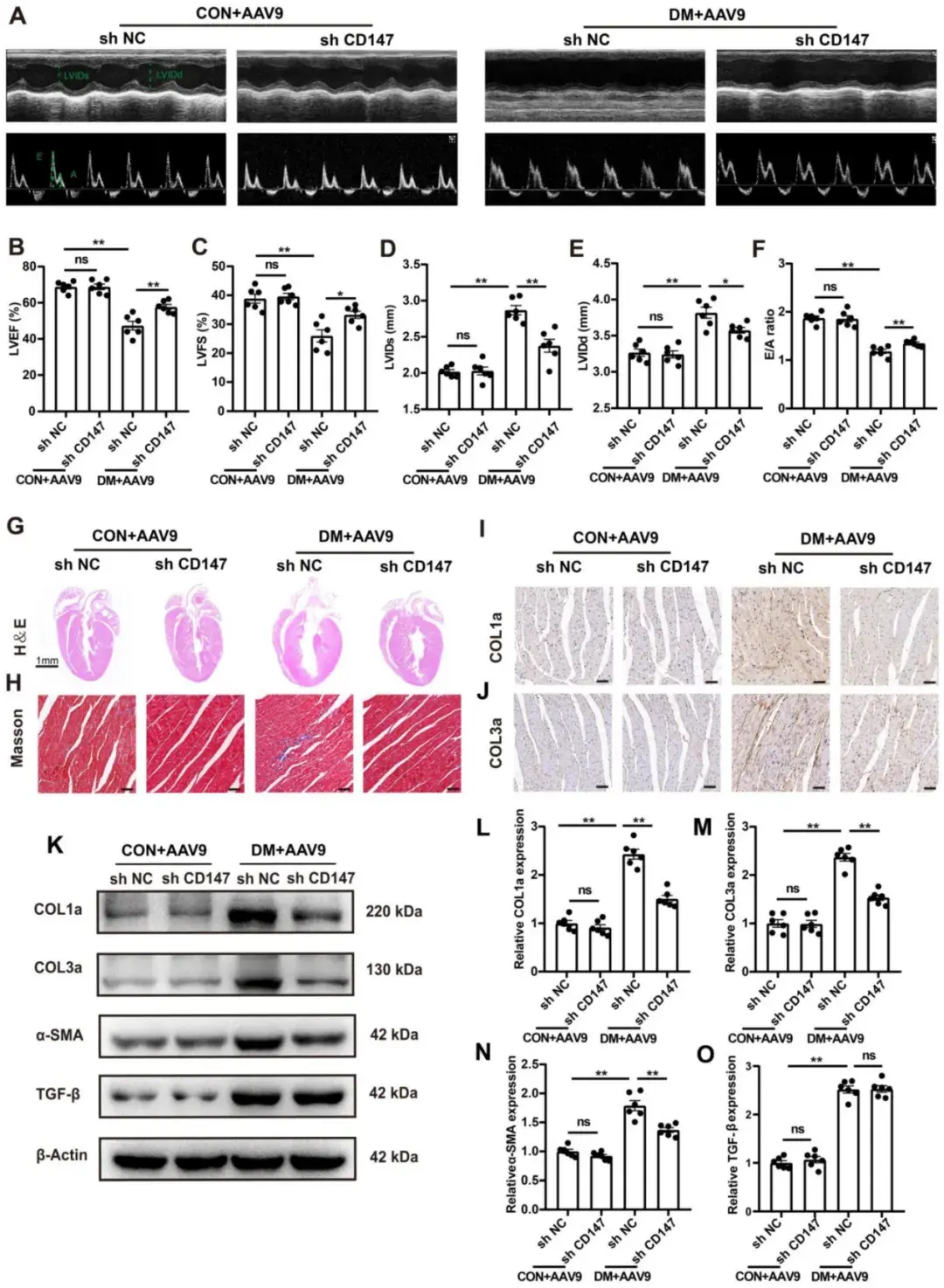
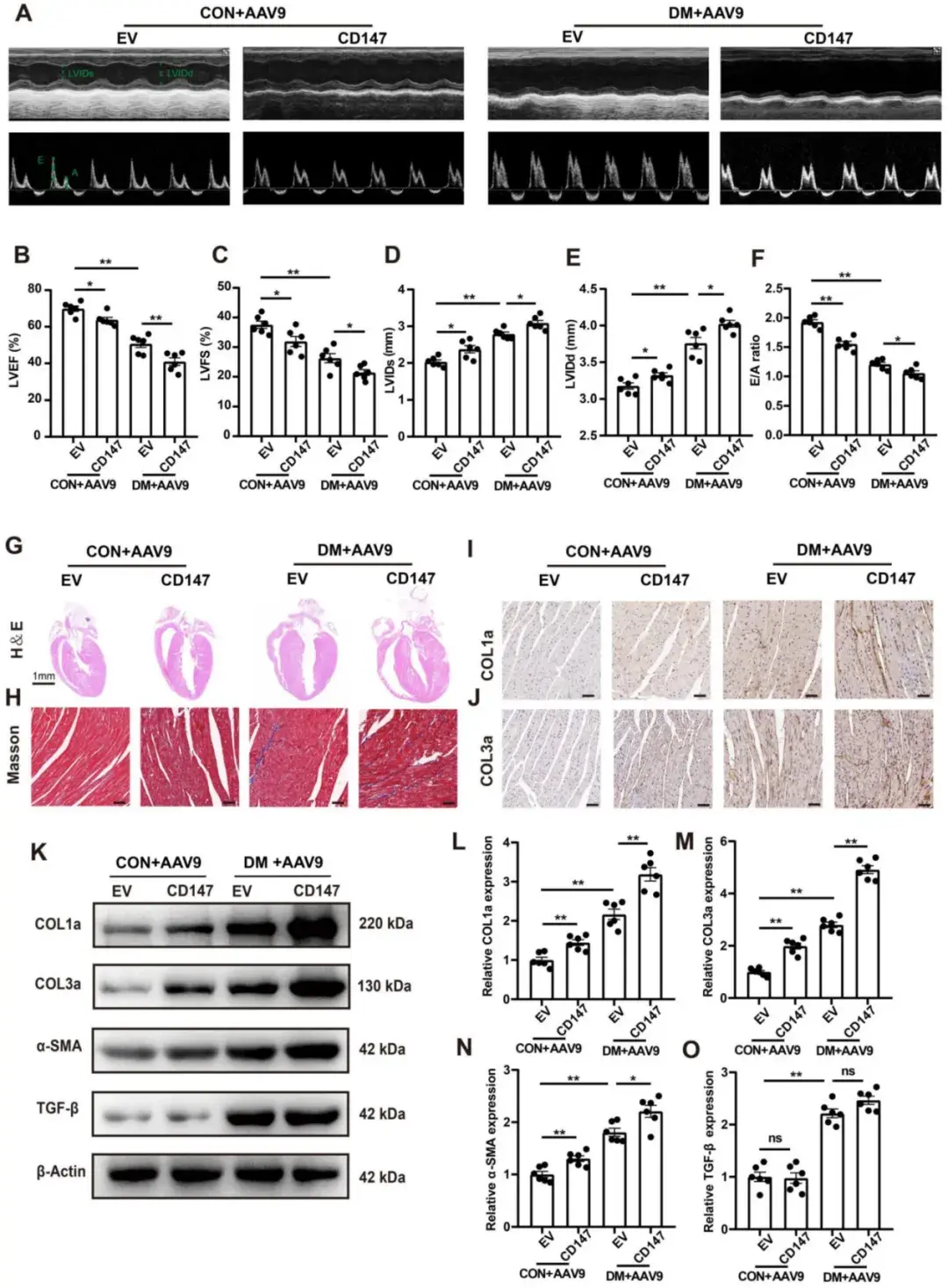
2、沉默CD147减轻DM小鼠心脏的功能障碍和纤维化
通过应用AAV9-shCD147进行CD147功能缺失实验,作者探究了CD147是否在DM中调控心功能。研究者将8周龄野生型(WT)小鼠与DM小鼠分别随机分为两组,14周龄时一组注射AAV9-shCD147,另一组注射AAV9-shNC,于注射后2、4、6 w利用Western blotting检测CD147蛋白水平,结果显示,病毒在注射后2 w开始显现效果,注射后4 w时达到峰值效应并持续至注射后6 w。免疫组化结果也表明,AAV9-shCD147在注射后6 w显著抑制CD147表达,证实病毒注射成功且具有高效抑制效果。对照和模型小鼠中,AAV9-shCD147对血糖及体重均未产生显著影响。然而,超声心动图显示:当心肌组织中CD147表达下调时,DM小鼠的心功能显著改善且心脏不良重塑得到缓解,具体表现为E/A比值、LVEF和LVFS升高,LVIDs和LVIDd缩小。此外,HE和Masson三色染色显示:DM小鼠中与shNC组相比,shCD147组的心肌纤维化区域减少且心腔缩小,凸显了靶向抑制CD147在DM中的抗纤维化作用。免疫组化染色、蛋白质印迹和实时定量PCR分析也表明,DM小鼠CD147敲低后心肌组织中COL1a和COL3a的沉积减少,纤维化标志物(包括COL1a、COL3a和α-SMA)的表达降低。然而,注射AAV9-shCD147的DM小鼠中,纤维化核心调控因子TGF-β的蛋白和mRNA水平未发生显著变化,表明CD147敲低不影响TGF-β的表达。对照小鼠心脏中敲低CD147对心功能和纤维化无显著影响。
3、CD147参与HG诱导CFs活化
成纤维细胞是心肌纤维化的主要效应细胞,既往研究证实HG可促进成纤维细胞的活化与增殖。通过体外高糖(33 mM)刺激模拟DM状态,研究人员发现HG显著上调CFs中COL1a、COL3a、TGF-β及α-SMA的表达水平,并显著促进CFs增殖。为进一步探究CD147是否介导HG诱导的成纤维细胞活化与增殖,研究者采用腺病毒介导的shRNA(Ad-shCD147)敲低CFs中CD147表达。IF与蛋白质印迹结果显示,CD147下调显著抑制了HG诱导的COL1a、COL3a、TGF-β及α-SMA表达上调。此外,CD147 shRNA明显逆转了HG对CFs增殖的促进作用。然而,流式细胞术与蛋白质印迹分析表明,CD147敲低并未影响HG组与对照组(5 mM)CFs的凋亡水平及cleaved-caspase-9(caspase-9通过裂解激活,形成cleaved-caspase-9,从而启动细胞凋亡的级联反应)表达量。
4、CD147激活HG诱导CFs中TGF-β下游信号通路
研究表明TGF-β是一种“关键”细胞因子/生长因子,在损伤或病变组织中通过经典SMAD信号通路激活成纤维细胞并促进ECM生成。为探究CD147调控HG诱导CFs活化与增殖的分子机制,研究者在HG诱导CFs中利用腺病毒敲降CD147(Ad-shCD147)。IF与蛋白质印迹分析显示,HG处理激活了TGF-β/SMAD信号通路。与HG+Ad-shNC组相比,敲低CD147显著抑制TGF-β下游SMAD2/3的核转位,并降低p-SMAD2和p-SMAD3蛋白水平。Cyclin D1作为p-SMAD2/3的靶蛋白,通过调控细胞周期促进细胞增殖;相较于HG+Ad-shNC组,HG+Ad-shCD147组Cyclin D1的表达水平也显著降低。然而,CD147的下调未能逆转HG刺激后TGF-β及其受体ALK5(TGFβ-RI)和ALK1(TGFβ-RII)的表达升高。这些结果表明,CD147通过调控TGF-β信号通路的活化发挥作用,而非通过影响TGF-β及其受体的表达实现。
5、CD147通过促进ALK5活化与内吞作用调节HG诱导的SMAD2/3磷酸化及核转位
为探究CD147调控TGF-β信号通路活化的机制,研究者在分离的原代CFs中进行免疫共沉淀(Co-IP)实验,并通过液相色谱-串联质谱(LC-MS/MS)分析,进而发现CD147能与分子量为55 kDa的TGF-β I型受体(ALK5)相互作用,于是选择该靶点进行深入研究。通过后续系列实验作者验证了HG诱导CFs中CD147与ALK5的相互作用:IF分析显示CD147与ALK5在CFs中显著共定位;Co-IP实验证实CD147抗体可下拉ALK5蛋白,反之亦然。研究显示ALK1首先与TGF-β结合,随后招募并磷酸化ALK5的激酶结构域,进而磷酸化SMAD蛋白。研究人员通过Co-IP分析进一步发现CD147敲低减弱了ALK1与ALK5、磷酸化ALK5的相互作用。磷酸化的ALK5会脱离细胞膜并内化至早期内吞体(即“内吞作用”),这一过程对SMAD2/3的磷酸化至关重要。IF分析进一步证实HG促进了ALK5内吞至细胞内区室,而CD147敲低阻断了此现象。位于早期内吞体的“受体激活的SMAD锚定蛋白(SARA)”是ALK5介导SMAD2/3磷酸化的必要条件,同时可作为早期内吞体标志物。研究者分析了ALK5与SARA的空间定位及CD147敲低对其共定位的影响。结果显示,HG增加了ALK5与SARA的共定位(表现为更多黄色阳性点),而CD147敲低显著降低ALK5-SARA共定位。综上所述,这些结果表明CD147可能作为支架蛋白促进ALK5的活化与内吞,从而最终激活TGF-β下游信号通路。
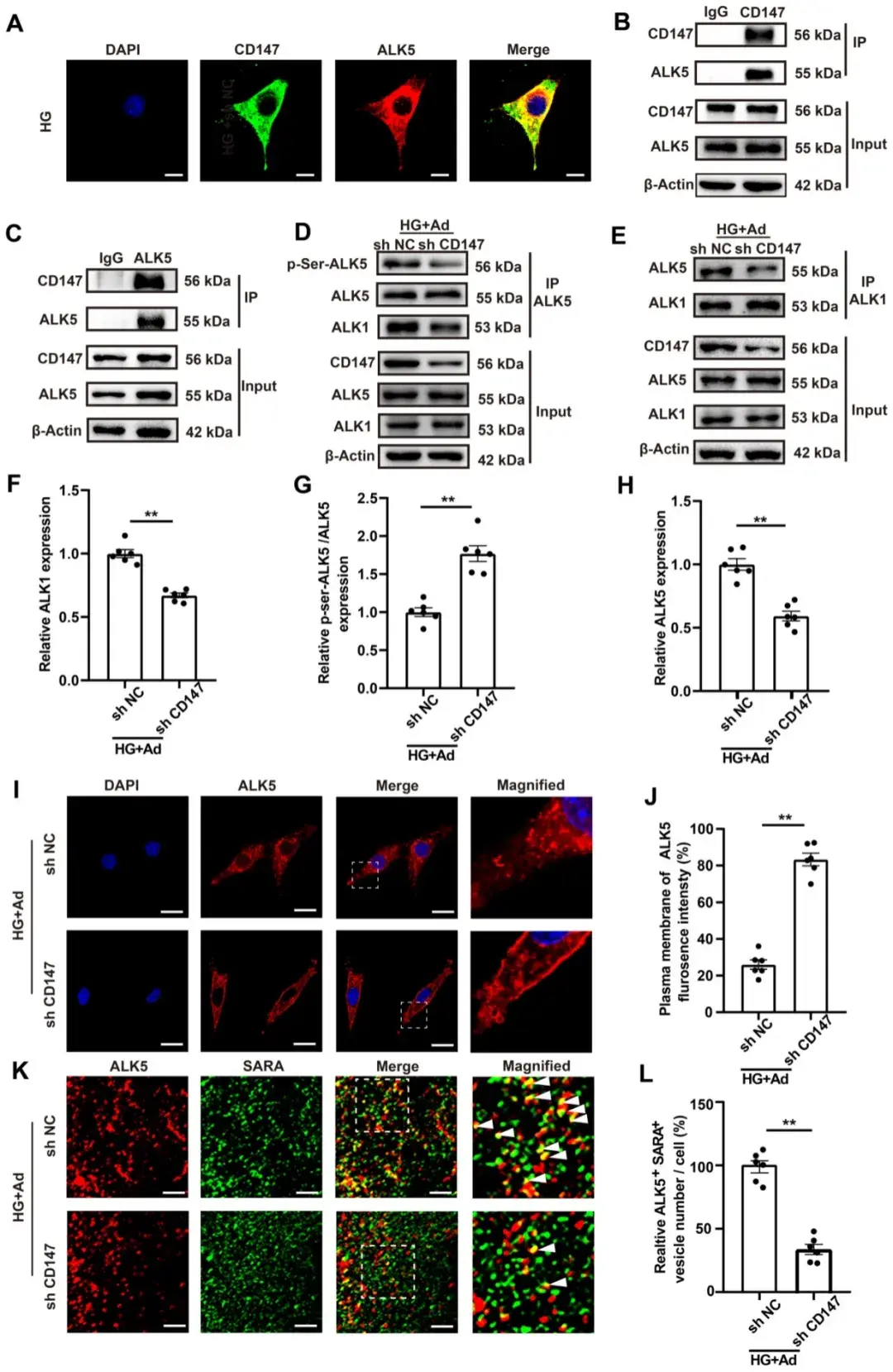
图3. CD147促进ALK5活化和内吞,从而调节HG诱导的SMAD2/3磷酸化和核转位
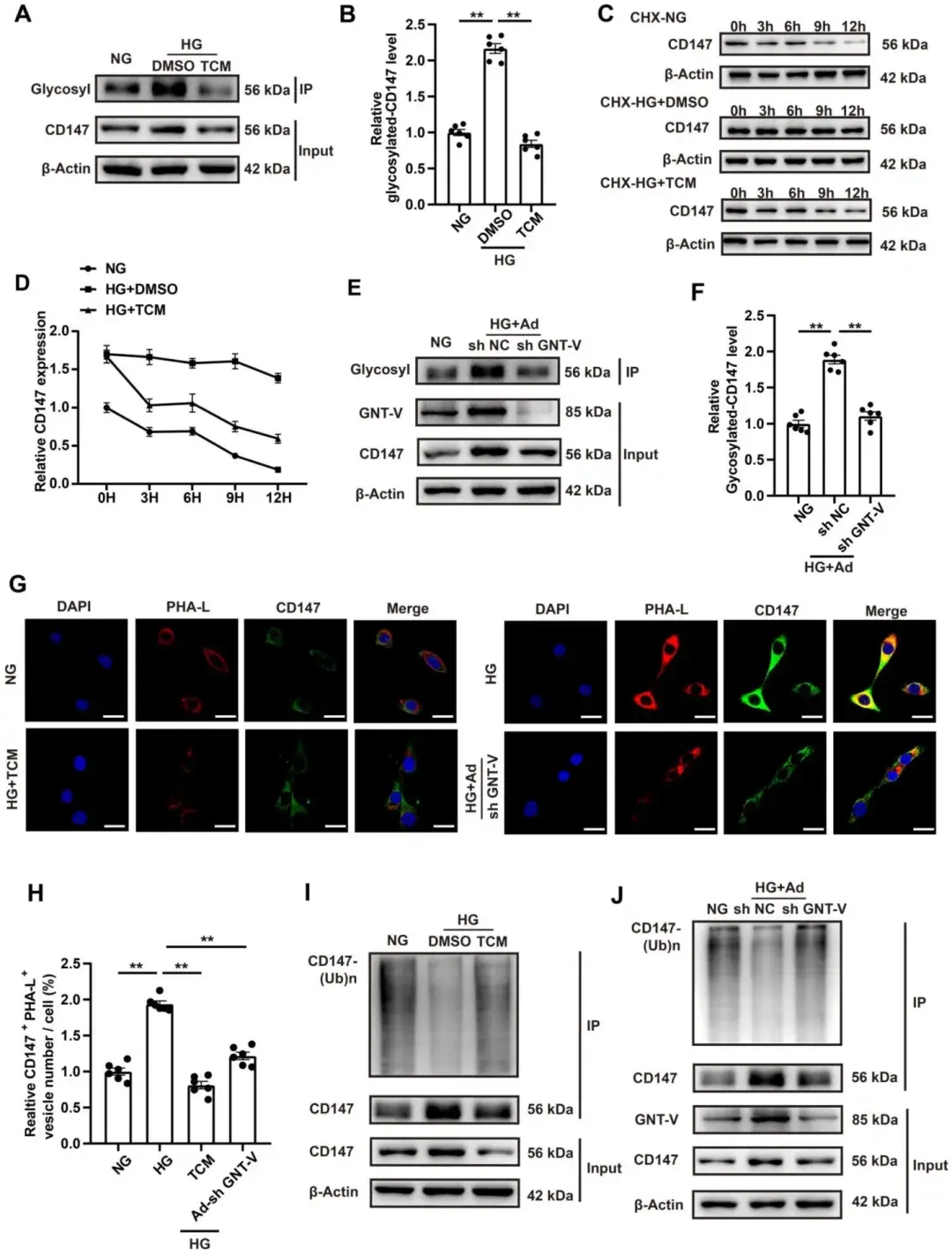
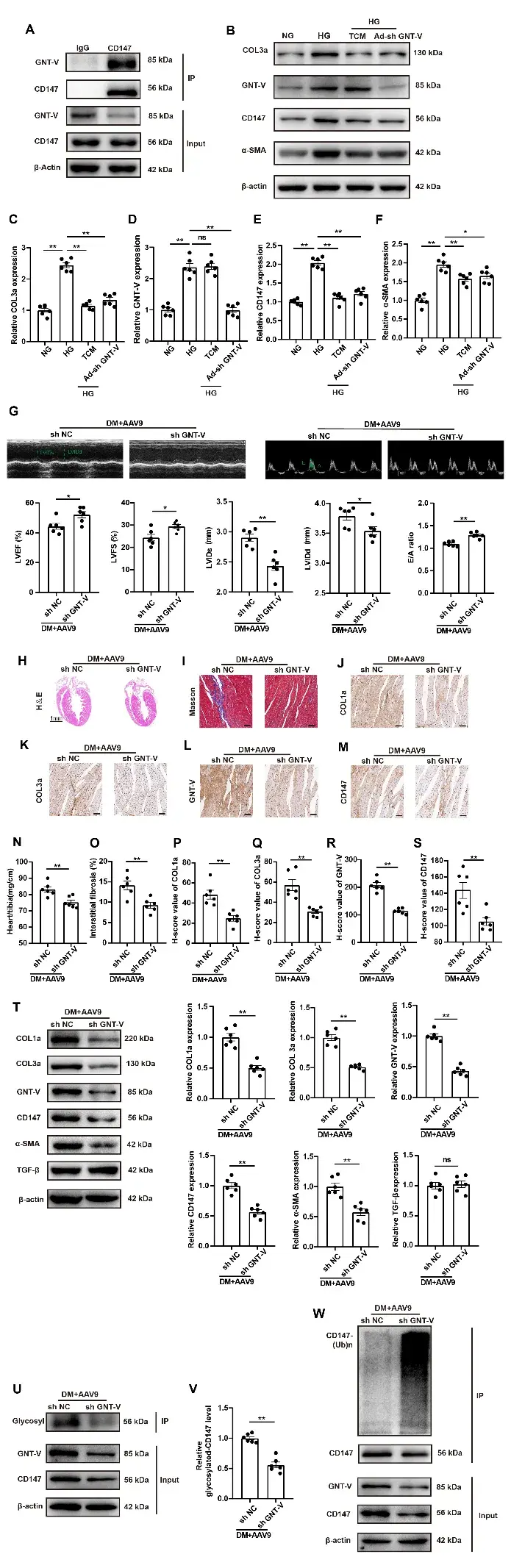
6、HG促进CD147糖基化并抑制其泛素-蛋白酶体降解
为探究HG调控CD147表达的机制,研究人员检测了CD147的转录水平及降解过程:Western blotting与实时荧光定量PCR结果显示,HG处理显著增加了CD147的蛋白表达水平,但未改变其mRNA水平,提示CD147受非转录水平调控。由于CD147是一种可发生翻译后修饰(如糖基化)的跨膜糖蛋白,作者进一步分析了其糖基化程度。结果显示,HG显著增强CD147糖基化,而糖基化抑制剂衣霉素(TCM)逆转了此效应。随后研究人员利用蛋白合成阻断剂环己酰亚胺(CHX)探究糖基化与蛋白稳定性的关系发现:HG处理延缓了CHX干预下CD147蛋白水平的降解,而TCM消除了此稳定作用。N-乙酰葡萄糖胺转移酶V(GNT-V)是肿瘤转移中CD147糖基化的关键酶,作者验证了其在CD147糖基化中的作用:Co-IP实验证实CFs中CD147与GNT-V存在相互作用,且HG处理进一步上调GNT-V表达;敲低GNT-V显著降低HG处理的CFs中CD147蛋白及糖基化水平。研究者进一步通过Co-IP分析发现,高效可逆的蛋白酶体抑制剂MG-132显著减少了HG诱导CFs中CD147的泛素化。而TCM与敲低GNT-V均可逆转此效应,并显著降低HG处理的CFs中CD147、COL3a及α-SMA的表达水平。此外,研究人员证实DM小鼠模型中,干扰GNT-V表达降低了CD147糖基化水平、增加其泛素化,从而减少胶原沉积并改善DM状态下的心功能异常。综上,HG通过上调GNT-V表达促进CD147糖基化,进而抑制其泛素-蛋白酶体降解途径,最终维持CD147蛋白稳定性。
图4. HG促进CD147糖基化并抑制其泛素-蛋白酶体降解
7、对照小鼠中过表达CD147模拟了DM诱导的心肌纤维化
为评估CD147过表达是否加剧正常小鼠心功能障碍和纤维化,研究人员通过心内注射AAV9-CD147来提高心肌组织CD147表达。研究者将8周龄野生型(WT)小鼠与DM小鼠分别随机分为两组,14周龄时一组注射AAV9-CD147,另一组注射AAV9-EV,于注射后2、4、6 w利用Western blotting检测CD147蛋白水平,结果显示,病毒在注射后2 w开始显现效果,注射后4 w时达到峰值效应并持续至注射后6 w。免疫组化进一步证实,AAV9-CD147在注射后6 w显著提升CD147表达,表明病毒注射成功且过表达效率高。对照和DM小鼠中,AAV9-CD147对血糖及体重均无显著影响。超声心动图分析显示,与CON+AAV9-EV组相比,外源性CD147显著损害对照小鼠心脏收缩和舒张功能(即CON+AAV9-CD147组心功能障碍),表现为E/A比值、LVEF和LVFS降低,LVIDs和LVIDd升高。HE和Masson三色染色证实外源性CD147引发对照小鼠不良心脏重构。免疫组化染色显示AAV9-CD147组COL1a和COL3a沉积量较AAV9-EV组显著增加。外源性CD147注射后,COL1a、COL3a及α-SMA的mRNA和蛋白水平均显著上升。值得注意的是,TGF-β表达未受CD147过表达影响。这些结果同时表明CD147过表达加剧了DM小鼠心功能障碍并促进心肌纤维化。
为探究CD147对心肌细胞的作用,作者构建了由cTnT启动子驱动的AAV9-cTnT-CD147载体,确保CD147在心肌细胞特异性表达并持续一个月。结果显示,对照小鼠中AAV9-cTnT-CD147未能模拟DM诱导的心功能异常。免疫组化和Western blotting进一步证实AAV9-cTnT-CD147组未见明显胶原沉积,再次验证了CD147通过CFs发挥促纤维化作用。
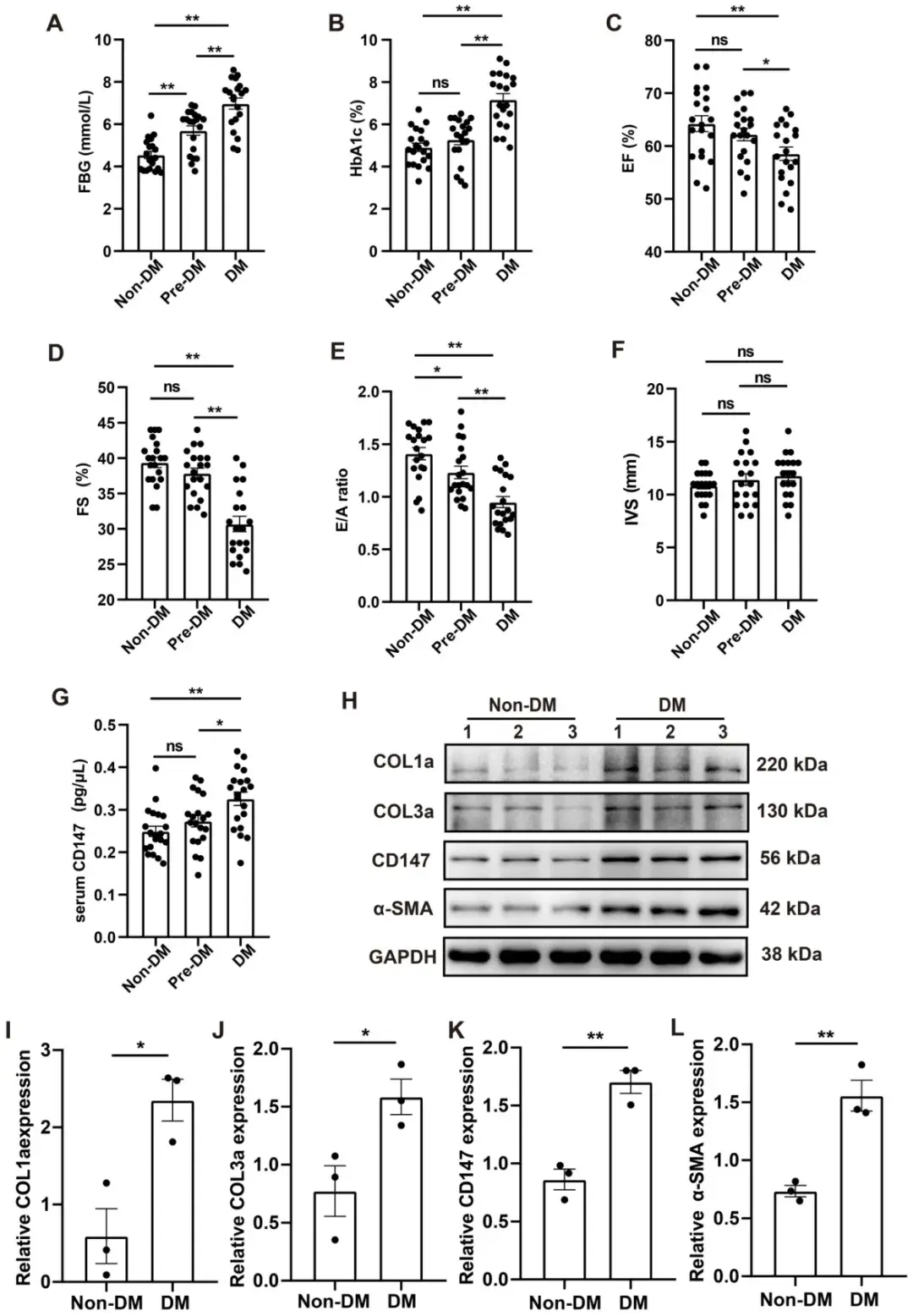
8、DM患者血清及心肌组织中CD147调控与心功能研究
本研究分析了接受心脏瓣膜置换手术的糖尿病患者(DM)、糖尿病前期患者(Pre-DM)及年龄匹配的非糖尿病受试者(Non-DM)的临床数据(包括超声心动图及临床样本)。结果显示,DM组空腹血糖(FBG)和糖化血红蛋白(HbA1c)水平显著高于Non-DM组;Pre-DM组FBG水平介于DM组与Non-DM组之间,但其HbA1c水平与Non-DM组无显著差异。超声心动图数据显示,DM组存在收缩与舒张功能障碍,表现为E/A比值、LVEF和LVFS降低。Pre-DM组较Non-DM组表现出一定程度的舒张功能异常,但其室间隔厚度未增加。CD147 ELISA检测显示,Pre-DM组血清CD147水平相较于Non-DM组虽无统计学差异但呈升高趋势,而DM组血清CD147水平显著高于Non-DM组。此外,DM组心肌组织中COL1a、COL3a、CD147及α-SMA表达水平均高于Non-DM组,与临床前研究数据一致。
结论与局限
本研究揭示了CD147在DCM心肌纤维化中的关键作用,提示CD147可能成为治疗DCM的新靶点。创新性地发现CD147的N-糖基化通过增强蛋白稳定性加速DM心肌纤维化进程。提出创新机制:CD147通过促进早期内吞体中ALK5的激活和内化,增强下游SMADs信号转导,从而介导DCM心肌纤维化。HG环境促进CD147糖基化,通过抑制其泛素化降解导致胶原异常沉积和心功能损伤。这些发现为开发基于CD147的DCM治疗策略提供了理论依据。然而本研究存在以下局限:第一,未采用CFs特异性CD147基因敲除小鼠,但通过体外CFs系列实验和心脏特异性AAV9-CD147过表达模型进行了佐证;第二,对ALK5激活和内吞作用的具体机制仍需深入解析;第三,CD147糖基化与泛素降解通路的相互作用有待进一步阐明。
本研究工作由国家自然科学基金(No.82070385、82000350)及陕西省高校科学技术协会青年人才基金(No.20210305)资助。
通讯作者介绍:
李妍,心血管内科主任,教授,博士生(后)研究生导师。先后留学日本大阪大学,美国斯坦福大学斯坦福医院。享受空军优秀人才岗位津贴。现任美国心脏学会专家委员(FACC)、美国心血管造影及介入学会专家委员(FSCAI)、中国医师协会心血管分会全国委员、全军心血管分会常委、首批国家卫健委介入培训导师等。从事心血管疾病介入治疗20余年,擅长各种心血管复杂危重疾病治疗,老年瓣膜病不开胸介入治疗、复杂冠心病(钙化、左主干、慢性闭塞病变)介入治疗,房颤左心耳封堵治疗、缓慢性心律失常起搏器治疗等。担任《JACC Cardiovasucar Imaging》编委、《中华心血管病学》审稿人、《心脏杂志》常务编委等,主持国家支撑计划子课题、国自然、军队省部级课题19项,获空军高层次科技人才资助,在Circulation,Diabetolocia等杂志发表SCI及核心期刊论文90余篇,最高影响因子23.603。获中华医学会医学科学技术奖一等奖、军队医疗成果一等奖。荣获中华医学会青年菁英奖、领衔获批陕西省科技创新才队、陕西省青年科技奖,荣立个人三等功1次,获陕西省三八红旗手称号。
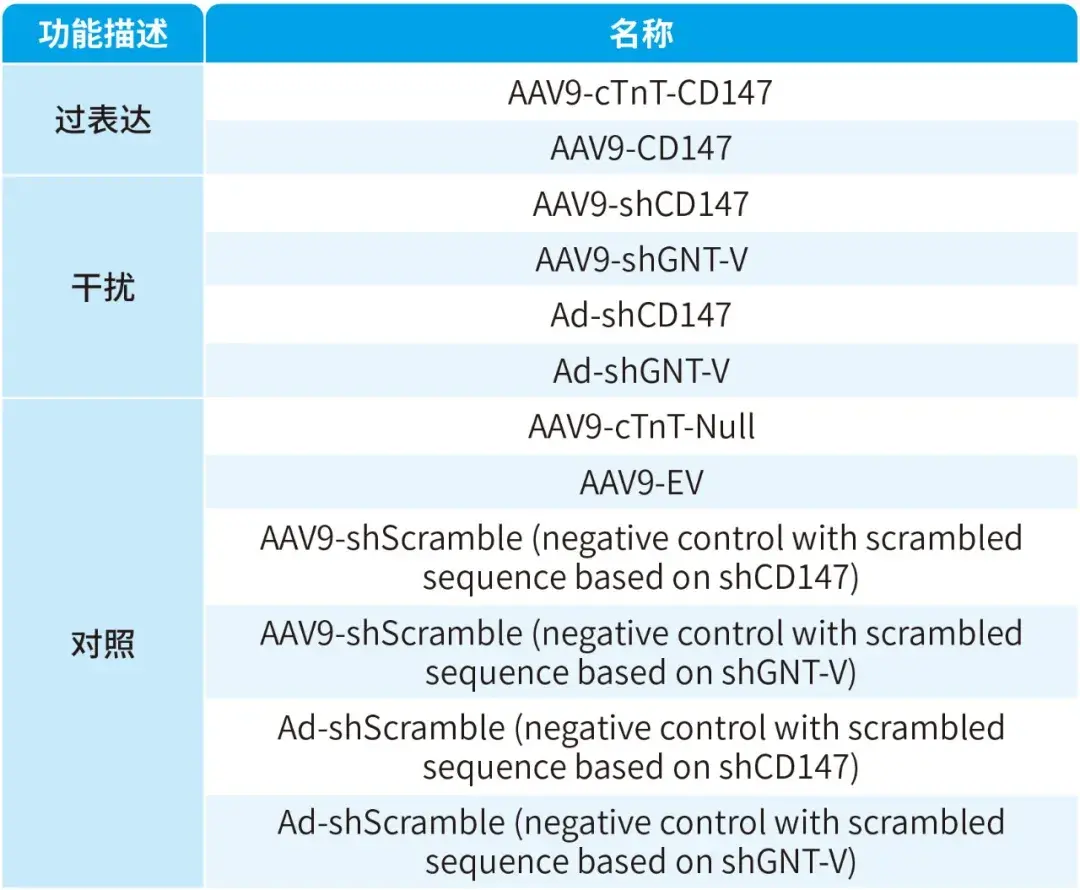
本文使用的病毒产品列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK