2025-04-07 阅读量:735
阿尔茨海默病(Alzheimer's disease, AD)是一种神经退行性疾病,其主要特征包括认知障碍、大脑中β-淀粉样蛋白(Aβ)沉积、神经元内tau蛋白形成的纤维缠结及神经元丢失等。然而,在神经元丢失之前,AD病人脑内神经元会表现为过度兴奋[1,2]。这种异常的神经元兴奋性被认为是导致认知障碍的关键机制,驱动了AD相关的神经退行性病变发生[3]。但其病理机制尚不明确,这也是该领域公认的重要谜团之一。
近期,中国科学技术大学神经退行性疾病研究中心申勇教授团队在Neuron上发表了题为“BACE1-dependent cleavage of GABAA receptor contributes to neural hyperexcitability and disease progression in Alzheimer's disease”的文章。该研究证明了AD病理的关键蛋白酶——β-分泌酶(BACE1)剪切GABAA受体(GABAAR)β亚基驱动了AD脑内神经元过度兴奋及疾病进展。
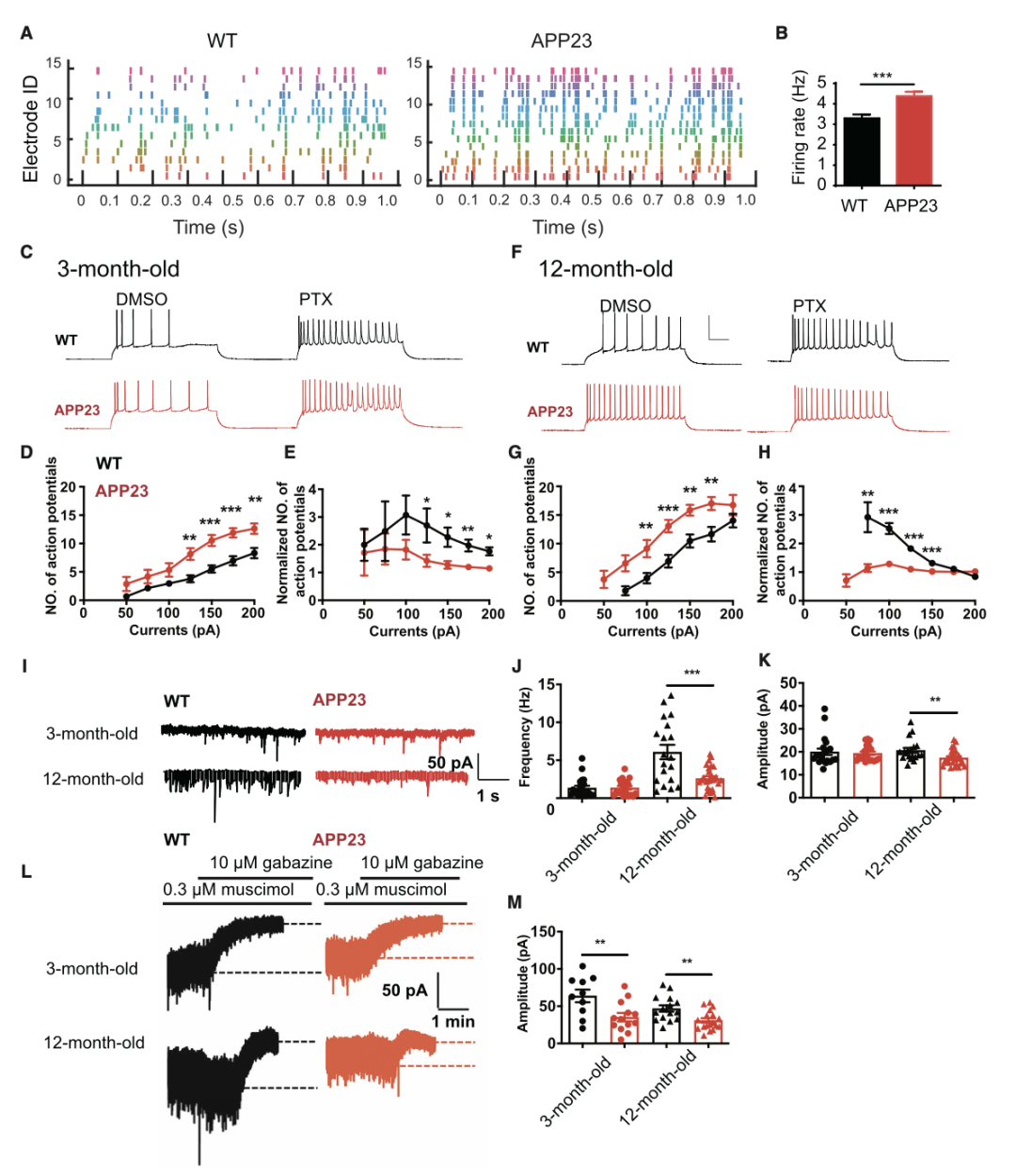
为研究AD神经元过度兴奋的病理机制,研究团队采用了APP23转基因小鼠模型,该模型通过过表达携带瑞典突变的APP(淀粉样前体蛋白)基因,能够模拟AD患者的淀粉样斑块的病理特征。研究显示,在淀粉样斑块出现之前(3月龄),APP23小鼠海马齿状回颗粒细胞已经表现出显著的过度兴奋,并证明了其与GABAAR介导的抑制性电流减少密切相关。神经元的过度兴奋在12月龄(斑块出现后)的AD小鼠颗粒细胞中仍然持续存在。这和在AD病人脑内观察到的现象一致,说明神经元异常兴奋性在AD发生的早期已经存在(图1)。
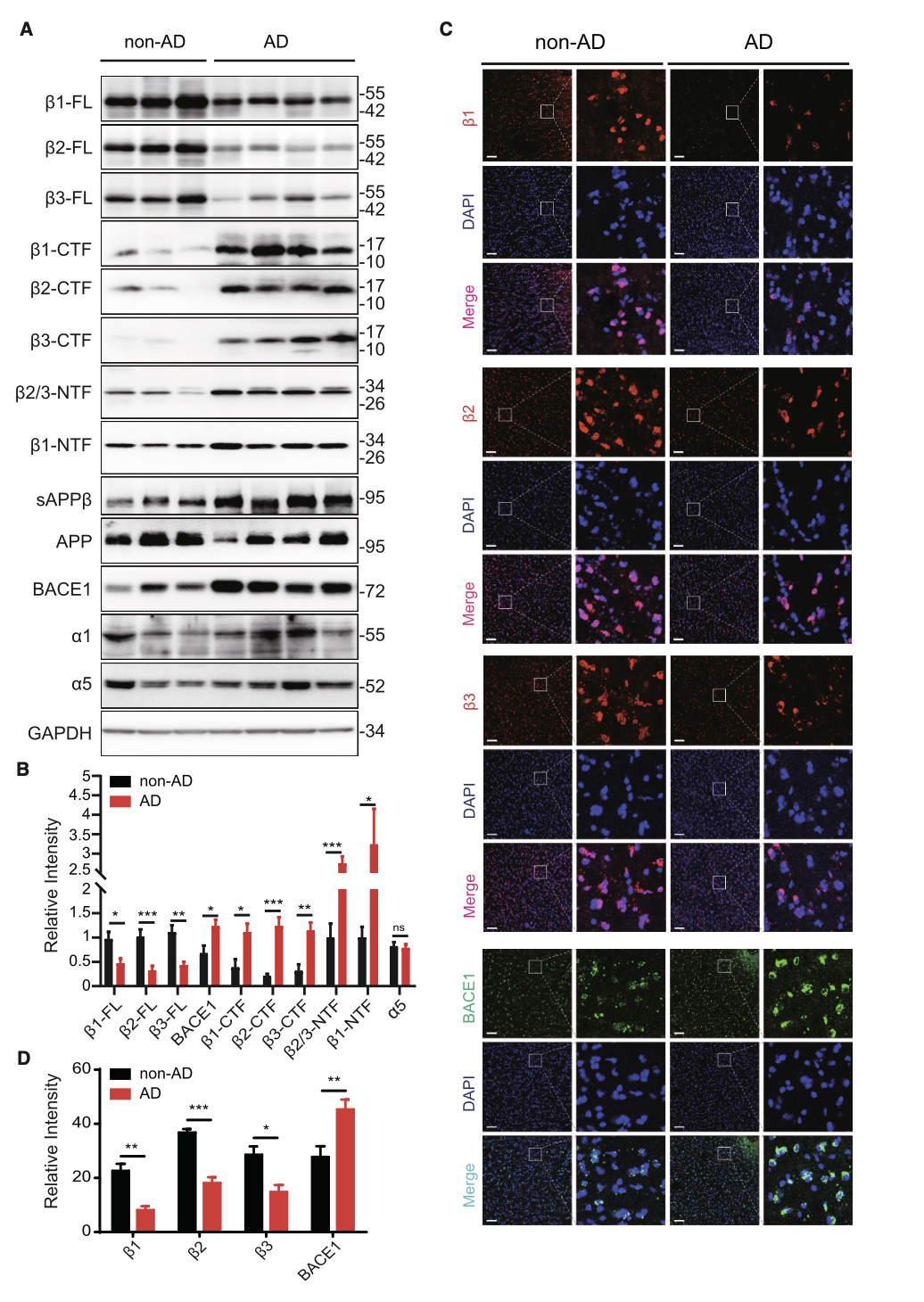
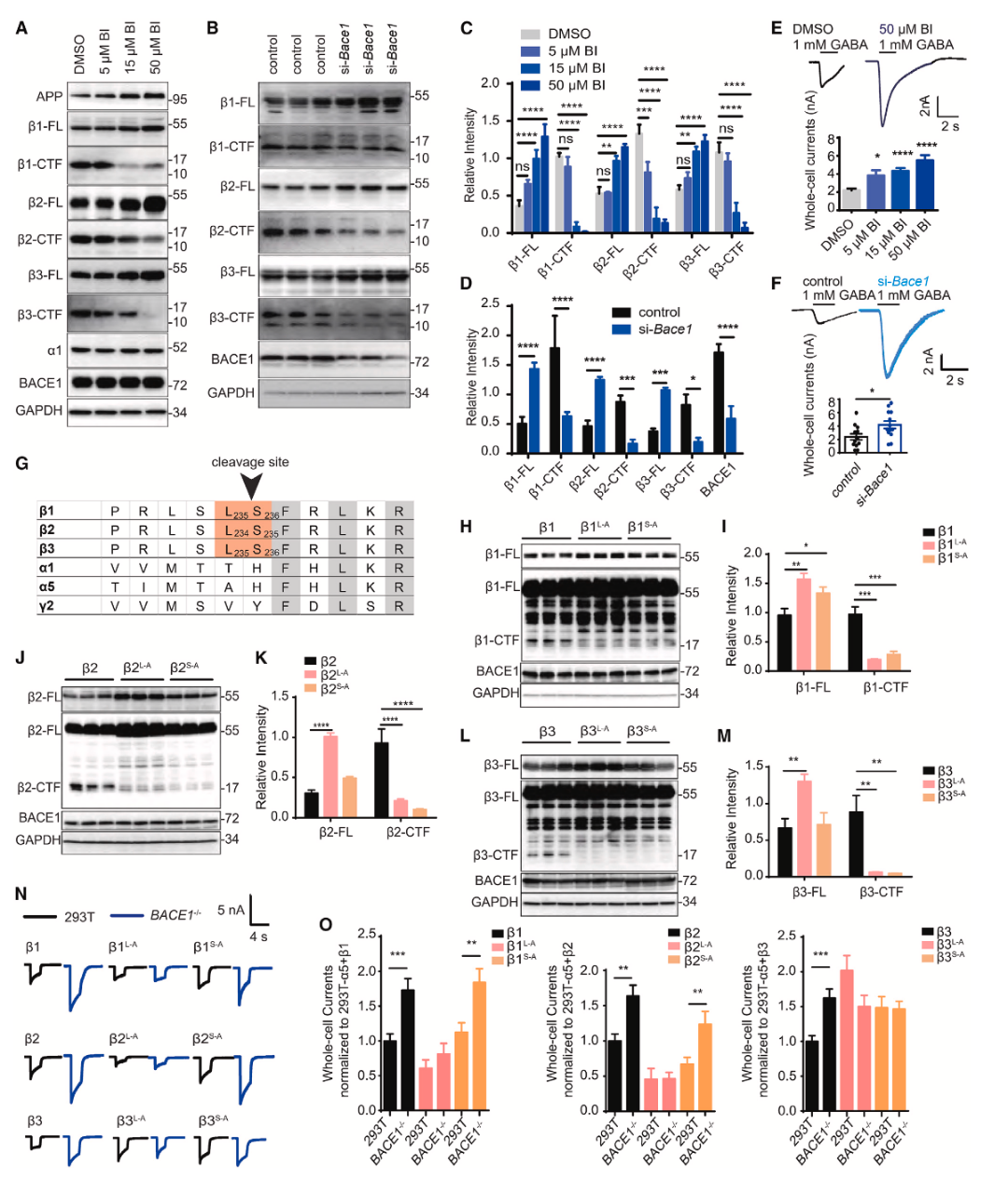
与此同时,研究团队发现,GABAAR β1/2/3亚基的减少可能是导致脑内抑制性电流功能损伤的机制。并且在AD病人以及APP23动物脑内均观察到了GABAAR β1/2/3亚基的片段,提示了其减少可能是因为异常的蛋白酶切割导致(图2)。进一步,研究团队通过蛋白质质谱、切割位点突变等手段,鉴定了切割APP的关键蛋白酶BACE1是切割GABAAR β亚基的蛋白酶(图3)。AD病人脑内的BACE1上调,导致GABAAR β亚基的过度切割,损伤了抑制性电流及其功能。这一工作也首次证实了BACE1在调控神经元的兴奋性中的直接作用。
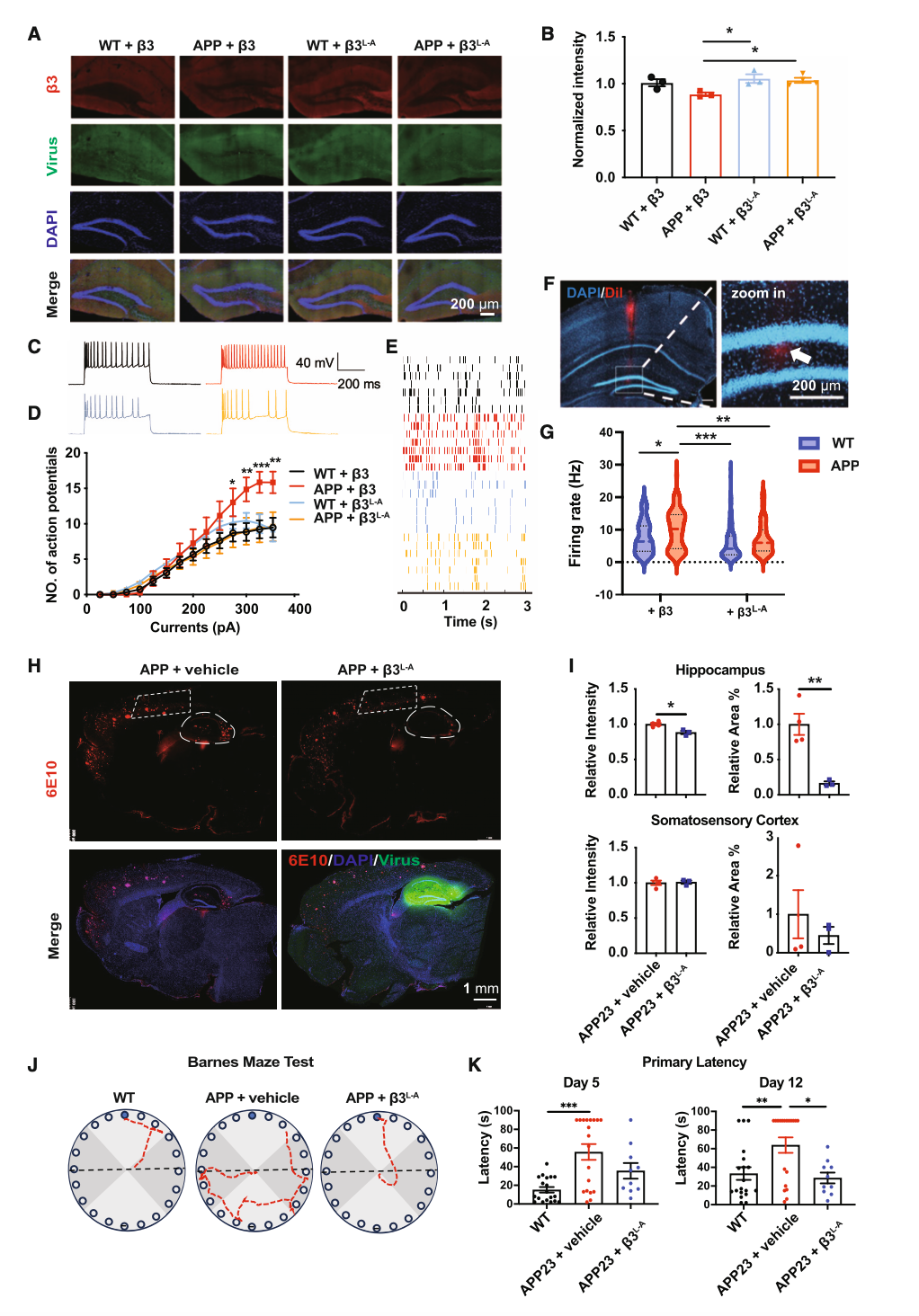
为进一步探讨神经元异常兴奋性病理意义,研究团队构建了无法被剪切的突变体亚型GABAAR β3L-A。利用rAAV(重组腺相关病毒)在APP23小鼠海马中表达GABAAR β3亚基及其突变体,研究团队发现GABAAR β3L-A突变体能够明显改善APP23小鼠颗粒细胞的过度兴奋,减少Aβ沉积,并改善小鼠的空间记忆障碍(图4)。这表明,通过靶向调节BACE1对GABAAR β亚基的剪切,能够抑制神经元异常兴奋,并有助于延缓AD的病理进展。
图4. 在APP23小鼠海马区表达无法被BACE1剪切的突变体亚型GABAAR β3L-A能够抑制Aβ病理进展并改善空间学习记忆能力
结论
参考文献:
[1] Palop, J.J., and Mucke, L. (2010). Amyloid-beta-induced neuronal dysfunction in Alzheimer’s disease: from synapses toward neural networks. Nat Neurosci 13, 812–818. https://doi.org/10.1038/nn.2583.
[2] Busche, M.A., Eichhoff, G., Adelsberger, H., Abramowski, D., Wiederhold, K.-H., Haass, C., Staufenbiel, M., Konnerth, A., and Garaschuk, O. (2008). Clusters of hyperactive neurons near amyloid plaques in a mouse model of Alzheimer’s disease. Science 321, 1686–1689. https://doi.org/10.1126/science.1162844.
[3] Mucke, L., and Selkoe, D.J. (2012). Neurotoxicity of amyloid β-protein: synaptic and network dysfunction. Cold Spring Harb Perspect Med 2, a006338. https://doi.org/10.1101/cshperspect.a006338.
[4] Hampel, H., Vassar, R., De Strooper, B., Hardy, J., Willem, M., Singh, N., Zhou, J., Yan, R., Vanmechelen, E., De Vos, A., et al. (2021). The β-Secretase BACE1 in Alzheimer’s Disease. Biol Psychiatry 89, 745–756. https://doi.org/10.1016/j.biopsych.2020.02.001.
本文使用的病毒产品均来自枢密科技,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK