2025-03-18 阅读量:1146
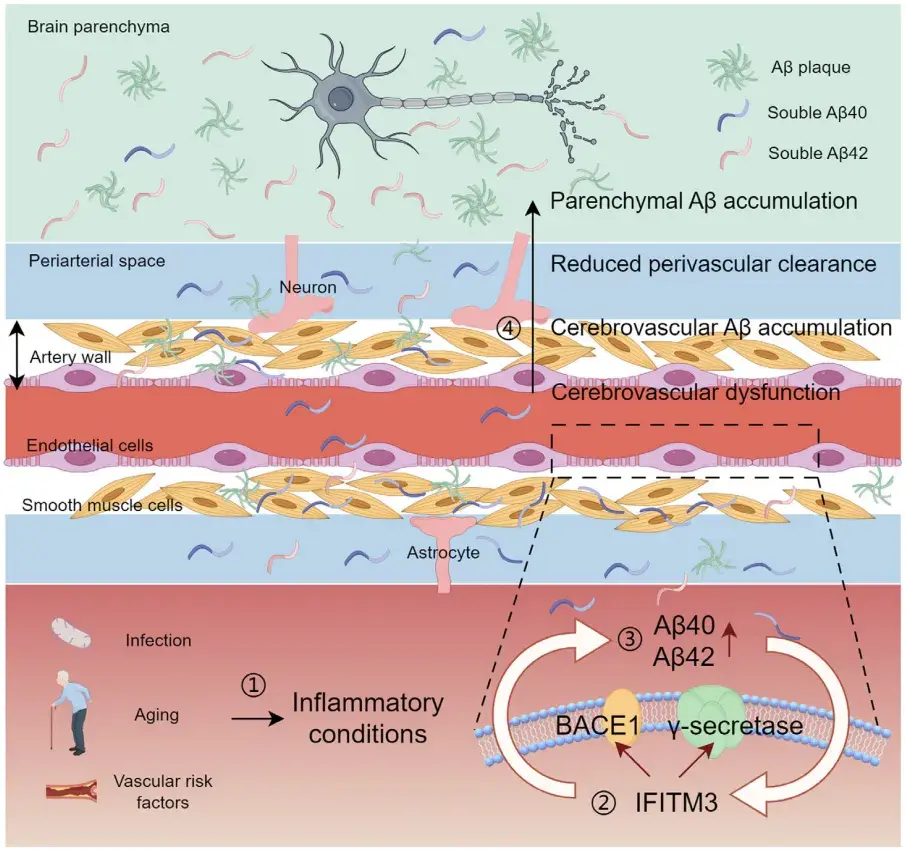
阿尔茨海默病(AD)是导致痴呆的主要原因,其主要临床特征为认知功能障碍,严重影响患者日常生活。AD的病理标志包括淀粉样斑块的形成和神经纤维缠结,导致神经元功能障碍和损伤。AD患者常伴随脑血管疾病,影响血脑屏障(BBB)和脑血流量(CBF)。研究表明,血管风险因素与淀粉样β(Aβ)病理在老年人群中常同时存在,且与认知障碍密切相关。此外,高血压和缺氧等血管风险因素可促进淀粉样蛋白沉积,可能与Aβ清除减少或淀粉样前体蛋白(APP)酶切增加有关。与不可控的AD风险因素(如遗传和衰老)相比,减轻血管风险因素是预防和管理AD的有效策略。
多数关于AD神经血管功能障碍机制的研究主要聚焦于Aβ上。Aβ是通过APP被β-分泌酶和γ-分泌酶连续切割而产生的,这一过程导致其在细胞外积累并形成Aβ斑块。抑制Aβ产生或促进α-分泌酶切割APP可减轻AD相关表型。Aβ斑块广泛分布于AD患者的脑实质和脑血管壁,其在脑血管中的积累会导致BBB功能障碍、血管周围Aβ清除减少和CBF降低,进一步加剧脑内病理沉积。干扰素(IFN)诱导跨膜蛋白(IFITM)属于干扰素诱导的抗病毒蛋白家族,最初在人神经母细胞瘤细胞中被发现。其中IFITM3是一种先天免疫蛋白,具有广谱抗病毒活性。近期研究发现,IFITM3与衰老和AD相关,可增强γ-分泌酶活性,从而增加Aβ产生。然而在AD病理过程中,IFITM3在不同类型脑细胞中的具体作用仍不清楚。
2025年1月14日,温州医科大学宋伟宏院士、南京鼓楼医院张韵研究员及温州医科大学附属第一医院潘思培副主任医师联合在Alzheimers & Dementia期刊上发表了题为“Inhibition of IFITM3 in cerebrovascular endothelium alleviates Alzheimer-related phenotypes”的研究论文,探讨了IFITM3在AD脑血管内皮细胞(CVECs)中的作用。研究发现,AD患者及AD转基因模型小鼠的脑血管内皮中IFITM3水平升高。利用腺相关病毒(AAV-BI30)特异性敲低CVECs中的IFITM3,可减少脑血管壁Aβ积累,恢复BBB完整性,并改善AD转基因小鼠的认知功能障碍。另外,在CVECs中过表达IFITM3可通过调节β-分泌酶(BACE1)和γ-分泌酶增加Aβ生成,而Aβ进一步上调IFITM3表达,形成恶性循环。这些结果表明,靶向抑制CVECs中的IFITM3可能是治疗AD的潜在策略。
1、IFITM3在AD患者及模型小鼠CVECs中均显著上调
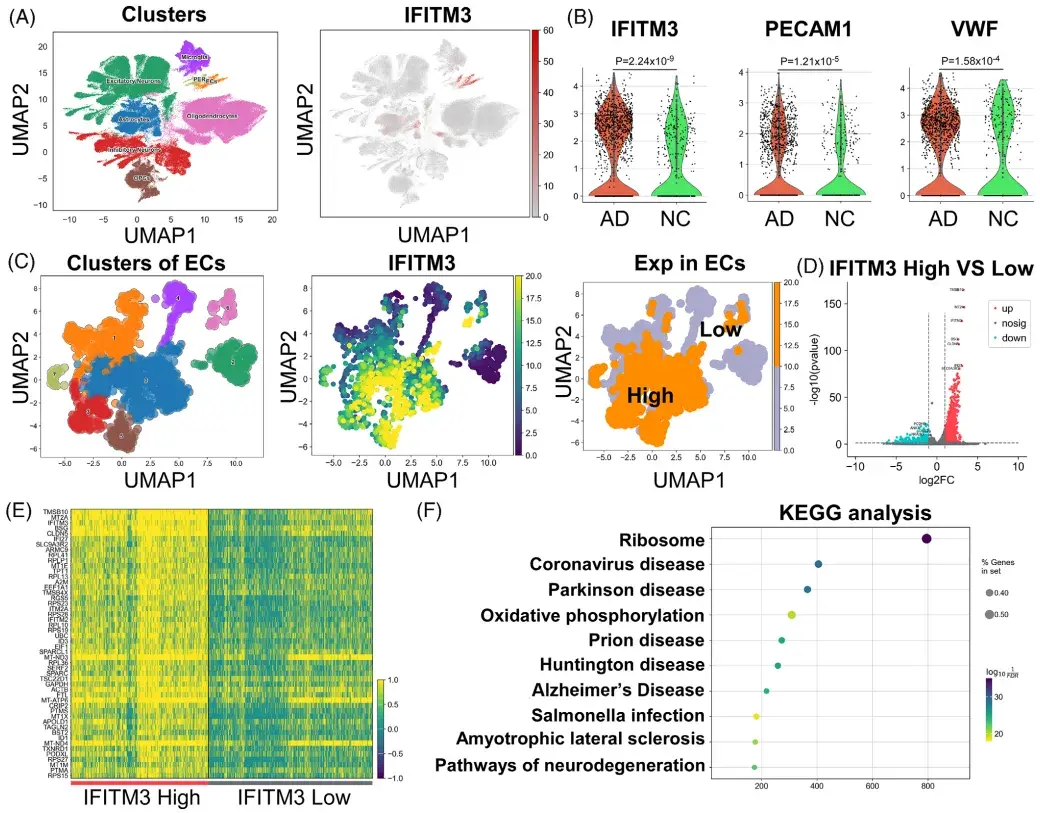
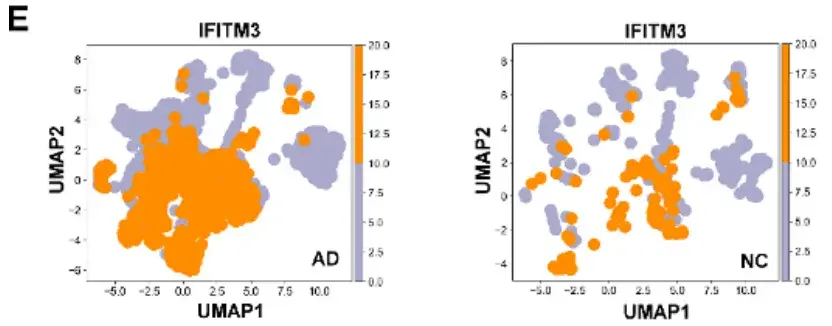
为了研究AD患者大脑中IFITM3的细胞特异性转录特征,研究人员首先整合并分析了来自30名AD患者和23名正常对照(NCs)的皮层样本的单细胞核转录组数据。发现IFITM3在CVECs和周细胞中显著高表达,且在AD患者CVECs中IFITM3转录水平显著高于NCs,并与脑内皮标志物内皮细胞黏附分子1(PECAM1,又称为CD31)和血管性血友病因子(VWF)的上调一致。进一步的亚群分析显示,在IFITM3高表达的内皮细胞亚群中,AD样本占比达89.13%,其余的10.87%来自NCs样品,且差异表达基因(DEGs)富集于神经退行性疾病相关通路,提示IFITM3在AD病理中的潜在作用。
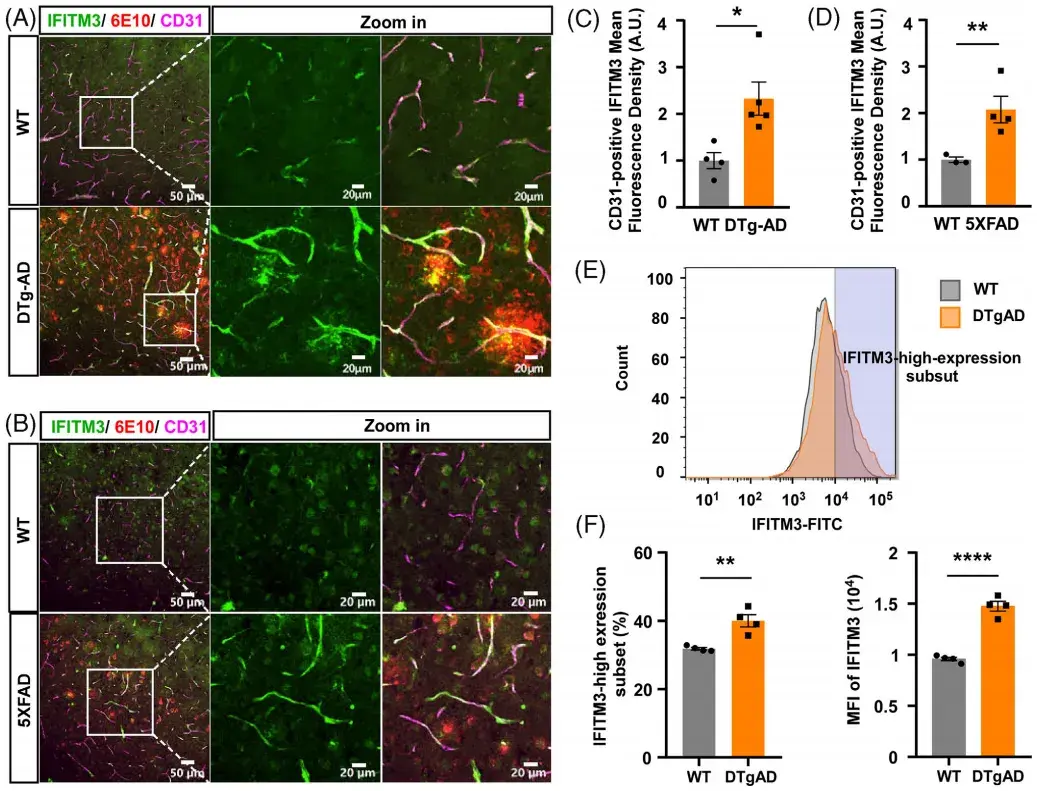
鉴于AD患者CVECs中IFITM3的显著高表达,研究人员进一步探索了其在AD小鼠模型中的表达模式。免疫荧光染色结果显示,在AD转基因小鼠模型[APP23/PS45双转基因AD小鼠(DTg-AD)和5XFAD小鼠]中IFITM3与CD31阳性内皮细胞共定位,IFITM3表达显著增加,并围绕Aβ斑块(人Aβ特异性抗体6E10标记)分布。流式细胞术进一步证实,DTg-AD小鼠CVECs中IFITM3高表达细胞比例及平均荧光强度(MFI)均显著高于野生型(WT)小鼠。这些结果表明,IFITM3在AD患者及模型小鼠的脑内皮细胞中均显著上调,且其表达与Aβ病理密切相关,为后续研究其在AD发病机制中的作用提供了重要依据。
2、CVECs中IFITM3的敲低可减少AD模型小鼠的Aβ沉积、BBB渗漏并改善其认知障碍
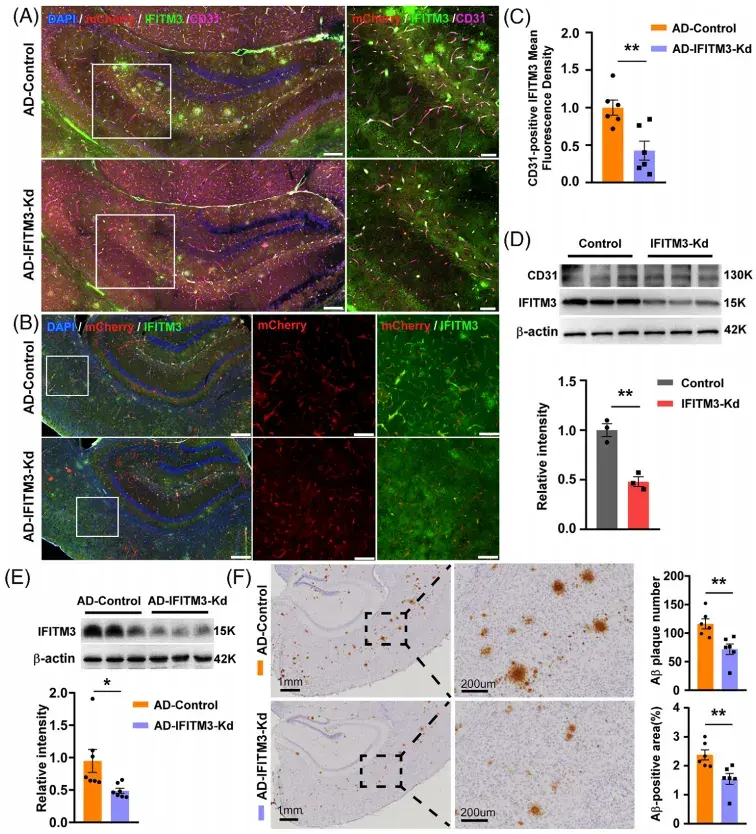
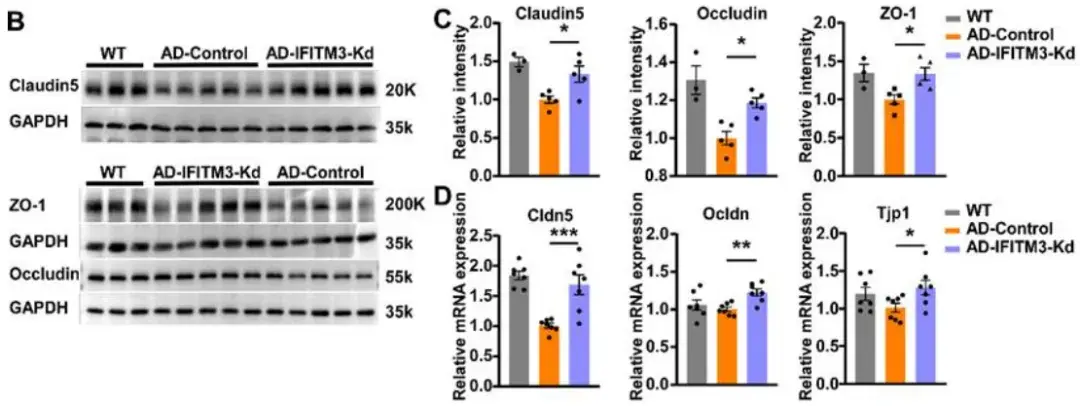
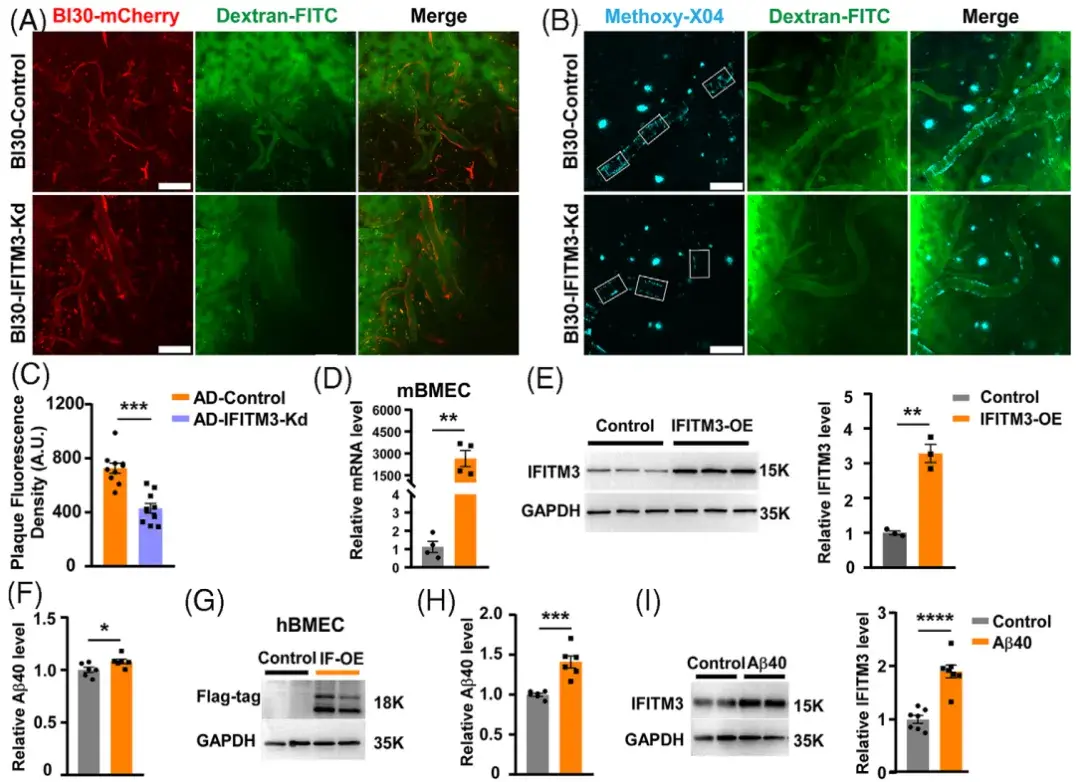
研究人员下一步探讨了CVECs中的IFITM3在AD病理中的功能。为了特异性抑制AD模型小鼠CVECs中IFITM3的表达,研究人员使用了AAV2-BI30病毒载体,该载体能够高效转导中枢神经系统内皮细胞(ECs)。免疫荧光染色结果显示,静脉注射AAV2/BI30-shRNA(IFITM3)-mCherry两个月后,在DTg-AD小鼠的CD31阳性CVECs中出现了强烈的mCherry荧光表达,并与IFITM3阳性信号共定位,且该病毒感染的ECs中观察到IFITM3的显著降低。研究人员从注射了该病毒的WT小鼠中分离出CVECs并进行原代培养,4天后收集ECs进行蛋白质免疫印记(WB)分析,结果显示,CVECs中IFITM3的水平显著降低。上述结果证明了该病毒的有效性。为探究CVECs中IFITM3表达下调对Aβ斑块的影响,研究人员进行了免疫组化染色。结果显示,与对照组相比,IFITM3敲低组中皮质和海马区域的Aβ斑块数量和阳性面积均显著减少。此外,IFITM3敲低组中BBB相关紧密连接蛋白(如claudin-5、occludin和ZO-1)的蛋白和mRNA水平均显著上调,提示IFITM3下调可恢复BBB完整性,减少BBB渗漏。
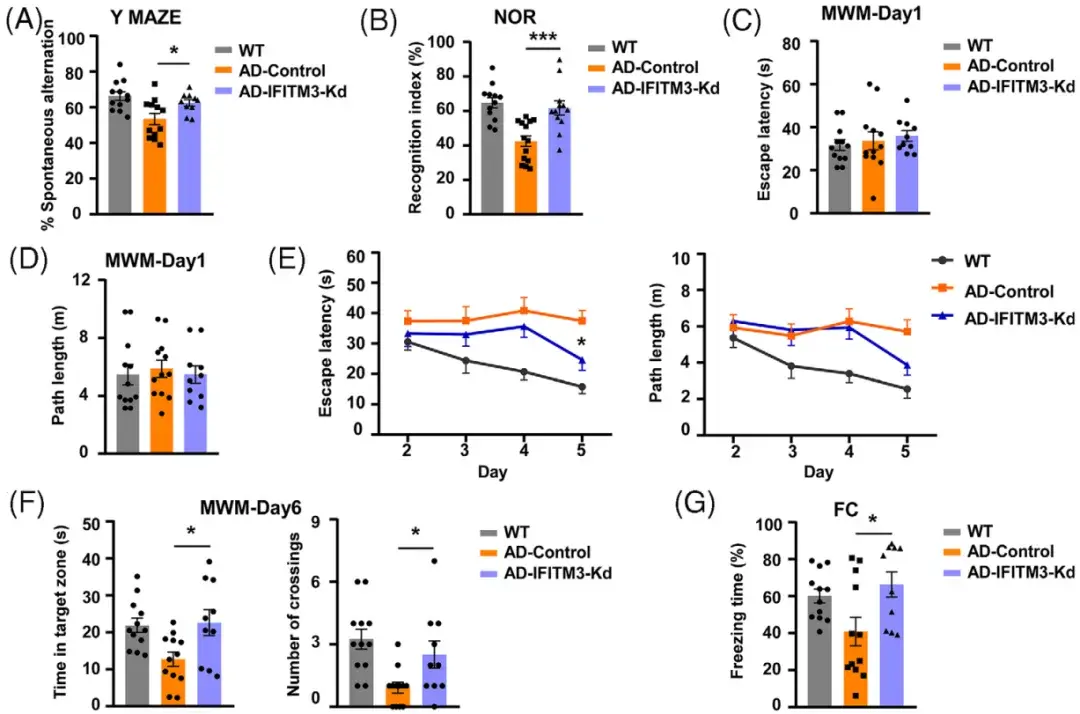
接下来研究人员通过一系列行为学实验对小鼠的认知功能进行评估。Y迷宫实验显示,IFITM3敲低组小鼠的自发交替率显著增加,表明其空间工作记忆改善;新物体识别(NOR)实验表明其记忆能力明显改善;Morris水迷宫(MWM)实验中,IFITM3敲低组小鼠在隐藏平台测试中的逃避潜伏期和路径长度显著缩短,且在探测试验中目标区域停留时间和穿越平台次数显著增加,提示空间学习和记忆能力增强;此外,条件恐惧(FC)实验中IFITM3敲低组小鼠的冻结时间显著减少,提示IFITM3敲低对恐惧记忆的调节作用。综上,IFITM3在CVECs中的下调不仅减少了Aβ沉积和改善了BBB功能,还显著改善了AD模型小鼠的认知障碍。
3、IFITM3与Aβ之间的相互调控作用
研究人员进一步探讨了IFITM3与Aβ之间的相互调控关系。实验利用AAV2-BI30病毒载体在AD模型小鼠(APP23/PS45转基因小鼠)中特异性敲低CVECs中的IFITM3,并通过双光子成像技术观察Aβ斑块的变化。结果显示,IFITM3敲低显著减少了脑血管壁上Aβ斑块沉积。此外,研究人员还通过慢病毒介导的IFITM3过表达实验发现,IFITM3在小鼠和人脑微血管内皮细胞(mBMECs和hBMECs)中的上调显著增加了培养基中Aβ40(Aβ的一种亚型,能反映Aβ的整体情况)的水平,表明IFITM3可促进Aβ的产生。此外,用Aβ寡聚物处理hBMECs后,IFITM3的表达显著增加,提示Aβ亦可反馈增强IFITM3的表达。总体而言,这些结果表明IFITM3与Aβ之间存在复杂的相互作用,形成了一种恶性循环,进一步加剧了AD的病理进程。
4、脑血管内皮IFITM3调节BACE1和γ-分泌酶活性
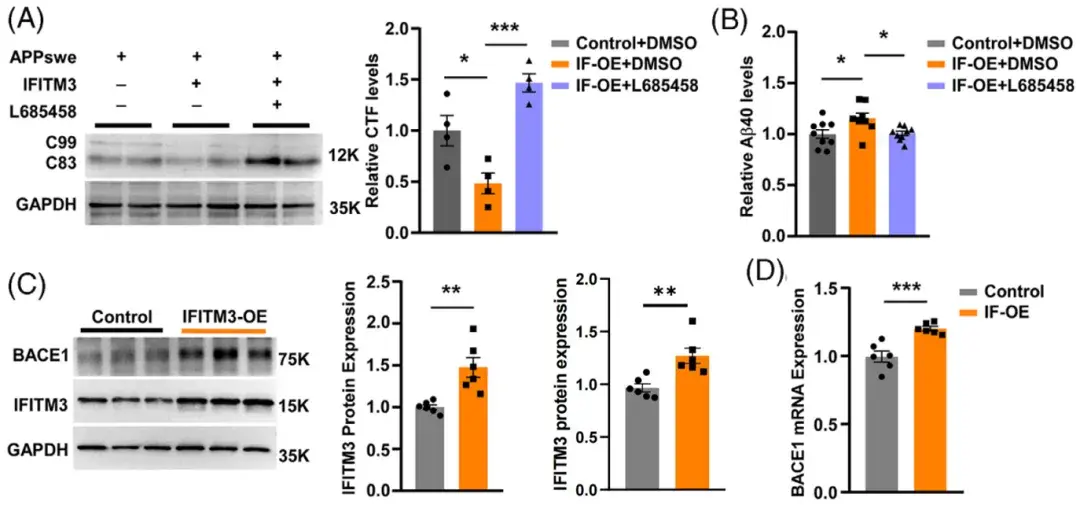
研究最后探讨了CVECs中IFITM3对Aβ产生机制的调控作用。研究人员在hBMECs中同时过表达瑞典突变型APP和IFITM3,发现叠加IFITM3的过表达显著降低了γ-分泌酶裂解底物C99和C83的C末端片段(CTF)水平,同时Aβ40水平显著增加。这些变化在γ-分泌酶抑制剂L-685458处理后被逆转。此外,IFITM3过表达还显著上调了β-分泌酶(BACE1)的蛋白和mRNA水平。这表明IFITM3通过调节BACE1表达和γ-分泌酶活性(这两种酶是Aβ生成过程中APP酶切的关键酶)来最终影响Aβ的生成。
结论
本研究揭示了CVECs中IFITM3在AD病理中的关键作用。IFITM3通过调控BACE1表达和γ-分泌酶活性促进Aβ生成,而Aβ的积累又进一步诱导IFITM3表达,形成恶性循环,加剧AD病理进程。研究发现,敲低CVECs中的IFITM3可显著减少脑血管壁Aβ沉积,改善BBB功能,并减轻APP23/PS45转基因小鼠的认知障碍。针对脑血管IFITM3的干预不仅可减少Aβ生成,还能改善脑血管功能,为AD治疗提供了新的策略。结合抗Aβ免疫疗法(Aducanumab),靶向IFITM3有望在AD早期阶段延缓其病理进展,恢复脑血管健康,为AD治疗开辟新途径。
图7. 脑血管内皮IFITM3影响AD表型的作用机制示意图
温州医科大学宋伟宏院士为论文的通讯作者,南京鼓楼医院张韵研究员及温州医科大学附属第一医院潘思培副主任医师为论文的共同通讯作者。宋伟宏院士团队的博士研究生冯艺佳、硕士研究生王圣雅以及博士研究生杨丹璐完成主要研究工作,为论文的共同第一作者。该研究得到国家自然科学基金项目的资助。
通讯作者介绍:
宋伟宏,加拿大健康科学院院士,瓯江实验室(浙江省实验室)主任,温州医科大学副校长、老年研究院院长,浙江省阿尔茨海默病研究重点实验室主任。2011年国家友谊奖获得者。加拿大阿尔茨海默病首席研究员,从事阿尔茨海默病的研究30余年,是该领域的顶尖专家。
张韵,南京鼓楼医院,研究员、博士生导师。南京大学脑重大疾病转化研究所副所长。主要从事糖尿病认知功能障碍及阿尔茨海默病发病机制与药物研发的研究。第一或通讯作者(含共同)发表SCI论文20余篇,累计影响因子375。主持和作为骨干成员参与5项国家自然科学基金、科技部及省部级科研项目,入选北京市青年海外高层次人才及北京市“青苗”计划。
本文使用的来自枢密科技的病毒,列表如下:
我司可提供靶向脑血管内皮细胞的AAV2-BR1、AAV2-BI30血清型现货及定制病毒,欢迎咨询选购!

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK