2025-03-03 阅读量:1300
肾纤维化是几乎所有形式慢性肾脏病(CKD)进展的必然结果。尽管CKD患病率高且致残/致死率高,但目前仍缺乏有效的治疗方法来阻止或逆转肾纤维化和CKD进展。全面解析介导肾纤维化的复杂机制和信号通路,可能会提出新的治疗途径。
肾纤维化是一种多因素且进行性疾病,涉及肾脏内外源性的多种细胞类型。在CKD进展过程中有4个主要的细胞类型参与:肾小管上皮细胞(TEC)、肌成纤维细胞、内皮细胞和免疫细胞。不同类型的细胞在这一过程中扮演着复杂、独特且相互关联的角色。TEC作为肾脏的主要组成部分,对损伤作出响应。先前的研究强调了驻留TEC是人肾纤维化的始动因素,受损的TEC经历部分上皮细胞-间充质细胞转化(EMT),但仍驻留在肾小管的基底膜内。它们的特征是获得间充质细胞特性,同时表达上皮细胞和间充质细胞标志物。因此,损伤的TEC释放促炎和促纤维化的旁分泌信号,从而重塑微环境以促进炎症和纤维化。研究表明,TEC中存在的一系列分子决定因素在肾纤维化和CKD中发挥关键作用。一些分子如蜗牛蛋白(Snail,由Snai1编码)、肾损伤分子1(KIM1)在TEC损伤和肾小管间质纤维化中起促进作用。
神经氨酸酶(NEU,或唾液酸酶)是一类糖苷水解酶家族,能发挥催化作用从病毒和细胞糖缀合物中去除唾液酸。目前研究最广泛的神经氨酸酶位于流感病毒表面,该酶从宿主受体上去除唾液酸以促进病毒释放。而在哺乳动物中,神经氨酸酶已被证明参与了多种生理和病理过程。首先,哺乳动物神经氨酸酶家族由4个成员(NEU1-NEU4)组成,通过去除唾液酸负责糖缀合物降解的初始步骤。其中,NEU1和NEU4通常位于溶酶体中。NEU1缺乏会导致唾液酸贮积症,这是一种以唾液酸糖肽和唾液酸寡糖在组织中积累为特征的疾病。其次,神经氨酸酶通过去唾液酸化参与翻译后修饰,并调节糖蛋白的结构和功能。再者,神经氨酸酶可通过蛋白-蛋白相互作用影响蛋白功能。作者前期工作表明,神经氨酸酶与转录因子GATA4结合以驱动心肌肥大。此外,作者还报道了神经氨酸酶激活导致循环N-乙酰神经氨酸的积累,这是一种信号代谢物,可触发RhoA和Cdc42依赖的心肌损伤。由于NEU多种功能,哺乳动物神经氨酸酶已被证实在多种人类疾病中发挥新作用,包括自身免疫性疾病、心血管疾病、癌症、神经退行性疾病和肺部疾病。设计靶向神经氨酸酶的特异性抑制剂具有治疗这些疾病的潜力。然而,神经氨酸酶在CKD和转化生长因子β(TGFβ)信号通路中的作用仍需进一步探索。为填补现有神经氨酸酶研究的空白,这项工作旨在探讨其在肾纤维化中的作用。
近期,中国药科大学齐炼文教授/张蕾研究员团队在Nature Communications期刊在线发表了题为“Neuraminidase 1 promotes renal fibrosis development in male mice”的研究论文。本文中,研究人员检测了肾纤维化患者以及接受单侧输尿管结扎(UUO)或给予叶酸(FA)刺激的小鼠中神经氨酸酶1(NEU1)的表达。构建了TEC特异性Neu1基因敲除和过表达小鼠,以表征NEU1在肾纤维化进展中的作用。并进一步探讨了NEU1促进肾纤维化的潜在机制。此外,筛选了与哺乳动物NEU1结合并保护小鼠肾脏免受损伤的天然化合物。作者发现,NEU1在纤维化肾脏中表达显著上调。TEC特异性Neu1敲除抑制了EMT、炎性细胞因子产生和胶原沉积。相反,Neu1过表达加剧了进展性肾纤维化。从机制上讲,NEU1与TGFβ I型受体ALK5的160-200氨基酸区域相互作用并稳定ALK5,从而导致SMAD2/3激活。中药丹参中提取的一种活性成分丹酚酸B被发现与NEU1具有高亲和力,并以NEU1依赖的方式有效保护小鼠免受肾纤维化侵害。综合来看,这项研究揭示了NEU1在肾纤维化中的促进作用,并提出了靶向NEU1治疗肾脏疾病的可能性。
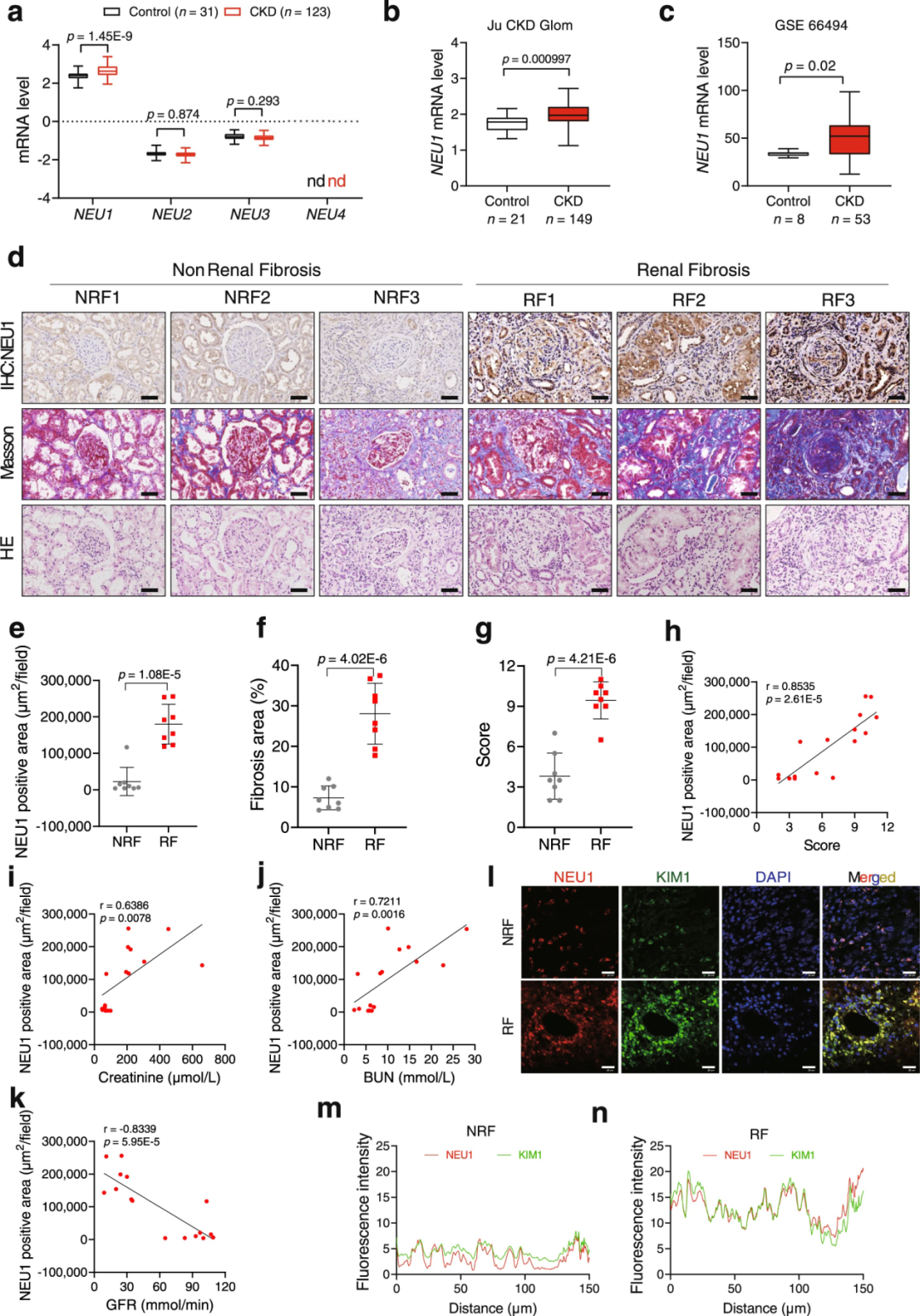
1、CKD患者肾脏NEU1表达升高
作者首先通过分析肾脏转录组数据库Nephroseq来研究4个神经氨酸酶成员(NEU1-NEU4)的表达情况。结果显示,Ju CKD Tublnt数据库中,与对照组相比,CKD患者的肾活检组织中仅NEU1的mRNA水平显著上调。具体而言,在CKD大多数类型(包括IgA肾病、糖尿病性肾病、系统性红斑狼疮性肾炎、局灶节段性肾小球硬化症和膜性肾小球肾炎)中NEU1 mRNA水平均明显升高。此外,NEU1在Ju CKD Glom、GSE66494数据库中也高表达。
接下来,研究者分析了从肾纤维化(n=8)和无肾纤维化患者(活检未发现特定病理改变,n=8)收集的16份显微切割的人肾脏样本。如Masson染色和苏木精-伊红(H&E)染色所示,肾纤维化患者显示出严重的胶原沉积和肾脏损伤。免疫组织化学(IHC)揭示,肾纤维化患者NEU1蛋白水平显著高于无肾纤维化患者。此外,NEU1水平与肾小管损伤评分、血清肌酐水平和血尿素氮(BUN)水平呈强正相关,但与估算的肾小球滤过率(GFR)呈负相关。免疫荧光(双标)显示,NEU1表达的增加主要与KIM1共定位,而KIM1是急性肾损伤和CKD中受损上皮细胞的生物标志物。对肾脏转录组数据库的分析还表明NEU1主要在肾皮质表达。
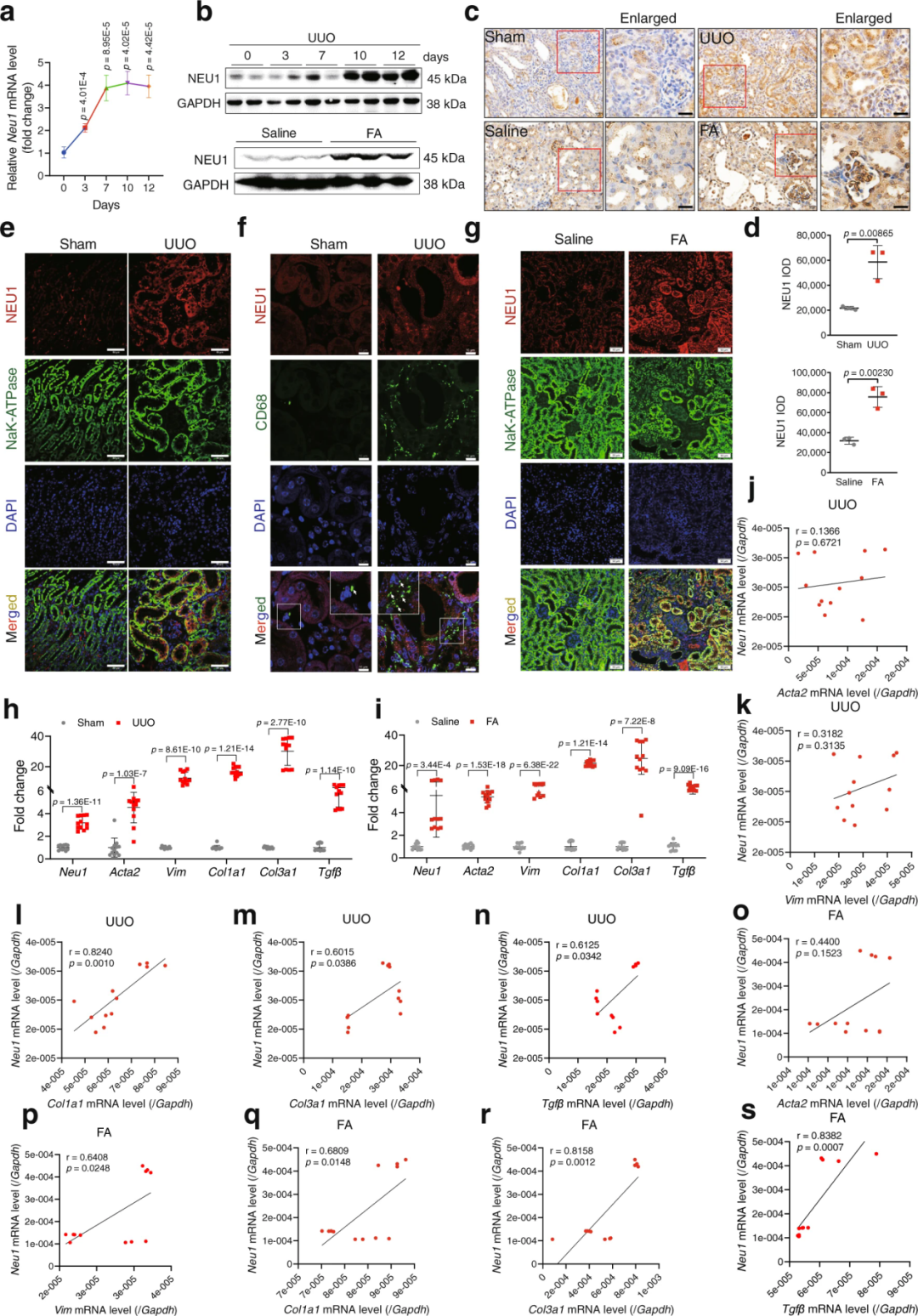
2、NEU1在小鼠纤维化肾脏中表达上调
接下来,研究人员测定了小鼠NEU1的蛋白水平。通过单侧输尿管结扎(UUO)或叶酸(FA,250 mg/kg,腹腔注射)刺激建立肾纤维化模型。UUO诱导的纤维化小鼠肾脏中NEU1 mRNA和蛋白水平显著增加,且这些增加呈时间依赖性(UUO后0、3、7、10、12 d)。同样地,在FA诱导的纤维化小鼠肾脏中也观察到NEU1的蛋白表达增加(FA注射后4 w)。肾脏组织切片免疫荧光染色显示,NEU1在TEC(Na+/K+-ATPase即钠钾泵标记)中表达增加。接下来,研究者分析了纤维化指标,并与NEU1表达进行相关性分析。结果表明,与对照组比较,纤维化肾脏中α-平滑肌肌动蛋白(α-SMA,由Acta2编码)、波形蛋白(Vimentin)、Ⅰ型胶原蛋白α1链(Col1a1)、Ⅲ型胶原蛋白α1链(Col3a1)和Tgfβ的mRNA表达显著增加。值得注意的是,NEU1水平与这些纤维化指标呈正相关。
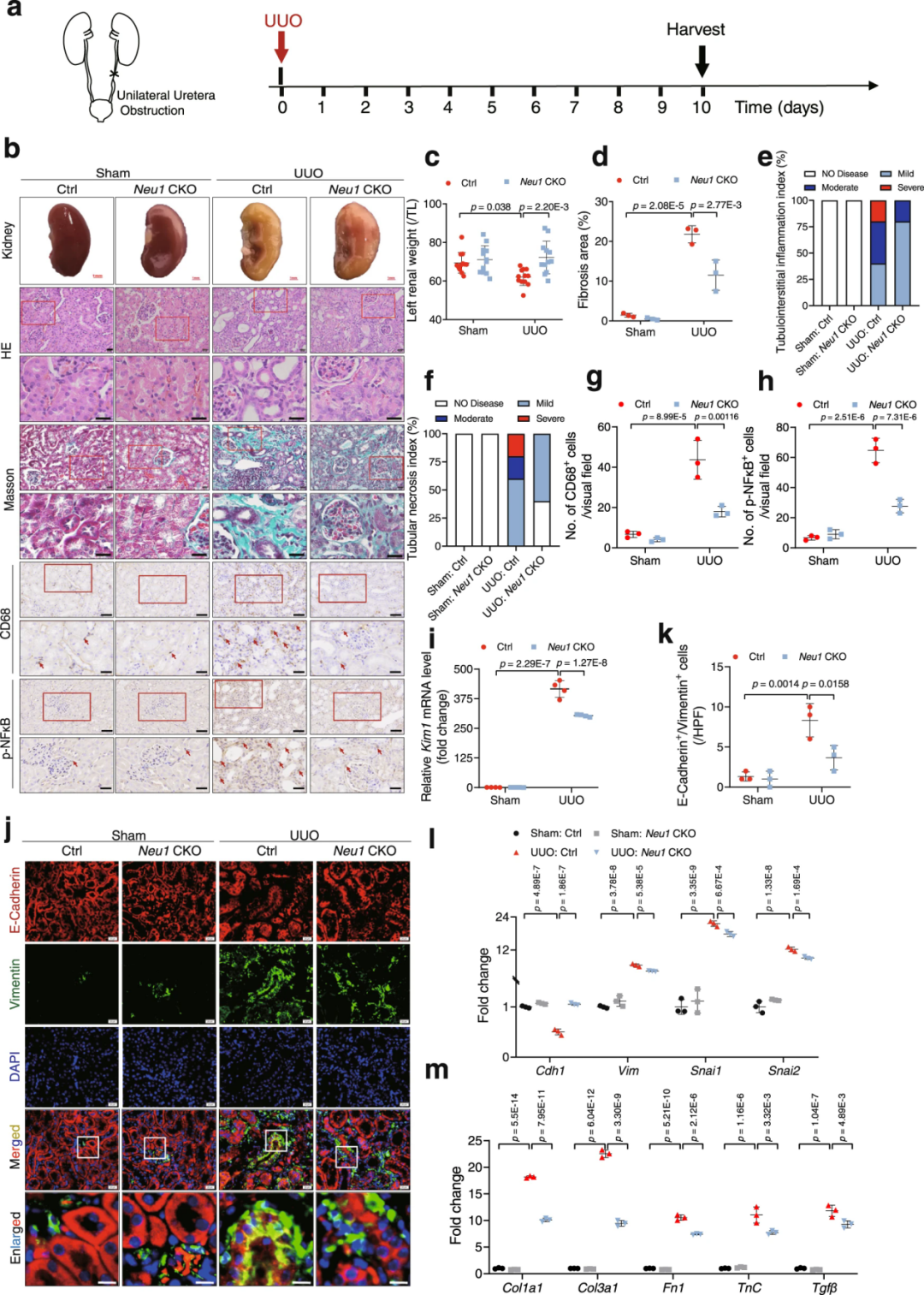
3、TEC特异性NEU1缺失抑制小鼠肾纤维化
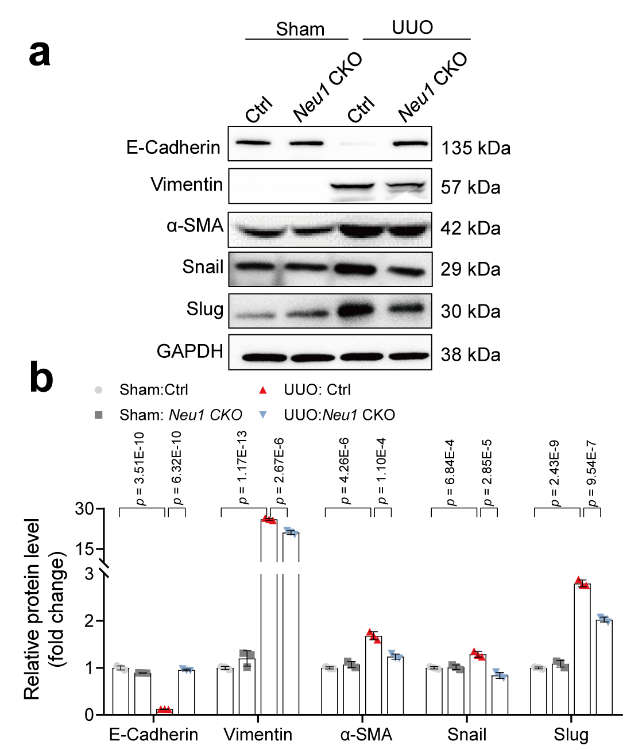
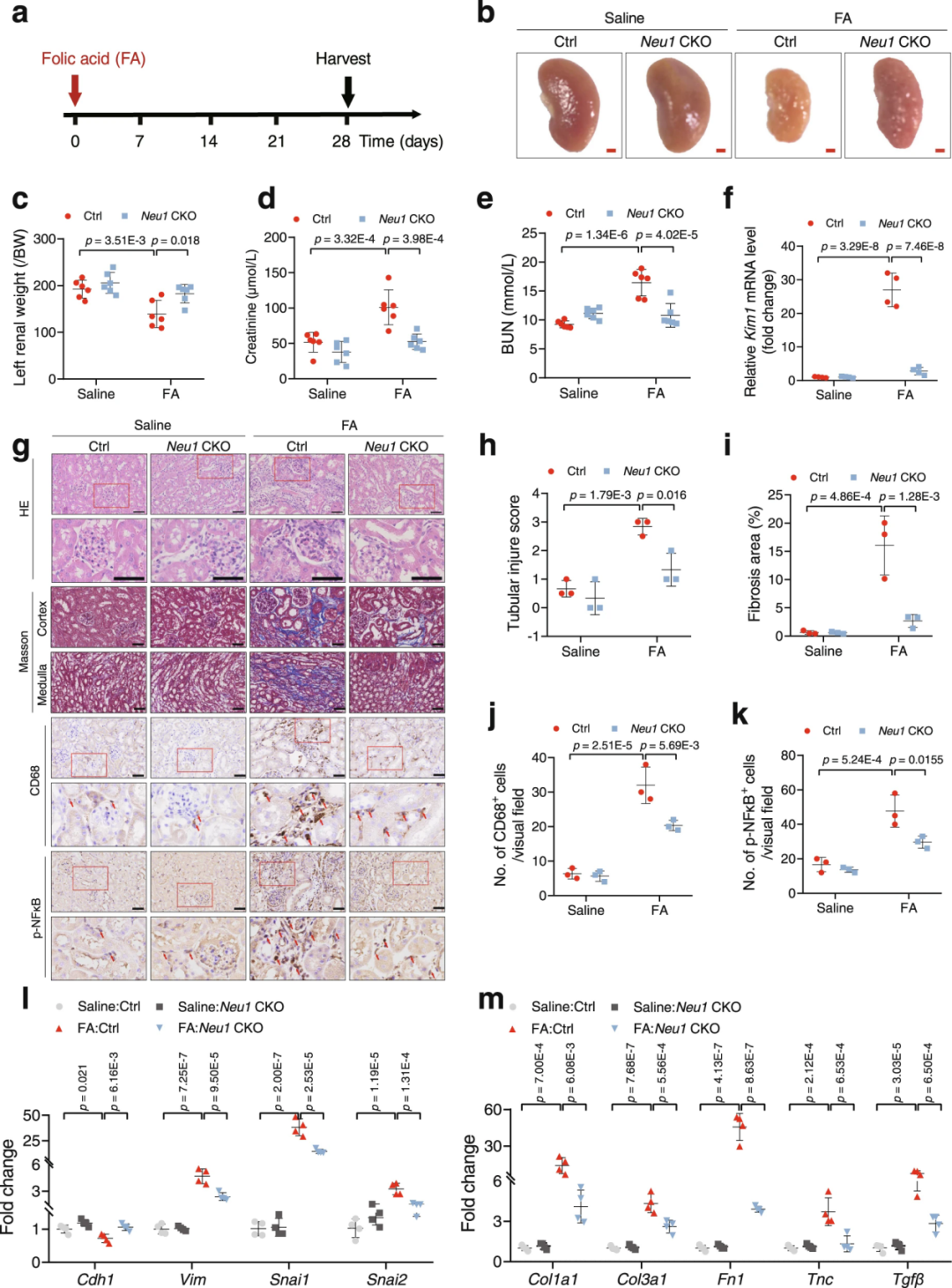
为探讨NEU1在肾纤维化中的作用,作者利用Cre/loxP依赖的条件性基因靶向方法构建了TEC特异性Neu1缺失的小鼠(Neu1 CKO小鼠即Neu1条件性敲除小鼠)。研究人员在小鼠UUO后10 d采集肾脏予以分析。结果显示,UUO组Neu1基因敲除显著改善了肾脏形态学特征,减少了胶原沉积,抑制了炎症损伤[肾小管坏死和肾小管间质炎症减轻;巨噬细胞(CD68标记)浸润减少]。此外,NEU1缺失显著降低了UUO诱导的Kim1(肾损伤标志物)表达。免疫荧光显示,UUO诱导了部分EMT,表现为基底膜残留TEC以及上皮细胞标志物上皮钙黏蛋白(E-Cadherin,由Cdh1编码)和间充质细胞标志物波形蛋白(Vimentin)的共表达。而这种EMT进程被Neu1敲除所抑制。与此一致,Neu1 CKO小鼠肾脏中E-Cadherin的mRNA和蛋白表达显著恢复,而EMT指标Snail蛋白、Slug蛋白(由Snai2编码)、α-SMA和波形蛋白表达显著下调。进一步的RT-qPCR实验证实,Neu1敲除显著抑制了UUO诱导的炎症因子(IL-1β、IL-6、IL-18等)、促纤维化因子(Col1a1、Col3a1、纤连蛋白1/Fn1、TGFβ1等)表达。
研究人员同样在另一肾纤维化模型中进行实验。FA注射后4 w采集肾脏予以分析,结果表明,Neu1 CKO小鼠也显示出显著改善的肾脏形态。与同窝对照(Neu1fl/fl )相比,Neu1 CKO小鼠的肾功能相关指标(肌酐和血尿素氮)显著改善。Neu1敲除显著抑制了FA诱导的Kim1表达。HE和Masson染色表明,Neu1 CKO小鼠的肾脏表现出更轻的肾小管损伤和间质纤维化。此外,由于TEC中NEU1缺失,巨噬细胞浸润,EMT标志物、促炎细胞因子、促纤维化因子表达均出现显著逆转。
4、Neu1过表达加剧UUO诱导小鼠肾纤维化
除了功能丧失研究外,研究人员还采用了功能获得方法,即使用编码NEU1的9型腺相关病毒(AAV9-NEU1)和对照(AAV9-Ctrl)。将病毒原位注射到小鼠肾皮质中。注射病毒5 w后小鼠实施UUO,10 d后采集肾脏予以分析。结果显示,AAV注射5 w后肾脏中NEU1的mRNA、蛋白表达显著增加。正如预期的那样,Neu1过表达加剧了UUO诱导的肾脏萎缩、肾小管扩张以及肾脏皮质和髓质中的胶原沉积。RT-qPCR、免疫组织化学表明,Neu1过表达增强了UUO诱导的肾脏中Kim1、促炎细胞因子与促纤维化因子表达,并促进了肾脏中巨噬细胞浸润与EMT进程。
5、丹酚酸B靶向NEU1保护肾脏
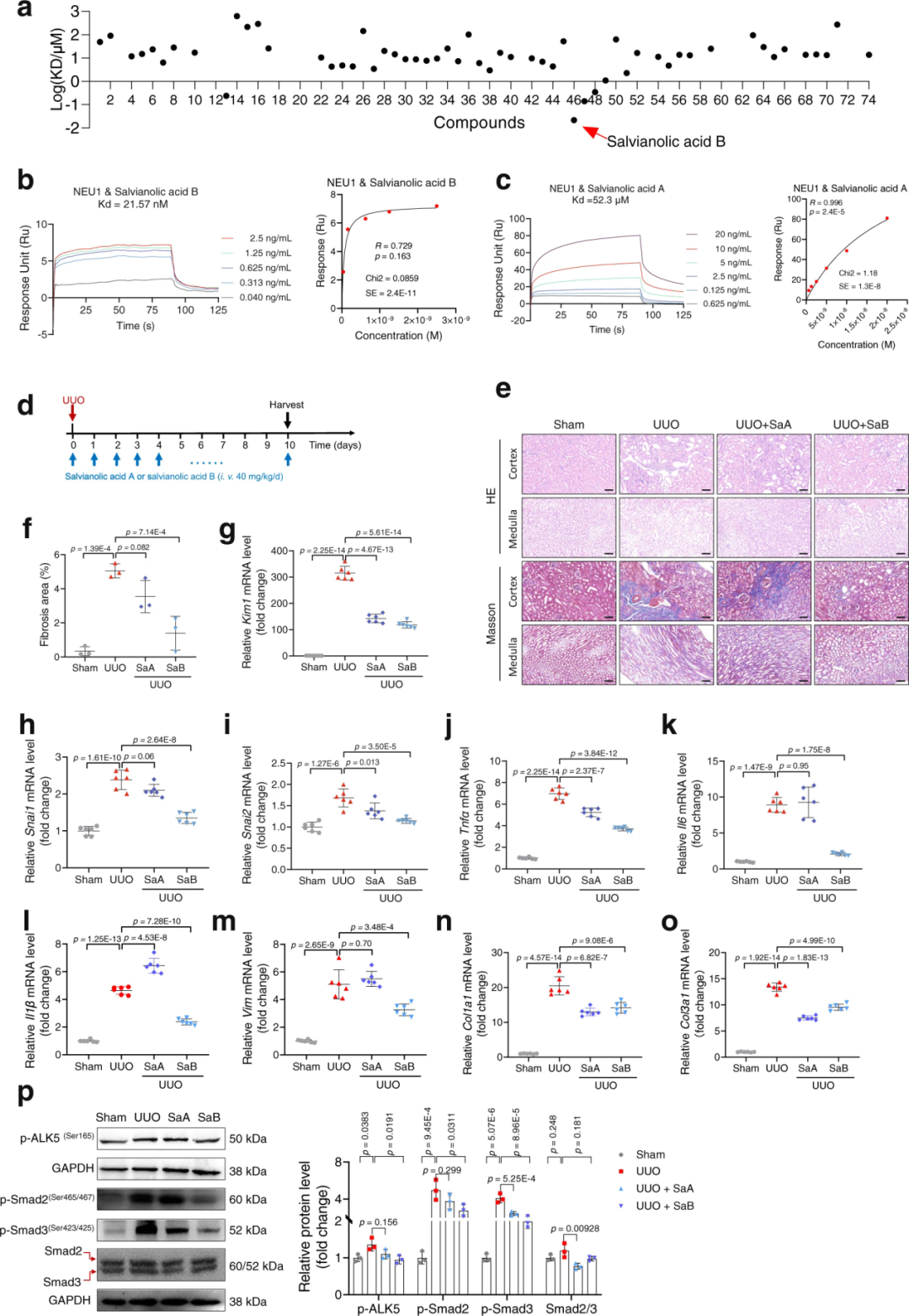
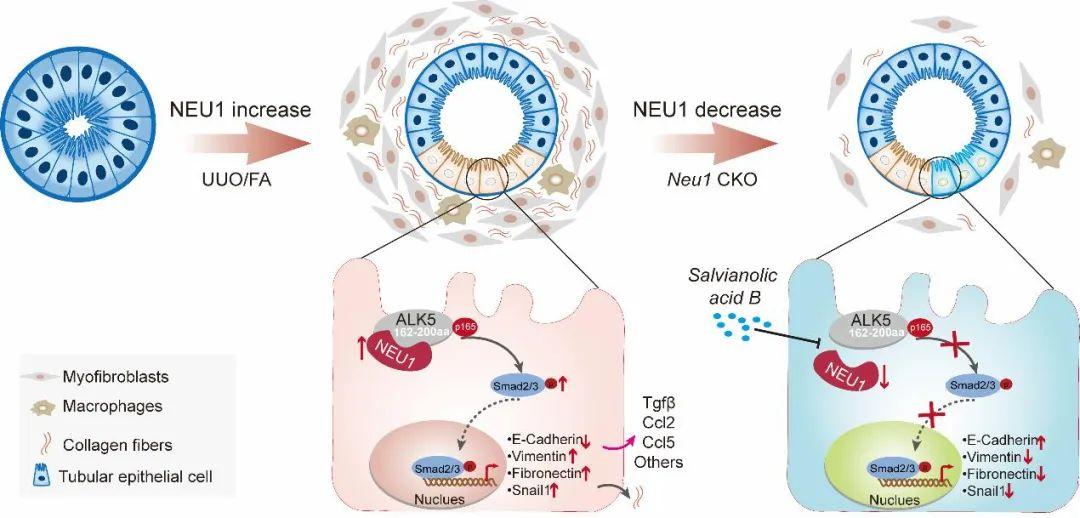
为解析NEU1促进肾纤维化的潜在机制,作者进一步研究发现NEU1与转化生长因子βI型受体ALK5发生相互作用,ALK5蛋白的160-200个氨基酸区域是NEU1的结合域。接下来,为研究NEU1-ALK5相互作用对ALK5的影响,研究人员发现NEU1与ALK5的相互作用使ALK5稳定;二者相互作用取决于ALK5的磷酸化状态;NEU1以ALK5依赖的方式促进肾纤维化。此外,由于ALK5能够使它的底物——SMAD家族磷酸化。研究者最终发现NEU1与ALK5氨基酸160-200区域相互作用,并随后增强ALK5-SMAD2/3信号通路,进而促进肾纤维化。
为鉴定靶向哺乳动物NEU1的候选化合物,研究者采用表面等离子共振(SPR)技术筛选了从药用植物中获得的74种天然产物与重组人NEU1蛋白的结合亲和力。进一步实验证明来自丹参的丹酚酸B显著抑制NEU1与ALK5之间的相互作用,TGFβ诱导的ALK5-SMAD2/3信号通路激活也被丹酚酸B阻断。
随后,研究人员探究了丹酚酸B在小鼠模型中对肾脏损伤的保护作用。H&E和Masson染色数据表明,丹酚酸B(40 mg/kg,尾静脉注射)显著减轻UUO诱导的肾脏损伤和肾纤维化。丹酚酸B处理显著抑制Kim1、Snai1和Snai2的表达及促炎细胞因子产生,减少胶原沉积。与之相符的是,丹酚酸B抑制ALK5及下游SMAD2/3的磷酸化。
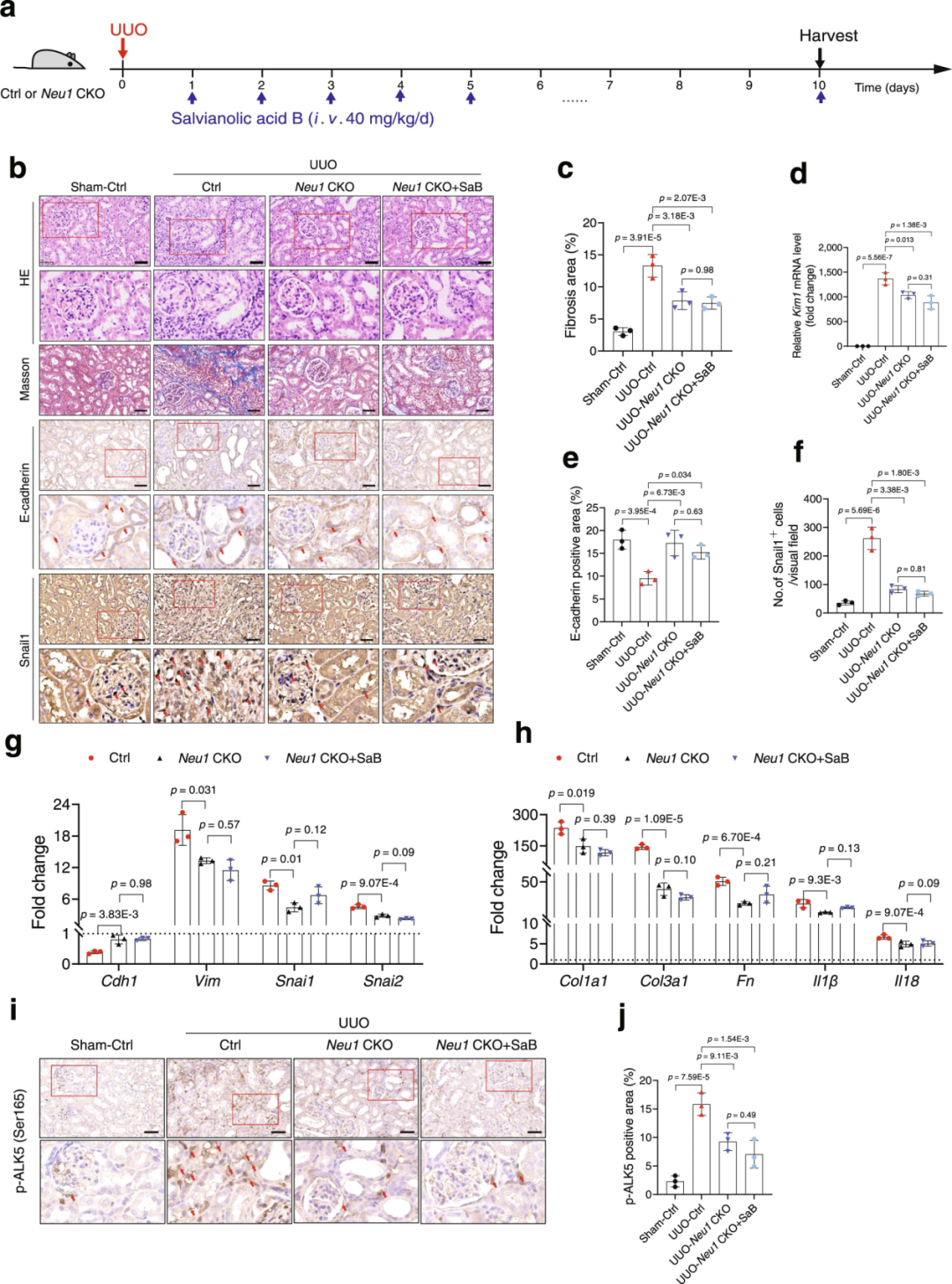
为测试NEU1是否介导丹酚酸B的保护作用,研究人员选用Neu1 CKO小鼠。肾脏组织切片的HE和Masson染色证实,丹酚酸B处理未能进一步减轻UUO刺激引起的肾脏损伤和肾纤维化。与此一致的是,丹酚酸B处理未能进一步抑制UUO诱导的Kim1表达、EMT、炎症因子升高和胶原产生;未能进一步增强对ALK5磷酸化的抑制作用。这些数据表明,NEU1是丹酚酸B发挥肾脏保护作用所必需的。
图6. 丹酚酸B靶向NEU1减轻UUO诱导肾纤维化
结论
本研究发现NEU1是诱发CKD的关键因子,并通过靶向NEU1途径为CKD的临床治疗和药物研发开拓了新方向,同时也为丹参防治肾损伤的临床应用提供了依据。
本研究得到了国家自然科学基金项目(项目批准号:81930107、81825023、82174013、82200292)、江苏省自然科学基金项目等支持。
通讯作者介绍:
齐炼文,中国药科大学中药学院生药学系教授、博士生导师,国家杰出青年基金学者。现任中国药科大学副校长、临床代谢组学中心主任。入选国家杰青、中组部“万人计划”、中国青年科技奖等。从事“心肾代谢性疾病靶标发现与中药干预”研究。主持国家自然科学基金重点项目、重大研究计划、国家重点研发计划、国家重大新药创制等,以通讯作者在Circulation、J Am Coll Cardiol、Eur Hear J、Gastroenterology、Nat Commun等发表论文100余篇;论文共被引用10000次,H指数为60,入围全球前2%终身影响力学者;获中国发明专利授权20件、美国专利授权2件,部分实现转化。研发临床试验药物1个、中药候选新药1个。
张蕾,中国药科大学中药学院生药学系特聘研究员,博士生导师,兴药青创学者,国家高层次人才计划青年项目入选者,江苏省优秀青年基金获得者(2021年),入选江苏省333高层次人才培养工程第三层次。研究方向为心血管病靶标发现与药物干预。以第一作者或通讯作者在Eur Heart J,Circulation,Nature Commuications,Oncogene,Br J Pharmacol等杂志发表多篇论文。近年来一直聚焦新靶点NEU1,采用药理学、分子生物学等方法,研究NEU1在心血管病发生发展中的作用及机制,并以NEU1为可干预靶点,筛选有效药物。
本文使用的病毒产品列表如下:


了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK