2025-03-10 阅读量:5238
简介
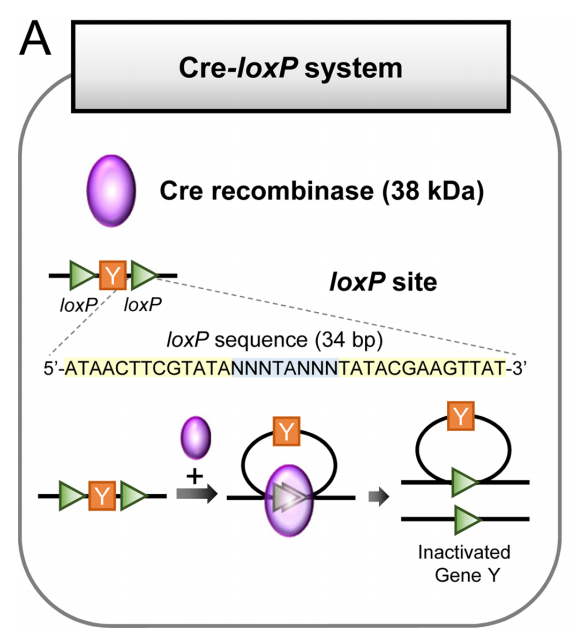
Cre-LoxP系统是一种基于位点特异性重组的基因编辑技术,由Cre重组酶和LoxP位点两部分组成。Cre(Cyclization recombination enzyme)是一种由噬菌体P1产生的38 kDa DNA重组酶,由343个氨基酸组成。它能够特异性识别LoxP位点的特定DNA序列,并介导两个LoxP位点之间DNA序列的重组。LoxP位点是一个34 bp的序列,包含两个13 bp的反向回文序列和一个8 bp的中间间隔序列。LoxP位点的反向回文序列是Cre重组酶的特异性结合位点,间隔区域决定了LoxP位点的特异性,两个LoxP位点之间的相对方向决定了重组的类型。
Cre-LoxP系统的核心优势在于其高效性和特异性。它能够在活体动物中实现基因的定点敲除、插入、翻转和易位等操作。自20世纪80年代末首次被描述以来,Cre-LoxP系统已被广泛应用于基因功能研究、疾病模型构建以及神经科学研究等领域。
Cre-LoxP系统(Kim, Hyeonhui et al., Laboratory animal research, 2018.)
基本原理
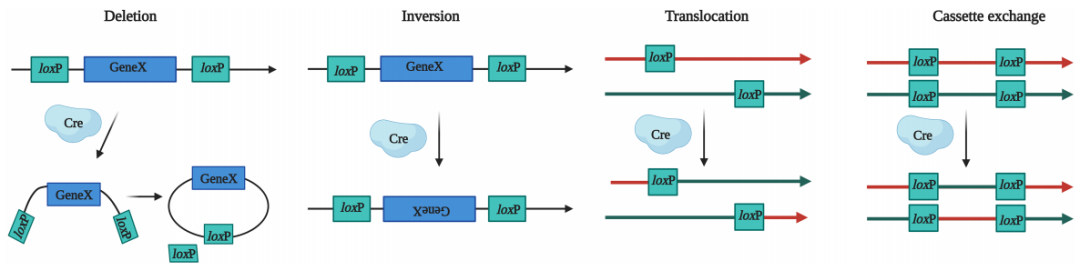
当基因中存在LoxP位点且有Cre重组酶存在时,Cre重组酶会特异性识别LoxP位点两端的反向重复序列,并与之结合形成二聚体。此二聚体与其他LoxP位点的二聚体结合,进而形成四聚体。随后,LoxP位点之间的DNA序列被Cre重组酶切割,产生DNA断裂。最终,断裂的DNA末端通过DNA连接酶的作用重新连接,完成重组过程。根据LoxP位点的方向和位置,Cre酶可以介导以下几种基因操作:
删除:当两个LoxP位点位于同一DNA片段的两端且方向相同时,Cre酶可以切除这两个位点之间的DNA片段。
翻转:当两个LoxP位点位于同一DNA片段的两端且方向相反时,Cre酶可以介导两个LoxP位点之间的序列发生翻转。
易位:当两个LoxP位点分别位于不同的DNA链或染色体上时,Cre酶会诱导两条DNA链或染色体发生易位。
交换:如果四个LoxP位点分别位于两条不同的DNA链或染色体上,Cre酶能诱导LoxP间的序列互换。
常见的Cre-LoxP系统
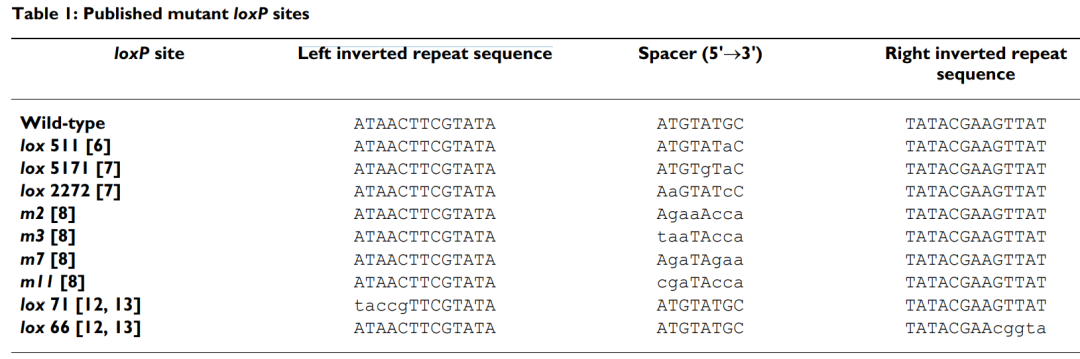
自Cre-LoxP系统被发现以来,科学家们对其进行了多项优化和改良,开发出多种突变版本,以提升其在不同生物体和条件下的应用效率和特异性。通过对LoxP位点序列的改造,产生了如Lox2272、Lox511、Lox5171、LoxN等变体,这些变体不仅在不同生物体中表现出更高的识别和切割效率,还能通过组合使用,实现更复杂的基因重组。
1.LSL系统
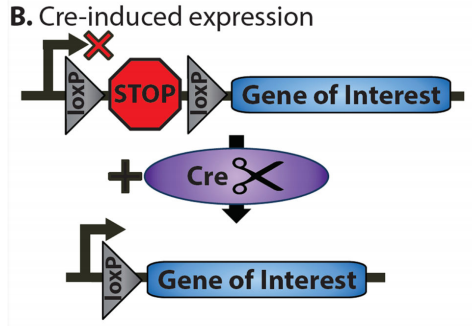
LSL(LoxP-Stop-LoxP)系统是一种基于Cre-LoxP系统的条件性基因表达工具,其核心设计是在目标基因上游插入一个由LoxP位点包围的终止盒(Stop Cassette)LoxP-Stop-LoxP,当Cre重组酶存在时,LoxP位点之间的DNA序列(包括终止盒)被切除,从而解除对目标基因的转录阻断,使其在特定启动子的驱动下表达。
LSL系统(Navabpour, Shaghayegh et al., Neuroscience and biobehavioral reviews, 2019.)
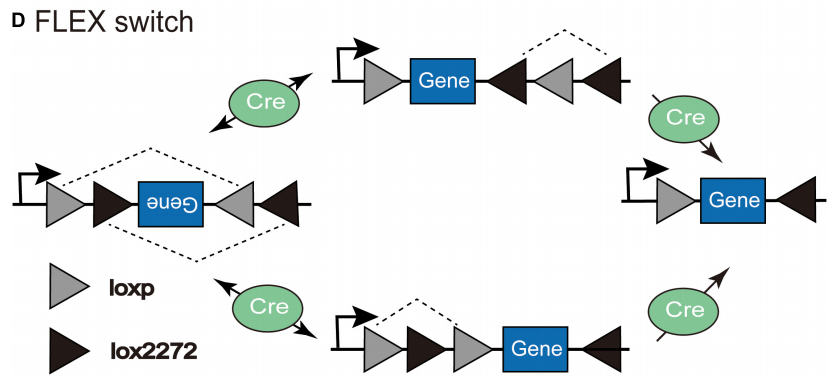
2.FLEX系统
FLEX(Flip-Excision)系统或称为翻转-切除系统,该系统通过在目标基因两侧设计两对不同方向或类型的LoxP位点,使得Cre重组酶介导的两次连续重组事件可先翻转基因片段方向再切除特定序列。相较于传统Cre-LoxP的单次重组功能,FLEX系统通过巧妙的位点排列实现了基因表达的双向调控。
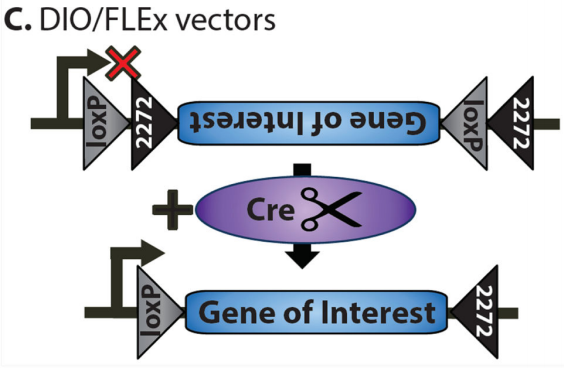
3.DIO系统
DIO(Double-Floxed Inverted Orientation)系统是基于FLEX系统的优化版本。在DIO系统中,目标基因的开放阅读框(ORF)被设计为反向排列,并被LoxP和Lox2272位点分别包围在两侧。由于目标基因的方向与启动子不一致,因此在初始状态下无法表达。当Cre重组酶存在时,Cre酶会特异性识别并结合LoxP和Lox2272位点,并介导这两个位点之间的DNA序列发生重组。这一过程导致目标基因的方向被翻转,使其与启动子方向一致,从而激活基因表达。由于LoxP和Lox2272位点互不兼容,重组后的基因无法再次翻转,从而实现了稳定的基因表达。
4.DO系统
在DO(Double-Floxed Orientation)系统中,目标基因的开放阅读框被设计为正向排列,其两侧分别由LoxP和Lox2272位点包围。在没有Cre重组酶的情况下,目标基因能够正常表达。然而,当Cre重组酶存在时,Cre酶会识别并结合LoxP或Lox2272位点,介导目标基因的方向发生翻转,使其与启动子方向不一致,从而抑制基因表达。由于LoxP和Lox2272位点互不兼容,重组后的基因无法再次翻转,实现了稳定的基因抑制。
病毒载体与Cre-LoxP系统的结合应用及案例
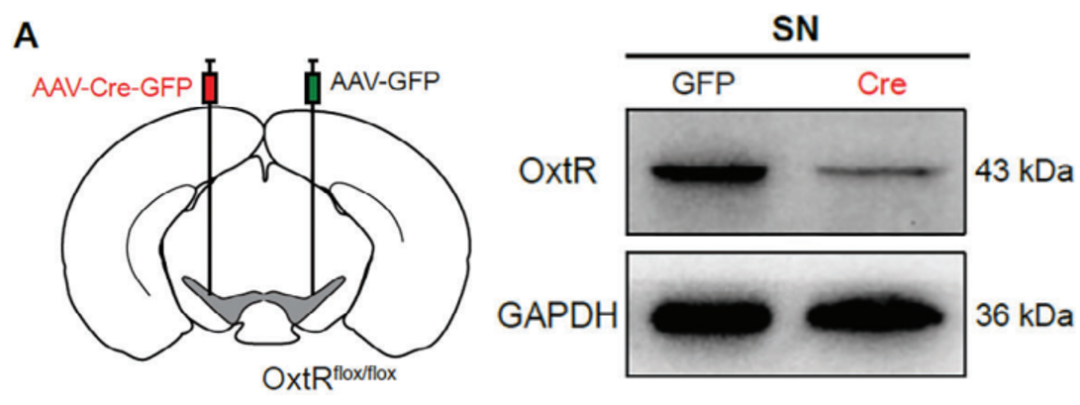
1、利用病毒载体外源性表达Cre重组酶,结合转基因小鼠中的LoxP位点,实现对目标基因的特异性敲除。
研究人员在转基因小鼠Oxtrflox/flox[催产素受体(OxtR)基因的特定外显子两侧被插入了同向的LoxP位点]一侧SN注射病毒AAV-Cre-GFP,另一侧SN注射对照病毒AAV-GFP,通过Cre-LoxP系统实现单侧SN特异性敲除Oxtr的目的。在病毒注射后30天,通过蛋白质免疫印迹实验验证了敲除效率。
客户文章(IF=14.3):Wang, Yurong et al. “Oxytocin Protects Nigrostriatal Dopamine Signal via Activating GABAergic Circuit in the MPTP-Induced Parkinson's Disease Model.” Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 11,36 (2024): e2310244. doi:10.1002/advs.202310244
使用我司病毒:AAV2/9-hSyn-Cre-EGFP-WPRE-PA
2、通过病毒载体外源性表达含LoxP位点的目标序列,结合Cre工具鼠,实现对目标序列的特异性表达调控从而介导过表达、干扰、环路示踪、光遗传学、化学遗传学、钙成像等调控及检测功能。
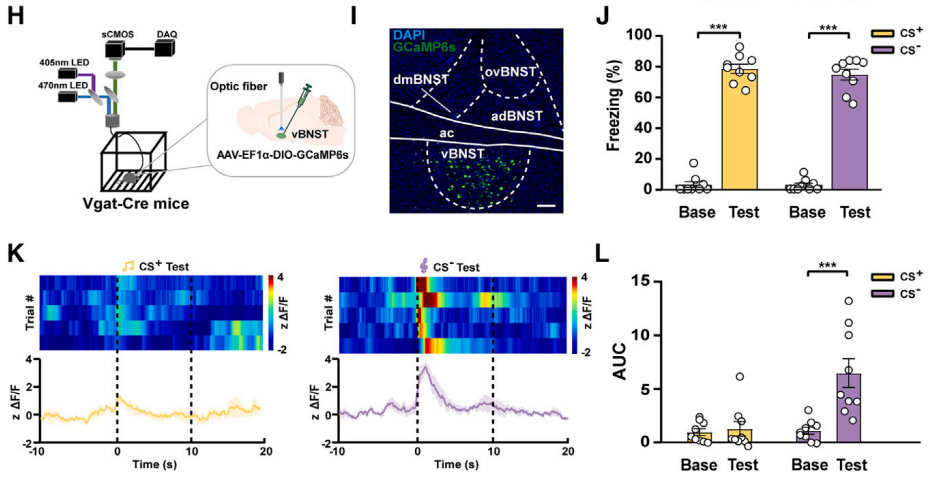
研究人员将AAV-DIO-GCaMp6s注射到Vgat-Cre小鼠(Vgat神经元中特异性表达Cre的小鼠)的vBNST脑区,借助DIO系统(Cre-on)在vBNST中的Vgat神经元中特异性表达钙离子指示剂GCaMp6s,从而检测钙离子波动。结果表明,在不可预测威胁(CS-)实验中,vBNST中Vgat神经元的Ca2+信号显著升高,而在可预测威胁(CS+)实验中则没有。
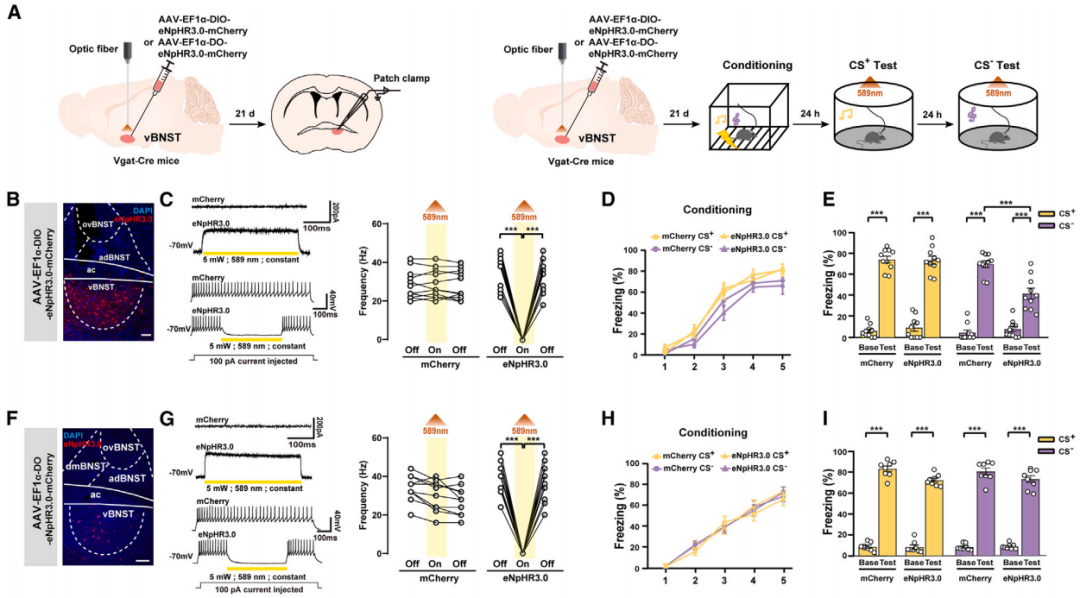
研究人员将AAV-EF1a-DIO-eNpHR3.0-EYFP或AAV-EF1a-DO-eNpHR3.0-EYFP注射到Vgat-Cre小鼠的vBNST中,借助DIO系统(Cre-on)或DO系统(Cre-off)分别在GABA能神经元或非GABA能神经元中表达光抑制型光敏蛋白eNpHR3.0。结果表明,光遗传学抑制vBNST中的GABA能神经元,小鼠响应CS-的僵直行为减少,而响应CS+的僵直行为无明显差异;抑制vBNST中的非GABA能神经元对小鼠在CS+或CS-条件下的响应均没有影响。
客户文章(IF=7.5):Teng, Shuai-Wen et al. “Coordinated excitatory and inhibitory circuits governing unpredictable threat-induced anxiety.” Cell reports vol. 44,1 (2025): 115146. doi:10.1016/j.celrep.2024.115146
使用我司病毒:
rAAV2/9-EF1a-DIO-GCaMp6s-WPRE-hGH polyA
rAAV2/9-EF1a-DIO-eNpHR3.0-mCherry-WPRE-hGH polyA
rAAV2/9-hSyn-DO-eNpHR3.0-EGFP-WPRE-hGH polyA
3、通过病毒载体外源性表达Cre重组酶和含LoxP位点的目标序列,实现对目标序列的特异性表达调控从而介导过表达、干扰、环路示踪、光遗传学、化学遗传学、钙成像等调控及检测功能。
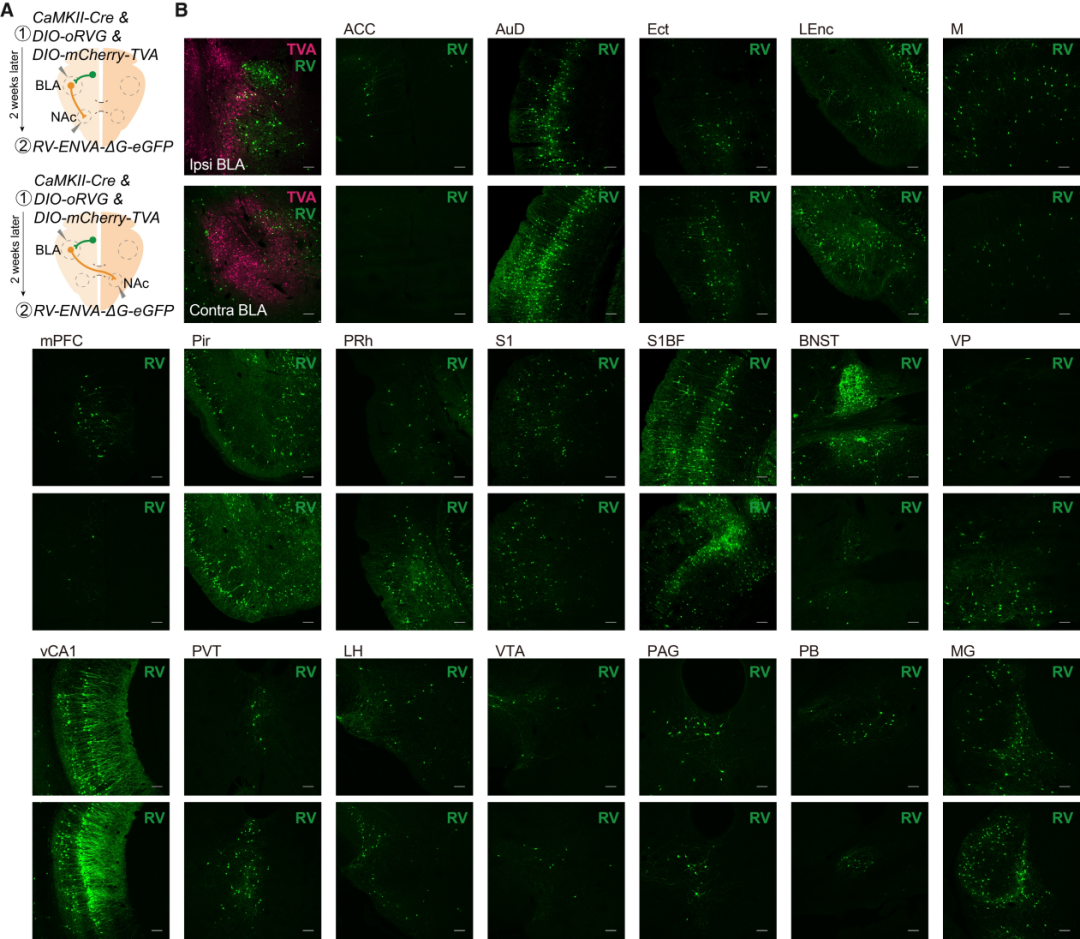
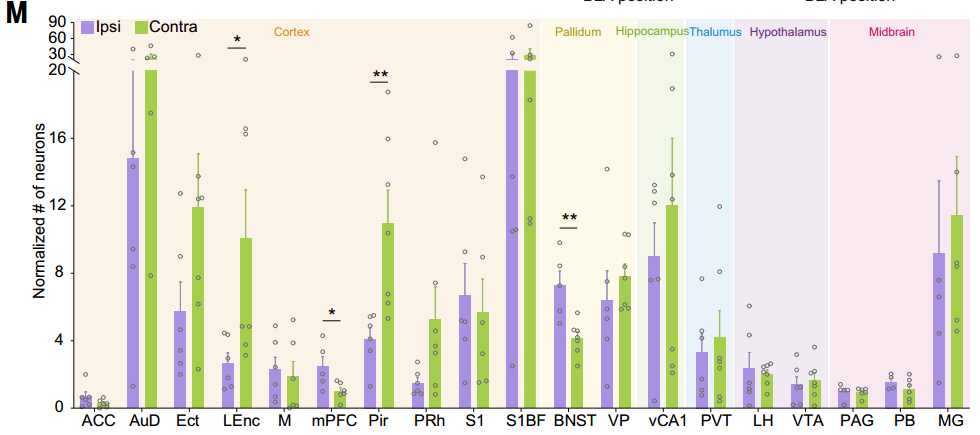
研究人员将病毒AAV-EF1a-DIO-mCherry-F2A-TVA、AAV-EF1a-DIO-RVG和兴奋性神经元启动子CaMKIIa驱动的AAV-CaMKIIa-Cre混合单侧注射到BLA中。两周后,将RV-ENVA-ΔG-eGFP注射到同侧或对侧NAc中。基于DIO系统(Cre-on)的狂犬病毒逆行跨单突触示踪显示,投射至同侧NAc的BLA神经元主要接收来自BNST和mPFC的输入,而投射至对侧NAc的BLA神经元则主要接收来自LEnc和Pir的输入。
客户文章(IF=44.7):Tian, Zhen et al. “The interhemispheric amygdala-accumbens circuit encodes negative valence in mice.” Science (New York, N.Y.) vol. 386,6722 (2024): eadp7520. doi:10.1126/science.adp7520
使用我司病毒:
RV-ENVA-ΔG-eGFP
AAV2/9-EF1a-DIO-RVG
AAV2/9-EF1a-D10-mcherry-F2A-TVA
AAV2/9-CaMKlla-Cre
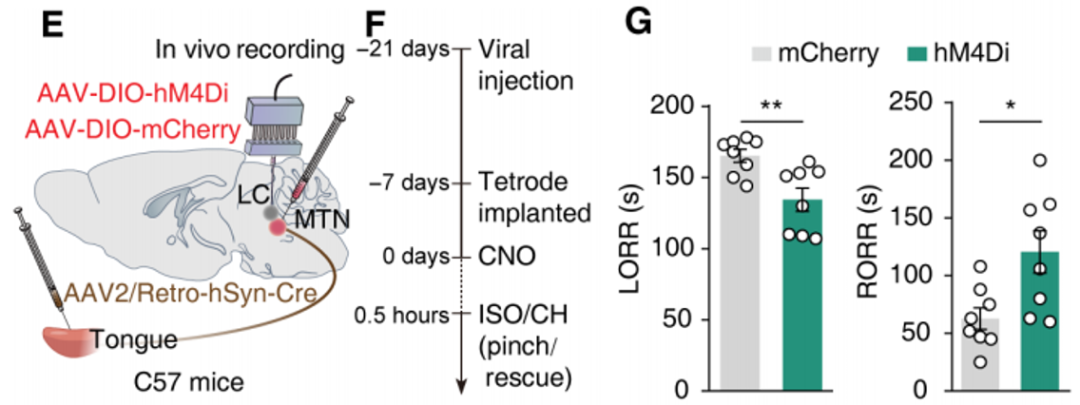
研究人员将逆行病毒AAV2/Retro-hSyn-Cre注入到C57小鼠舌头中,并将Cre依赖性病毒AAV-DIO-hM4D(Gi)-mCherry注射到小鼠双侧MTN脑区,借助DIO系统(Cre-on)特异性在舌投射的MTN神经元中表达化学遗传抑制受体hM4D(Gi)。实验结果表明,与表达mCherry的对照组相比,化学遗传学抑制舌投射的MTN神经元显著降低了麻醉小鼠的翻正反射消失(LORR)时间,同时显著增加了翻正反射恢复(RORR)时间。
客户文章(IF=11.7):Cao, Peng et al. “Rescue-like behavior in a bystander mouse toward anesthetized conspecifics promotes arousal via a tongue-brain connection.” Science advances vol. 11,4 (2025): eadq3874. doi:10.1126/sciadv.adq3874
使用我司病毒:
rAAV2/Retro-hSyn-Cre-WPRE-hGH pA
rAAV2/9-DIO-hM4D(Gi)-mCherry
rAAV2/9-EFla-DIO-mCherry-WPRE-hGH pA
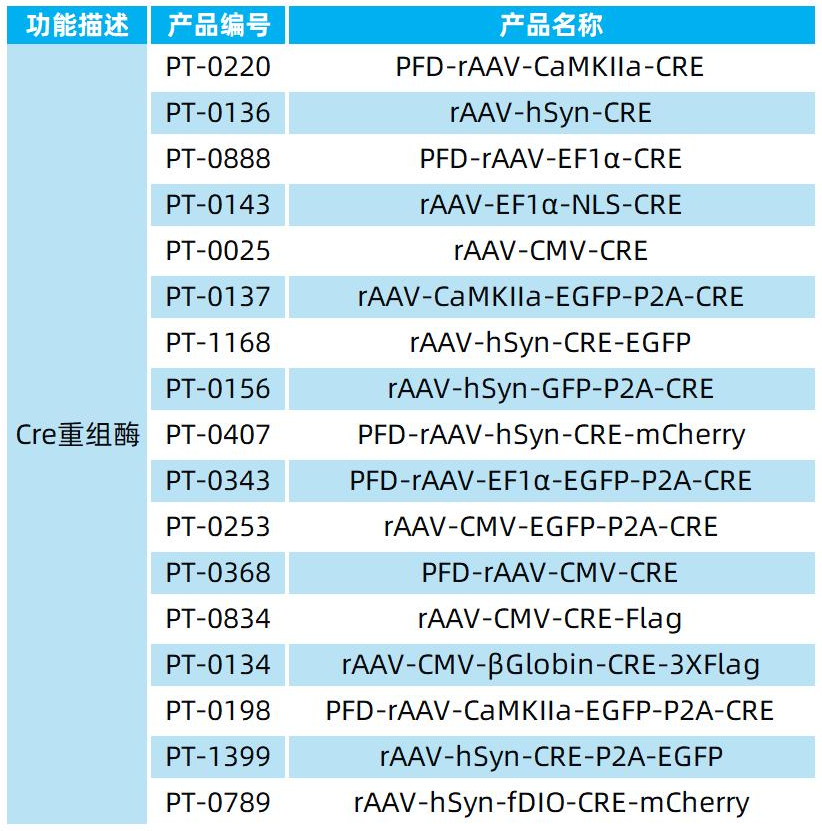
我司提供的部分Cre重组酶病毒列表如下:
另外我司提供多种Cre-LoxP系统病毒工具,涵盖DIO、DO、FLEX等系统,支持基因干扰、过表达、神经示踪、光遗传学、化学遗传学及钙成像等多种调控及检测功能。

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK