2025-03-10 阅读量:1953
小胶质细胞是中枢神经系统(CNS)的免疫细胞,在维持脑内稳态、清除病理蛋白、调控神经炎症、神经损伤及退行性疾病等方面发挥关键作用。小胶质细胞可作为吞噬细胞并分泌促炎或抗炎介质来调节CNS的退行性变化、修复和再生。对小胶质细胞的遗传操作有助于了解它们的功能,并为开发治疗CNS疾病的新方法提供潜力。然而,由于传统病毒工具(如慢病毒、腺相关病毒)难以高效靶向小胶质细胞,其功能研究和临床转化长期受限。
近期,德克萨斯大学西南医学中心张春立教授团队在《iScience》期刊发表了一项研究成果,作者开发了基于人IBA1启动子的截短启动子(hIBA1a),并用AAV载体包装,成功实现小胶质细胞的高效精准靶向。该靶向策略对静息态与激活态小胶质细胞均适用。研究者进一步结合miR124T(miR124靶向序列,神经元抑制元件),海马中远离注射位点区域高达98%的转导细胞被鉴定为小胶质细胞。这种简单且高度特异性的小胶质细胞靶向策略有望在研究与治疗方面进一步优化。
实验设计流程图
1、慢病毒载体筛选
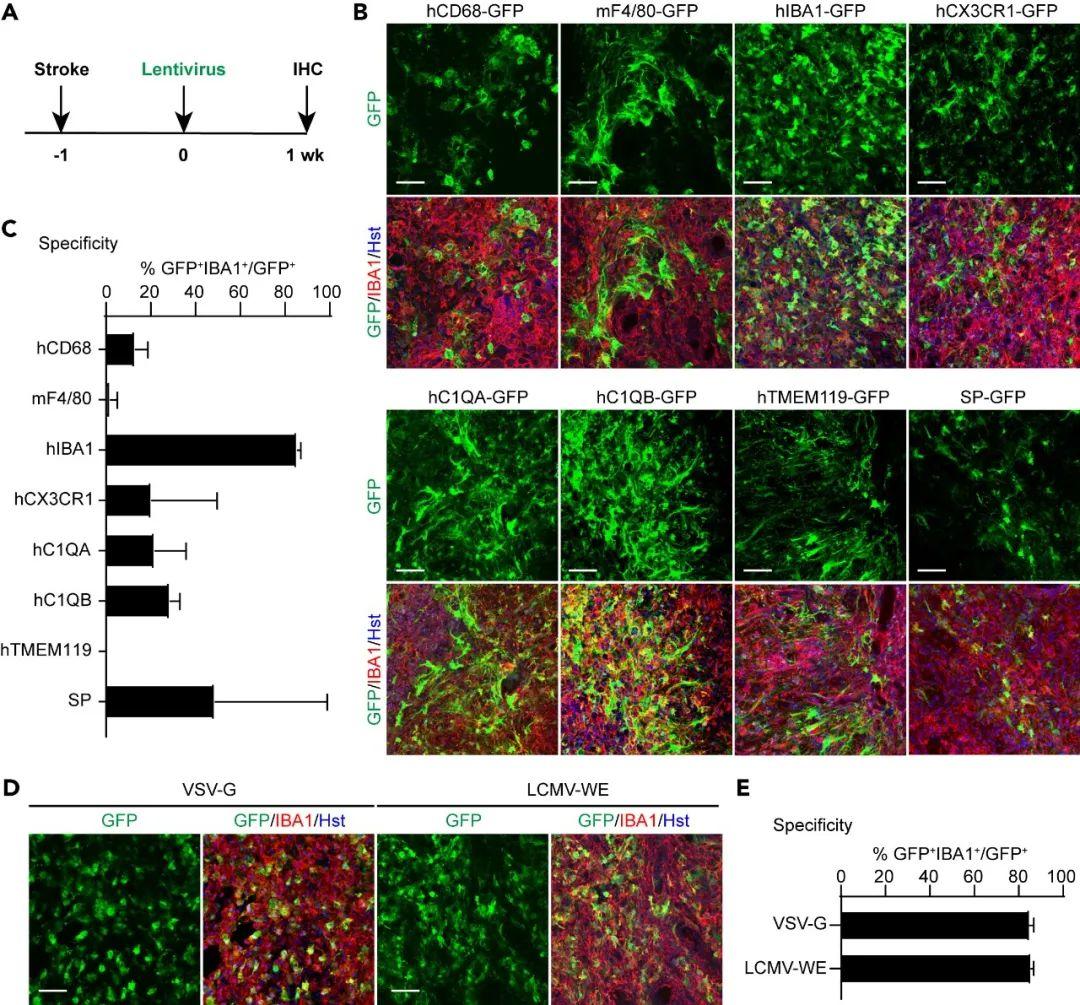
作者前期多次尝试均未能通过慢病毒有效转导小胶质细胞。因此,研究人员针对其它可能通过慢病毒驱动驻留小胶质细胞基因表达的启动子开展了体内筛选。研究重点聚焦于人源基因启动子,该类启动子进化保守,未来具有治疗转化潜力。研究者选用8种与小胶质细胞特定基因表达相关的启动子,包括hCD68、mF4/80、hIBA1等,并用这些启动子驱动GFP表达以检验慢病毒载体对小胶质细胞的靶向效果。由于激活态小胶质细胞在神经系统疾病中发挥重要作用,作者对小鼠实施MCAO(大脑中动脉闭塞)诱导脑卒中,1 w后将慢病毒注射到纹状体,病毒注射后1 w分析GFP及小胶质细胞标志物IBA1表达。结果显示,hIBA1启动子驱动的GFP在小胶质细胞中的表达特异性最高(85.64%)。此外,据报道,慢病毒的细胞特异性受到病毒包膜的影响。为验证这一可能性,作者比较了使用VSV-G或LCMV-WE包膜包装的hIBA1-GFP慢病毒表达效果。结果显示,病毒注射后1 w两种包膜包装慢病毒都表现出对小胶质细胞具有高靶向特异性(VSV-G组为84.96%;LCMV-WE组为85.64%)。
图1. 小胶质细胞靶向慢病毒的体内筛选
2、AAV载体筛选
慢病毒和腺相关病毒(AAV)载体广泛应用于体内的基因表达。鉴于AAV在基因治疗中的优势,此外,据报道相比于单链AAV(ssAAV),自互补AAV(scAAV)驱动更强的基因表达。于是,研究者进一步考察了scAAV载体。他们将hIBA1启动子置于8种不同AAV衣壳中,包括AAV1、AAV2、AAV5等,并将其注射到经L-NIO(L-亚胺基乙基鸟氨酸,一氧化氮合酶抑制剂)诱导脑卒中(与MCAO比较,产生更多稳定和局限的梗死灶)的小鼠纹状体中。结果显示,scAAV5和scAAV8衣壳在小胶质细胞中的转导特异性和效率最高,分别为93.68%和77.42%以及69.7%和82.11%。此外,这些载体在病毒注射后4 w仍能在小胶质细胞中维持较强的GFP表达。细胞类型特异性和转导效率与病毒注射后1 w时相当。
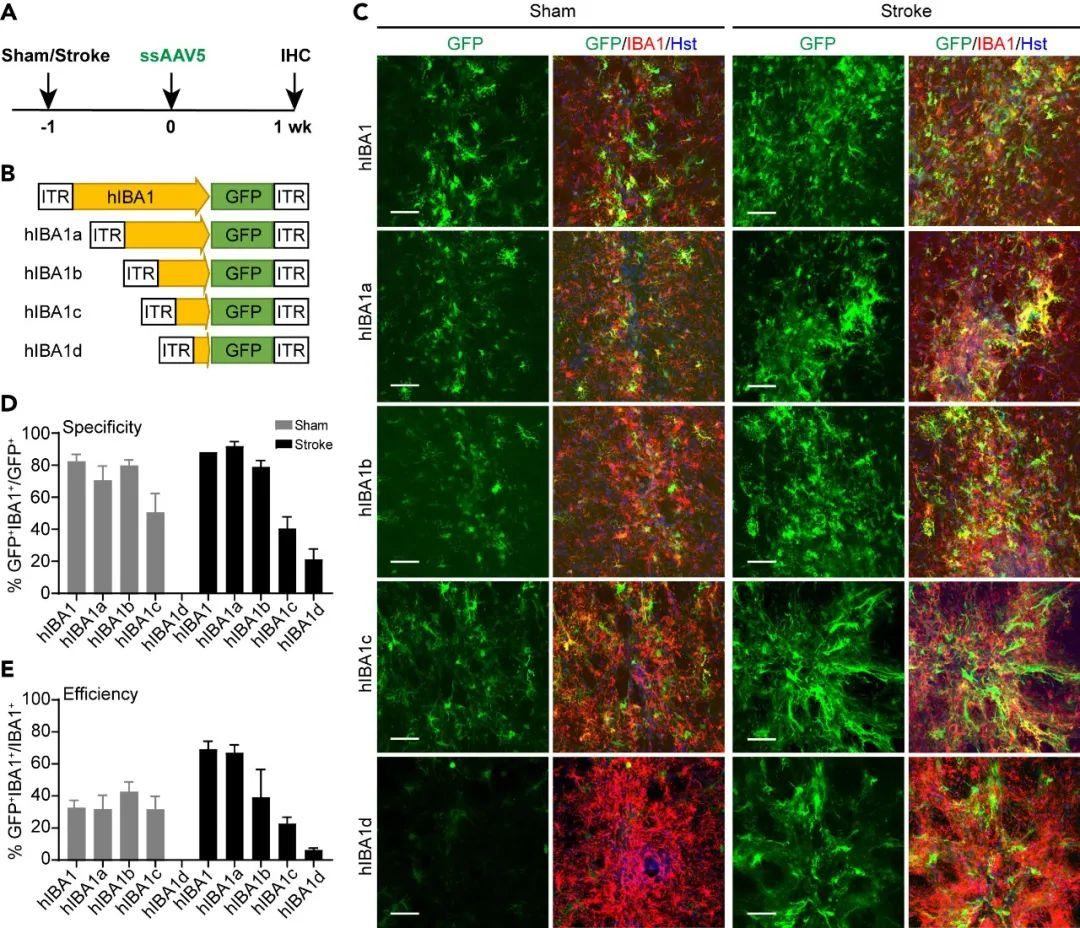
由于AAV载体的包装容量有限(ssAAV容量约为4.5 kb,scAAV容量更小),为增加外源基因片段长度,研究者对hIBA1启动子进行了逐步截短。ssAAV5载体结果表明,466 bp的hIBA1a启动子片段足以驱动小胶质细胞特异性表达,并具有与hIBA1启动子相似的表达模式,表现为较高的特异性和转导效率。此外,在有或无L-NIO诱导脑卒中条件下hIBA1a启动子片段的小胶质细胞特异性相当(Stroke组转导效率更高)。然而,在病毒注射后4 w进行检测时,所有病毒都表现出较低的小胶质细胞特异性和转导效率。表明了ssAAV病毒具有时间依赖性效应。
因此,研究者进一步选用scAAV以测试能否改善这一结果。作者构建了scAAV5-hIBA1a-GFP病毒载体,将其注射到小鼠纹状体中,同时考虑了L-NIO诱导的脑卒中情况,并在病毒注射后1 w、4 w分别检查基因表达。结果发现,在病毒注射后1 w的非损伤和损伤脑组织中均观察到小胶质细胞呈现强烈的GFP表达。病毒注射后4 w,小胶质细胞转导的效率和特异性不仅得以保持,反而略有提高,脑卒中条件下达到80%以上(特异性:87.62%;效率:88.74%)。这些结果表明,当采用scAAV载体包装时,可驱动转基因高度特异性的小胶质细胞表达。
图3. 小胶质细胞靶向截短启动子的体内筛选
3、miR124T的应用
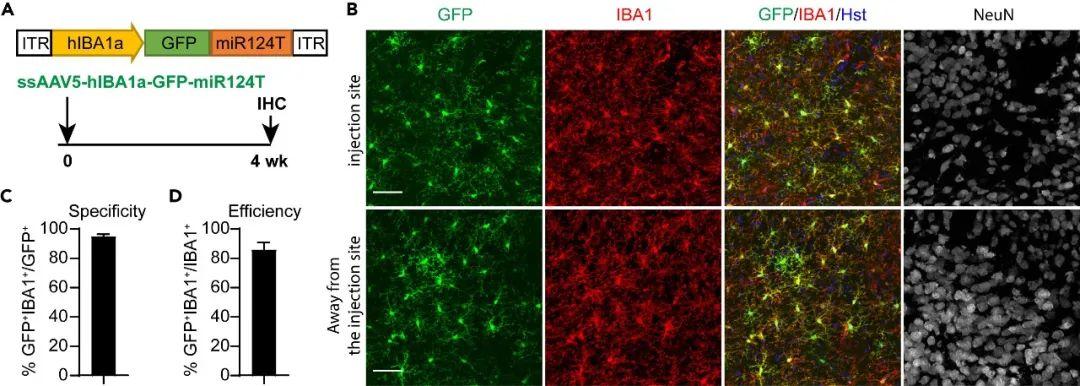
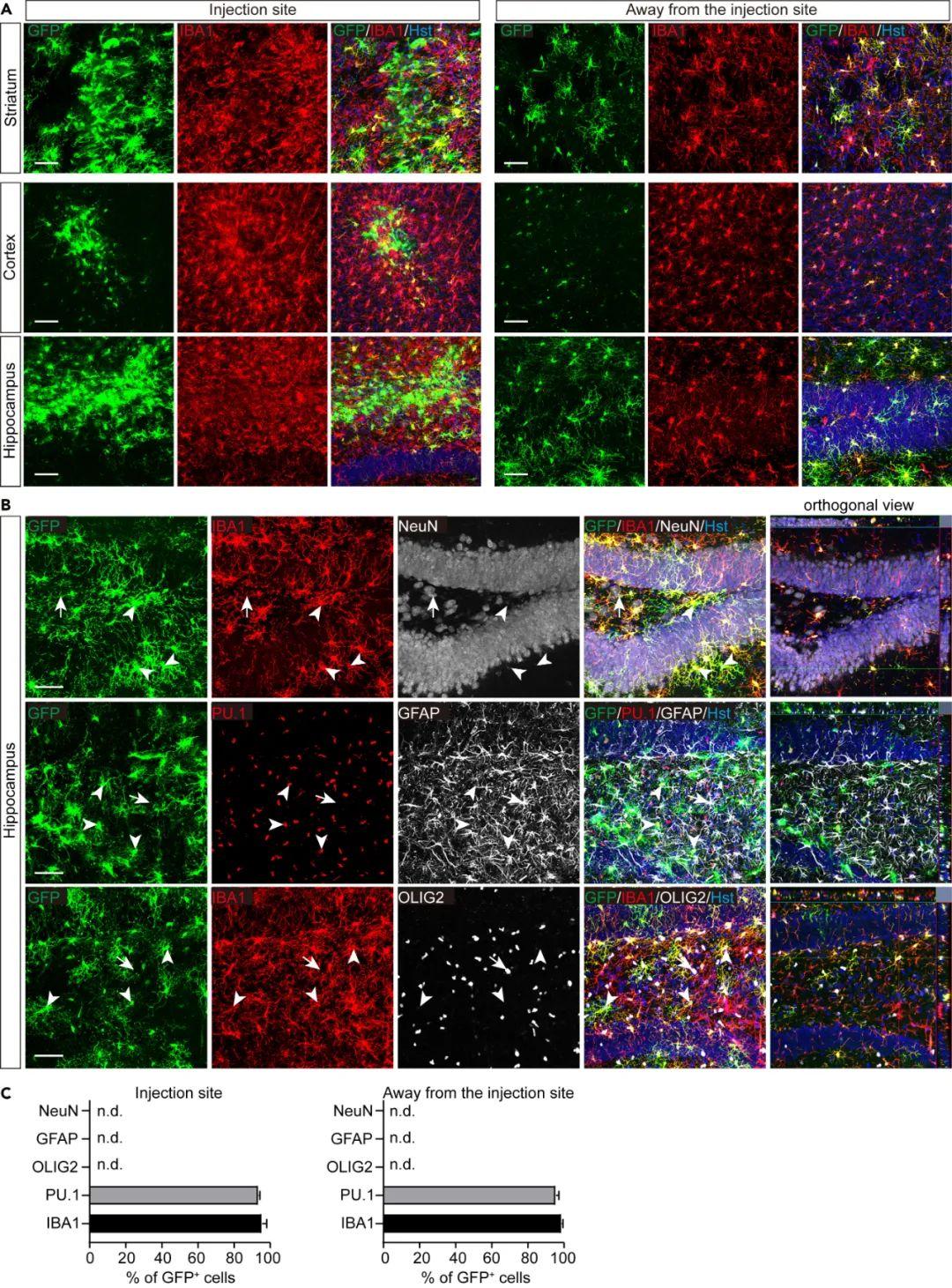
虽然scAAV可提高小胶质细胞的转导稳定性,但其有限包装容量对较大基因的递送构成限制。为在维持细胞特异性的同时提高包装能力,作者重新构建了携带hIBA1a启动子的新ssAAV载体。鉴于绝大多数GFP阳性非小胶质细胞为神经元,研究人员在转基因序列下游插入了含4拷贝miR124靶向序列(miR124T)的合成元件。miR124是一种在神经元中高度富集的微RNA。通过引入其靶向序列可实现神经元内转基因沉默,而其他细胞类型不受影响。研究者包装ssAAV5-hIBA1a-GFP-miR124T病毒,并注射至未损伤小鼠纹状体。病毒注射后4 w检测显示,GFP信号特异性地高表达于IBA1阳性小胶质细胞,而NeuN阳性神经元未见表达。定量分析显示94.78%的GFP阳性细胞为小胶质细胞,表明小胶质细胞特异性非常高,同时转导效率高达85.83%。
4、不同脑区的小胶质细胞特异性
为确定其它脑区的小胶质细胞是否也能被靶向,研究人员将ssAAV5-hIBA1a-GFP-miR124T病毒注射到小鼠的海马、纹状体和皮层。在病毒注射后4 w收集脑组织进行分析。尽管与纹状体和海马相比,皮层中的GFP阳性细胞分布更集中,但GFP的表达主要局限于IBA1阳性细胞。进一步使用细胞类型特异性标记物对海马进行了检查(PU.1标记小胶质细胞;GFAP标记星形胶质细胞;NeuN标记神经元;OLIG2标记少突胶质细胞及其前体)。定量分析显示,在注射位点及远离注射位点区域GFP均被高度特异性地检测到存在于小胶质细胞中。表现为注射位点:95.56%的GFP阳性细胞为IBA1阳性,93.63%的GFP阳性细胞为PU.1阳性;远离注射位点区域:98.72%的GFP阳性细胞为IBA1阳性,95.58%的GFP阳性细胞为PU.1阳性。而在其它被检查的细胞类型(如星形胶质细胞、神经元或少突胶质细胞)中未观察到GFP表达。此外,GFP信号强度足以直接成像,无需免疫染色。
结论与局限
这项研究提供了一种简单且高度特异性的方法,利用AAV或慢病毒载体靶向CNS中的驻留小胶质细胞。通过使用466 bp的hIBA1a启动子和miR124T序列,可显著提高小胶质细胞的靶向特异性和转基因表达稳定性,为小胶质细胞的基础研究和临床治疗应用提供了有力工具。未来,这一方法有望结合突变的AAV衣壳,进一步拓展在不同脑区和病理条件下的应用,为神经科学研究和疾病治疗带来新的突破。
研究的局限性:本研究中选用的AAV衣壳在脑中的扩散范围有限。这一局限性可通过突变型AAV衣壳来解决。由于AAV介导的表达的细胞类型特异性也可能受到转基因本身的影响,未来应检查更多基因,而不仅仅是荧光报告基因。尽管我们检查了脑卒中的情况,但目前尚不清楚在其它病理条件下(如阿尔茨海默病)细胞类型特异性和基因表达水平是否会有差异。此外,未来的工作需要建立AAV介导操纵小胶质细胞活动和功能的工具箱,包括用于光遗传学、化学遗传学、shRNA(短发夹RNA)介导敲低及基于CRISPR/Cas9应用的载体。
枢密科技可提供本文中构建的新AAV载体,列表如下:
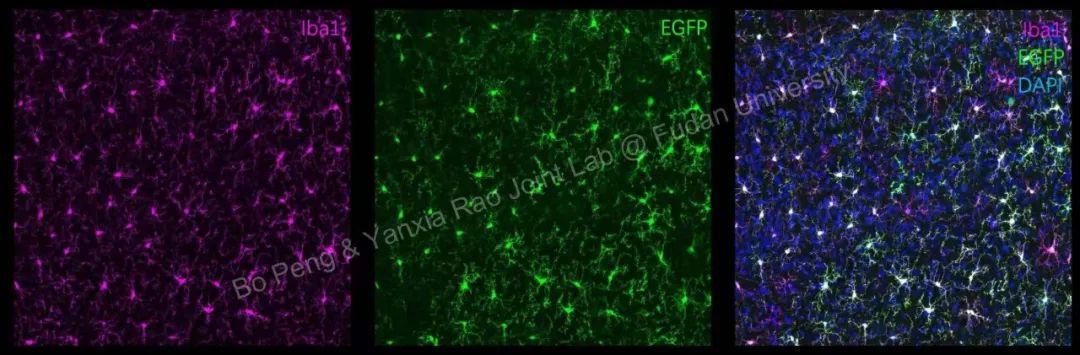
我司客户使用结果反馈:
动物:7周龄C57小鼠(非WT)
注射位置:皮层
病毒滴度:5.23E+12 vg/mL
注射量:100 nL
注射后5 w取材染色观察。

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK