2025-02-12 阅读量:17197
神经元间突触信号传递对神经信息处理至关重要,而精确的突触标记工具对于研究神经环路的连接性、可塑性极为重要。传统免疫组化方法因需要固定组织而无法用于活体观察,且难以区分特定突触斑点的来源细胞。近年来,遗传编码荧光蛋白为活体或固定组织的细胞类型特异性标记提供了新途径,但这些方法在标记突触时仍存在局限性。例如,基于GFP表达识别兴奋性树突棘的方法无法识别位于树突干上的抑制性突触,也无法识别不形成独特突触小泡样结构的无棘神经元上的兴奋性突触;而表达与荧光团融合的外源性突触蛋白以标记兴奋性和抑制性突触的方法可能会干扰突触的生理功能。为解决这些问题,研究人员开发了不改变内源性蛋白水平的基因编码工具。其中,由mRNA展示技术生成的纤维连接蛋白内抗体(FingR)能够特异性地结合突触蛋白PSD95(兴奋性突触的支架蛋白)和gephyrin(抑制性突触的支架蛋白),实现荧光标记兴奋性和抑制性突触,且不干扰突触生理功能。这些工具通过转染或胚胎期电穿孔引入,已成功应用于神经元培养、小鼠脑切片和活转基因斑马鱼中,但此前缺乏可轻松用于脑部的病毒载体。
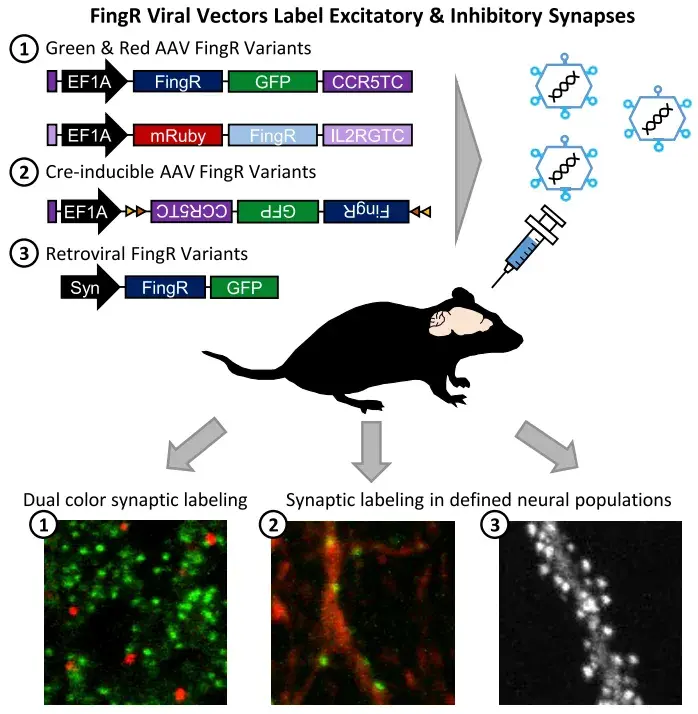
来自美国波士顿大学的Han Lab在Iscience期刊上发表了题为“A Viral Toolbox of Genetically Encoded Fluorescent Synaptic Tags”的研究论文,该研究开发了携带PSD95.FingR和Gephyrin.FingR的腺相关病毒(AAV)载体,这些载体具备强组成型和Cre诱导型表达能力,可用于标记皮层及皮层下脑区的兴奋性或抑制性突触。作者首先筛选出具有突触靶向特异性的N端融合红色FingR,并将其包装到AAV载体中。这种红色FingR可与绿色FingR配合实现双色突触标记,并支持全脑或细胞类型特异性的标记。此外,作者还开发了不含转录控制元件的FingR逆转录病毒载体,能有效标记成年新生颗粒细胞的兴奋性和抑制性突触,并追踪其在成熟过程中的突触发育。这些FingR病毒载体将为神经科学研究提供有力支持,可用于绘制神经环路、追踪突触发育以及研究突触可塑性,适用于正常生理状态及疾病条件下的相关研究。

枢密科技隆重推出系列突触标记AAV工具,为神经科学研究提供强大支持!该AAV工具基于前沿FingR技术,可高效、特异地标记兴奋性和抑制性突触,助力神经环路解析、突触可塑性研究及神经疾病机制探索。我们的产品经过严格质控,确保高效转导和稳定表达,助您轻松解锁突触研究新维度!
1、皮层及皮层下脑区兴奋性和抑制性突触标记
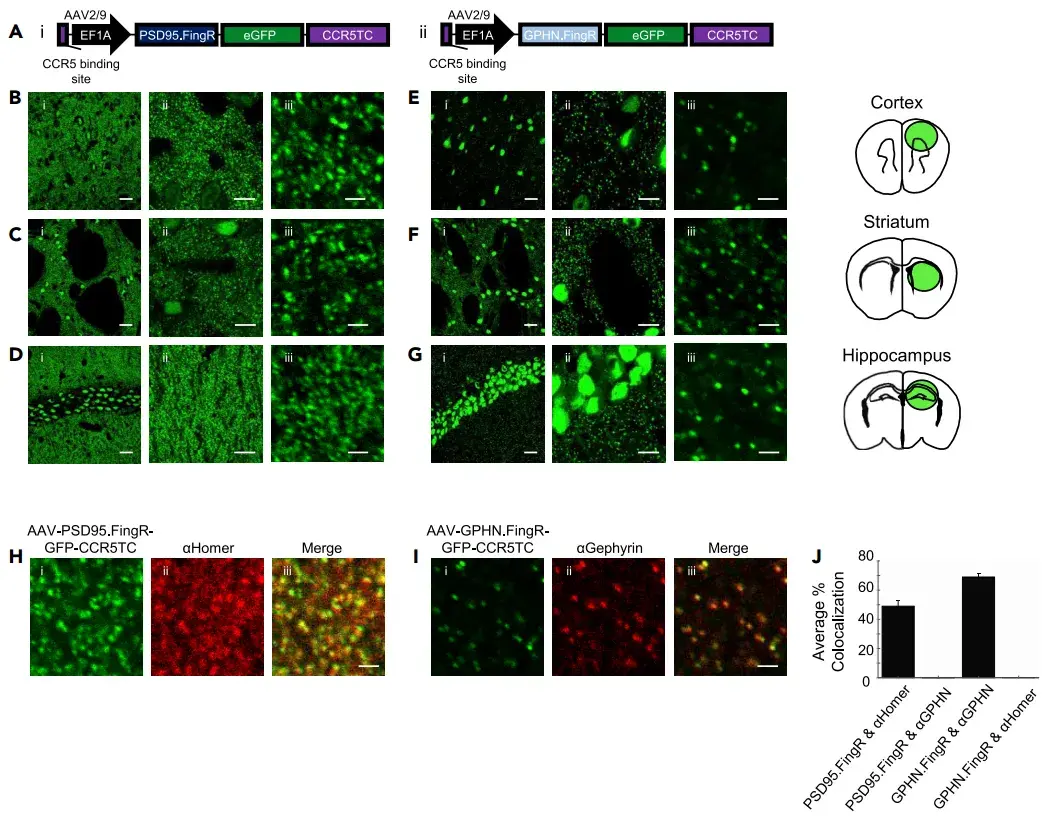
为了实现基于FingR的突触标记策略的广泛应用,作者构建了两种AAV基因组载体:AAV-EF1a-PSD95.FingR-GFP-CCR5TC和AAV-EF1a-Gephyrin.FingR-GFP-CCR5TC。这两种载体分别在强启动子EF1a的驱动下表达PSD95.FingR和Gephyrin.FingR,并在GFP的C端融合了CCR5转录反馈调节域(CCR5TC)。该结构域由CCR5锌指蛋白识别序列与KRAB(A)转录抑制域组成,用于调控FingR的表达水平。为了确保在啮齿类动物中枢神经系统中获得优异的表达效果,作者选择了AAV9衣壳蛋白来包装这些病毒颗粒。将这两种病毒载体分别注射到小鼠大脑的皮层、纹状体和海马区,3周后对固定脑切片进行组织化学处理,结果显示所有测试的大脑区域以及标记的细胞核中均检测到强烈的GFP点状模式表达。PSD95.FingR的斑点密度在所有测试脑区中均高于Gephyrin.FingR,这与先前的兴奋性突触密度高于抑制性突触的研究结果一致。
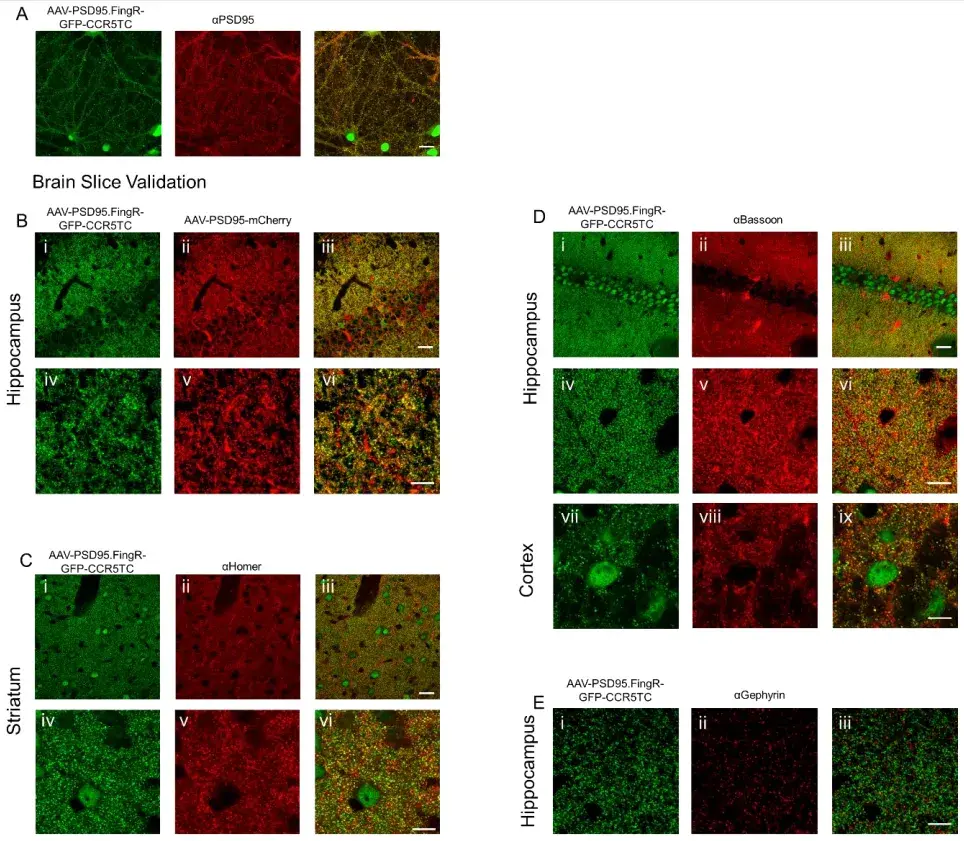
为了验证标记斑点的身份,作者使用传统抗体染色分析了免疫荧光与GFP的共定位。结果显示,Gephyrin.FingR-GFP与gephyrin抗体在小鼠脑切片中共定位率高达69.1%±6.0%;而PSD95.FingR-GFP与兴奋性突触后标记物Homer及突触前标记物Bassoon也显示出强烈的共定位。此外,在神经元培养中,PSD95.FingR与PSD95抗体能够共定位,且共注射AAV-EF1a-PSD95.FingR-GFP-CCR5TC和AAV-Syn-PSD95-mCherry在小鼠脑切片中也观察到共定位现象。作为对照,Gephyrin.FingR-GFP阳性斑点与Homer免疫荧光的共定位率仅为0.03%±0.02%;PSD95.FingR-GFP阳性斑点与gephyrin免疫荧光的共定位率为0.11%±0.08%。这些结果表明,AAV-EF1a-PSD95.FingR-GFP-CCR5TC和AAV-EF1a-Gephyrin.FingR-GFP-CCR5TC能够特异性地标记小鼠大脑中的兴奋性和抑制性突触,并保持亚微米级的空间分辨率。
图1. PSD95.FingR和Gephyrin.FingR AAV载体以亚微米分辨率标记兴奋性和抑制性突触
图2. PSD95.FingR AAV标记兴奋性突触的验证
2、红色Gephyrin.FingR变体的开发与双色突触标记应用
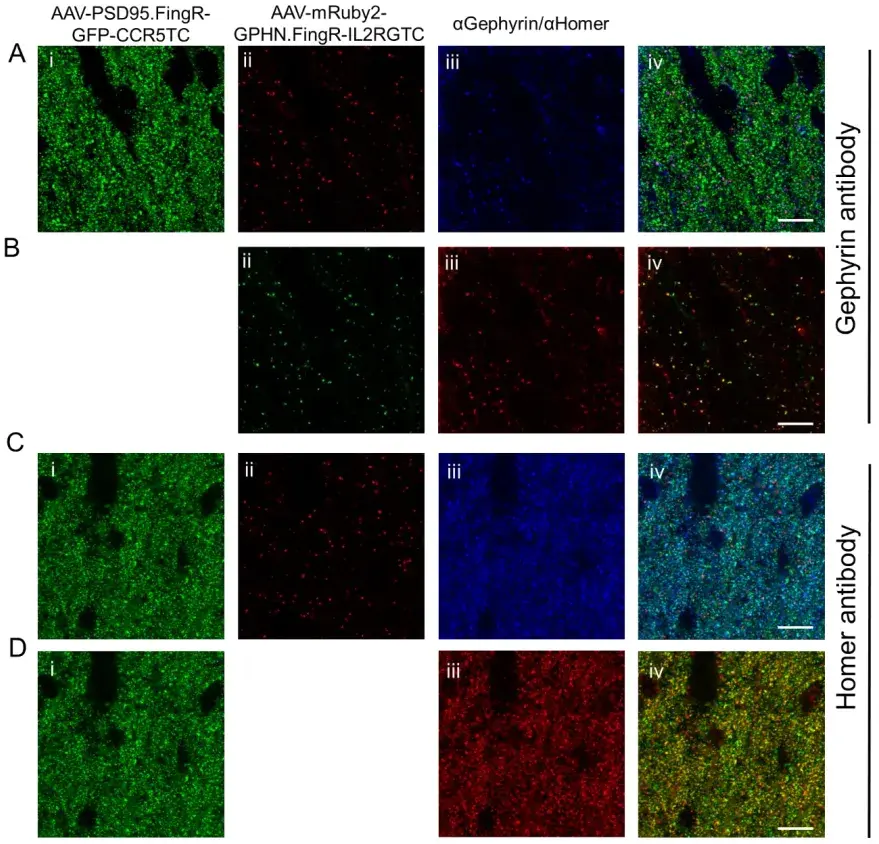
为了实现同一神经元中兴奋性和抑制性突触的双色标记,作者设计了一种红色荧光蛋白FingR变体,以与绿色FingR配合使用。由于与GFP相比,红色荧光蛋白是二聚体的,更容易聚集,并且在融合蛋白中功能不佳,研究选择了亮度高、单体化的红色荧光蛋白mScarlet,并构建了Gephyrin.FingR的mScarlet变体。实验发现,N端融合的mScarlet-Gephyrin.FingR比C端融合的表现出更明显的斑点状表达模式,表明荧光蛋白的位置可能会影响FingR的表达水平及其与内源性蛋白的共定位。基于这一发现,研究人员进一步筛选了其他红色荧光蛋白mRuby2和mCherry,并将其融合到Gephyrin.FingR的N端。在神经元培养中,mScarlet-Gephyrin.FingR和mRuby2-Gephyrin.FingR的免疫荧光共定位率与绿色Gephyrin.FingR-GFP的效果相当,但mCherry-Gephyrin.FingR在突触中表达较少且容易聚集。这些结果表明,将mScarlet和mRuby2融合到Gephyrin.FingR的N端后,这些变体不仅保留了FingR的功能,还能够有效标记抑制性突触,为双色突触标记提供了可靠的工具。
为了验证双色突触标记的效果,作者将AAV-EF1a-PSD95.FingR-GFP-CCR5TC与AAV-EF1a-mRuby2-Gephyrin.FingR-IL2RGTC共注射到小鼠大脑中。结果显示,mRuby2-Gephyrin.FingR在小鼠脑切片中表现出点状表达模式,且与PSD95.FingR-GFP标记的突触点基本不重叠,表明这两种FingR能够分别特异性地标记兴奋性和抑制性突触。使用Homer和gephyrin抗体进行免疫荧光染色也进一步证实了这一点。因此,AAV-EF1a-PSD95.FingR-GFP-CCR5TC和AAV-EF1a-mRuby2-Gephyrin.FingR-IL2RGTC可以作为一对FingR标记工具,在同一脑组织中分别标记兴奋性和抑制性突触。
图3. 红色Gephyrin.FingR AAV的优化实现兴奋性和抑制性突触的双重标记
图4. 双突触标记的抗体染色
3、逆转录病毒载体实现海马体成年新生颗粒细胞中兴奋性和抑制性突触的标记
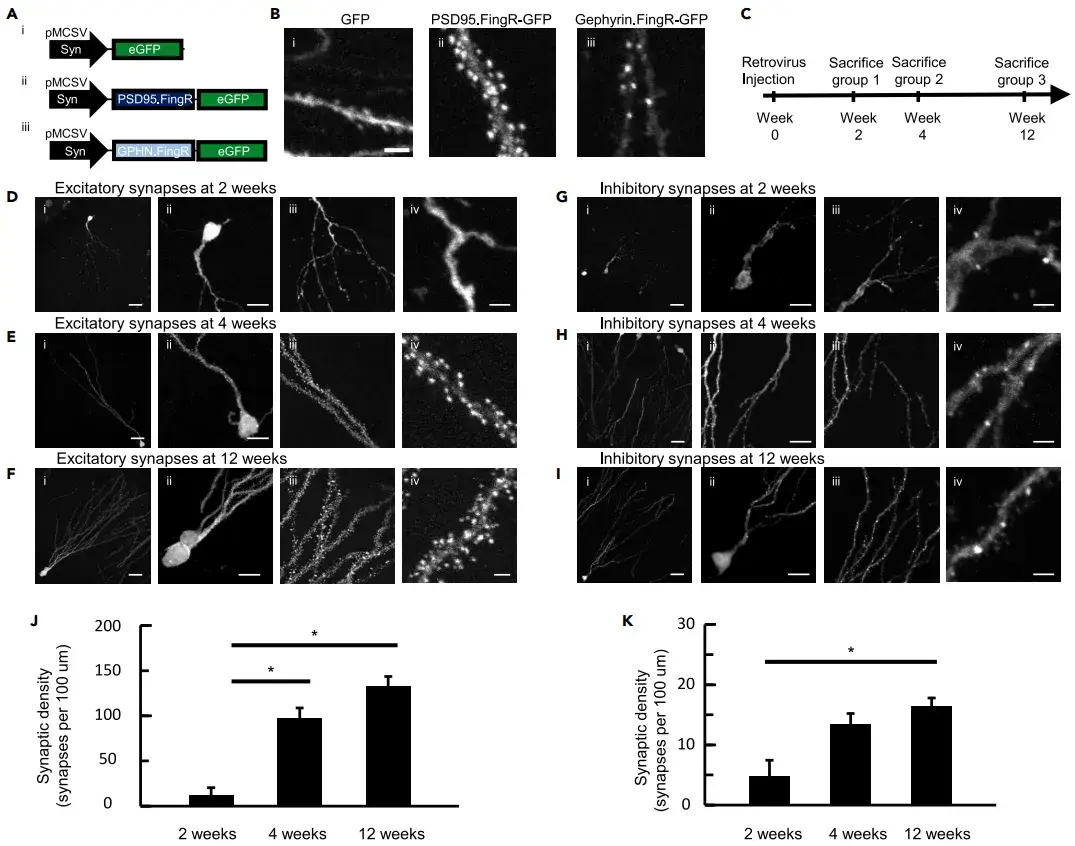
为了研究新生神经元的突触发育,作者利用带有突触蛋白启动子的小鼠干细胞病毒(MSCV)逆转录病毒表达系统,分别表达PSD95.FingR和Gephyrin.FingR,以标记兴奋性和抑制性突触。该系统可在病毒注射后1天内特异性标记成年新生颗粒细胞,且通过负反馈转录控制确保标记蛋白水平与内源性蛋白一致。作者在成年小鼠海马齿状回注射MSCV-Syn-PSD95.FingR-GFP和MSCV-Syn-Gephyrin.FingR-GFP病毒,并在注射后4周分析突触斑点。结果显示,PSD95.FingR标记的兴奋性突触主要集中在树突棘,而Gephyrin.FingR标记的抑制性突触主要分布在树突干。通过在不同时间点(2、4、12周)处死小鼠,作者追踪了整个成熟期兴奋性和抑制性突触的形成过程。2周时,新生颗粒细胞的兴奋性突触密度较低(每100 μm树突有12±9个突触),4周时显著增加至97±11个突触(每100 μm),12周时进一步增加至132±11个突触(每100 μm),但与4周时差异不显著。抑制性突触密度在2周时为每100 μm有5±3个突触,4周时增加至13±2个突触,12周时为16±1个突触。因此,在兴奋性和抑制性突触的发育过程中,突触密度的最大增长出现在第2至4周之间,而在第4至12周期间增长较为平缓。这一发现为理解成年神经发生的功能整合提供了重要依据。
图5. 逆转录病毒介导的FingR标记实现对成年新生齿状颗粒细胞突触发育全程的追踪
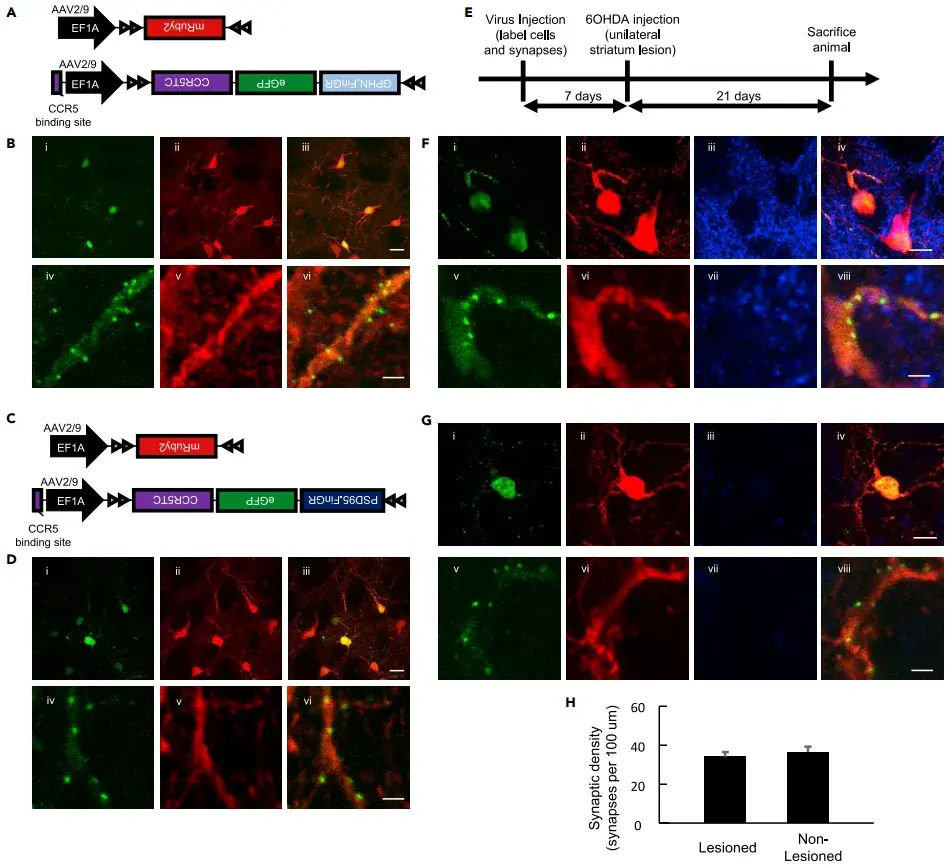
4、Cre诱导型FingR AAV载体实现对纹状体无棘胆碱能中间神经元的突触标记
为了进一步探索无棘神经元(如纹状体胆碱能中间神经元)的突触特性,作者开发了一种基于Cre诱导的FingR AAV载体,并利用这一工具研究了帕金森病(PD)模型中多巴胺耗竭对这些神经元突触的影响。纹状体胆碱能中间神经元仅占纹状体细胞的1%–2%,但它们在运动行为和学习中发挥重要作用。由于这些神经元缺乏树突棘,其突触密度的研究相对较少。为此,作者构建了Cre依赖的AAV-FingR载体,将AAV-DIO-mRuby2与AAV-DIO-Gephyrin.FingR-GFP-CCR5TC或AAV-DIO-PSD95.FingR-GFP-CCR5TC共注射到ChAT-Cre小鼠(Cre重组酶的表达特异性地局限于胆碱能神经元)的纹状体中以标记抑制性突触或兴奋性突触。结果显示,AAV-DIO-mRuby2能够均匀标记胆碱能中间神经元的胞体和树突,而AAV-DIO-Gephyrin.FingR-GFP-CCR5TC和AAV-DIO-PSD95.FingR-GFP-CCR5TC则以点状模式分别成功标记了抑制性和兴奋性突触。
在PD模型中,多巴胺耗竭会导致纹状体的突触重塑。为了研究多巴胺耗竭对胆碱能神经元抑制性突触的影响,作者在ChAT-Cre小鼠的双侧纹状体共注射了AAV-DIO-mRuby2和AAV-DIO-Gephyrin.FingR-GFP-CCR5TC。1周后,单侧注射神经毒素6-OHDA到纹状体,以选择性耗竭多巴胺能输入。3周后,作者通过酪氨酸羟化酶抗体染色验证了多巴胺的耗竭,并量化了受损和未受损半球的突触密度。结果显示,多巴胺耗竭后3周,胆碱能神经元的抑制性突触密度并未发生显著变化,表明多巴胺耗竭并未导致纹状体胆碱能中间神经元的抑制性突触重塑。这些实验结果表明,Cre诱导的AAV-FingR病毒载体在分析疾病模型伴随的突触重组中广泛的应用潜力,为研究帕金森病等神经退行性疾病的病理机制提供了新的工具。
图6. Cre诱导型FingR变体标记无棘纹状体胆碱能中间神经元的突触
总结
本研究开发了一套基于遗传编码荧光突触标签的病毒工具箱,能够广泛应用于小鼠大脑中兴奋性和抑制性突触的FingR标记,实现全脑或细胞特异性的标记。作者发现N端融合的红色荧光蛋白FingR在突触靶向特异性上优于C端融合,并通过AAV载体实现了双色突触标记,支持细胞类型特异性的标记。此外,去除转录控制元件后,成功生成的FingR逆转录病毒载体可用于标记成年新生颗粒细胞的突触。Cre依赖型AAV-FingR变体还可在健康和疾病状态下量化胆碱能中间神经元的抑制性突触密度。另外,研究发现新生颗粒细胞在出生后14天内形成最早的GABA能突触,且在成熟过程中突触数量增加。在PD模型中,多巴胺耗竭后3周内,胆碱能中间神经元的抑制性突触密度未发生显著变化,表明多巴胺耗竭未立即诱导这些神经元的突触可塑性变化。总体而言,FingR病毒载体工具箱为绘制突触图谱以及理解发育或疾病相关可塑性中的突触变化提供了强大的支持。
本研究的局限性在于,FingR病毒载体仅在皮层、海马和纹状体三个主要脑区进行了测试,且在固定脑切片中量化突触密度时,仅在特定时间点进行了分析。未来的研究可以通过高分辨率活体成像技术,追踪同一动物中突触的动态变化。此外,FingR病毒载体还可与其他遗传编码工具结合使用,进一步拓展其应用范围。
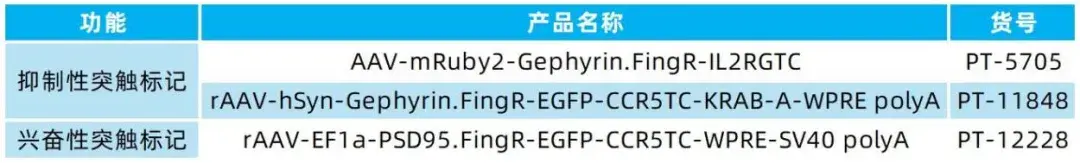
我司可提供系列突触标记AAV工具,部分列表如下:

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK