2025-01-17 阅读量:17207
在哺乳动物的生存与繁衍进程中,社交活动占据着无可替代的关键地位。无论是满足个体的内在生理需求,还是应对外部复杂多变的生存环境,动物都需要精准且灵活地做出社交决策,以此来保障自身能够获得最大程度的利益。尽管当前学界对社交决策背后的神经调控机制已开展了广泛且深入的研究,但内在需求信号与来自外部环境的信息究竟是如何在神经系统中进行整合的,以及它们怎样协同对社交决策进行编码,这些问题依旧笼罩在迷雾之中,亟待清晰的解答。在各类社交活动要素里,社交对象的性别属性堪称影响社交决策走向的核心因素。异性之间的社交互动,对于物种的交配、繁衍,乃至整个种族的延续起着决定性作用;而同性社交同样不可小觑,在维持个体身心健康、提供情感依托、促进合作以及助力获取生存资源等方面,发挥着不可或缺的重要作用。然而,在社交场景中,动物形成性别偏好的神经决策机制,以及外部环境因素是通过何种途径对其产生影响的,目前还处于未知状态,亟待系统性的研究来揭示。
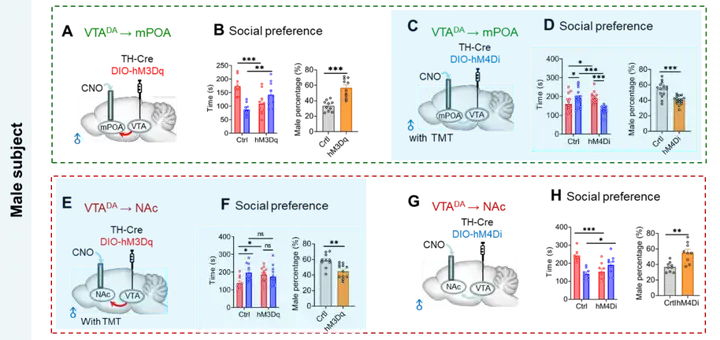
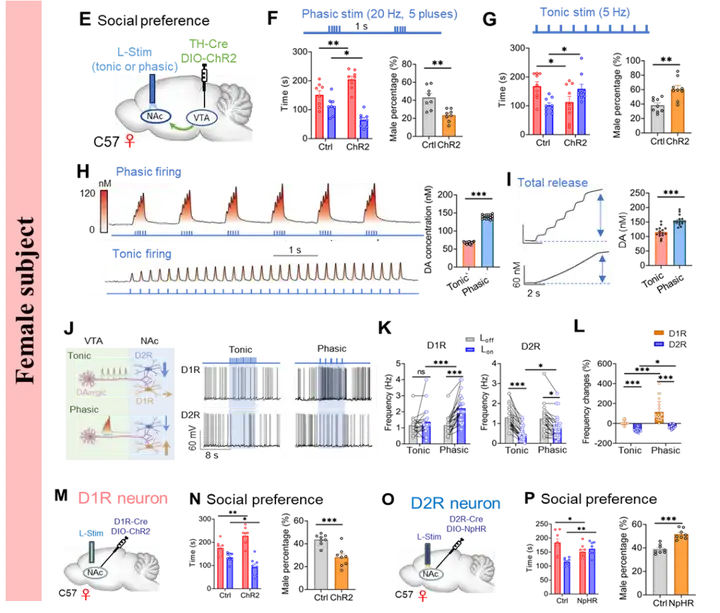
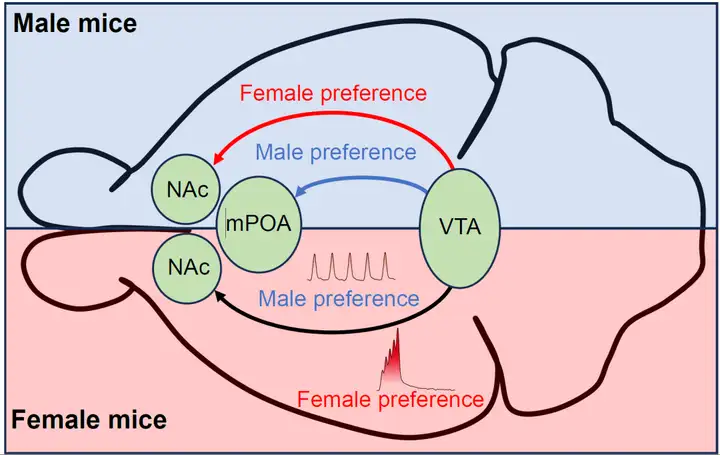
2025年1月10日,西安交通大学的王昌河教授团队在国际顶刊《Science》上发表了一篇重磅研究论文,标题为 “Sexually dimorphic dopaminergic circuits determine sex preference”。此项研究成果具有开创性意义,首次明确证实,在正常的生理状态下,成年雄性小鼠以及处于非发情期的雌性小鼠,均会展现出对雌性个体的社交偏好倾向。但值得注意的是,一旦面临严峻的生存威胁,它们的社交偏好会迅速发生转变,转而倾向于选择与雄性个体进行社交互动。研究进一步发现,中脑多巴胺(DA)奖赏系统在这一复杂的行为决策过程中扮演着核心枢纽的角色。有趣的是,雄性和雌性个体在利用该系统进行社交决策时,采用了截然不同的神经环路机制,这充分体现了性别二态性的特点。具体而言,在雄性个体中,腹侧被盖区多巴胺能神经元(VTADA)向伏隔核(NAc)投射所形成的奖赏环路,基于生殖繁衍这一内在刚性需求,介导了雄性对雌性的社交偏好;与此同时,VTADA向内侧视前区(mPOA)投射形成的防御环路,则主要负责对外在生存威胁做出响应,介导了雄性对雄性的社交偏好。雄性个体的性别选择,实际上是这两个环路之间相互竞争与动态平衡的最终结果。反观雌性个体,无论是对雄性还是雌性的社交偏好,均由VTADA-NAc奖赏环路负责介导。不过,在这一环路中,多巴胺能神经元独特的放电模式成为了决定偏好走向的关键因素:紧张性放电模式能够促进雌性对雄性的社交偏好,而时相性放电模式则介导了雌性对雌性的社交偏好。
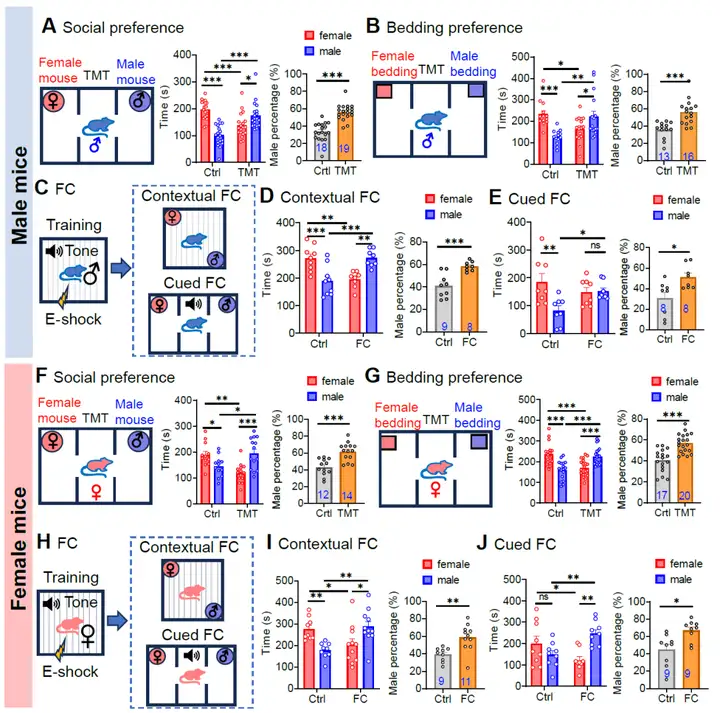
1、外界生存威胁改变雌雄个体社交性偏好
在三箱社交实验中科研人员观察到,在正常生理状态下,成年雄性小鼠及非发情期雌性小鼠均倾向于选择与雌性进行社交互动。然而,当社交环境被人为添加了狐狸尿的主要成分三甲基噻唑啉(TMT)这一潜在生存威胁后,雄性与雌性小鼠的社交偏好均发生了显著改变,由原本偏好雌性社交转变为偏好雄性社交。为了深入探究这种社交偏好转变是否仅由嗅觉通路所介导,研究人员进一步开展了条件恐惧实验,通过足底电刺激结合特定的环境及声音信号进行综合研究。实验结果显示,视觉和听觉通路所传递的生存威胁信号同样能够促使小鼠的社交偏好从“亲雌”状态转变为“亲雄”状态。这一发现表明,不同感觉信号通路均具备介导外界生存压力的能力,并参与调节社交决策过程。同时,这也充分说明动物的社交决策并非固定不变,而是会依据其内在生理需求以及外界环境条件的动态变化而相应调整,以在社交互动中实现生存效益的最大化。
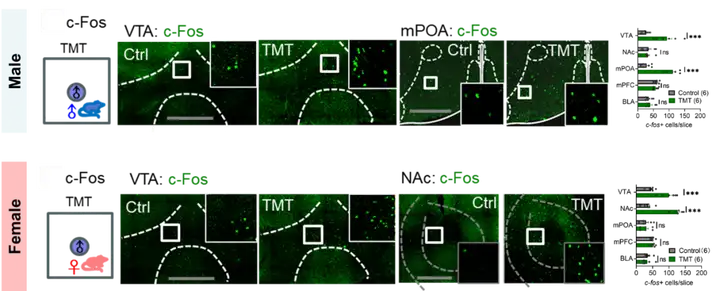
2、外界生存威胁导致多巴胺环路的性别二态性变化
3、DA系统介导社交性偏好转变
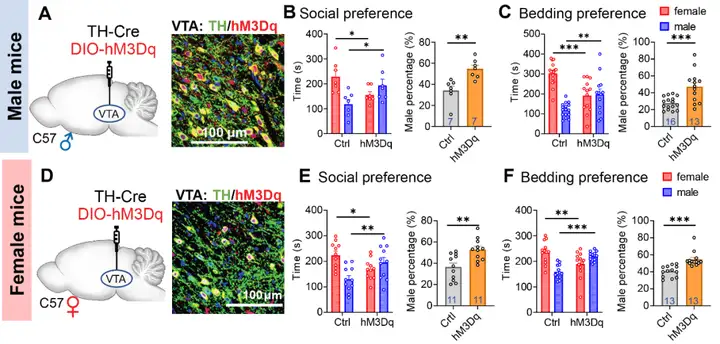
4、DA环路性别二态性变化与性偏好
图4. DA环路的性别二态性与社交性别偏好密切关联(图源:Anqi Wei, et al., Science, 2025)
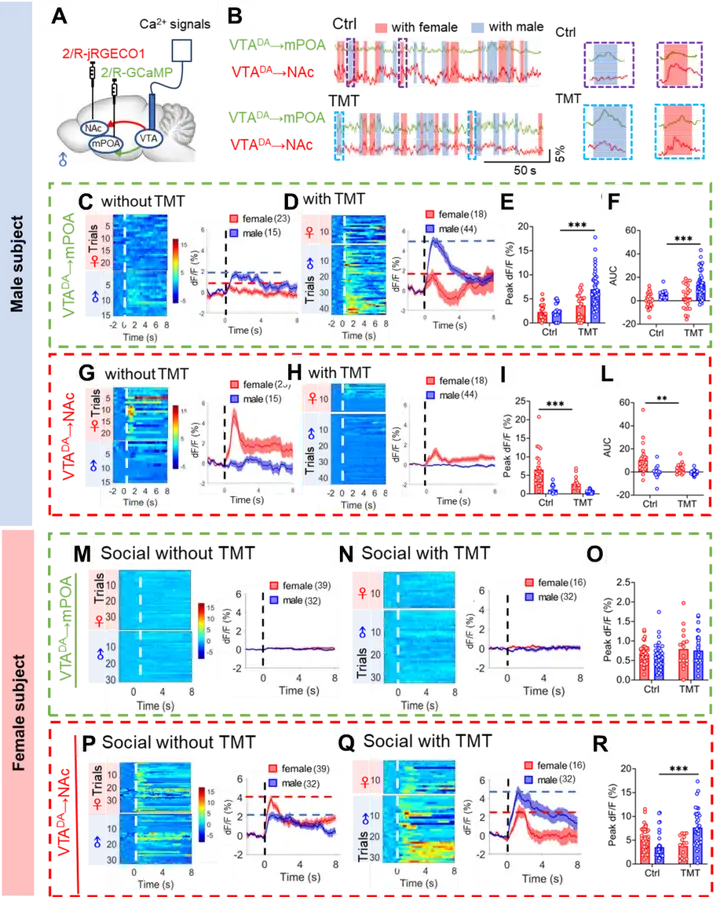
5、雄鼠通过DA环路的竞争平衡编码其社交性偏好
图5. 雄鼠通过DA环路间的竞争平衡决定其社交性偏好(图源:Anqi Wei, et al., Science, 2025)
6、雌鼠通过DA奖赏通路放电模式的切换编码其性别偏好
图6. 雌鼠通过VTADA-NAc环路放电模式的切换决定其性别偏好(图源:Anqi Wei, et al., Science, 2025)
结论
西安交通大学王昌河教授为本文的通讯作者,西安交通大学徐华栋副教授、西南医科大学康新江教授和张春祥教授为共同通讯作者。西安交通大学博士后韦安琪、博士生赵安然、博士后郑超文和董楠为本文的共同第一作者。西安交通大学分析测试中心郝英工程师协助完成Confocal成像数据的采集。中山大学李勃兴教授、空军军医大学王文挺教授为本研究提供了宝贵意见和帮助。西安交通大学附属创新港中学王恩乐同学为本研究论文的artwork提供了重要帮助。本研究获得国家自然科学基金、国家科技创新项目、陕西省科技创新团队项目、陕西省杰出青年基金、陕西省重点研发计划、中国博士后基金等项目资助。
通讯作者介绍:
王昌河,教授,博士生导师,国家级人才,陕西省科技创新团队带头人、陕西省杰出青年基金获得者,西安交通大学师德标兵,西安交通大学青年拔尖人才,荣获第六届贝时璋青年生物物理学家奖、第十三届陕西省青年科技奖、教育部自然科学一等奖(第三)、脑科学与类脑智能科创青年30人等;目前担任生物系主任、神经科学研究中心主任、中国生物物理学会理事、中国生物物理学会神经生物物理分会副主任兼秘书长、中国神经科学学会突触可塑性分会副主任、中国神经科学学会离子通道与受体分会委员、中国生理学会衰老与健康专业委员会委员、中国生物物理学会科普委员会委员、中国老年学学会衰老与抗衰老科学委员会委员、CAMPUS Asia Project学术委员会委员、中国神经修复学会精准治疗分会委员、科普中国特聘专家、Neuroscience Bulletin青年编委。在国际权威学术期刊发表研究(SCI)论文52篇,累计影响因子~517;其中,以通讯作者在Science (2025), Nat Neurosci (2024), Adv Sci (2024), Nat Commun (2024, 2023, 2014), PNAS (in press, 2022, 2019), J Cell Biol (2020, 2016)等期刊发表高水平论文22篇,申请/授权国际/国家发明专利15项,研究成果得到Nature, Science, Nat Rev Neurosci, Nat Neurosci, J Cell Biol, Mov Disord, F1000 Prime等亮点评述和特别推荐。同时,受邀担任国内神经领域经典教科书《神经科学》第四版中《神经递质的分泌与调控》和《多巴胺》两个章节的主编人、承担《中国大百科全书》第三版中《胞吐》、《胞吞》和《胞饮》三个条目的撰写、担任国家十三五规划图书《人体线粒体功能障碍与重大疾病》(获国家出版基金、陕西省出版基金)第五卷《线粒体与神经退行性疾病》主编。
徐华栋,副教授,学术研究领域为神经分泌与脑疾病机制,利用电生理、电化学、光遗传学、化学遗传学、在体成像等特色优势技术,研究帕金森疾病的运动障碍、情绪障碍的病理机制,以及抑郁、焦虑等情绪障碍的神经环路机制。目前主持国家/省部级项目4项,包括国家自然青年科学基金1项和四川省科技厅应用基础项目1项、陕西省科技厅基础研究面上项目1项、陕西省博士后特别资助项目1项。在Science、Nature neurosci、Brain、PNAS、Nature comun等国际学术期刊上发表文章十余篇。
康新江,教授,通过电生理(膜片钳记录、sniffer patch、UV-flash、钙成像)、电化学(微碳纤电极在细胞/脑片/in vivo水平的实时记录、微透析-HPLC分析)、生物成像(confocal、TIRF、two photon、电镜等)、光遗传、药物遗传、行为学实验及分子生化等实验室特色技术手段围绕帕金森病、精神分裂症及成瘾等相关神经疾病的发病机理和心脏神经调节机制等核心问题展开深入而系统的研究。
学术成就:以第一/通讯作者(含共同)在Science,Nature Neuroscience,Nature Communications,PNAS(‘Weekly press tipsheet’特别推荐论文),Analyst,Frontiers in Molecular Neuroscience(特邀综述)等国际权威学术期刊发表研究论文共计5篇,累计影响因子~43(平均影响因子~8.6)。
张春祥教授长期从事心血管疾病及心血管药理学方面的研究。其在国际上率先开展非编码RNA与心血管疾病的研究,是这一领域国际公认的开拓者和领军人物,在此领域作出了系列原创性贡献。在相关领域国际权威杂志如Science, The Journal of the American College of Cardiology, Journal of Experimental Medicine, Cell Metabolism, Molecular Cell, Nature Communications, circulation, Circulation Research等发表SCI论文150多篇。论文引用次数达1万3千余次,h-index为53。研究论文曾获本领域顶刊Circulation Research最佳论文奖。在美国主持大型国家级(NIH)项目13项。回国后已共同主持科技部国际合作重点项目一项,主持国家自然科学重点项目一项、重大专项项目一项及面上项目一项、四川省重点研发项目一项。张教授在全球10万顶级科学家中位列第25548位,位列中国第2050位,位列中国心血管领域第10位;并入选爱思唯尔(Elsevier)中国高被引学者。长期担任国家自然科学基金、长江学者及杰青评审专家。
本文使用来自枢密科技的病毒,列表如下:


了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK