2025-01-07 阅读量:18344
胰高血糖素样肽-1受体(GLP1R)是一种肽激素靶点,在大脑的各个部位均有表达,尤其是在基底外侧杏仁核和下丘脑区域,并且在中枢神经系统以外的部位也有广泛表达。其内源性配体,胰高血糖素样肽-1(GLP-1),是一种在哺乳动物中完全保守的肽,主要由两种细胞类型产生:主要位于脑孤束核中的前胰高血糖素原(PPG)神经元,以及位于肠道中的肠内分泌细胞(ECs)。进食后,GLP-1会与胃肠抑制多肽(GIP)一起从肠道迅速释放到血液中,靶向胰腺的β细胞,并在高血糖条件下刺激胰岛素的产生和分泌。这种被称为“肠促胰素效应”的现象在代谢紊乱(如2型糖尿病)中受损,因此GLP-1信号通路成为治疗这些疾病的有吸引力的治疗靶点。除了其在控制饱腹感和食物摄入量方面的作用外,中枢GLP-1还被证明具有中枢神经保护作用,这表明其在人体生理学中具有多方面的作用。
人类的GLP1R(hmGLP1R)是药物筛选和药物开发的首要靶点,鉴于GLP-1受体激动剂(GLP1RAs)数十年来一直被用于2型糖尿病的治疗,近来已成为最为有效且广泛应用的减肥药之一。可用作GLP1R筛选工作的技术包括:通过基于放射性的检测或荧光标记的配体来监测配体与GLP1R结合的技术,以及能够监测GLP1R与下游信号通路偶联的技术,例如通过闪烁计数法、荧光法或生物发光共振能量转移检测。开发一种具有高灵敏度、分子特异性及时空分辨率的技术,以直接探测配体诱导的GLP1R构象活化,将极大地促进药物筛选工作,并有望拓展出许多重要的新应用领域。然而,目前此类技术尚缺。
枢密科技重磅推出GLP-1探针AAV工具:AAV-hSyn-GLPLight1-WPRE-PA!该工具基于前沿光学技术,能够实时、高时空分辨率地响应GLP-1信号,并高效监测GLP1R的激活动态,为探索神经退行性疾病、糖尿病、肥胖症等疾病治疗新路径提供强大支持,助力药物筛选与临床研究。选择枢密科技,解锁GLP1R研究新篇章!
Tommaso Patriarchi与Nina Hartrampf在期刊eLife上发表了题为“Optical tools for visualizing and controlling human GLP-1 receptor activation with high spatiotemporal resolution”的文章,该研究利用已确立的蛋白质工程策略,设计并表征了一种基于GLP1R的新型遗传编码传感器,命名为GLPLight1。该传感器能够直接并实时地光学读取细胞内GLP1R的构象激活情况,研究通过确认其对GLP-1优于其他B1类G蛋白偶联受体(GPCR)配体的高特异性,对胰高血糖素的低亲和力,以及对GLP-1丙氨酸突变体的特异性功能缺陷,从而验证了GLPLight1在针对GLP1R的药物筛选实验中的潜力。最后,为进一步扩展光学工具包,该研究还开发了一种光控GLP-1衍生物(photo-GLP1),并将其与GLPLight1结合使用,以实现GLP1R激活的全光学控制和可视化。总之,本研究引入的新型全光学工具包,提供了以高时空分辨率深入探究GLP1R激活机制的有力手段,从而为在各种条件和系统下详细探究GLP1R的生理和药理调节机制提供了空前的机遇。

1、GLPLight1的开发及其体外表征
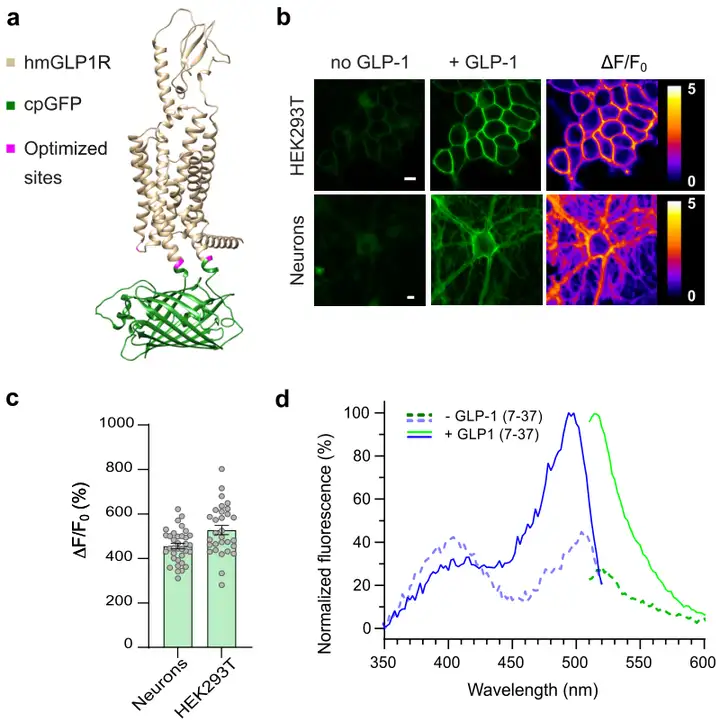
为了开发基于hmGLP1R的遗传编码传感器,研究者首先将hmGLP1R的第三个胞内环(ICL3)替换为多巴胺传感器dLight1.3b的cpGFP(循环排列的绿色荧光蛋白)模块,替换位置在氨基酸残基K336和T343之间。但初版传感器在细胞表面表达不佳,对GLP-1饱和浓度(10 µM)的荧光响应微弱(ΔF/F0=39%)。去除内源性GLP1R N端分泌序列(氨基酸1-23)后,膜表达和对GLP-1的荧光响应得到改善(ΔF/F0=107%)。接着,研究者对传感器的第二内环(ICL2)的赖氨酸残基进行扫描,发现L260K突变使传感器的动态范围翻倍(ΔF/F0=180%)。进一步的位点饱和突变筛选出一个新变体(包含K336Y和T343N突变),其ΔF/F0约为341%。为了提高传感器的表面表达,研究者在该变体上引入了一个C末端内质网导出序列。此外,在cpGFP片段中引入了三个突变,提高了探针的基础亮度而不影响其动态范围。最后,研究者突变了C末端负责GLP1R内化的八个磷酸化位点,以最大限度减少传感器内化。最终得到的传感器变体表现出良好的膜表达和与GLP-1结合时528%的最大荧光响应。该变体被命名为GLPLight1,并被选为进一步表征的对象。
为了验证GLPLight1作为研究hmGLP1R的新工具的实用性,研究者首先在体外对其特性进行了表征。他们通过腺相关病毒(AAV)转导将GLPLight1表达在培养的原代皮层神经元中,两周后,GLPLight1在神经元膜上表达良好,并对GLP-1(10 µM)表现出456%的最大响应。随后,研究者在HEK细胞(人胚肾细胞)中测量了传感器的光谱特性,这些特性与绿色G蛋白偶联受体(GPCR)传感器的光谱特性相似,显示出在500 nm附近的峰值激发、512 nm附近的峰值发射和425 nm附近的等吸光点。接下来,作者比较了传感器GLPLight1及其亲本受体(野生型GLP1R,WT GLP1R)与下游信号的偶联。通过分裂纳米荧光素酶互补实验,发现GLPLight1与所有测试信号伴侣的耦合显著降低。进一步的环磷酸腺苷(cAMP)信号实验表明,GLPLight1未能像野生型GLP1R那样有效诱导细胞内cAMP增加。这些结果表明,GLPLight1不太可能与内源性细胞内信号通路偶联。
2、GLPLight1作为药物筛选工具的应用
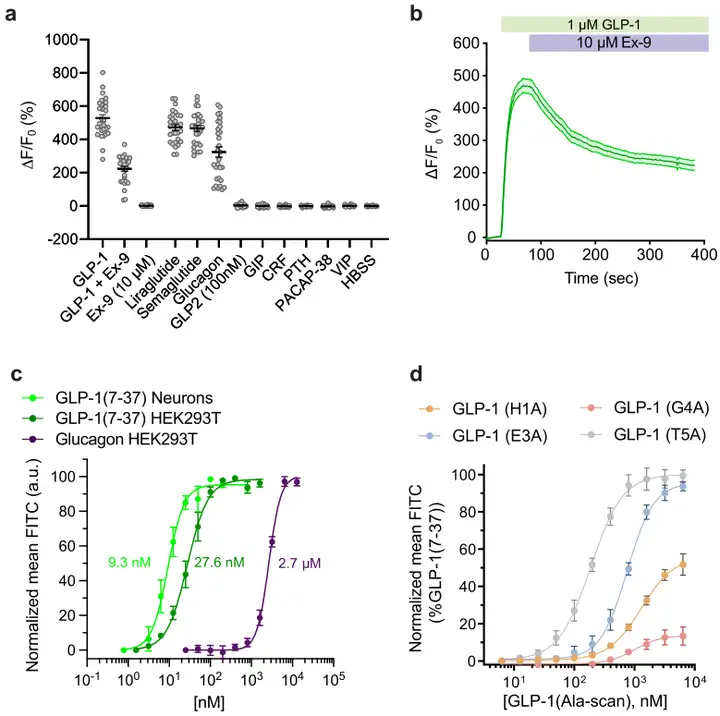
GLPLight1是一种新型的基因编码传感器,能够敏感地以强度测量的方式读取hmGLP1R对其内源性配体的激活情况。为确保其作为筛选工具的实用性,作者通过GLP-1与拮抗肽的竞争实验,检验了传感器响应的可逆性:向表达GLPLight1的HEK293T细胞依次加入1.0 µM GLP-1和10 µM exendin-9(Ex-9,一种众所周知的GLP1R拮抗肽),结果显示,Ex-9能在体外5分钟内部分逆转信号至最大GLP-1响应的42%。随后,作者测试了两种临床上用于抗肥胖的已知GLP1R激动剂——利拉鲁肽(Liraglutide)和司美格鲁肽(Semaglutide),是否能触发传感器的响应。结果显示GLPLight1对这两种药物的响应几乎与GLP-1相当。表明其可作为直接读取药物对hmGLP1R作用的工具。
鉴于GLP-1、GLP-2和胰高血糖素均源自共同的前体蛋白前胰高血糖素原(PPG)的蛋白水解加工,作者研究了传感器对这些其他肽的特异性。实验发现,传感器对GLP-2的荧光响应未检测到任何显著增加,但对胰高血糖素的响应产生了324%的ΔF/F0(占GLP-1最大响应的61%)。为进一步表征GLPLight1对其内源性激动剂的敏感性,作者在HEK293T细胞中进行了GLP-1和胰高血糖素的滴定实验,结果显示GLPLight1对GLP-1的亲和力比胰高血糖素高94倍。此外,在原代神经元中测得的GLP-1亲和力(EC50=9.3 nM)与在HEK细胞中的相似。另外,GLPLight1对在高浓度(1.0 µM)下测试的一系列其他内源性B1类GPCR肽配体(包括GIP(葡萄糖依赖性促胰岛素多肽)、CRF(促肾上腺皮质激素释放因子)、PTH(甲状旁腺激素)、PACAP(垂体腺苷酸环化酶激活肽)或VIP(血管活性肠肽))均无响应。
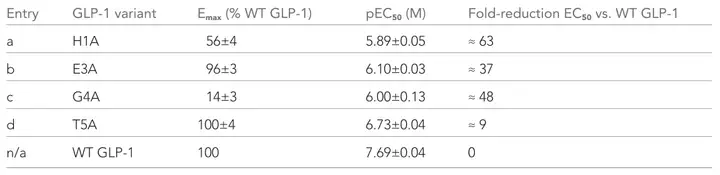
为了进一步验证GLPLight1的荧光响应是否与GLP1R激活的经典药理学读数一致,研究者合成了GLP-1的四个单残基丙氨酸突变体,并在GLPLight1表达细胞上进行滴定实验。结果表明,这些突变对最大传感器响应(Emax)和配体的效力(EC50)有明显影响,与文献报道的结果相符。即GLPLight1的荧光响应可用于研究GLP1R配体的Emax和效力相对趋势。最后,研究者还探讨了GLPLight1在体外检测内源性GLP-1释放的潜力。通过将表达GLPLight1的HEK293T细胞与GLP-1/胰高血糖素分泌的永生化肠内分泌细胞(ECs)共培养,发现GLPLight1能部分预激活,表明其能够检测到ECs分泌的内源性GLP-1。这为使用GLPLight1作为筛选工具,研究调节ECs分泌GLP-1的内在/外在因素提供了可能。
图2. GLPLight1的药理特性
表1. GLP-1肽的丙氨酸扫描变体的滴定参数(Emax和pEC50值是通过每种肽的四参数非线性拟合得出的,而EC50的位移则是通过与同时测量的野生型GLP-1肽进行比较得出的。)
3、Photo-GLP1的制备及体外表征
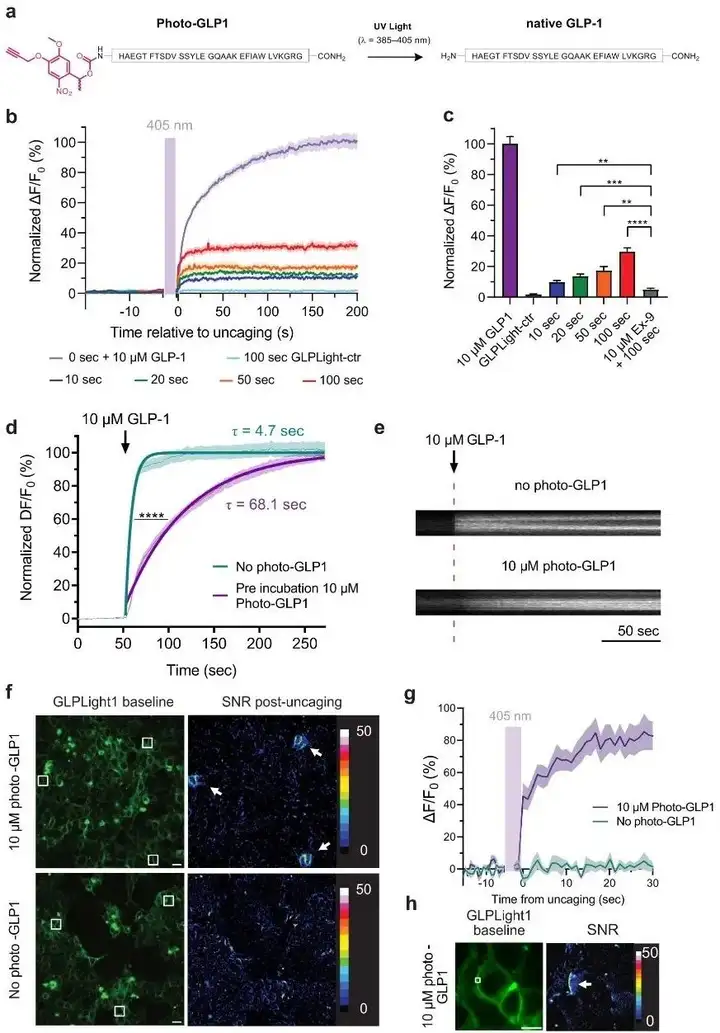
为了研究GLP1R和GLPLight1的时空激活特性,作者构想了一种光控GLP-1衍生物(photo-GLP1)。为确保photo-GLP1在释放前(即暗态下)不激活GLP1R或GLPLight1,光控基团必须位于GLP-1结合所必需的区域或其附近(肽的光控可通过在肽的侧链功能基团、主链酰胺或在肽的C端或N端连接光控分子来实现)。GLP-1主要通过其N端与GLP1R结合。因此,作者探索了N端光控策略以生成photo-GLP1。为确认photo-GLP1在紫外线照射下能释放野生型GLP-1,将photo-GLP1在LED光(λ=370 nm, 0.64 mW/mm2)下空气冷却照射20 min后,经液相色谱-质谱联用(LCMS)和超高效液相色谱(UHPLC)分析,photo-GLP1完全被分离得到WT GLP-1。随后,作者利用GLPLight1建立了一种全光学检测方法,用于表征体外光控GLP-1的释放过程。通过向表达GLPLight1的HEK293T细胞培养液中加入photo-GLP1并暴露于405 nm激光(紫外线)实现光控释放,同时用488 nm激光监测传感器荧光。无紫外线照射时,photo-GLP1无功能活性;而经10 s紫外线照射后,GLPLight1荧光显著增强,表明GLP-1成功释放并激活了传感器。延长照射时间可增强响应,最大测试释放时间(100 s)触发了传感器约30%的最大响应。且用GLP1R拮抗剂Ex-9预处理可显著减弱光控释放(100 s)引起的传感器响应。这些结果表明,使用405 nm光可有效控制photo-GLP1的体外释放,进而调控hmGLP1R的激活。
4、GLP1R活性的高分辨率全光学可视化与控制
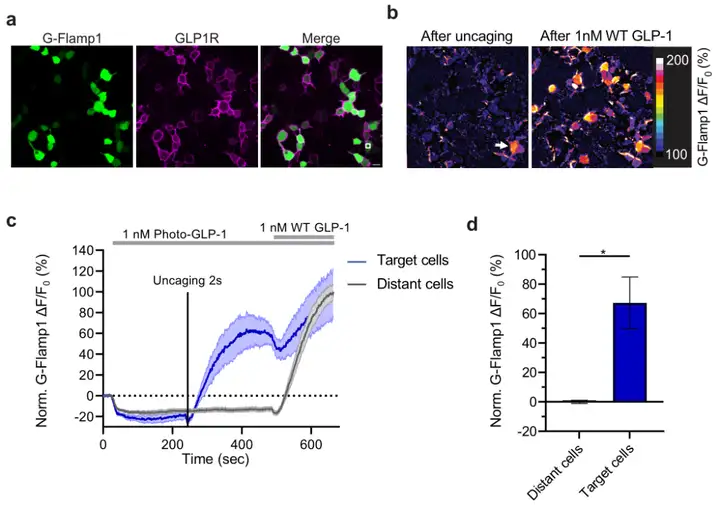
在进行photo-GLP1的释放实验时,研究者发现传感器对培养液中GLP-1的响应在有无photo-GLP1存在时存在差异。进一步研究表明,photo-GLP1能显著影响GLP1R的激活动力学,降低激活速度,这可能是通过其与受体的细胞外结构域(ECD)结合,从而与功能活性的GLP-1竞争。接下来,研究者探讨了利用GLPLight1获取photo-GLP1释放后GLP1R激活程度的空间信息的可能性。通过在较大视野内三个不同区域(各约400 µm²)进行photo-GLP1的光学释放实验,结果显示GLPLight1在释放区域表现出荧光响应,而视野内其余部分的荧光保持不变,具有高度空间定位性。为确定该检测中的传感器读数是否能以亚细胞分辨率报告GLP1R的激活情况,作者选择了约16 µm²的释放区域直接位于细胞膜上重复了释放实验。结果显示,紫外线照射导致GLPLight1的局部激活,仅限于细胞膜的一部分,并未扩散至邻近细胞。这些结果表明,GLPLight1的光学特性使其能精确确定GLP1R激活的空间范围,甚至达到亚细胞域级别。
最后,研究者测试了photo-GLP1的释放是否可用于控制hmGLP1R激活后的功能信号。为此,他们使用了一种新开发的基因编码cAMP传感器(G-Flamp1),cAMP是GLP1R激活后细胞信号传导的主要第二信使。在对共转染hmGLP1R和G-Flamp1的HEK293T细胞进行photo-GLP1释放后,仅在释放区域正下方的细胞中观察到cAMP传感器信号显著增加。这些结果表明,光控GLP-1的释放可以用于以高时空分辨率光学控制GLP1R信号激活。
总结
本研究开发了一种基于hmGLP1R的基因编码传感器GLPLight1。该工具具备高灵敏度和优异的时空分辨率,能够直接、实时地检测受体在配体诱导下的构象激活。尽管传感器似乎不适合检测GLP-1通过内分泌信号在周围环境中达到的浓度范围,但在特定脑区或靠近肠道肠内分泌细胞的地方,GLP-1的释放水平可能足够高以被GLPLight1检测到。未来研究可尝试在体内使用GLPLight1,结合AAV介导的表达和光纤光度测量等技术,进一步探索GLP-1释放动态与生理或病理条件的关系。此外,该研究还利用GLPLight1表征了photo-GLP1的释放过程,发现其能以单细胞或亚细胞分辨率控制GLP1R依赖的下游细胞信号传导。尽管photo-GLP1在体内应用时可能受DPPIV(二肽基肽酶IV)降解的影响,但仍有望在脑组织的神经生物学研究中应用,因为脑中DPPIV水平显著低于外周器官。
总之,该研究开发并应用了一套新的全光学工具包,揭示了GLP-1/GLP1R系统之前无法触及的空间维度。这些工具可以广泛应用于多种场景,其中一些已在本研究中展示,以增进我们对GLP-1/胰高血糖素/GLP1R信号系统在生理学中作用的理解,促进针对GLP1R通路的药物筛选与开发进程。

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK