2025-01-06 阅读量:18104
超声遗传学:结合机械敏感机制与超声波的创新技术
MscL:超声遗传学中的关键离子通道
2020年8月18日,香港理工大学生物医学工程学院孙雷教授团队在Cell Reports期刊上发表了题为“Targeted Neurostimulation in Mouse Brains with Non-invasive Ultrasound”的研究论文。该研究成功开发了超声遗传学技术,这是一种利用超声波激活特定神经元的创新方法。通过表达机械敏感通道MscL-G22S(MscL的突变版本),团队实现了对神经元的精确激活。该技术的优势在于能够无创地穿透头骨,精确地聚焦于大脑内的微小区域,为治疗脑肿瘤等脑部疾病以及特发性震颤等神经系统疾病提供了新的可能。这一发现为非侵入性脑刺激技术的发展提供了新的方向。

继2020年的研究之后,孙雷教授团队于2023年5月22日在PNAS杂志上发表了题为“Modulation of deep neural circuits with sonogenetics”的研究论文,该研究在MscL-G22S介导的超声遗传学的基础上取得了新的进展。通过在小鼠大脑中特异性表达MscL-G22S,展示了超声遗传学技术能够调节背侧纹状体(dSTR)和腹侧被盖区(VTA)等亚皮层脑区神经元的活动,并能在自由活动的小鼠中诱导相应的行为变化。从而证实该技术能够选择性地激活特定的神经环路,从而影响动物的行为,并有效缓解神经退行性疾病的症状。
以上文章中使用的MSCL-G22S AAV病毒由孙雷教授团队开发,枢密科技生产,揭示了超声遗传学方法不仅可能会增强我们对细胞病理生理学的新理解,并且可能会促进神经精神疾病和非神经疾病新疗法的发展。我司还可提供一系列由孙雷教授单独授权的超声遗传学AAV病毒。详情见文末列表。
孙雷教授团队的这两项研究,不仅在理论上推动了超声遗传学技术的发展,而且在实际应用中展示了其在调节特定神经通路和改善神经性疾病症状方面的潜力。这些成果为未来神经科学研究和临床治疗提供了强有力的工具,预示着超声遗传学技术在神经科学领域的重要地位和广泛的应用前景。
超声遗传学技术研究成果
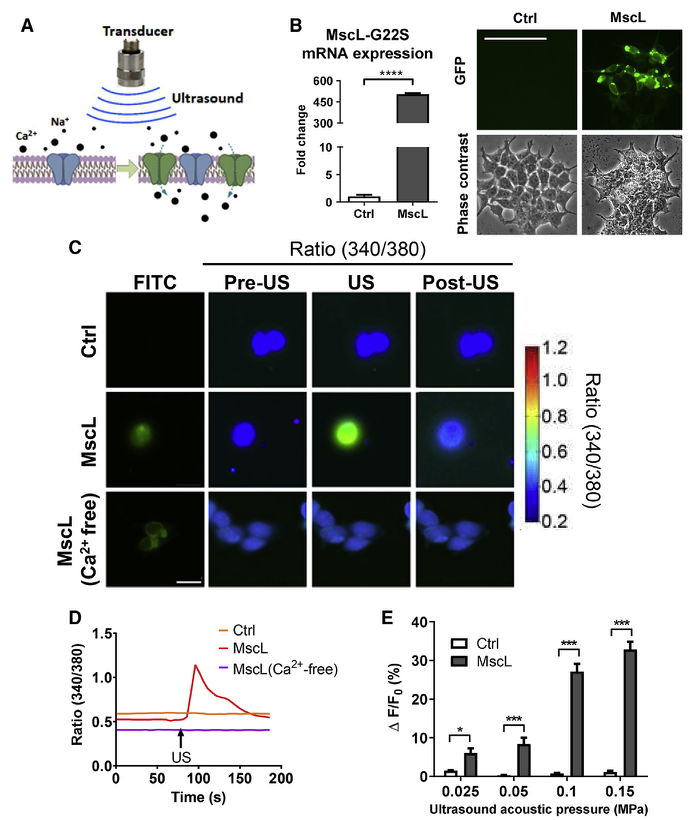
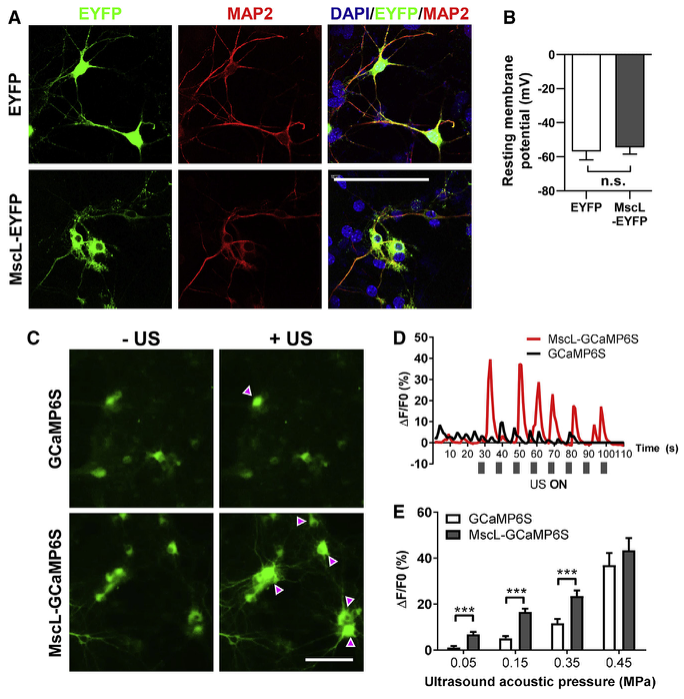
1、低强度超声波在表达MscL-G22S的293T细胞和鼠原代神经元中诱导Ca2+内流
图1. 低强度超声诱导表达MscL-G22S的293T细胞Ca2+内流(Qiu, Zhihai et al. Cell reports. 2020)
图2. 低强度超声诱导表达MscL-G22S的小鼠原代神经元Ca2+内流显著增加 (Qiu, Zhihai et al. Cell reports. 2020)
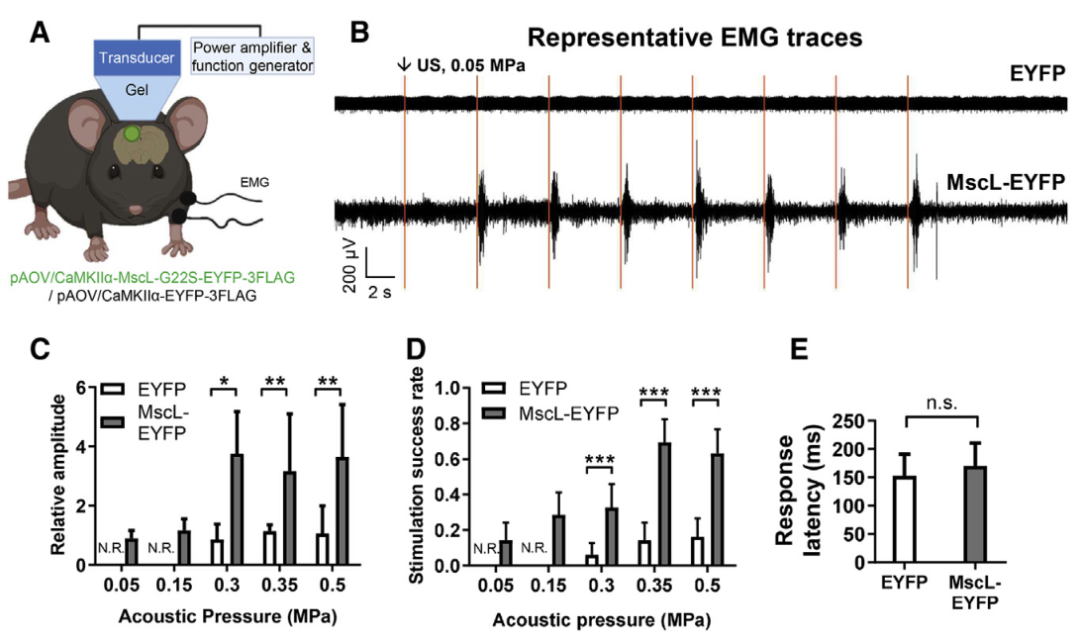
2、低强度超声能够诱导肌肉反应且选择性激活MscL-G22S神经元
图3. 超声刺激表达MscL-G22S的小鼠皮层能引起更显著的肌肉反应(Qiu, Zhihai et al. Cell reports. 2020)
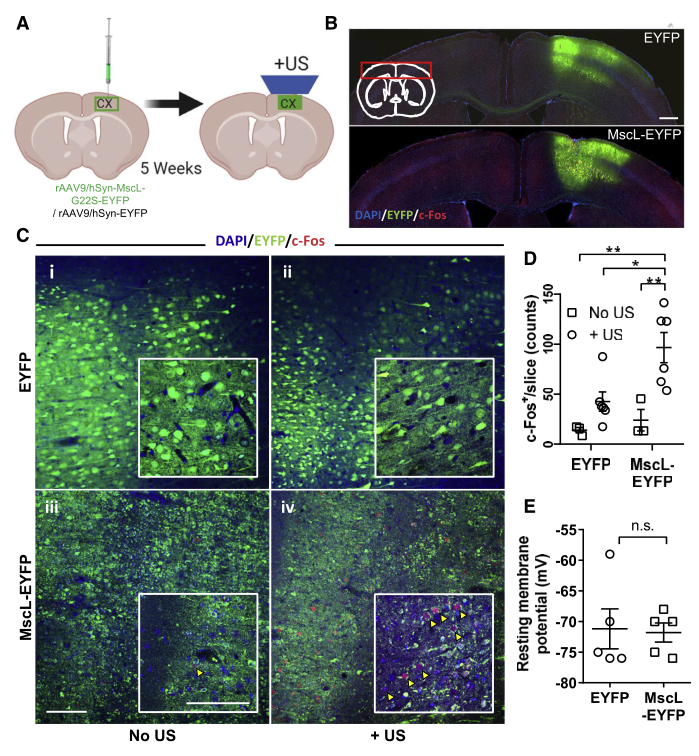
图4. 低强度超声显著激活小鼠大脑皮层表达MscL-G22S的神经元(Qiu, Zhihai et al. Cell reports. 2020)
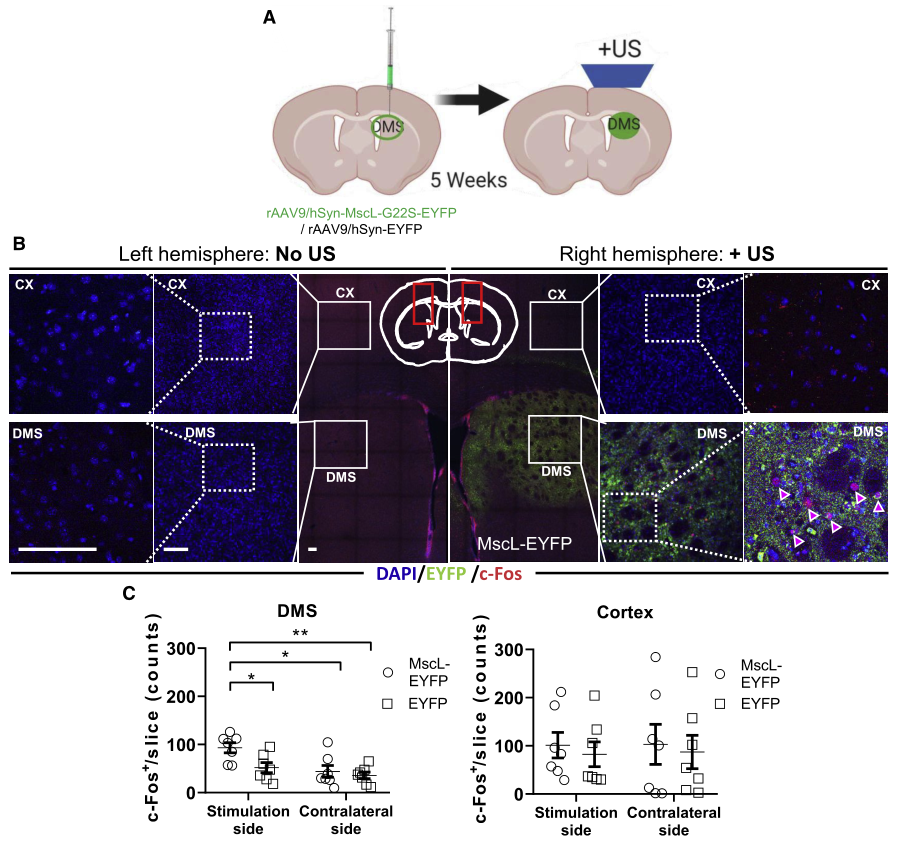
图5. 低强度超声显著激活小鼠DMS中表达MscL-G22S的神经元(Qiu, Zhihai et al. Cell reports. 2020)
3、Mscl-超声遗传学介导高时空分辨率的视觉恢复
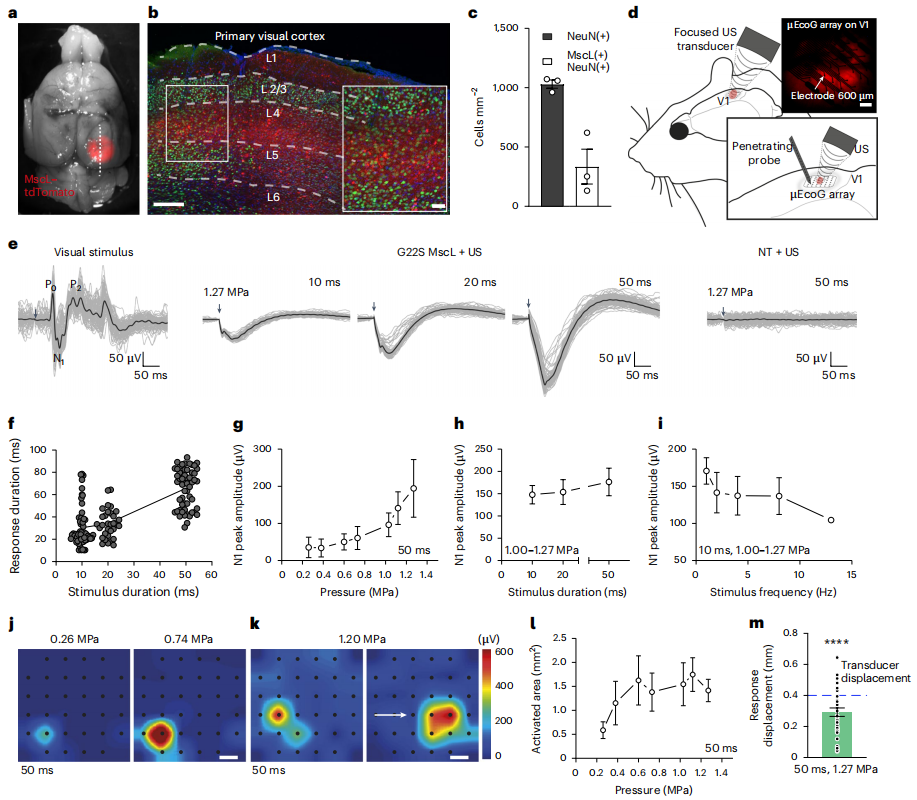
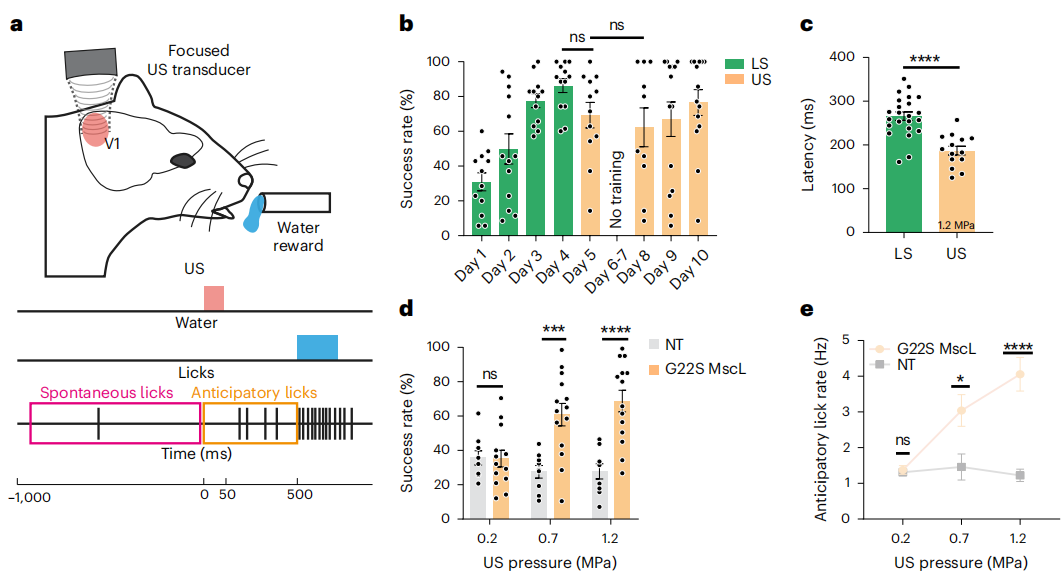
此外,研究人员使用AAV载体注入大鼠初级视皮层(V1),在神经元特异性CaMKII启动子的控制下表达MscL-G22S,并在V1的皮质表面放置了微电极皮层电图(μEcoG)电极阵列。检测结果表明超声遗传学治疗方法在15 MHz刺激下可能实现400 μm内的空间分辨率(图8)。为确定超声激活表达MscL-G22S的兴奋性皮质神经元是否能够引发光感知,研究者在V1脑区表达MscL-G22S和未表达(NT)小鼠中进行了联合学习测试,测试包括15 MHz超声波刺激V1。经过训练MscL-G22S小鼠能够将光刺激与水分奖励联系起来,成功率随时间增加显著提高。在进行超声刺激后,MscL-G22S小鼠的成功率与光刺激后的表现相当,而NT小鼠的成功率则显著下降(图9)。这些发现表明,超声遗传学技术可能在小鼠中模拟光感知,为未来视觉恢复治疗提供了新的思路。
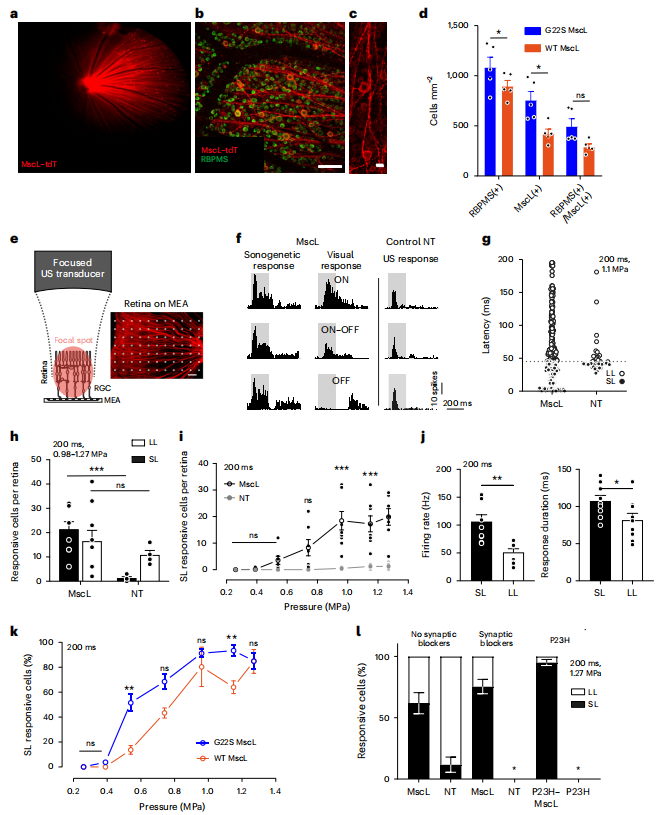
图6. 大鼠RGCs的超声遗传学治疗(Cadoni, Sara et al. Nature nanotechnology. 2023)
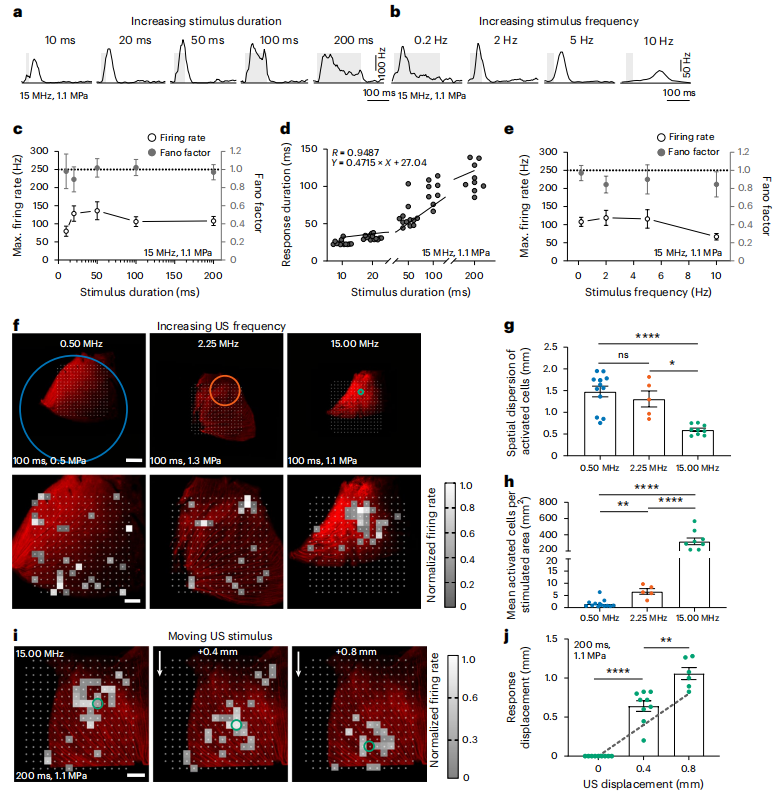
图7. 超声遗传学视网膜反应的时空特性(Cadoni, Sara et al. Nature nanotechnology. 2023)
图8. 体内V1皮层神经元超声遗传学治疗的空间分辨率(Cadoni, Sara et al. Nature nanotechnology. 2023)
图9. 小鼠在联合视觉训练后由V1皮层的超声遗传学激活诱导的行为反应(Cadoni, Sara et al. Nature nanotechnology. 2023)
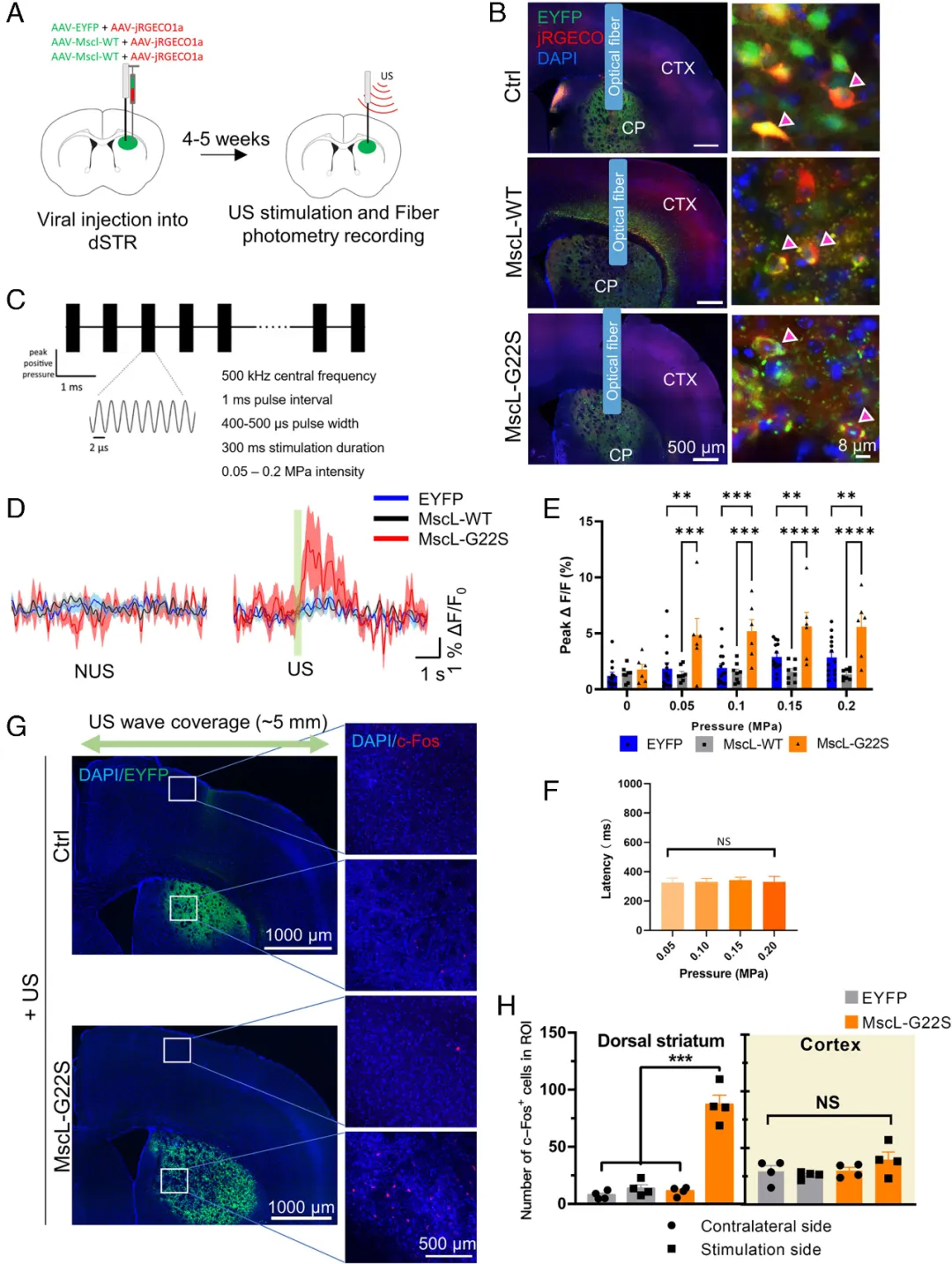
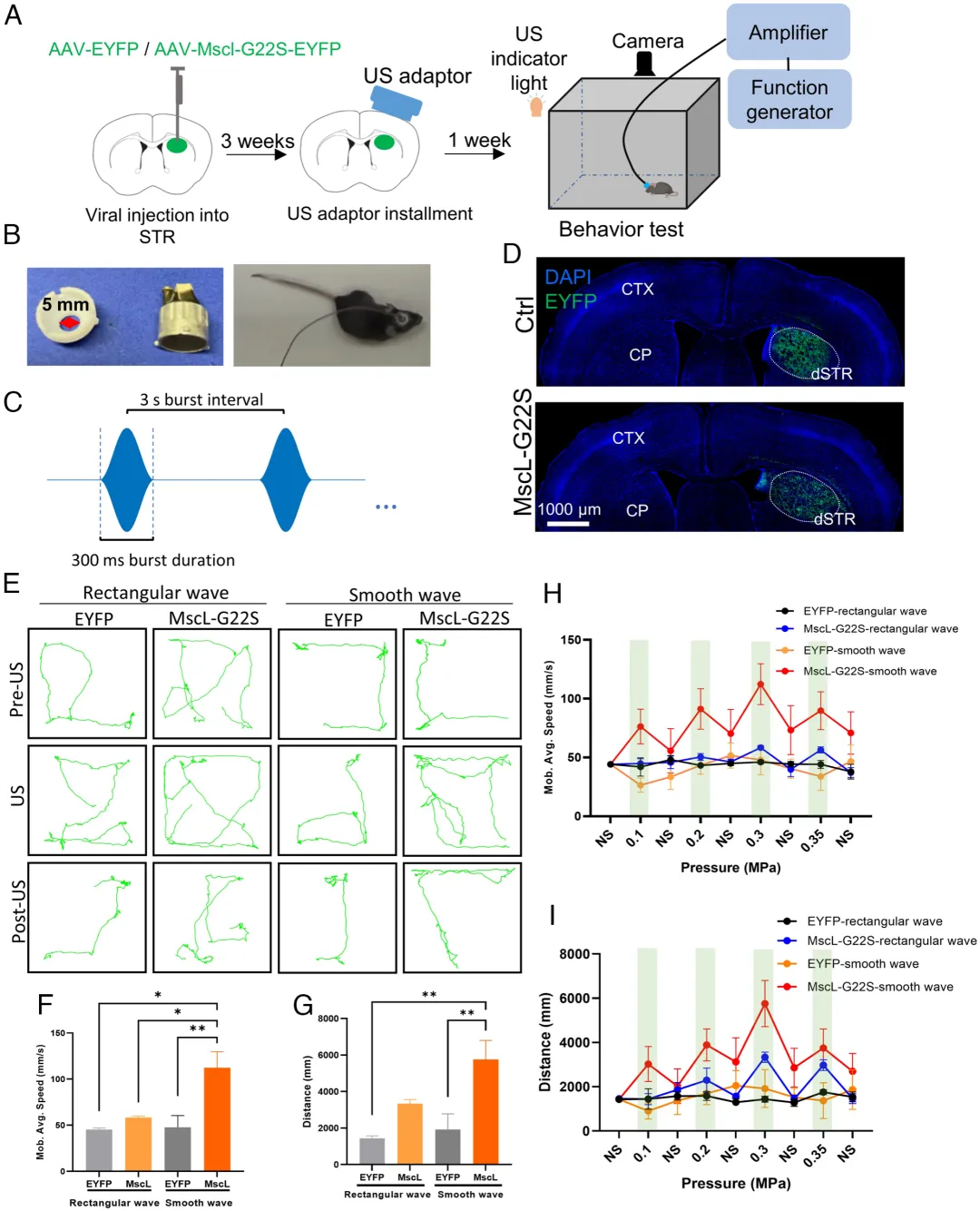
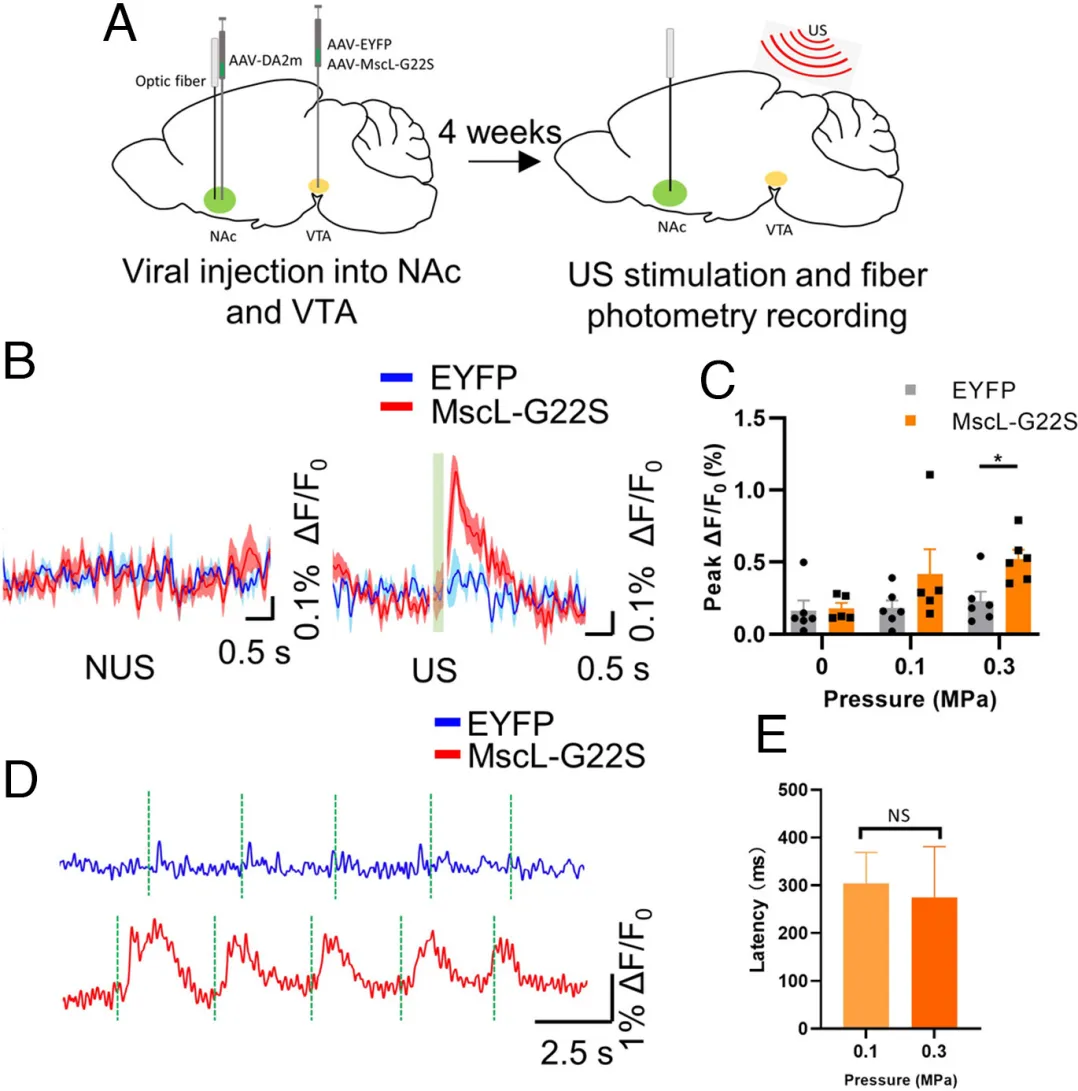
4、Mscl-超声遗传学特异性激活dSTR神经元并诱导自由移动小鼠的运动反应
图10. Mscl-超声遗传学方法能够特异性激活dSTR的神经元活动(Xian, Quanxiang et al. Proc Natl Acad Sci U S A. 2023)
图11. 超声刺激诱导dSTR表达MSCL-G22S的小鼠产生更大的运动反应(Xian, Quanxiang et al. Proc Natl Acad Sci U S A. 2023)
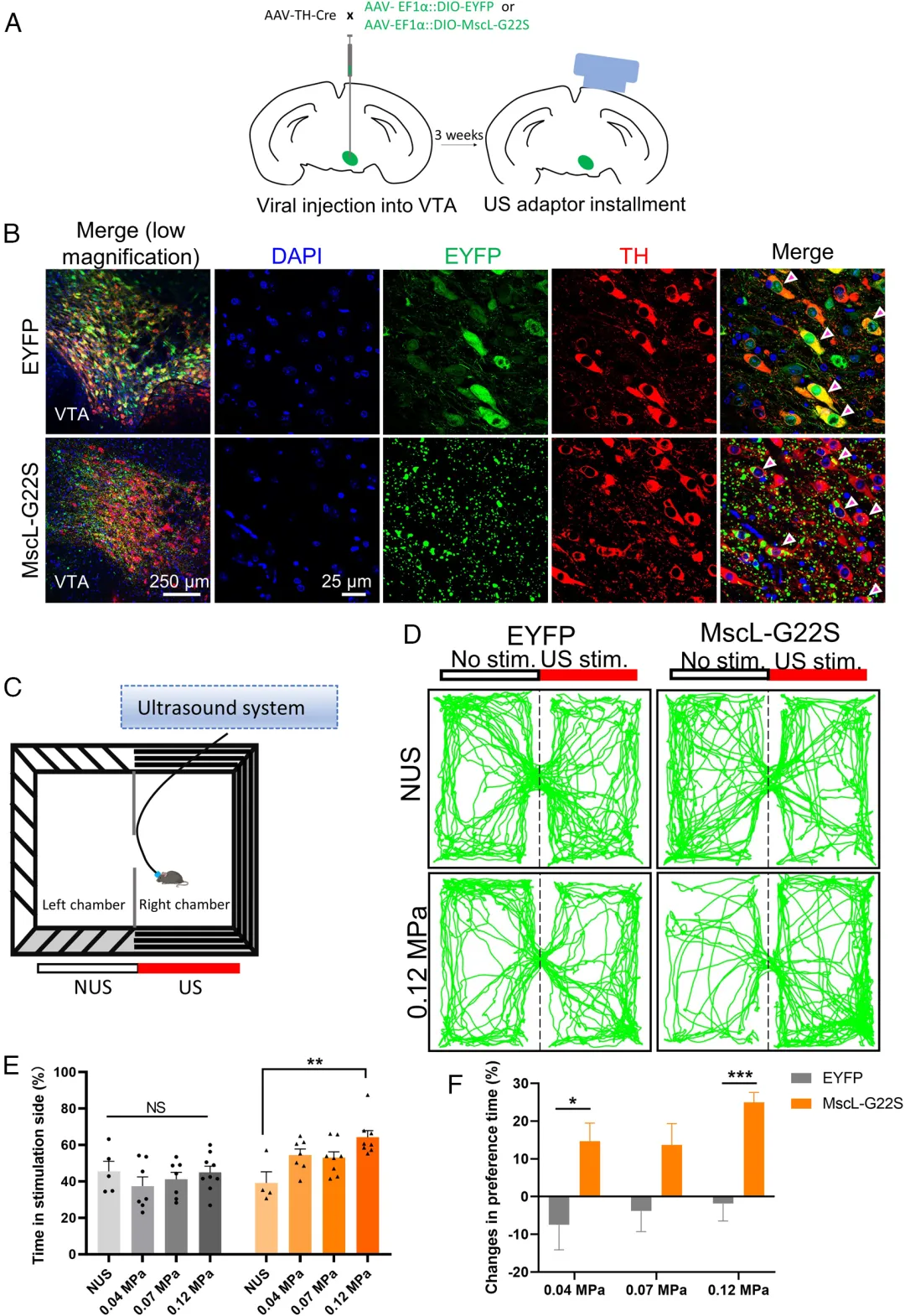
5、通过MscL-超声遗传学调节VTA奖赏环路实现诱导多巴胺释放和改变动物位置偏好行为
图12. Mscl-超声遗传技术可以选择性激活中脑边缘通路改变位置偏好行为(Xian, Quanxiang et al. Proc Natl Acad Sci U S A. 2023)
图13. Mscl-超声遗传方法可以通过调控中脑边缘通路诱导VTA中的多巴胺释放(Xian, Quanxiang et al. Proc Natl Acad Sci U S A. 2023)
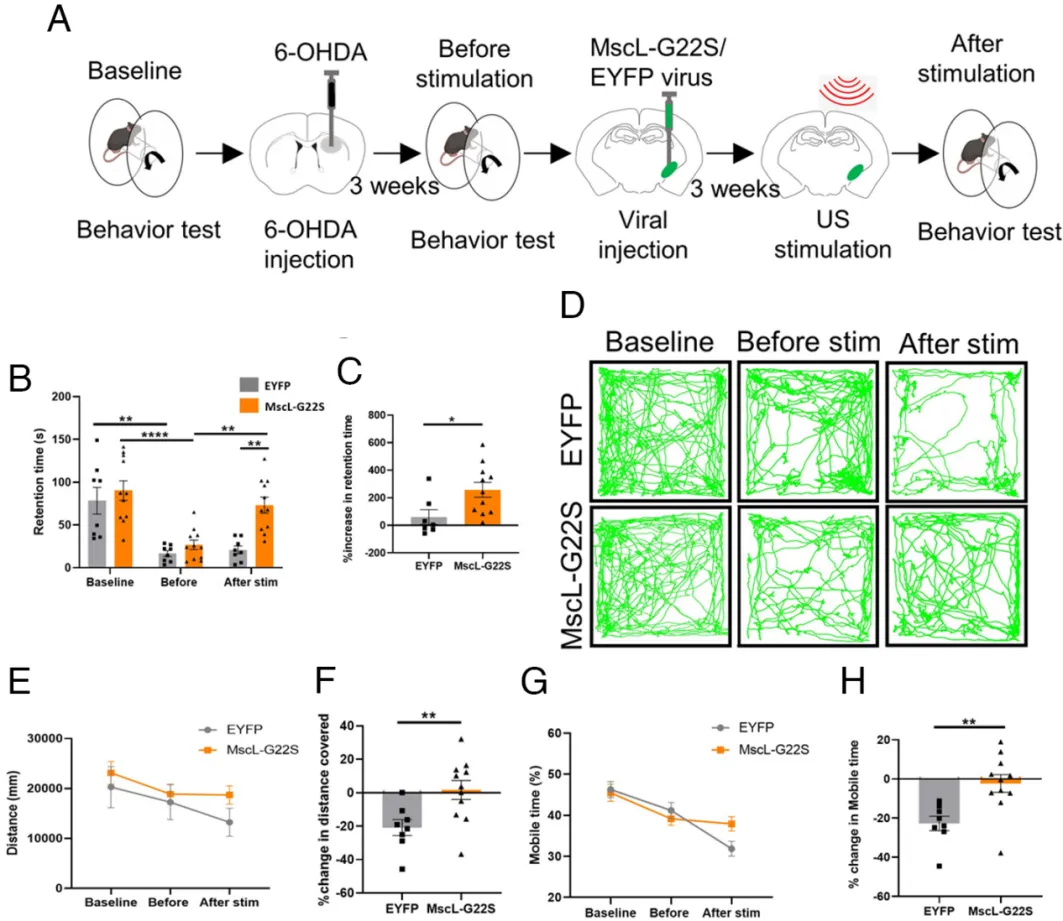
6、体内Mscl-超声遗传学刺激可缓解自由移动小鼠的帕金森疾病症状
图14. 超声遗传学调控STN脑区有效改善PD小鼠的运动障碍(Xian, Quanxiang et al. Proc Natl Acad Sci U S A. 2023)
总结
超声遗传学结合了机械敏感介质和非侵入性超声刺激,通过在特定脑区注射病毒并使用Cre-Lox系统,实现了对特定细胞类型的精准调控。这种组合式的方法为定制化治疗方案提供了多种机会,并有望与其他技术如fMRI(功能性磁共振成像)整合,拓展到大型动物的研究中。关于超声遗传学的一个潜在问题是神经元的非特异性激活,为了降低这种影响,研究团队采用了低强度的超声波。尽管如此,内源性机械敏感离子通道的存在仍可能对此产生影响。因此,提高超声遗传介质的灵敏度以及开发精确检测原位声压的策略对对于超声遗传学的发展至关重要,未来研究需进一步探索超声对机械敏感离子通道的作用机制。
总而言之,与药理学或基于病变的干预措施不同,超声遗传学具有非侵入性的优势,同时具备细胞特异性和神经环路准确性。作为一种新兴的神经调控技术,超声遗传学展现了在治疗神经系统疾病方面的巨大潜力,并有望成为传统治疗方法的重要补充。
我司可提供孙雷教授单独授权的超声遗传学系列病毒,列表如下:

参考文献:
1. Qiu, Zhihai et al. “Targeted Neurostimulation in Mouse Brains with Non-invasive Ultrasound.” Cell reports vol. 34,1 (2021): 108595. doi:10.1016/j.celrep.2020.108595
2. Ibsen, Stuart et al. “Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans.” Nature communications vol. 6 8264. 15 Sep. 2015, doi:10.1038/ncomms9264
3. Huang, Yao-Shen et al. “Sonogenetic Modulation of Cellular Activities Using an Engineered Auditory-Sensing Protein.” Nano letters vol. 20,2 (2020): 1089-1100. doi:10.1021/acs.nanolett.9b04373
4. Sorum, Ben et al. “Ultrasound activates mechanosensitive TRAAK K+ channels through the lipid membrane.” Proceedings of the National Academy of Sciences of the United States of America vol. 118,6 (2021): e2006980118. doi:10.1073/pnas.2006980118
5. Yang, Yaoheng et al. “Sonothermogenetics for noninvasive and cell-type specific deep brain neuromodulation.” Brain stimulation vol. 14,4 (2021): 790-800. doi:10.1016/j.brs.2021.04.021
6. Duque, Marc et al. “Sonogenetic control of mammalian cells using exogenous Transient Receptor Potential A1 channels.” Nature communications vol. 13,1 600. 9 Feb. 2022, doi:10.1038/s41467-022-28205-y
7. Liu, Tianyi et al. “Sonogenetics: Recent advances and future directions.” Brain stimulation vol. 15,5 (2022): 1308-1317. doi:10.1016/j.brs.2022.09.002
8. Chang, G et al. “Structure of the MscL homolog from Mycobacterium tuberculosis: a gated mechanosensitive ion channel.” Science (New York, N.Y.) vol. 282,5397 (1998): 2220-6. doi:10.1126/science.282.5397.2220
9. Liu, Zhenfeng et al. “Structure of a tetrameric MscL in an expanded intermediate state.” Nature vol. 461,7260 (2009): 120-4. doi:10.1038/nature08277
10. Martinac, Boris. “Mechanosensitive ion channels: molecules of mechanotransduction.” Journal of cell science vol. 117,Pt 12 (2004): 2449-60. doi:10.1242/jcs.01232
11. Ye, Jia et al. “Ultrasonic Control of Neural Activity through Activation of the Mechanosensitive Channel MscL.” Nano letters vol. 18,7 (2018): 4148-4155. doi:10.1021/acs.nanolett.8b00935
12. Sukharev, S et al. “The gating mechanism of the large mechanosensitive channel MscL.” Nature vol. 409,6821 (2001): 720-4. doi:10.1038/35055559
13. D'Angelo, Egidio, and Stefano Casali. “Seeking a unified framework for cerebellar function and dysfunction: from circuit operations to cognition.” Frontiers in neural circuits vol. 6 116. 10 Jan. 2013, doi:10.3389/fncir.2012.00116
14. Yoshimura, K et al. “Hydrophilicity of a single residue within MscL correlates with increased channel mechanosensitivity.” Biophysical journal vol. 77,4 (1999): 1960-72. doi:10.1016/S0006-3495(99)77037-2
15. Heureaux, Johanna et al. “Activation of a bacterial mechanosensitive channel in mammalian cells by cytoskeletal stress.” Cellular and molecular bioengineering vol. 7,3 (2014): 307-319. doi:10.1007/s12195-014-0337-8
16. Cadoni, Sara et al. “Ectopic expression of a mechanosensitive channel confers spatiotemporal resolution to ultrasound stimulations of neurons for visual restoration.” Nature nanotechnology vol. 18,6 (2023): 667-676. doi:10.1038/s41565-023-01359-6
详情欢迎扫码咨询
微信号:BrainVTA2020


市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK