2024-11-26 阅读量:2714
嵌合抗原受体(CAR) T细胞疗法在治疗B细胞恶性肿瘤方面已经证明了变革性的疗效。然而,高成本和制造复杂性阻碍了它们的广泛应用。为了克服这些障碍,作者开发了VivoVec平台,这是一种能够在体内产生CAR-T细胞的慢病毒载体,T细胞激活和共刺激信号以多域融合蛋白的形式结合到VivoVec颗粒(VVP)表面,并显示出增强的体内转导和改善的CAR-T细胞抗肿瘤功能。此外,在没有淋巴细胞消耗化疗的情况下,对非人灵长类动物施用VVP可导致抗CD20 CAR-T细胞的强劲生成和B细胞的完全耗尽,持续时间超过10周。这些数据支持其向人体临床试验的过渡,为CAR-T细胞治疗领域提供了模式转变。
近期发表在《Blood》期刊上题为“In vivo CAR T-cell generation in nonhuman primates using lentiviral vectors displaying a multidomain fusion ligand”的一篇文章研究了一种VivoVec的慢病毒系统,该慢病毒通过在T细胞结合时同时激活T细胞受体复合体和共刺激分子,模仿了生理上关键的启动信号,从而体内生成了大量高质量的CAR-T细胞,其扩增方式类似于对特异性抗原作出反应的内源性T细胞。
枢密科技可提供在体内产生CAR T细胞的病毒载体现货及定制产品,该产品能够以多结构域融合蛋白的形式将T细胞激活和共刺激信号整合到病毒颗粒表面,并显示出增强的体内转导和改进的CAR-T细胞抗肿瘤功能。
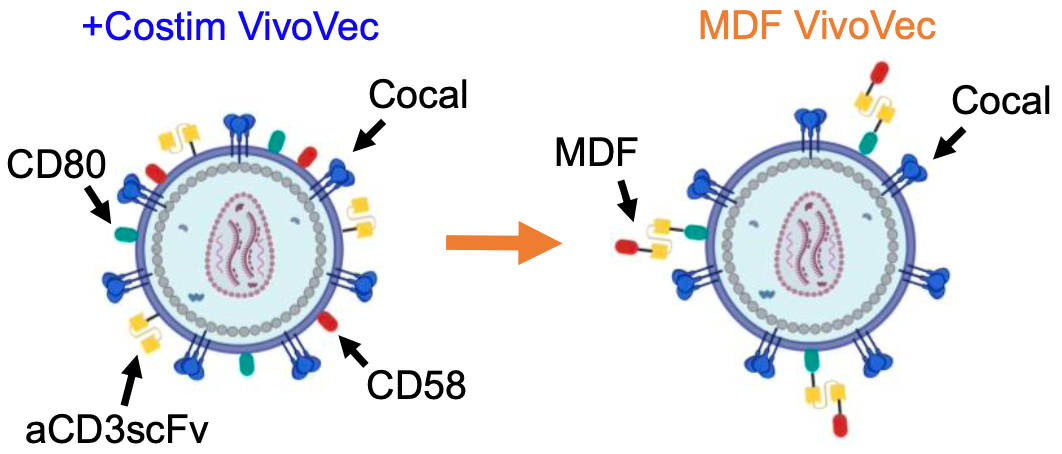
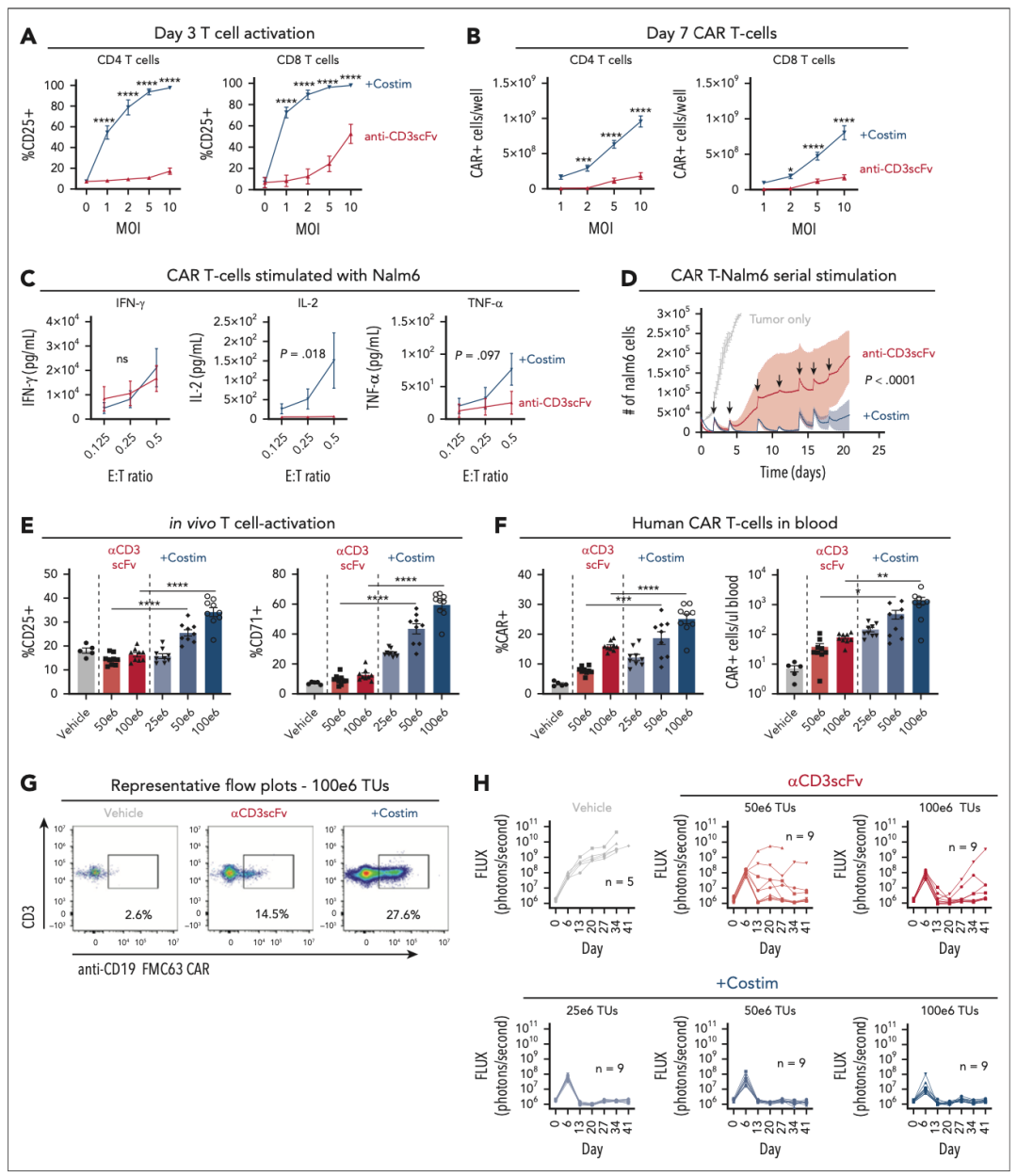
作者构建了名为VivoVec的平台,由第三代自失活的慢病毒颗粒(VVP)组成,这些颗粒表面表达了一种抗CD3单链可变片段(scFv);为了于确保T细胞的正常激活、促进分化、获得效应功能和形成长期记忆,作者在慢病毒颗粒表面插入CD80和CD58共刺激因子,并进行测试:实验组为载有共刺激因子(Costin)的VVP,对照组为不含有CD80和CD58共刺激因子(anti-CD3 scFv)的VVP,两者与健康供体的外周血单个核细胞(PBMC)体外培养后,将产生的CAR-T细胞与肿瘤细胞接触,结果显示:载有CD80和CD58共刺激因子的VVP所产生的CAR-T能分泌更多的免疫因子,且随着时间的推移更好地控制肿瘤细胞的生长。
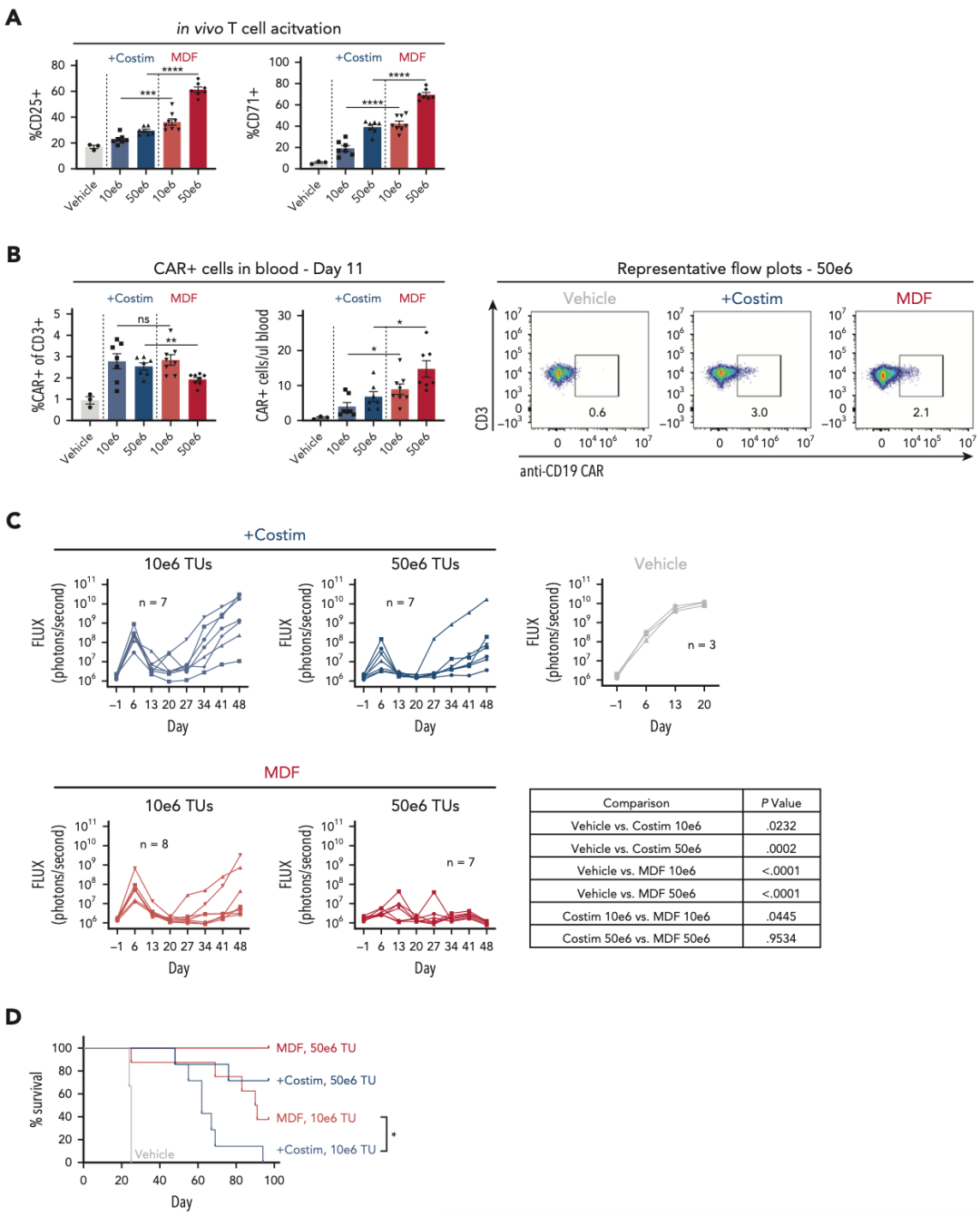
在体内实验中,作者采用全身性Nalm6、PBMC人源化NSG MHC I/II KO小鼠模型(将Nalm6肿瘤细胞通过静脉注射接种到NSG MHC I/II敲除小鼠体内,随后通过腹腔注射给予人源PBMC。)检测体内抗肿瘤效果,与体外数据一致,用带有共刺激配体的抗CD3 scFv的VVP处理的动物显示出更高的CAR-T细胞数量,随着时间的推移评估肿瘤负荷,用实验组的VVP治疗的动物在较低剂量下表现出更好的肿瘤控制。
图1. 在慢病毒颗粒表面插入CD80和CD58共刺激因子
图2. 含有CD80和CD58共刺激结构域的VVP增强了T细胞活化,产生更多数量的CAR-T细胞,可以在体外和体内增强抗肿瘤功能。
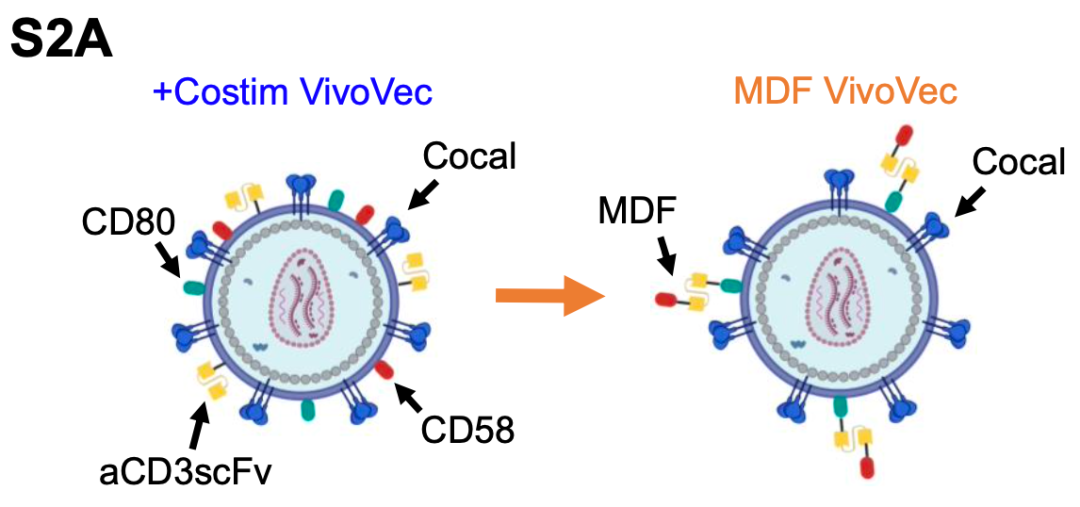
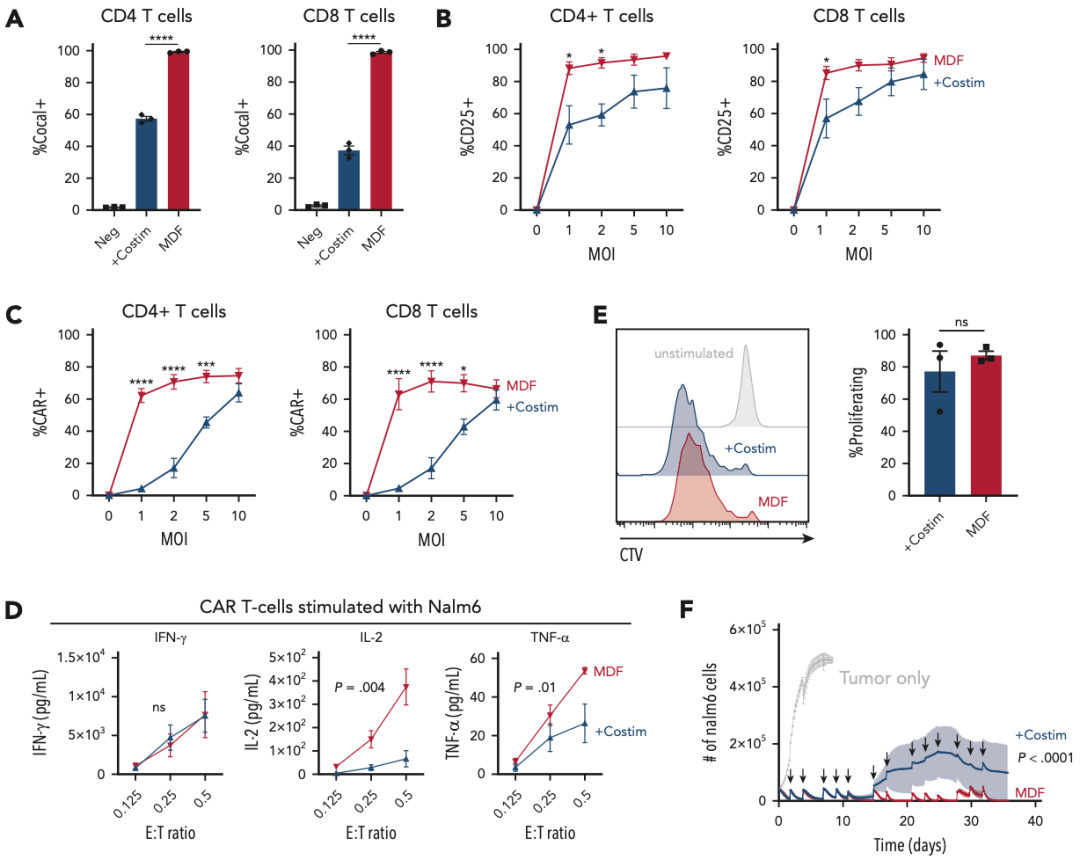
作者为了简化VVP的制造,设计了一种由CD58、抗CD3 scFv和CD80组成的单多肽MDF(多结构域融合)蛋白,并成功地将MDF蛋白包装在VVP上。体外结果显示:载有MDF蛋白的VVP(MDF VVP)与T细胞的结合,比对照组VVP颗粒的结合要大得多,并导致更高的T细胞的CD25表达。此外,MDF VVP在体外更有效地生成CAR-T细胞。有趣的是,MDF VVP生成的CAR-T细胞在Nalm6共培养后产生更多的IL-2和肿瘤坏死因子-a,这表明MDF VVP生成的CAR-T细胞可能具有更强的功能,与增强的抗肿瘤功能和持久性一致,MDF VVP生成的CAR-T细胞在一系列刺激实验中能够更好地控制Nalm6肿瘤的生长,甚至优于使用传统的基于aCD3/aCD28(Dynabeads)的刺激方案生成的CAR-T细胞。这些数据表明,MDF VVP在体外更有效地产生CAR-T细胞,具有增强的抗肿瘤功能。
图3. CD58、抗CD3 scFv和CD80组成的单多肽MDF蛋白成功地包装在VVP上
图4. MDF蛋白包含一个与CD58细胞外结构域和CD80融合的抗CD3 scFv,表现出增强T细胞活化和转导的特性。
作者为了测试新载体MDF VVP的体内实验效果,使用上述NSG MHC I/II KO小鼠模型检测了MDF VVP在体内的抗肿瘤功能。与体外观察结果一致,与抗CD3 scFv和个体共刺激配体的VVP相比,MDF VVP在激活血液中T细胞的情况下表现出更高的效力。在第11天,作者观察到两组VVP颗粒,在血液中产生了相似百分比的CAR-T细胞,但含有MDF的VVP颗粒产生了更大的数量,这可能是由于MDF蛋白诱导的T细胞活化和随后的增殖增加。与之前的体内异种移植实验相比,血液中观察到的CAR-T细胞较少,这些类型的差异在体内异种移植实验中很常见,是由这些模型中供体T细胞反应的差异引起的。
尽管两种类型的颗粒都能引起肿瘤控制,但MDF VVP在原发性肿瘤清除和总生存期方面表现略好。这在较低剂量的1E+6个转导单位时尤为明显,其中MDF VVP治疗的动物的中位生存期为90.5天,而对照组颗粒的中位生存期为62天。值得注意的是,在5E+6个转导单位的较高剂量下,MDF VVP治疗的动物在研究期间获得了100%的存活率。综上所述,这些数据表明,在人源化小鼠白血病模型中,与表达抗CD3 scFv和个体共刺激配体的VVP相比,MDF VVP具有更好的抗肿瘤功效。
图5. MDF VVP在人源化小鼠白血病模型中表现出强劲的抗肿瘤功能
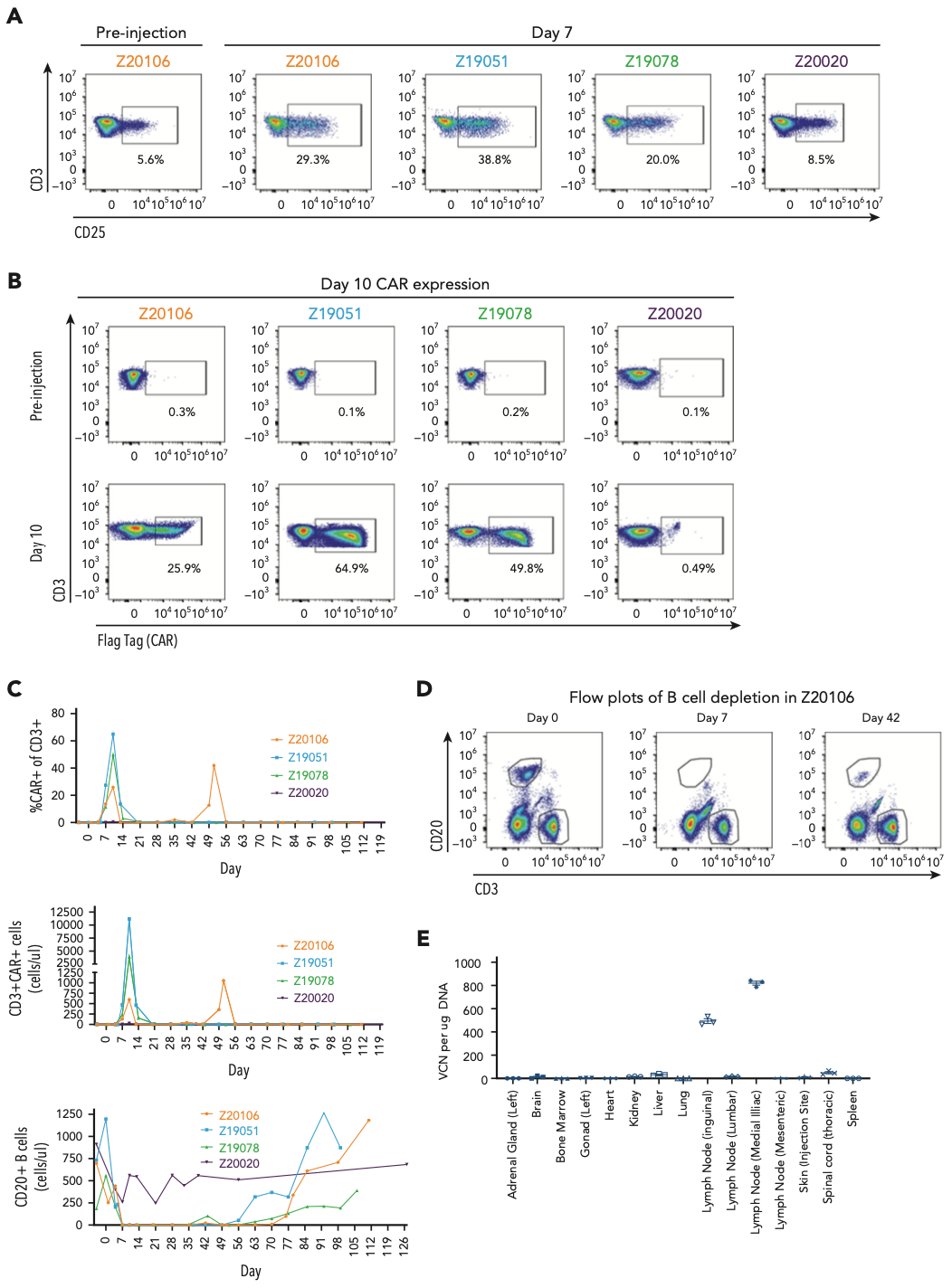
虽然新载体MDF VVP在小鼠实验中取得成功,但人源化小鼠模型有局限性,不能代表动物免疫系统的全部情况,特别是完全缺乏正常发育的次级淋巴组织和对异种移植物抗宿主病的易感性。为了解决这些局限性,作者建立了非人类灵长类动物(NHP)模型,探究MDF VVPs在非人类灵长类动物体内能否有效地生成CAR-T细胞,并导致B细胞的耗竭。
作者用抗NHP CD3 scFv38取代了抗人CD3 scFv。人源CD58和CD80被保留,因为这两个蛋白在两个物种之间具有高度的序列同源性。通过淋巴结注射的方式给4只NHPs注射了携带抗CD20 CAR有效载荷的NHP MDF VVPs,剂量不等。结果显示:在4只动物中,有3只在注射后7天内显示了NHP MDF VVPs诱导的T细胞激活。这些动物在注射后的第10天,体内生成了高达65%的CAR-T细胞,B细胞的数量急剧下降,到了第7天,B细胞没了。作为剂量递减研究的一部分,一只动物(Z20020)接受了五倍低剂量的VVPs,这只动物没有明显的T细胞激活迹象。通过淋巴内注射给予的VivoVec在免疫功能正常的非人类灵长类动物体内能够有效地生成CAR-T细胞,而无需进行淋巴细胞耗竭。这些CAR-T细胞高度功能性,导致长达76天的B细胞耗竭。
结论
在体CAR-T细胞疗法在治疗B细胞恶性肿瘤方面已显示出显著的疗效,但其制造和管理方面的重大挑战阻碍了其广泛应用。CAR-T细胞的体内生成是一种新兴的方法,可以缓解这些重大的后勤问题。作者为VivoVec平台提供了明确的原理证明,并证明了在NHPs中高效地在体内生成高功能CAR-T细胞。这些结果为基于VivoVec的药物产品进入人体临床研究奠定了基础,有可能在肿瘤和自身免疫性疾病适应症中大幅扩大患者获得治愈的机会。
枢密科技已开发一系列慢病毒现货产品,可提供基因下调、基因过表达、基因敲入/敲除、功能扰动、钙信号检测等现货产品及包装定制服务。质量稳定,周期短,欢迎查询选购!现在还有一口价(点击了解详情)的优惠活动哦~走过路过,不要错过!

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK