2024-12-09 阅读量:1096
牙本质(Dentin)是牙齿的主要硬组织,对牙齿的正常功能起着至关重要的作用,成牙本质细胞(Odontoblasts)负责牙本质的形成。据报道,小鼠中几种基因的突变或缺失,如Dlx3、Dspp和Mdm2,会导致成牙本质功能障碍和随后的异常牙本质形成。在人类中,包括DSPP、COL1A1、COL1A2和SMOC2在内的基因突变也会导致遗传性牙本质疾病。这种牙本质缺陷是否可以通过成牙细胞基因治疗来逆转仍是未知的。
基因疗法是一种通过向体内细胞直接导入遗传物质或在体外修饰细胞后再回输至体内,以治疗疾病的方法。腺相关病毒(AAV)是基因治疗中最常用的病毒载体,具有高安全性、可长效表达基因、免疫原性低、嗜性广泛、血清型众多等优点。近年来,AAV已被应用于多种人类遗传性疾病的临床试验中,如Leber先天性黑矇、Duchenne型肌营养不良和血友病B等。然而,AAV是否可以作为基因治疗工具递送到成牙本质细胞以阻断遗传性牙本质疾病仍然未知。
2023年5月17日,武汉大学口腔医院袁国华主任医师团队在Human Gene Therapy期刊在线发表了题为“AAV6-Mediated Gene Therapy Prevents Developmental Dentin Defects in a Dentinogenesis Imperfecta Type III Mouse Model”的研究论文。本研究筛选出AAV6血清型为一种安全高效的载体,能够成功将基因转移至成牙本质细胞。通过局部注射病毒,实现了向牙齿的有效基因递送。基于AAV6的基因疗法在治疗人类遗传性牙本质疾病方面展现出潜在的有效性。

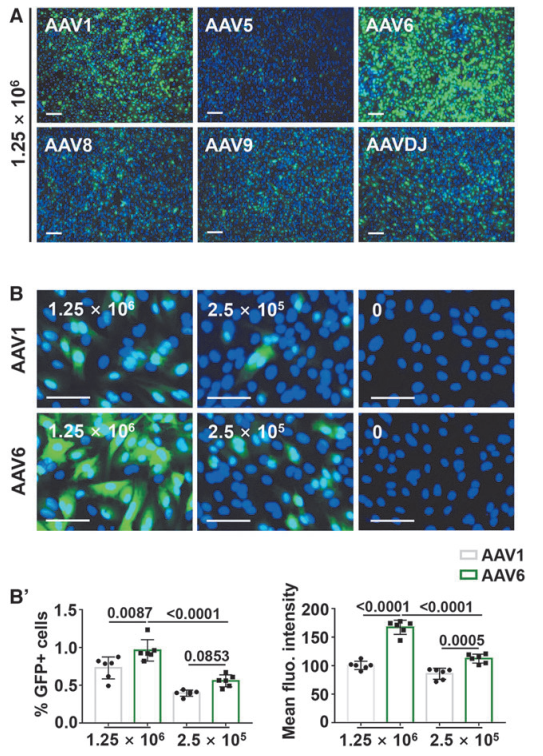
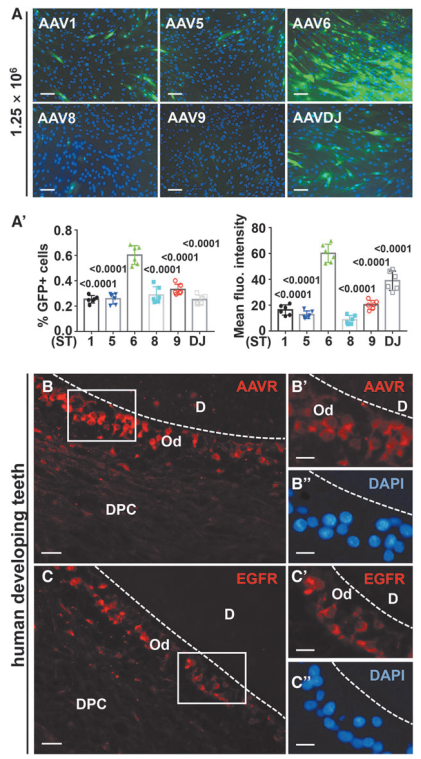
首先作者对比了6种常用的AAV血清型(AAV1、AAV5、AAV6、AAV8、AAV9和AAVDJ)对小鼠成牙本质细胞样细胞(Odontoblast-like cells,OLCs)的感染效率。结果显示,AAV1和AAV6的感染效率高于其他AAV血清型,MOIs(感染指数)分别为1.25×10^6和6.25×10^5 vg/cell。通过量化GFP(绿色荧光蛋白)阳性细胞百分比和平均荧光强度,进一步比较不同MOIs下AAV1和AAV6血清型的感染效率。结果显示,AAV6感染细胞中GFP阳性细胞百分比和GFP平均表达水平均高于AAV1血清型感染细胞,MOIs分别为1.25×10^6和2.5×10^5 vg/cell。表明AAV6血清型能高效感染体外培养的小鼠OLCs。
图1. AAV6血清型能高效感染体外培养的小鼠OLCs
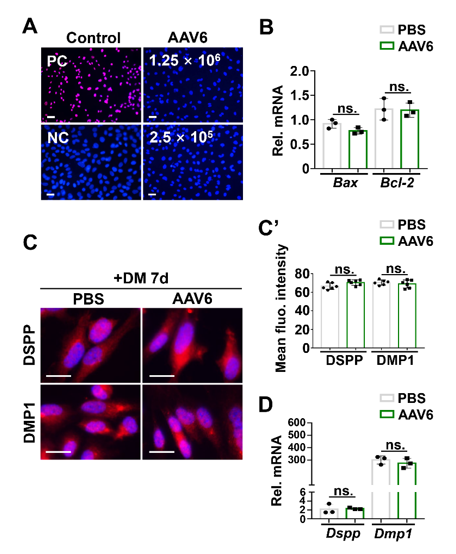
为了检测AAV6感染是否会对小鼠OLCs产生不良影响,接着作者采用TUNEL(脱氧核糖核苷酸末端转移酶介导的缺口末端标记法)检测细胞凋亡,与DNaseI(脱氧核糖核酸酶I)处理的阳性对照细胞相比,AAV6感染组中凋亡细胞较少;采用qRT-PCR(实时定量反转录聚合酶链式反应)方法检测凋亡相关基因Bcl-2和Bax的表达,结果显示,在感染AAV6和未感染AAV6的细胞中,两者均未显示出显著差异;免疫荧光(IF)检测分化诱导后DSPP和DMP1(DSPP和DMP1是成牙细胞分化的两种标志物)的表达水平,结果显示,感染AAV6的小鼠OLCs与未感染的小鼠OLCs中,DSPP和DMP1的荧光强度无明显差异。同时,qRT-PCR也显示两组间Dspp和Dmp1的mRNA水平无显著差异。以上结果表明AAV6感染OLCs不影响其存活和分化能力。
图2. AAV6感染对体外小鼠OLCs无不良影响
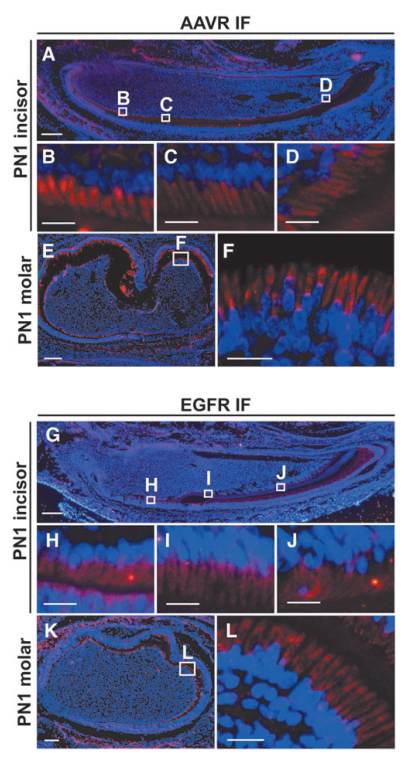
已有研究表明两种细胞受体AAVR(AAV受体)和EGFR(表皮生长因子受体)可识别AAV6,接下来为了评估AAV6在体内递送至小鼠成牙本质细胞的可行性,作者用免疫荧光检测了两种受体在小鼠磨牙和门牙中的表达模式。发现AAVR在小鼠门牙和磨牙的成牙层中均高表达,包括前成牙本质细胞、分泌型成牙本质细胞以及成熟成牙本质细胞。同时在门牙和磨牙的成牙本质细胞层中也观察到显著的EGFR阳性信号。表明对AAV6具有高亲和力的两个受体AAVR和EGFR在小鼠体内成牙层中高表达。
图3. 对AAV6具有高亲和力的两个受体AAVR和EGFR在小鼠体内成牙层中高表达
由于成牙细胞是终末分化的细胞,其细胞突延伸到牙本质小管中,因此分离成牙细胞并在体外将基因递送给成牙细胞的方法是不可行的。为了研究局部给药是否可以作为向成牙本质细胞递送药物的可行方法。作者在出生后第1天(PN1)的小鼠磨牙上局部注射了2 μl的稀释墨水。组织学分析显示,墨水成功注射到了外乳头细胞层和成牙本质细胞层。为深入评估AAV6在体内的嗜向性和转导效率,作者在PN1时向磨牙注射了2 μL的AAV6或磷酸盐缓冲液(PBS)。注射后3天,评估磨牙中的GFP表达。结果显示,AAV6注射组的磨牙成牙本质细胞中可见明显的GFP表达,而PBS注射组的成牙本质细胞则未显示任何GFP表达。
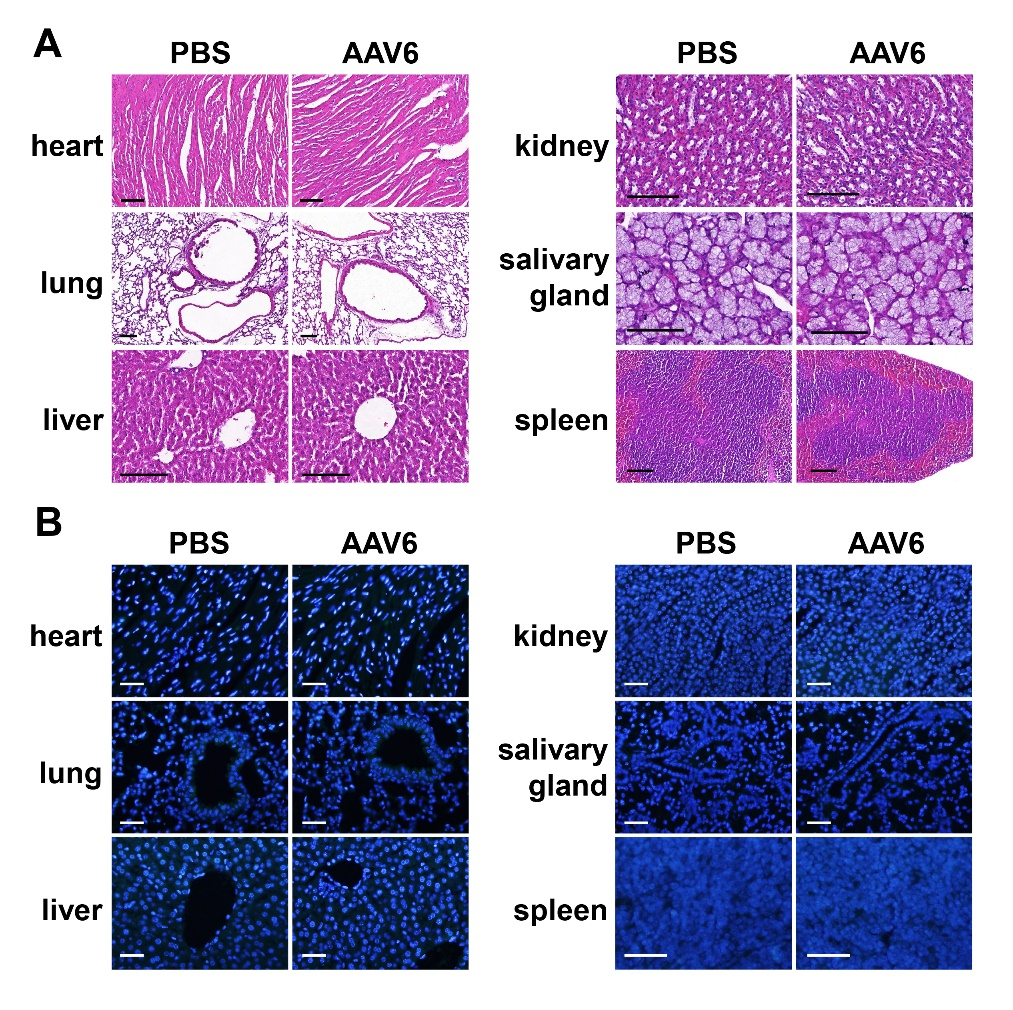
为了观察局部注射AAV6对成牙细胞的长期影响,在注射后1个月采集磨牙。显微计算机断层扫描(μ-CT)和H&E(苏木精-伊红)染色均显示局部注射AAV6未引起牙齿发育缺陷。此外,通过IF检测DSPP和DMP1的表达水平,发现两组间表达水平相当。TUNEL试验显示,局部递送AAV6未诱导细胞凋亡。另外,AAV6注射组的重要器官(如心、肺、肝、肾、脾和唾液腺)均未出现组织学变化或意外感染。表明AAV6局部给药是一种安全有效的小鼠磨牙成牙本质细胞给药方法。
图4. AAV6局部给药是一种安全有效的小鼠磨牙成牙本质细胞给药方法
图5. PBS与AAV6注射组重要器官的组织学分析
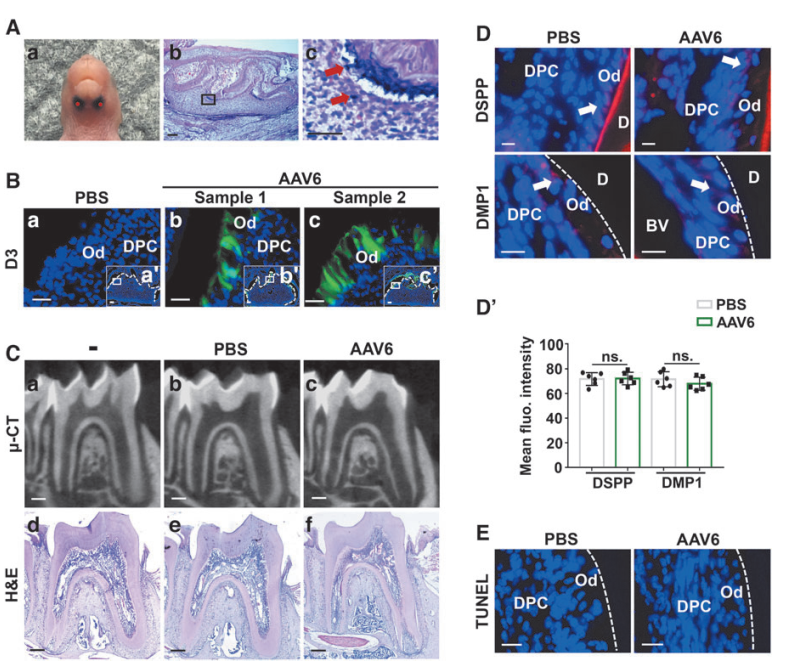
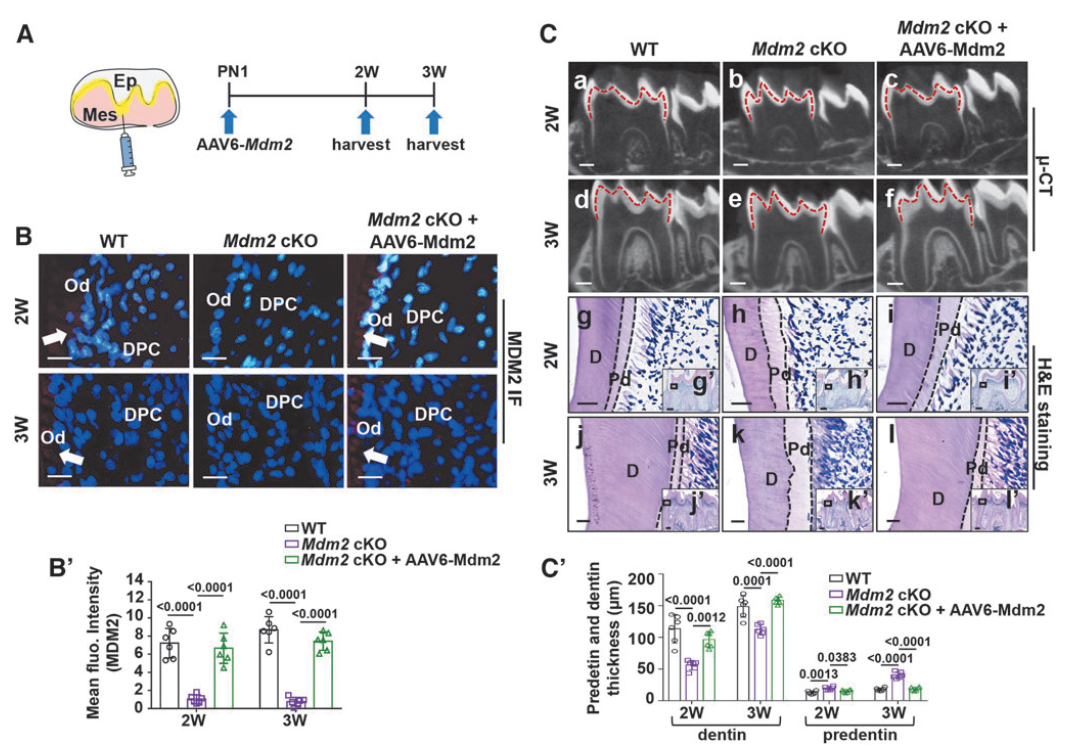
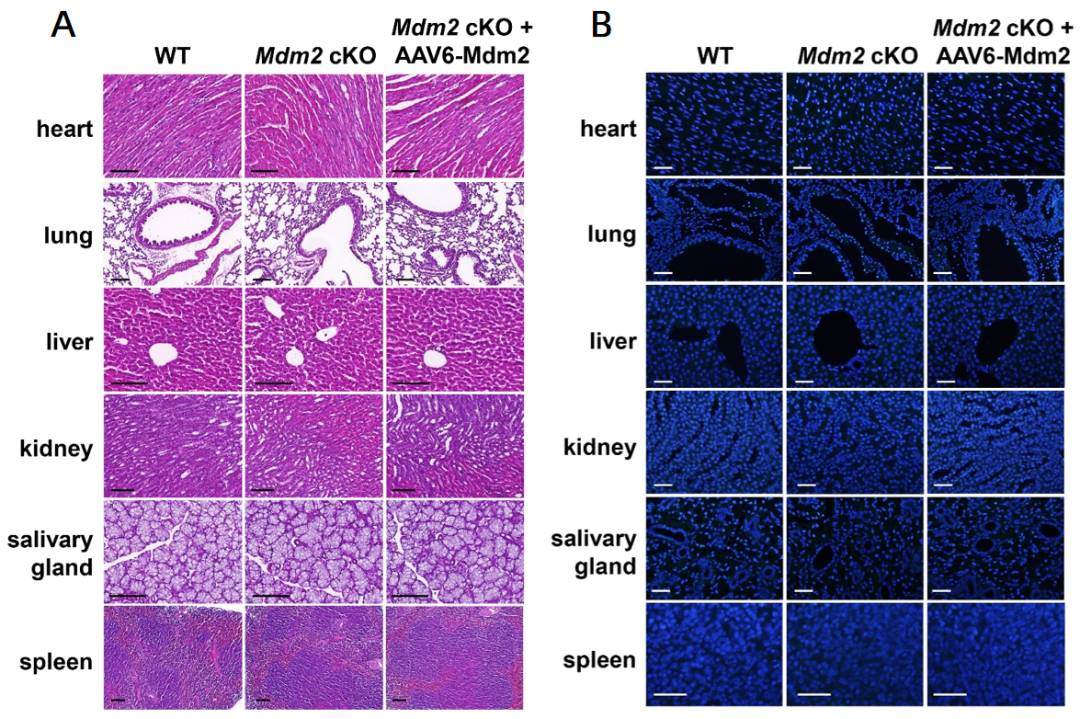
先前研究表明,MDM2(一种E3泛素连接酶)可以增加成牙细胞标记基因Dspp和Dmp1的表达。接下来作者构建了由EF1a启动子驱动MDM2表达的AAV6载体(AAV6-Mdm2),进一步探索AAV6作为成牙细胞基因传递平台的效率。结果发现OLCs中给予AAV6-Mdm2成功地恢复了MDM2 cKO(MDM2条件性敲除)细胞中MDM2的表达,逆转了由Mdm2缺失导致的DSPP和DMP1蛋白水平的降低。近期研究发现,2至3周龄Mdm2 cKO小鼠发育中的磨牙表现出与人III型牙本质发育不全(一种遗传性牙本质疾病)相似的表型。因此,研究采用Mdm2 cKO小鼠作为AAV6载体基因治疗的概念验证临床前模型。对PN1小鼠的磨牙局部注射AAV6-Mdm2,2至3周后,免疫染色显示Mdm2 cKO小鼠成牙本质细胞层MDM2表达恢复;μ-CT扫描显示矿化牙本质的宽度恢复正常;H&E染色显示前牙本质宽度减小,矿化前沿在前牙本质与矿化牙本质之间变得规则。同时,在注射AAV6后3周,心脏、肺、肝、肾、脾和唾液腺等重要器官在AAV6注射组中未显示任何组织学变化或意外感染。因此,局部注射AAV6-Mdm2成功地逆转了Mdm2 cKO小鼠磨牙的牙本质发育缺陷,且没有任何不良影响。
图6. AAV6-Mdm2可逆转MDM2 cKO小鼠的牙质发育缺陷
图7. 重要器官在AAV6注射组中未显示任何组织学变化或意外感染
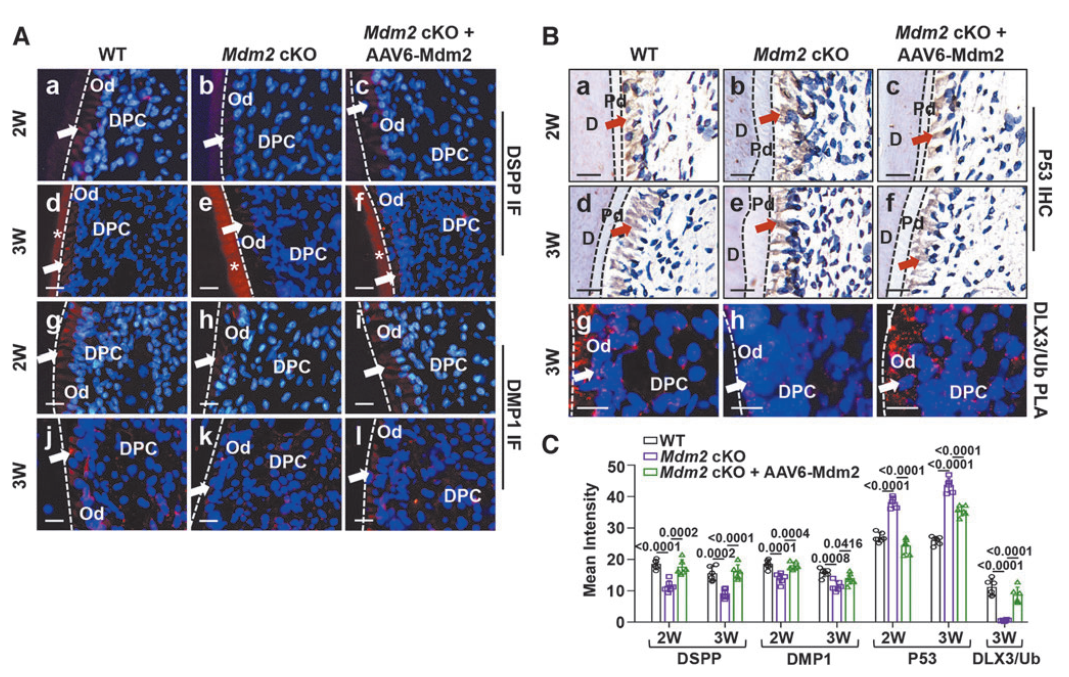
为了进一步评估由AAV6递送的MDM2是否有效发挥功能,作者进行了免疫荧光实验,结果显示Mdm2缺失引起的DSPP和DMP1的表达降低可被AAV6-Mdm2有效逆转,且可抑制Mdm2缺失引起的p53(MDM2的底物)的升高。同时,成牙本质细胞中转录因子DLX3的泛素化水平也得以恢复。表明局部递送AAV6-Mdm2成功逆转Mdm2缺失引起的成牙本质细胞异常蛋白表达。
图8. 局部递送AAV6-Mdm2成功逆转Mdm2缺失引起的成牙本质细胞异常蛋白表达
最后,为了评估不同AAV血清型在人OLCs中的感染效率,作者将六种血清型AAV分别转染人OLCs,在病毒感染后72 h评估感染效率。同样发现AAV6具有最高的感染效率,且AAVR和EGFR在提取的人类发育中的磨牙成牙层中有大量的表达,表明AAV6能有效感染人OLCs,且其高亲和力受体在人磨牙成牙层中高表达。这些结果提示AAV6在人类成牙本质细胞中具有潜在的应用价值,可用于基因递送和治疗人类遗传性牙本质疾病。
图9. AAV6能有效感染人OLCs,且其高亲和力受体在人磨牙成牙层中高表达
结论
武汉大学口腔医院博士研究生傅晶为论文第一作者,武汉大学口腔医院袁国华主任医师为论文通讯作者,本研究得到国家自然科学基金(82170914)资助。
本文使用的病毒均来自枢密科技,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK