2024-11-29 阅读量:2194
哺乳动物的大脑通过三条主要的神经通路,即胼胝体(Corpus callosum,CC)、海马连合(Hippocampal commissure,HC)和前连合(Anterior commissure,AC)实现左右半球之间的链接。这些跨半球的连接被认为在半球间的协作和信息处理中发挥重要作用。人脑的左右半球在功能上不对称,有研究表明动物和人的CC或AC发育不全或损伤可能导致情绪功能障碍,并引发神经精神疾病。然而,这些结构如何连接两个大脑半球及其在情绪中的功能尚不清楚。
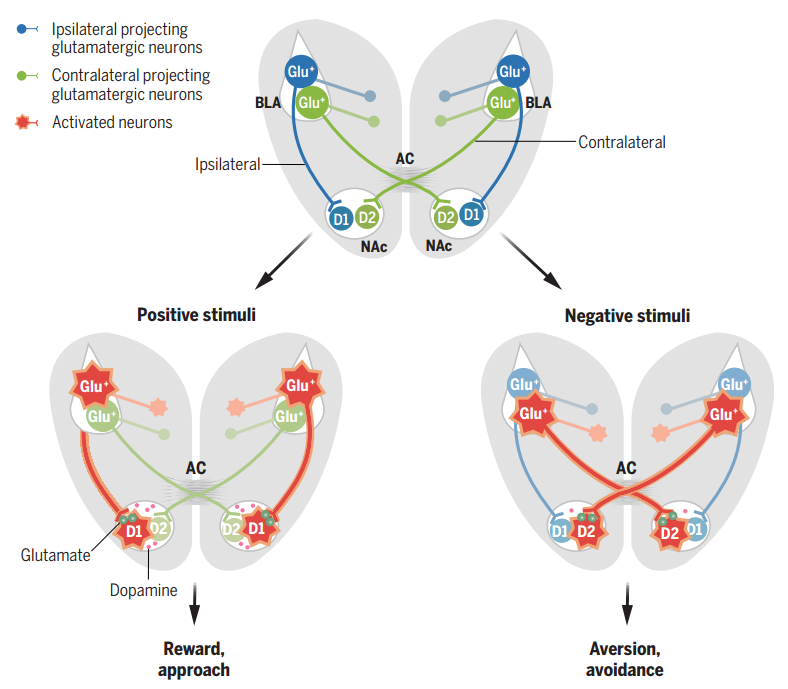
在脊椎动物大脑中,前连合是最古老的连合投射,且其纤维在不同物种间差异显著,在大、小鼠中,AC主要连接嗅觉和杏仁核区域。基底外侧杏仁核(BLA)编码正负情绪效价,其神经元对正负情绪效价相关线索均有响应。BLA内不同神经元群体可能分别编码奖励或厌恶,且正负神经网络输出可能表现出隔离:光激活BLA至伏隔核(NAc)投射促进寻求奖励和食欲行为,而光激活BLA至中央核投射则驱动负效价关联的学习行为。然而,鉴于大脑两侧半球内核团的结构对称性,先前研究主要假设核团间的连接是单侧的,而不同半球核团间回路的生理功能往往被忽视。
2024年11月8日,复旦大学刘星教授和马兰院士在Science上发表题为“The interhemispheric amygdala-accumbens circuit encodes negative valence in mice”的研究论文,发现小鼠脑内BLA神经元,通过连接左右两侧脑半球的AC投射到对侧脑半球的NAc,这一跨脑半球神经环路在功能上与同侧半球神经环路相反,编码恐惧相关负性情绪及逃避行为。

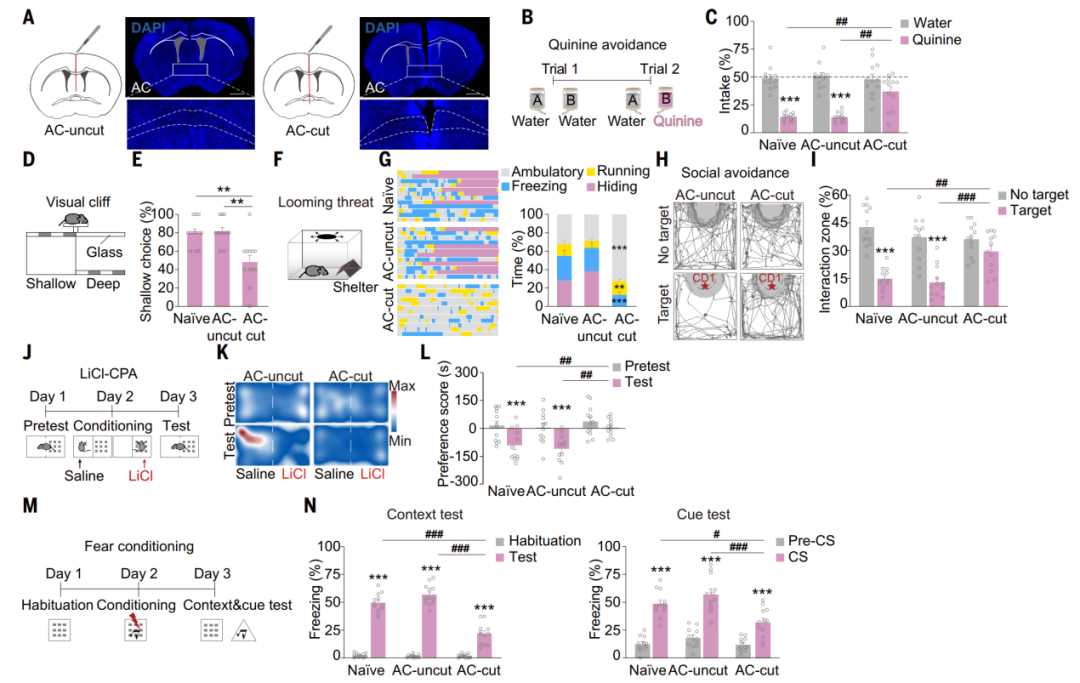
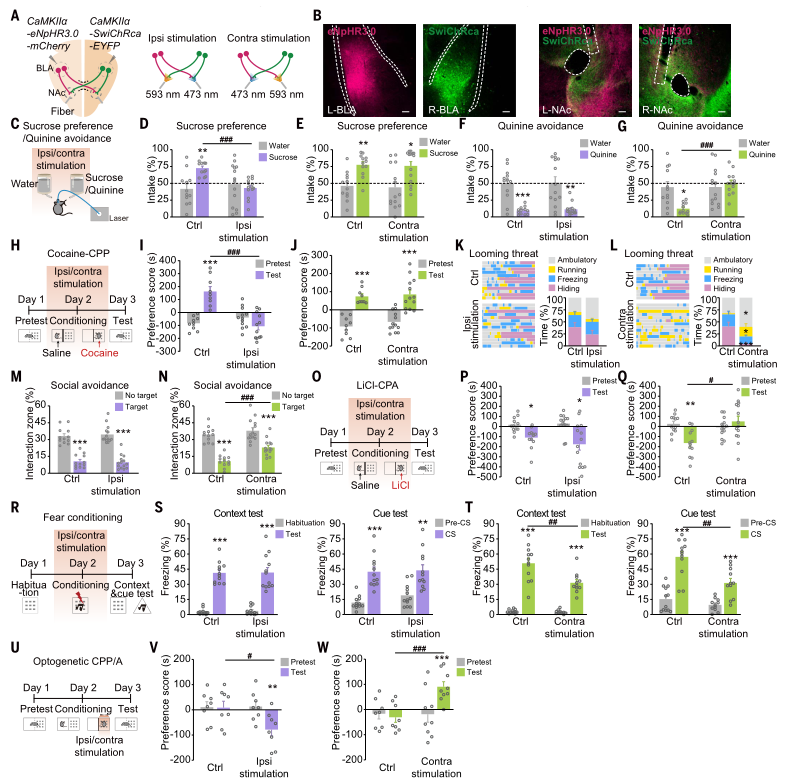
研究人员通过在小鼠中缝处切断AC(AC-cut)来探究其对小鼠行为学的影响。与未经手术(naïve)和假手术(AC-uncut)小鼠相比,AC切断的小鼠在运动活动、焦虑水平、社交能力或蔗糖偏好方面没有表现出明显的差异,但在厌恶测试中,AC切断的小鼠饮用更多的奎宁液(苦水);在视觉悬崖测试中,AC切断小鼠对较浅侧的偏好降低;在逼近威胁测试中,AC切断的小鼠几乎没有时间呆在庇护所内,而且冻结状态的时间很短,大部分时间都在庇护所外面走动;在社交回避测试中,AC切断小鼠花费更多时间探索攻击性CD1小鼠。此外,在LiCl条件性场所回避(CPA)和条件恐惧性训练中,AC切断小鼠对LiCl配对室的回避较少,并且展示出恐惧记忆学习缺陷。提示通过AC的跨半球连接对负刺激诱导的厌恶至关重要。
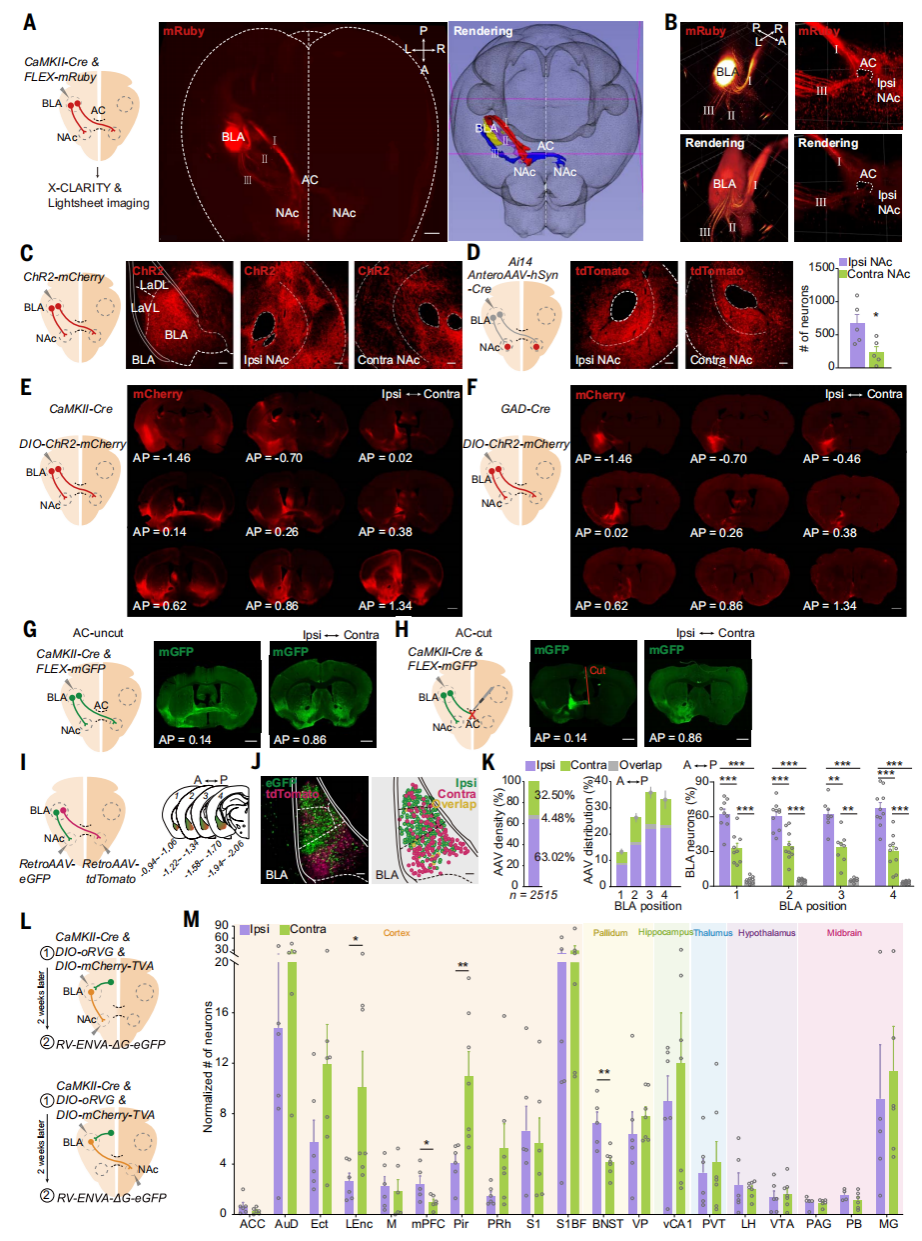
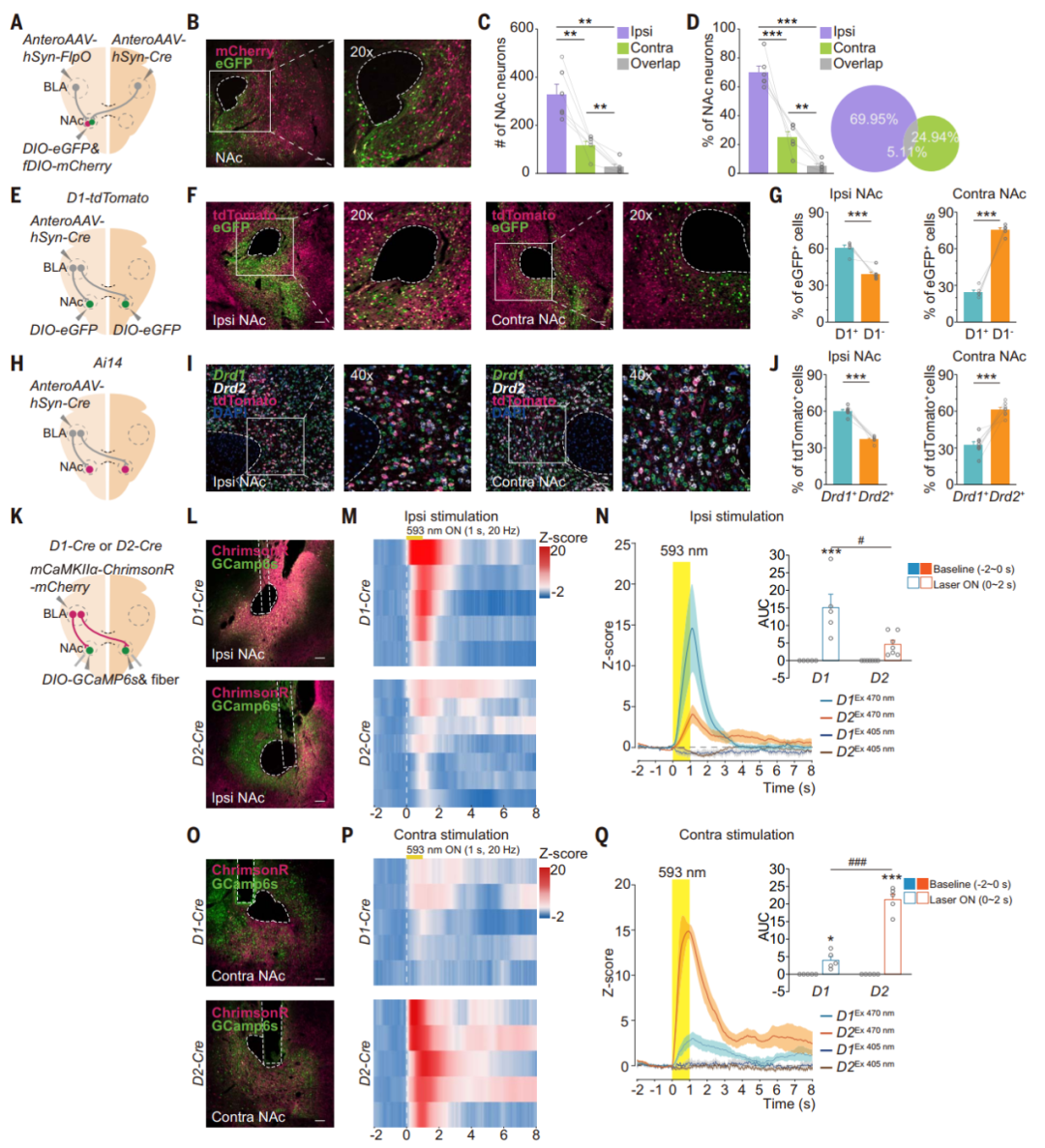
杏仁核在编码负价方面发挥着关键作用,部分BLA神经元通过AC通路支配对侧BLA。研究人员在单侧BLA的谷氨酸能神经元中表达mRuby,并使用X-CLARITY追踪单侧BLA向全脑的投射,重建和渲染的三维(3D)图像显示了来自BLA的三个主要的mRuby标记投射:(I)终纹(ST)通路以倒U形从BLA行进至同侧NAc;(II)腹侧杏仁核(VAF)通路与背侧ST通路在同侧NAc处汇合;(III)另一个腹侧轴突束横向行进至VAF通路,进入AC,并到达对侧半球。除了NAc之外,在对侧BLA、内侧前额叶皮层(mPFC)、室旁丘脑和腹侧被盖区也检测到了BLA投射,但在腹侧海马CA1未检测到。在CC中未发现任何投射,这表明BLA的对侧投射不进入CC。研究人员将含有ChR2-mCherry的腺相关病毒(AAV)单侧注射到C57BL/6J小鼠的BLA中,检测到BLA在对侧和同侧NAc中的投射。将携带Cre的顺行跨突触AAV单侧注射到Ai14小鼠的BLA,在同侧和对侧NAc中检测到tdTomato+细胞,其中细胞密度最高的在NAc核心区域。随后,在CaMKII-Cre或GAD-Cre小鼠单侧注射含有floxed ChR2-mCherry的AAV到BLA中,在对侧的NAc中出现了谷氨酸能投射,未观察到γ-氨基丁酸(GABA)能投射。进一步地,通过mGFP顺行标记显示,切断AC后,未能检测到对侧BLA-NAc的谷氨酸能投射。接下来研究人员在一侧NAc注射RetroAAV-eGFP,另一侧注射RetroAAV-tdTomato,用不同颜色标记同侧与对侧投射的BLA神经元。结果显示,67.50%±2.14%的BLA神经元向同侧NAc投射,36.98%±2.16%向对侧投射,且存在小部分(4.48±0.33%)BLA神经元向双侧投射,这些投射在BLA的中间和后部最为密集。基于狂犬病毒的跨单突触示踪结果显示,同侧NAc投射的BLA神经元接收到的输入更多的是来自于大脑皮层的输入,而对侧NAc投射的BLA神经元接收到的输入更多的是来自外侧内嗅皮层和梨状皮质的输入。以上结果不仅揭示了BLA神经元在全脑的投射图谱,还确认了BLA能通过AC投射至对侧NAc。
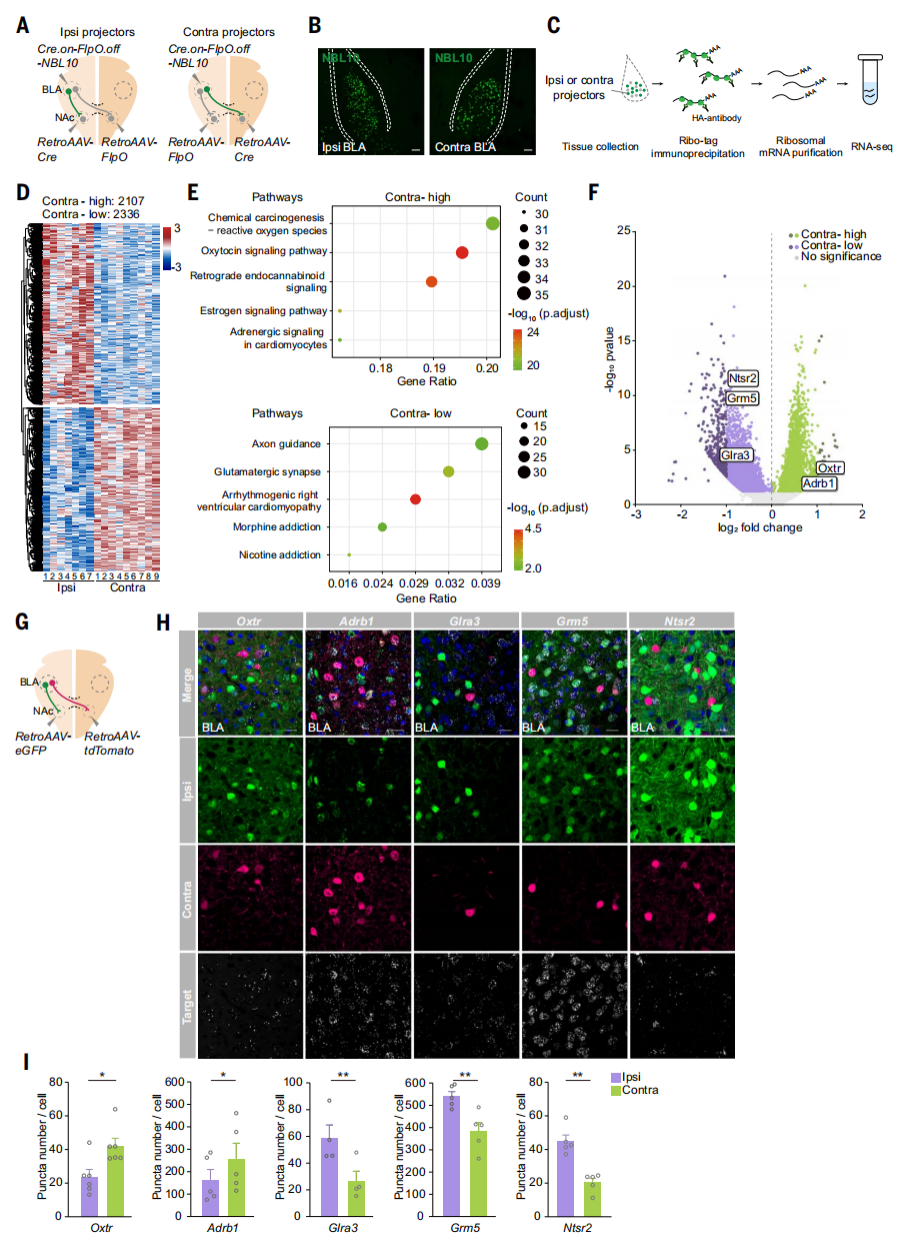
研究人员为了分析不同投射方向的BLA神经元的转录差异,进行了以下实验:将AAV-Cre.on-FlpO.off-NBL10注射到一侧半球的BLA中,并将逆行跨突触AAV-Cre注射到同侧NAc,对来自同侧和对侧NAc投射BLA神经元核糖体相关mRNA进行分离并测序。结果显示,与同侧NAc投射BLA神经元相比,对侧NAc投射BLA神经元中有2107个基因的表达水平较高,有2336个基因的表达水平较低。KEGG分析发现对侧投射到NAc的BLA神经元中富集催产素信号通路,同侧投射到NAc的BLA神经元中富集轴突引导和谷氨酸能突触通路。通过多重单分子RNA荧光原位杂交(smFISH)实验确定对侧NAc投射的BLA神经元中Oxtr和Adrb1高表达,而同侧NAc投射的BLA神经元中Glra3、Grm5和Ntsr2表达水平较高。以上结果表明同侧和对侧投射至NAc的BLA神经元是分离的群体。
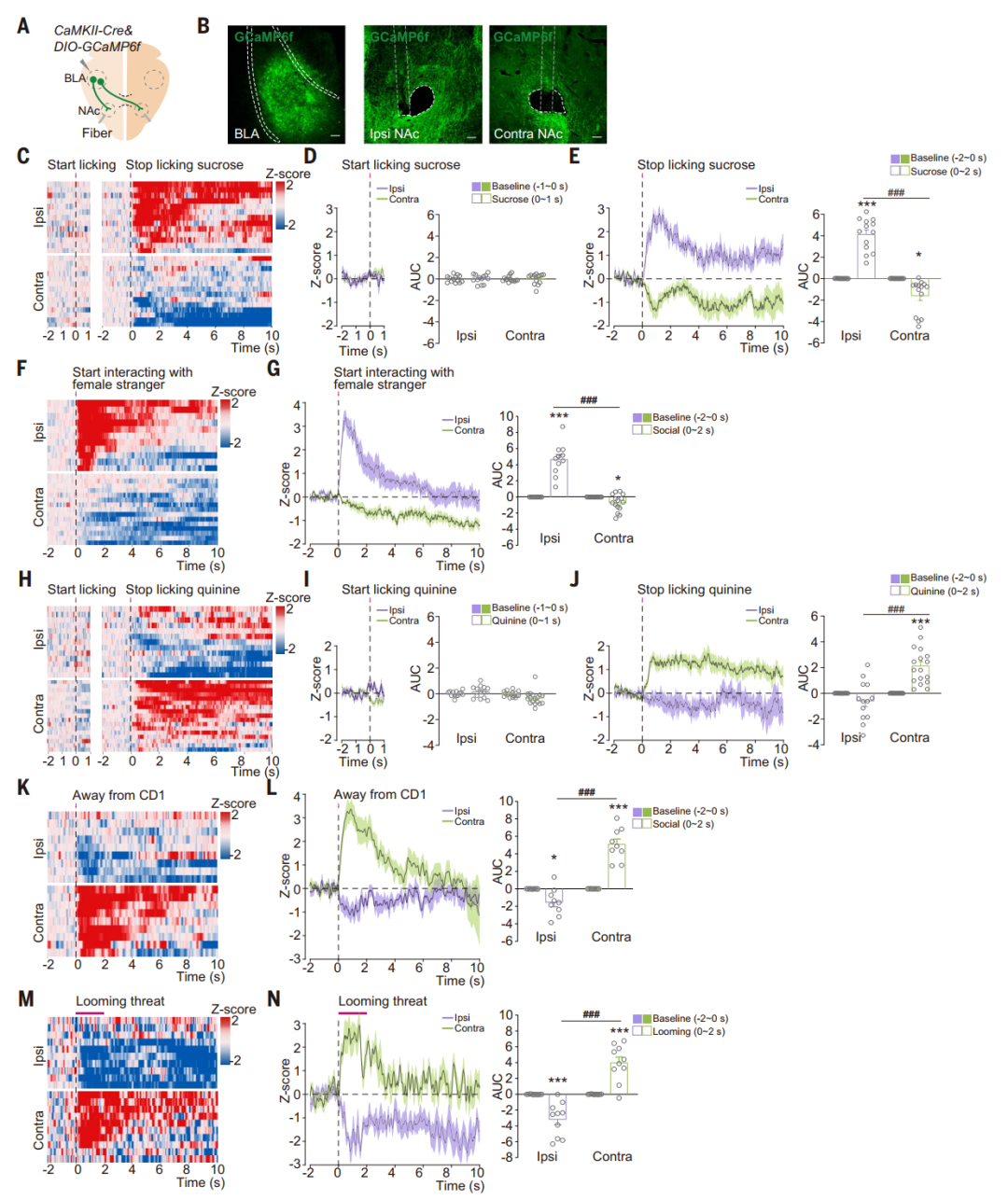
为了检查对侧和同侧BLA-NAc投射对正价和负价刺激的反应,研究人员借助在小鼠脑内植入光纤在体实时记录神经元活动信号和光遗传学实时特异性干预等方法,发现在自由饮用蔗糖溶液后,同侧BLA-NAc投射中的GCaMP荧光显著增加,而舔舐奎宁溶液后,对侧BLA-NAc投射中GCaMP荧光增加。此外,嗅探陌生雌性小鼠(社交奖励)增加了同侧投射中的GCaMP荧光,而逃离攻击性小鼠(逃跑行为)则触发了对侧投射中更大的钙离子信号变化。潜在威胁降低了同侧投射GCaMP荧光,但增加了对侧投射GCaMP荧光。空气喷射和尾部悬挂的负面刺激引起的钙离子信号变化在对侧投射中比同侧投射更高。这些结果表明摄食甜水、与异性社交等奖赏性刺激选择性地激活BLA到同侧半球NAc的神经投射,而摄入苦水、面临危险等厌恶性刺激则选择性地激活BLA到对侧半球NAc的神经投射。
为了深入探究同侧与对侧BLA-NAc通路在小鼠行为反应中的不同作用,研究人员采用了光遗传学技术。他们在一侧BLA中注射了AAV-CaMKIIa-eNpHR3.0-mCherry,在另一侧注射了AAV-CaMKIIa-SwiChRca-EYFP,通过不同波长的激光选择性地抑制投射到同侧或对侧NAc的BLA轴突末梢。实验发现,在蔗糖偏好测试和可卡因条件反射测试中,选择性抑制同侧BLA-NAc投射会降低蔗糖摄入量并损害可卡因条件位置偏好(CPP)的获得;而对侧BLA-NAc投射的抑制则会增加奎宁消耗量,减少躲藏时间,增加活动时间,并减少对CD1攻击性小鼠的回避。此外,在LiCl条件性场所回避测试和恐惧条件测试中,抑制对侧BLA-NAc投射也会减少对LiCl的位置厌恶或冻结行为。研究还显示,光遗传抑制同侧BLA-NAc投射的小鼠会发展出对激光配对侧的回避行为;相反,抑制对侧BLA-NAc投射的小鼠则表现出对激光配对侧的偏好。这些结果共同表明,同侧和对侧的BLA-NAc投射通路分别参与小鼠正面情绪和负面情绪的行为。
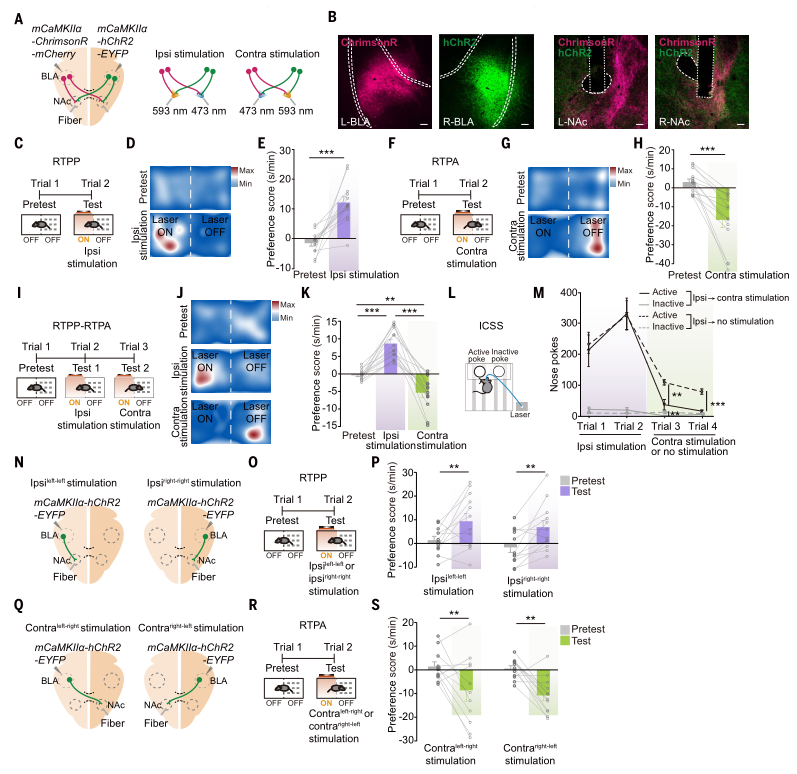
研究人员为了探究刺激同侧和对侧BLA-NAc投射是否会引发相反的情绪状态,进行了系列实验。将AAV-CaMKIIa-ChrimsonR-mCherry和AAV-mCaMKIIa-hChR2-EYFP分别注射到小鼠大脑的两侧BLA中,以激活NAc中来自同侧或对侧的BLA投射纤维。通过实时位置偏好(RTPP)或回避(RTPA)测试发现,激活同侧BLA-NAc投射能增加小鼠停留在激光配对侧的时间,表明其介导正面情绪行为;而激活对侧BLA-NAc投射则效果相反,表明其介导负面情绪行为。在RTPP-RTPA切换测试中,小鼠在同侧激活时表现出强烈的停留在激光配对侧偏好,切换到对侧激活时则转为回避激光配对侧,这表明BLA-NAc的对侧激活可能会拮抗同侧激活的作用。此外,双孔激光颅内自我刺激(ICSS)实验也支持了这一结论,即激活同侧增加小鼠主动鼻戳行为,而对侧激活则减少该行为。这些结果共同表明,激活同侧和对侧BLA-NAc投射分别介导正面和负面情绪行为,且对侧激活能拮抗同侧激活的效果。
为标记受同侧或对侧BLA支配的NAc神经元,研究人员采用了特定的病毒注射策略。将顺行跨突触AAV-FlpO注射到小鼠大脑一侧的BLA中,并将AAV-Cre注射到另一侧的BLA,以及AAV-DIO-eGFP和AAV-fDIO-mCherry的混合病毒注入一侧的NAc,发现69.95±4.41%的NAc神经元受同侧支配,24.94±4.01%的NAc神经元受对侧支配,只有5.11±1.41%的NAc神经元受双侧支配。多巴胺受体D1和D2阳性的中棘神经元(MSN)对情绪价值处理至关重要,约占NAc神经元的95%。为进一步研究这些神经元,研究人员向一侧BLA注射顺行跨突触AAV-Cre,并在D1-tdTomato小鼠的NAc中双侧注射AAV-DIO-eGFP。进一步分析发现同侧BLA支配的NAc神经元中有60.99±2.00%为D1-MSN,对侧BLA支配的NAc神经元中有24.52±1.61%为D1-MSN。smFISH实验数据表明,同侧BLA支配的NAc中60.22±3.34%的tdTomato+细胞为D1-MSN,对侧BLA支配的NAc中61.35±5.21%的tdTomato+细胞为D2-MSN。光遗传学结合光纤钙成像记录,发现光激活同侧BLA-NAc环路会导致D1-MSN中GCaMP信号显著增加,而光激活对侧BLA-NAc环路则会导致D2-MSN中的GCaMP信号显著增加。以上结果表明,同侧BLA投射主要支配D1-MSN,而对侧BLA投射主要支配NAc中的D2-MSN。
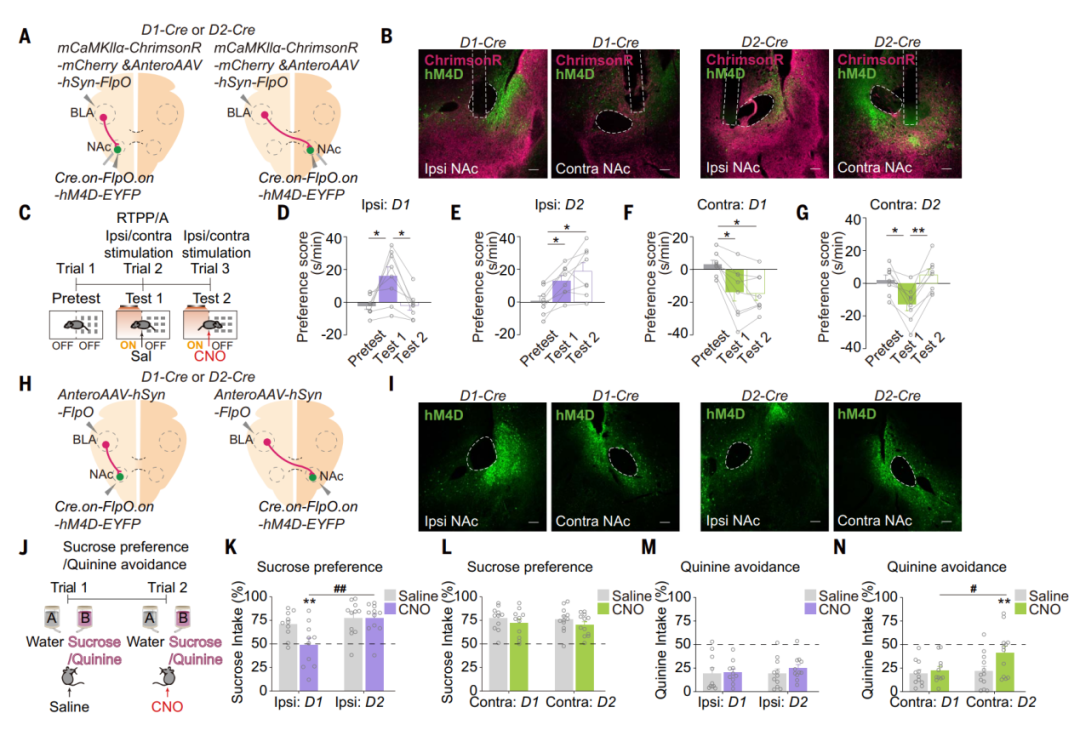
最后研究人员深入探究了BLA-NAc环路在不同效价行为编码中的作用。向D1-Cre或D2-Cre小鼠的一侧大脑的BLA中注射了AAV-mCaMKIIa-ChrimsonR-mCherry病毒和顺行跨突触scAAV-hSyn-FlpO病毒,并向同侧或对侧NAc中注射了AAV-EF1a-Cre.on-FlpO.on-hM4D-EYFP病毒。结果显示,抑制由同侧BLA支配的D1-MSN阻断了由同侧BLA-NAc投射激活产生的RTPP,而抑制由对侧BLA支配的D2-MSN则阻止了由对侧BLA-NAc投射激活产生的RTPA。此外,抑制由同侧BLA支配的D1-MSN损害了小鼠对蔗糖的偏好,而抑制由对侧BLA支配的D2-MSN则损害了小鼠对奎宁的回避。这些发现共同表明,同侧BLA-NAc D1-MSN编码正价行为,而对侧BLA-NAc D2-MSN编码负价行为。
结论
该研究表明,与同侧相比,对侧BLA到NAc的投射在应对不同效价的刺激、调节D1型和D2型MSN活性以及调节多巴胺释放方面具有不同的功能,它们的激活最终会导致厌恶反应,这表明跨大脑半球的BLA-AC-NAc环路在编码负性情绪中起着关键作用。该研究结果为跨大脑半球的AC通路在处理负性信息和促进逃避行为发展中的作用提供了新的见解,这些行为对于个体生存至关重要。
复旦大学脑科学研究院博士研究生田振、宋嘉琛为论文共同第一作者,赵旭滢、周一鸣和陈曦等为共同作者。基础医学院刘星教授为论文最后通讯作者、脑科学研究院马兰教授为共同通讯作者。该研究得到科技创新2030—“脑科学与类脑研究”重大项目、国家自然科学基金项目资助。
通讯作者介绍:
刘星教授长期致力于情绪相关记忆机制的研究,近年来发现伏隔核的D1神经元新亚群,揭示其拮抗经典D1神经元亚群奖赏效应、促进负性情绪形成的作用;揭示“痕迹神经元神经环路”介导记忆的存储,可卡因记忆痕迹神经元在戒断后兴奋性持续增强介导药物渴求的“孵育”现象;获得东方英才计划领军项目支持。
马兰,1958年9月生,1990年获美国北卡罗来纳大学博士学位,1991-1995年先后在美国北卡罗来纳大学和拜耳公司制药部从事博士后研究工作,1995年12月起任上海医科大学/复旦大学上海医学院教授至今。先后获得国家杰出青年科学基金、创新研究群体科学基金、何梁何利科技进步奖、担任中国生理学会副理事长,中国神经科学学会常务理事,国家973计划首席科学家。现任复旦大学脑科学研究院院长,医学神经生物学国家重点实验室主任,教育部脑科学前沿科学中心首席科学家。
研究方向为记忆与药物成瘾机制。采用分子和细胞生物学、光遗传学、电生理、行为学、药理学、遗传学等多种手段深入研究学习记忆和精神药物成瘾机制,揭示相关药物的新靶点。近年来的主要研究成果包括:发现β-arrestin的核信使功能及其调控药物靶基因表达的表观遗传学机制,阐述其介导记忆巩固和再巩固的新通路,揭示β抑制蛋白偏向性信号介导记忆的再巩固与消退;发现GRK参与神经网络形成和学习记忆的分子机制;发现组蛋白乙酰化修饰在药物奖赏及动机增强中的作用,揭示药物成瘾的跨代遗传现象及其表观遗传机制。在Cell、Nature Neuroscience、PNAS等SCI刊物发表论文一百余篇,获国家自然科学二等奖2项、省部级科技进步一等奖6项,国家教学成果二等奖和上海市教学成果一等奖各1项,所指导的博士生论文入选全国百篇优秀博士学位论文,被复旦大学研究生评为“我心目中的好导师”。
本文使用的病毒,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK