2024-11-04 阅读量:891
在生存压力下,地球上的生物需要进食来维持机体的能量稳态。进食稳态的失调会影响生物生存,进食匮乏可能会导致个体死亡,而过量进食则会导致个体产生肥胖或者多种健康问题。大脑下丘脑可以整合外周和中枢的各种信号,来调节食物摄入。下丘脑室旁核(PVH)是下丘脑一个高度异质性区域,已有大量研究表明PVH调节摄食的作用。目前已经确定PVH可以通过投射到臂旁复合体(PB)或者下丘脑腹内侧核(VMH)调节食欲。鉴于PVH在食欲调节中的突出地位,需要确定是否存在其他的神经环路,以更好了解PVH调节食欲的机制。
2024年10月16日,天津医科大学朱宪彝纪念医院内分泌研究所谢向阳教授和中国科学院生物物理所张树利副研究员合作在Nature Communications期刊上在线发表题为“Paraventricular hypothalamic RUVBL2 neurons suppress appetite by enhancing excitatory synaptic transmission in distinct neurocircuits”的研究论文。该研究利用病毒注射、化学遗传学、光遗传学、电生理等方法,揭示PVH调节食欲的两条新型神经环路,并阐明PVHRUVBL2通过增强这两条环路的兴奋性突触传递而抑制食欲。

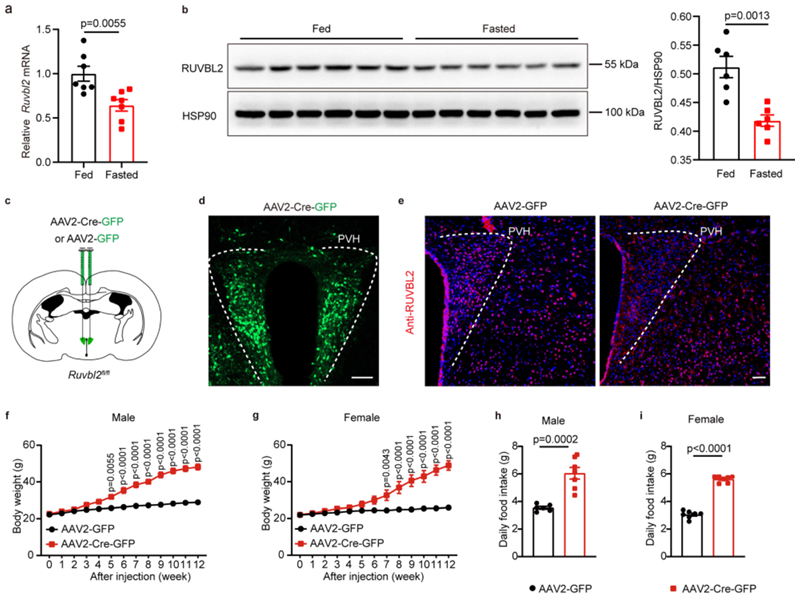
RUVBL2是一种高度保守的AAA+ATP酶(与多种细胞活动相关的ATP酶),已被证明可参与多种细胞过程,在机体内广泛表达。研究人员发现过夜饥饿会导致小鼠PVH的RUVBL2的mRNA和蛋白表达水平下降,这表明PVH的RUVBL2可以感应能量稳态。随后,构建Ruvbl2fl/fl小鼠模型,利用病毒注射特异性敲除PVH中的Ruvbl2。研究人员发现敲除PVH中的Ruvbl2会诱导小鼠过度摄食而导致肥胖。
图1. 敲除PVH中的Ruvbl2会诱导小鼠过度摄食导致肥胖
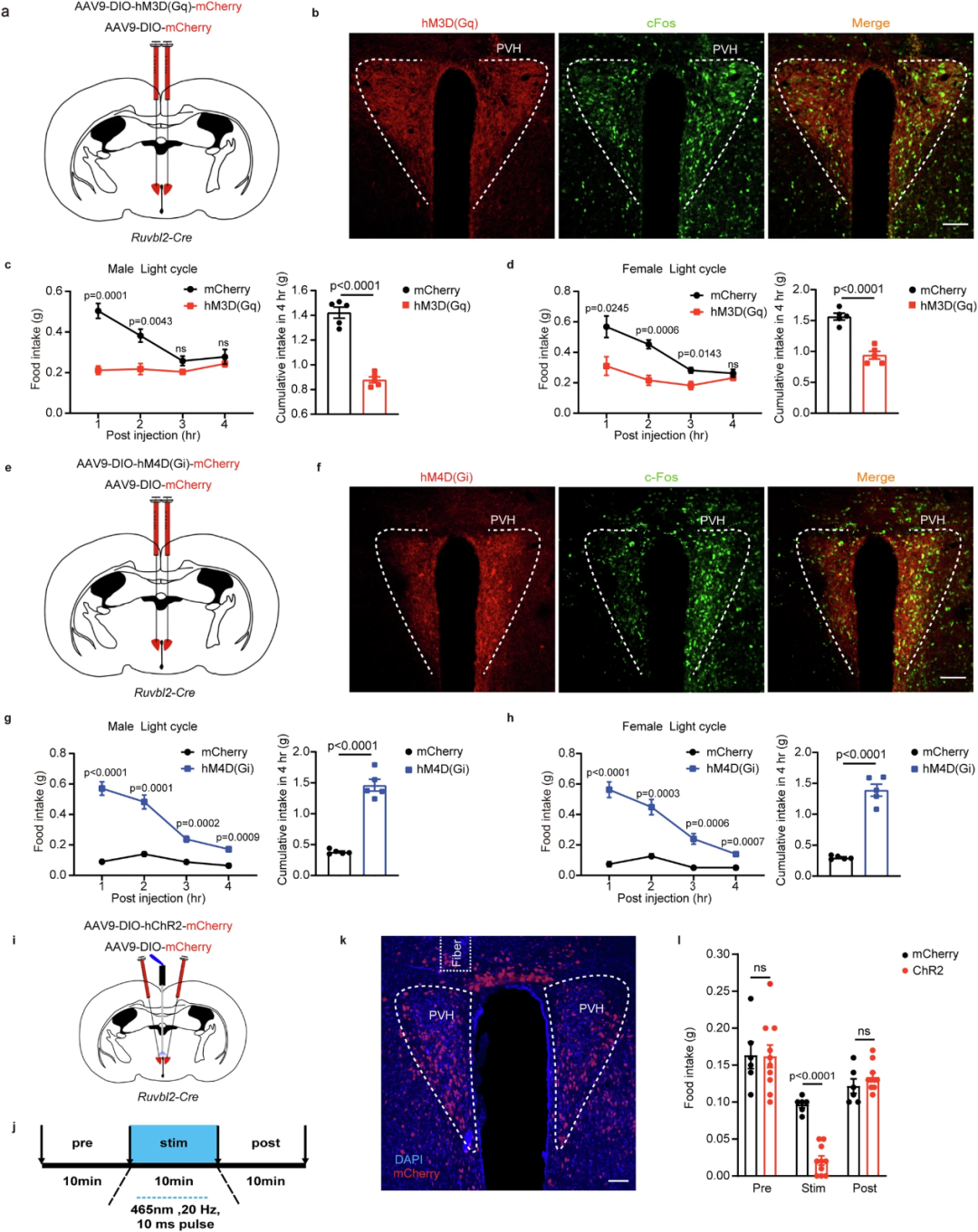
为了探究PVH的RUVBL2神经元(PVHRUVBL2)在调节食欲中的作用,研究人员利用化学遗传学和光遗传学来操纵PVH的RUVBL2神经元活性。研究表明,激活PVHRUVBL2会抑制食欲,而抑制PVHRUVBL2会增加食欲。
图2. PVH的RUVBL2神经元调节食欲
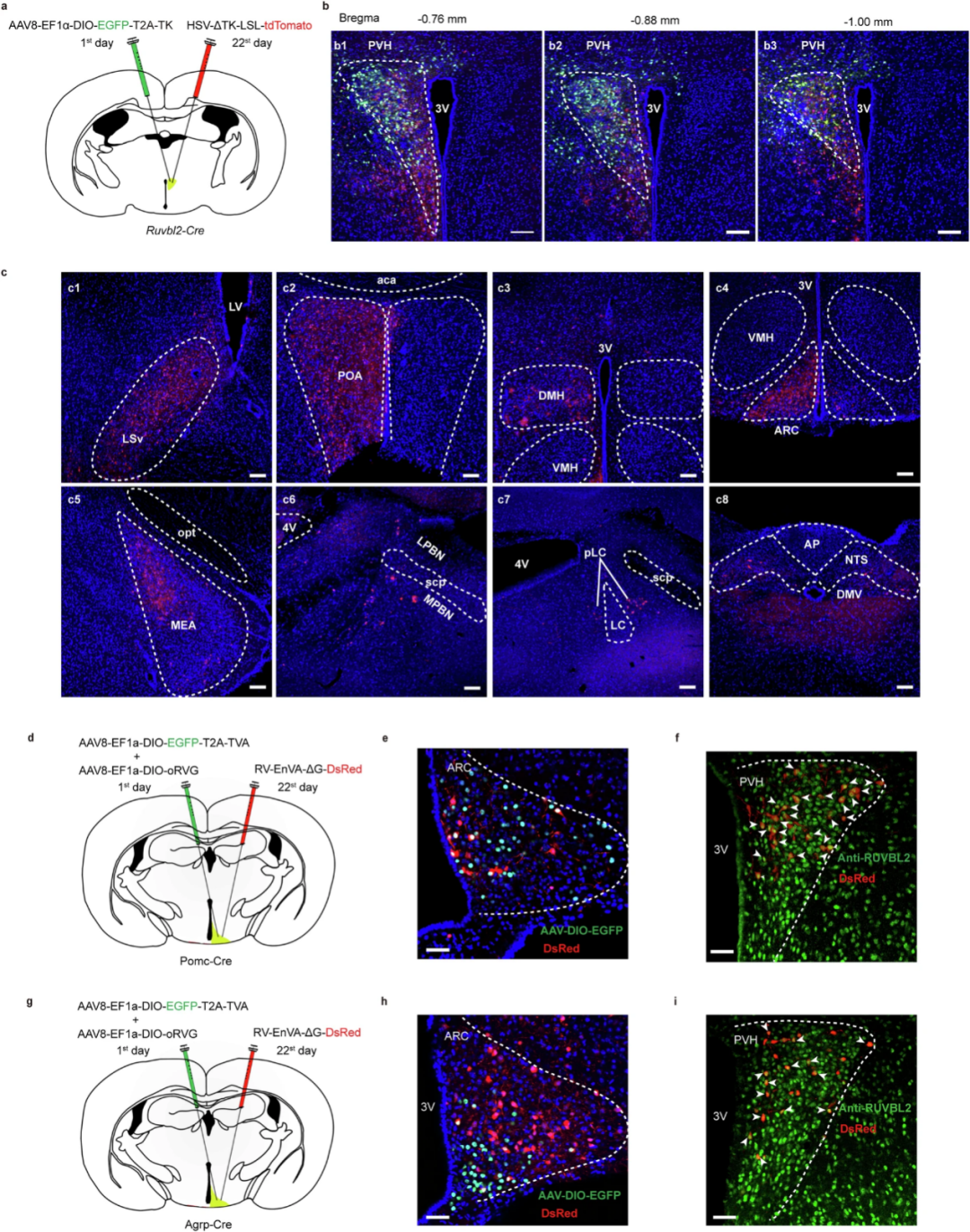
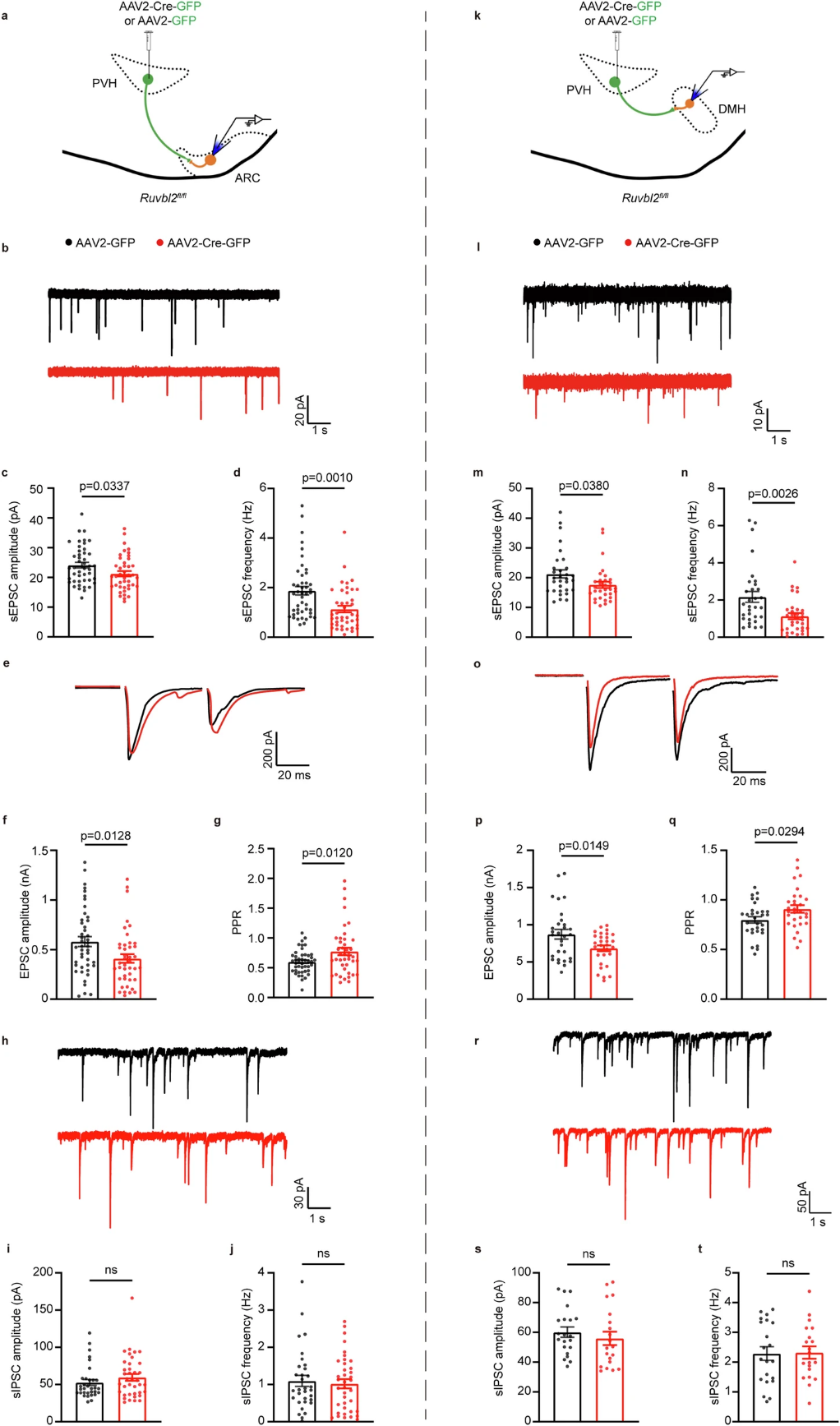
随后,研究人员利用HSV顺行示踪病毒来探究PVH的RUVBL2神经元投射的下游脑区。研究表明,PVHRUVBL2会投射到LSv(腹外侧隔核)、POA(视前区)、DMH(下丘脑背内侧核)、ARC(下丘脑弓状核)、MeA(内侧杏仁核)、PB和NTS(孤束核)脑区。ARC中有两群重要的神经元,AgRP(刺鼠相关肽)神经元和POMC(阿黑皮素原)神经元,为了确定PVH的RUVBL2神经元是否会投射到这两群神经元来调节食欲。利用逆行示踪病毒,发现PVH的RUVBL2神经元可以投射到ARC的AgRP神经元和POMC神经元。
图3. PVH的RUVBL2神经元投射到多个下游脑区
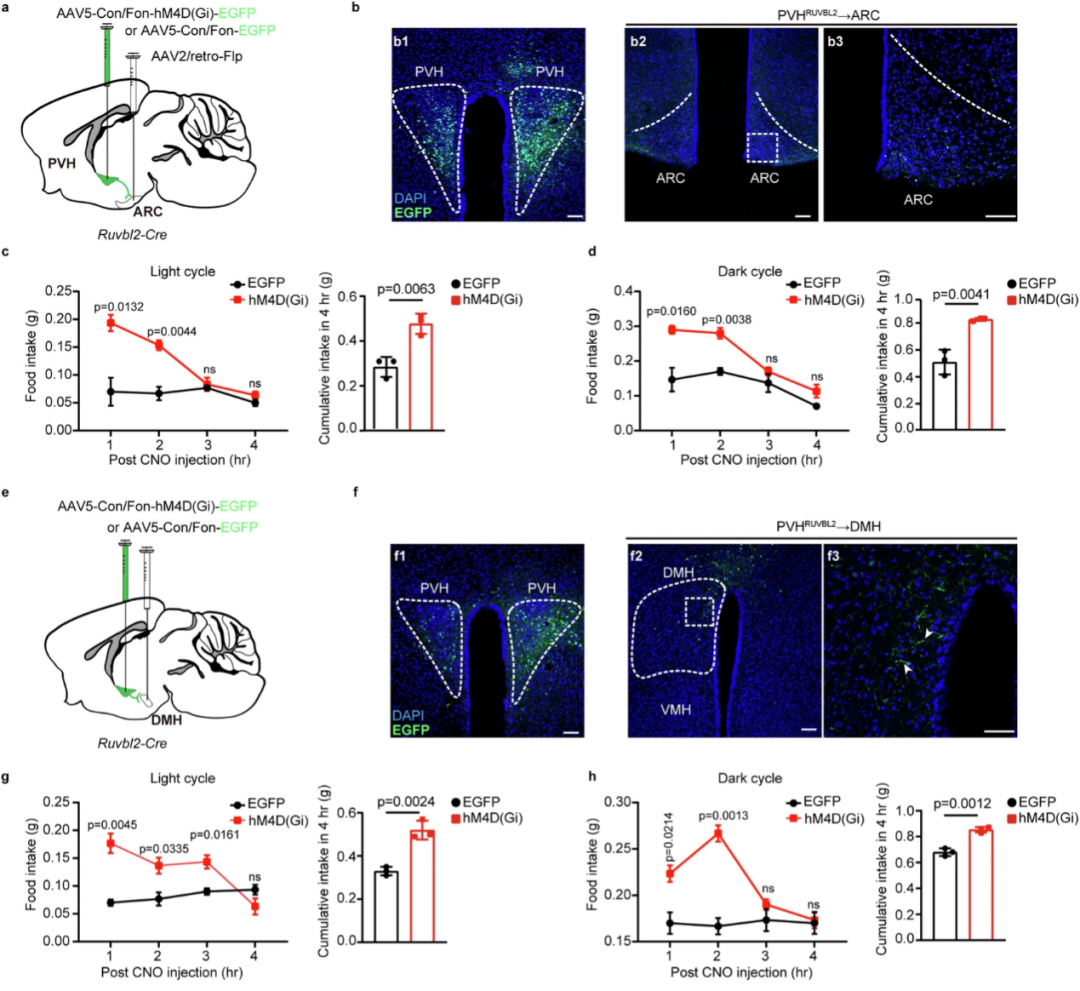
为了确定哪些PVH的RUVBL2神经元的神经环路可以调节食欲,研究人员利用环路特异的化学遗传学发现,PVH的RUVBL2神经元通过投射到ARC、DMH和PB脑区发挥食欲抑制作用。
图4. PVHRUVBL2通过投射到ARC和DMH脑区抑制食欲
接下来,研究人员为了研究PVH的RUVBL2蛋白以及RUVBL2神经元抑制食欲的细胞机制。利用电生理方法,发现敲除PVH的Ruvbl2会损害神经元兴奋性突触传递而不影响抑制性突触传递。
图5. 敲除Ruvbl2会影响PVH神经元兴奋性突触传递
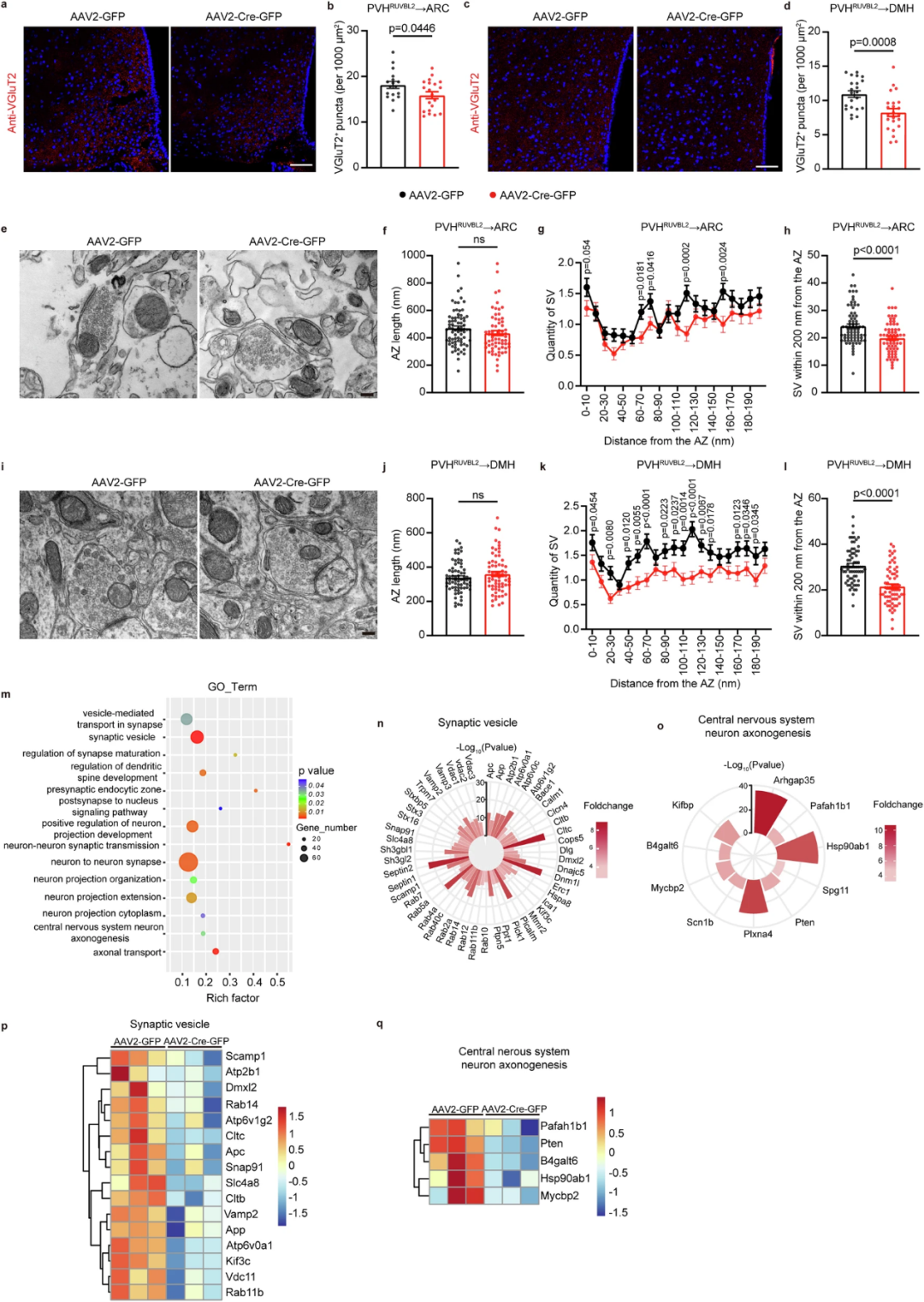
突触传递受损可能是由两种原因导致,一方面是突触前输入受损,另一方面则是囊泡分布不均导致的。为了确定突触传递受损的具体成因,研究人员通过免疫组化方法,发现敲除PVH的Ruvbl2会减少ARC和DMH神经末梢中VGluT2斑点。而利用电镜技术,研究人员发现敲除PVH的Ruvbl2显著减少突触囊泡数量。随后,研究人员利用ChIP-Seq(染色质免疫沉淀测序)联合RNA-Seq(RNA测序)分析,证实RUVBL2参与调控与神经元轴突形成和突触囊泡相关基因的表达。
图6. 敲除PVH的Ruvbl2会减少突触前扣结和囊泡数量
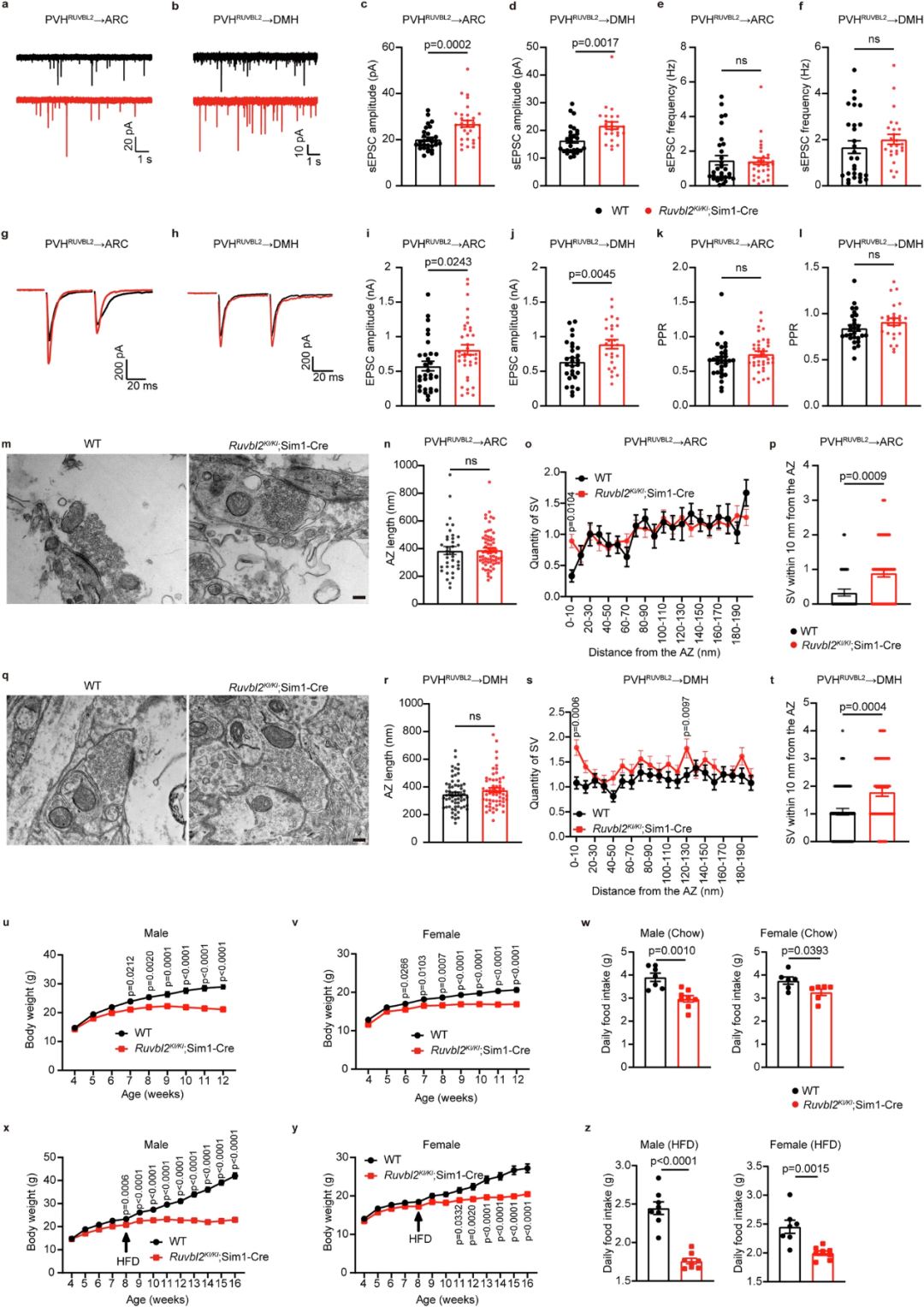
最后,研究人员想知道,RUVBL2过表达是否能增加兴奋性突触传递,从而抑制食欲进而达到降低体重的目的。利用Ruvbl2KI/KI;Sim1-Cre小鼠模型实现RUVBL2在PVH中的过表达。电生理数据表明,PVH的RUVBL2过表达增强了PVHRUVBL2→ARC和PVHRUVBL2→DMH神经环路的兴奋性突触传递,这是由于RUVBL2过表达改变突触囊泡分布。而增强兴奋性输入会降低小鼠食欲,显著缓解高脂肪饮食(HFD)诱导的肥胖。
图7. PVH过表达RUVBL2会增强兴奋性突触传递从而抵抗饮食诱导的肥胖
结论
综上所述,研究人员利用多种手段揭示了PVH中的RUVBL2通过调节突触可塑性来抑制食物摄入,并证明PVHRUVBL2神经元通过投射到三个大脑区域来发挥其厌食作用。同时,RUVBL2可能作为临床上治疗肥胖新的潜在靶点。
天津医科大学博士研究生邢明明、张玉琪,硕士研究生周珏牟以及中国科学院生物物理所博士研究生李洋为本文共同第一作者。天津医科大学朱宪彝纪念医院内分泌研究所谢向阳教授和中国科学院生物物理所张树利副研究员为本文共同通讯作者。这项工作得到了国家重点研发计划、中粤国家自然科学基金联合基金、ST2030-Majr项目、中国国家自然科学基金、天津市科学技术委员会,广州国家实验室研发计划,中国科学院仪器开发项目和天津市重点医学学科(专科)建设项目支持。
通讯作者介绍:
谢向阳,教授,博士生导师,天津医科大学朱宪彝纪念医院内分泌研究所课题组长,国家卫健委激素与发育重点实验室和天津市代谢性疾病重点实验室糖脂代谢方向学术骨干,入选天津市特聘教授青年学者,获得天津市杰出青年基金资助。主持2项国家自然科学基金面上项目,1项天津市杰出青年基金,作为研究骨干参与1项国家重点研发计划。相关研究成果以第一或通讯作者发表于《Cell Metabolism》、《Cell research》、《JBC》、《IUBMB Life》等国际知名期刊。曾获得美国佛罗里达州卫生厅资助的James & Esther King博士后研究基金(2010-2013)、美国糖尿病协会(ADA)青年学者旅行奖(2011)和美国Robert M. Sandelman科学卓越奖(2017)等荣誉。兼任中国生物工程学会第六届医学生物技术专业委员会委员。
张树利,博士毕业于中国科学院昆明动物研究所神经生物学专业。2009年2月入职中国科学院生物物理研究所,现被聘为副研究员。2019年申请中国科学院公派出国留学计划并获资助;目前主要从事神经调控代谢的功能机制研究;先后以第一作者、通讯作者和参与者身份在Nucleic Acids Research(SCI第一作者,IF=16.97)、Cell Reports(SCI通讯作者,IF=9.42)、Diabetes(通讯作者)、Nature Communications(SCI通讯作者,IF=14.91)等高水平国际期刊上发表文章16篇,申请专利3项。
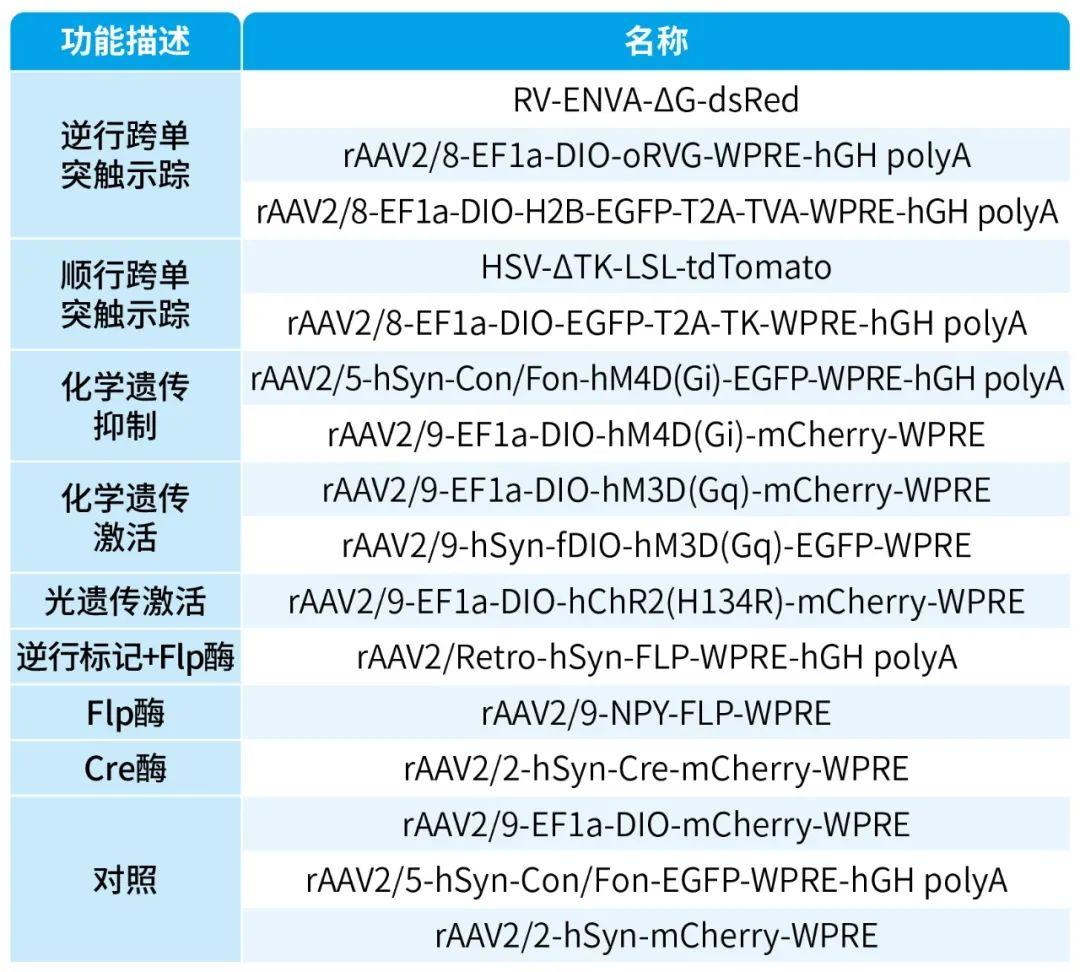
本文使用的来自枢密科技的病毒产品,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK