2020-10-15 阅读量:9798
一、光遗传学
2005年,由斯坦福大学Diesseroth和Boyde将一种来自绿藻的光敏通道蛋白channelrhodopsin-2 (ChR2)插入到培养皿中生长的神经元中,在蓝光脉冲的照射下,通道打开,大量的阳离子涌入神经元,光遗传学技术由此诞生。2007年Diesseroth实验室在《自然》(Nature)杂志上发表关于光控制神经回路的文章,被麻省理工学院技术综述评为该年度十大最有影响的技术之一。2010年该技术入选Nature Methods年度方法(Method of the Year)",Science杂志"十年突破(Breakthroughs of the Decade)"。光遗传学技术自诞生以来,一直受到科研工作者的广泛关注,关于光遗传学方面的研究论文随后大量涌现。
1. 技术原理
光遗传学(Optogenetics)是指结合光学与遗传学手段,精确控制特定神经元活动的技术。该技术利用分子生物学、病毒生物学等手段,将外源光敏感蛋白基因导入活细胞中,在细胞膜结构上表达了光敏感通道蛋白;然后通过特定波长光的照射,控制细胞膜结构上的光敏感通道蛋白的激活与关闭;光敏感蛋白的激活和关闭可控制细胞膜上离子通道的打开与关闭,进而改变细胞膜电压的变化,如膜的去极化与超极化。当膜电压去极化超过一定阈值时就会诱发神经元产生可传导的电信号,即神经元的激活;相反,当膜电压超极化到一定水平时,就会抑制神经元动作电位的产生,即神经元的抑制。
传统的电生理激活多种神经元,具有高时间分辨率。相比电生理,光遗传学技术可以无损伤或低损伤地控制特异神经元的活动,来研究该神经网络功能,特别适用于在体、甚至清醒动物行为学实验,具有高时空分辨率、高特异性以及轴突投射选择性(如图1)。
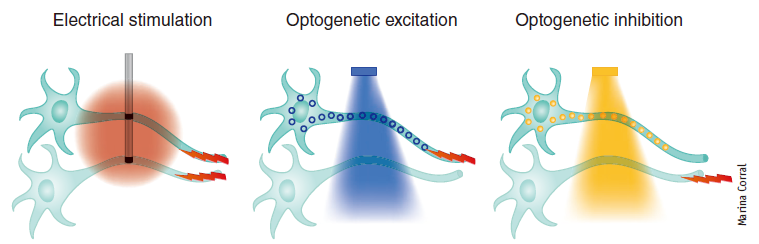
图1.光遗传学与电生理调控细胞的差异
光遗传学技术调控细胞的活性取决于光敏感通道蛋白的种类,即兴奋性光敏感通道和抑制性光敏感通道。如果转入细胞的通道是ChR,在细胞受到蓝光照射时,通道开发,阳离子大量内流,产生去极化诱发动作电位,激活细胞;如果转入细胞的通道是HR,细胞在受到黄光照射时,通道开放,阴离子大量内流,产生超极化导致动作电位不易发出,抑制细胞活性;此外,还有一类光激活或抑制的通道optoXR,给予一定频率的光激活后,改变的是细胞内激酶系统,影响细胞活动(如图2)。
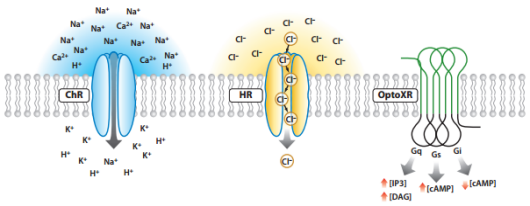
图2.光遗传学技术调控细胞活性的类型(Karl Deisseroth, et al.,Annu.Rev.Neurosci, 2011)
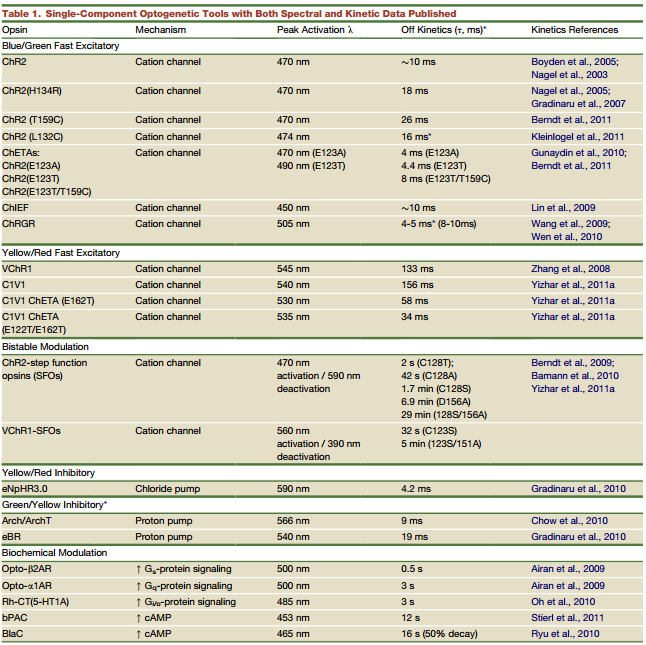
由此可见,光遗传学技术的关键在于光敏感通道的发现。根据最初的兴奋性光敏感通道Channelrhodopsin(ChR)和抑制性光敏感通道Halorhodopsin(NpHR),科研工作者开发了一系列新的光敏感通道,这些通道的激发光频率和持续时间各异,导致其用于不同类型的研究中。现在一些常用的光敏感通道及特点见表1:
表1.常见光敏感通道的离子通道类型、激发特性及通道开放时间(Karl Deisseroth, et al., Neuron, 2011)
2. 实施方法
光遗传学技术主要包括病毒包装、病毒注射、光纤埋植、光调控、行为测试和电生理记录6个步骤(如图3)。具体实施应该包括下面5个方面:
① 根据实验设计需要,选择合适的光敏感通道;
② 将合适的光敏感通道插入病毒载体中并感染细胞,使光敏感通道在特定类型的细胞中表达;
③ 将光纤埋植在实验动物脑中;
④ 根据病毒的表达时间,通过特定频率的激光调控光敏感通道的开发;
⑤ 通过行为学或电生理记录实验结果。
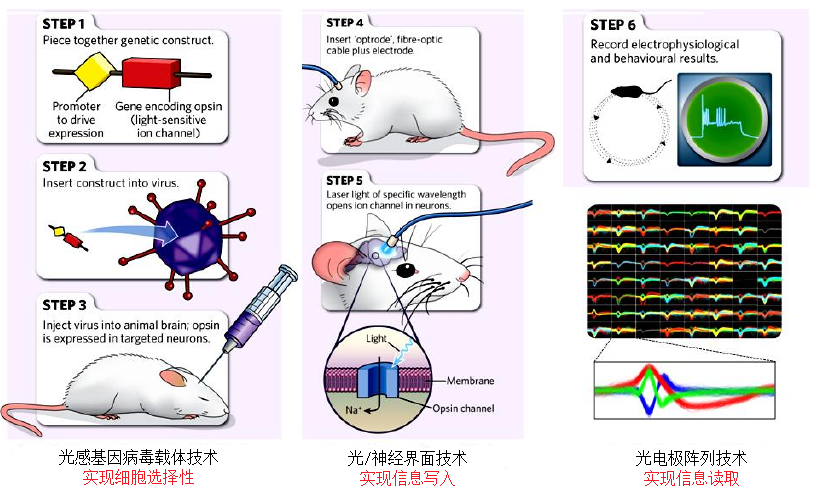
图3.光遗传学的实验步骤(Buchen L, Nature, 2010, modified)
3. 应用案例
目前,光遗传学技术已经广泛用于研究各类基础问题,尤其是在神经科学领域。光遗传学技术的应用在2010年后得到飞速的发展,应用研究领域涵盖多个经典实验动物种系(果蝇、线虫、小鼠、大鼠、绒猴以及食蟹猴等),并涉及神经科学研究的多个方面,包括神经环路基础研究、学习记忆研究、成瘾性研究、运动障碍、睡眠障碍、帕金森症模型、抑郁症和焦虑症动物模型等应用。为神经科学提供了革命性的研究手段。
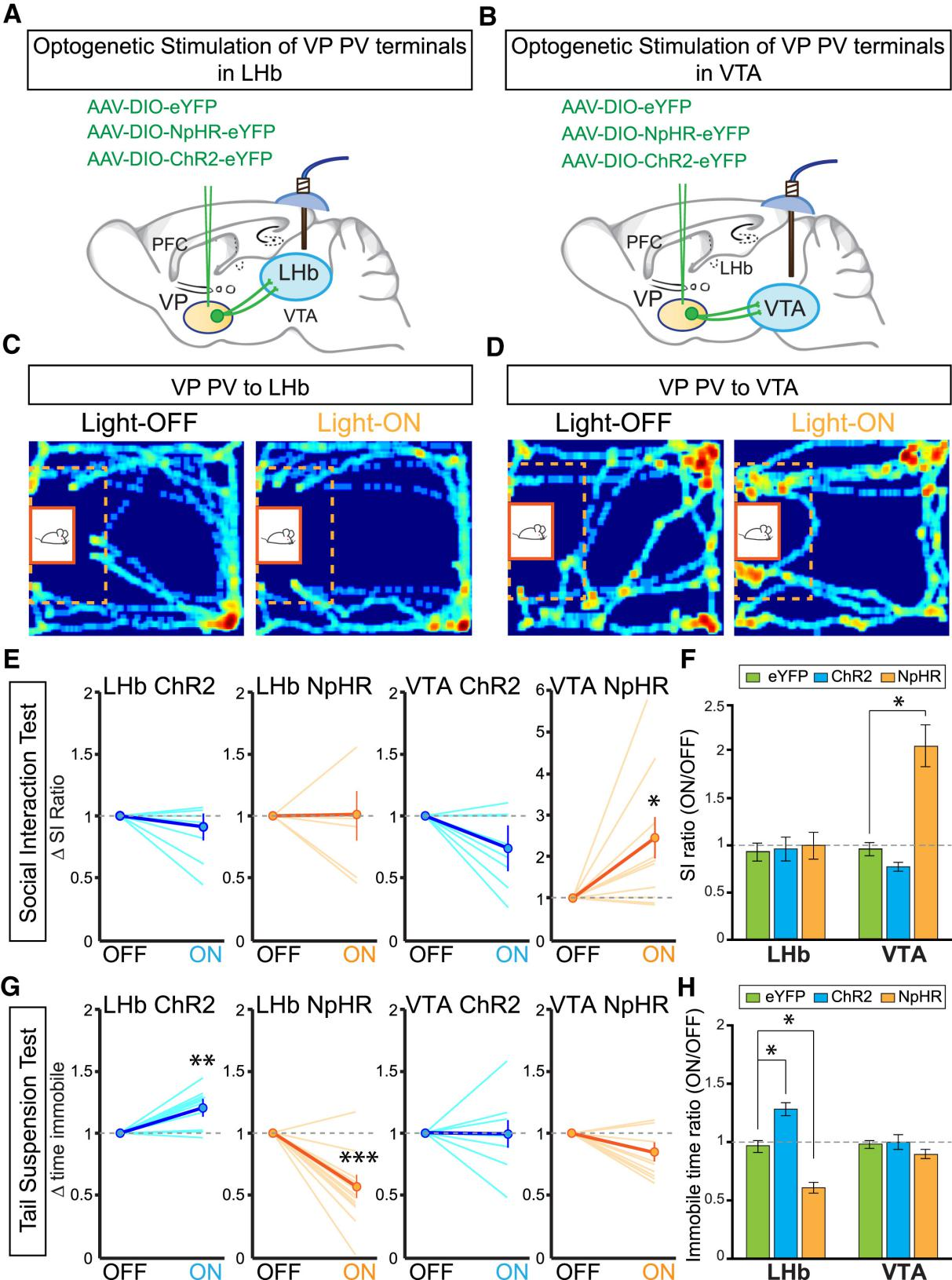
2017年7月,《Cell》杂志刊登了美国芝加哥大学Byung Kook Lim教授的一篇研究论文,该论文利用神经示踪、电生理、光遗传学及化学遗传学技术研究不同的腹侧苍白球(ventral pallidum, VP)神经投射介导抑郁的不同症状(如图4)。首先他们用神经示踪、电生理证明VP到腹侧被盖区(ventral tegmental area, VTA)及外侧缰核(lateral habenula, LHb)存在神经投射,随后用光遗传学和化学遗传学技术揭示了VP区神经元活性增加是动物抑郁的标志,还证明了VP / VTA、VP / LHb神经投射调节抑郁的不同离散症状。
图4. VP / VTA、VP / LHb神经投射调节抑郁的不同离散症状(Byung Kook Lim, et al., Cell, 2017)
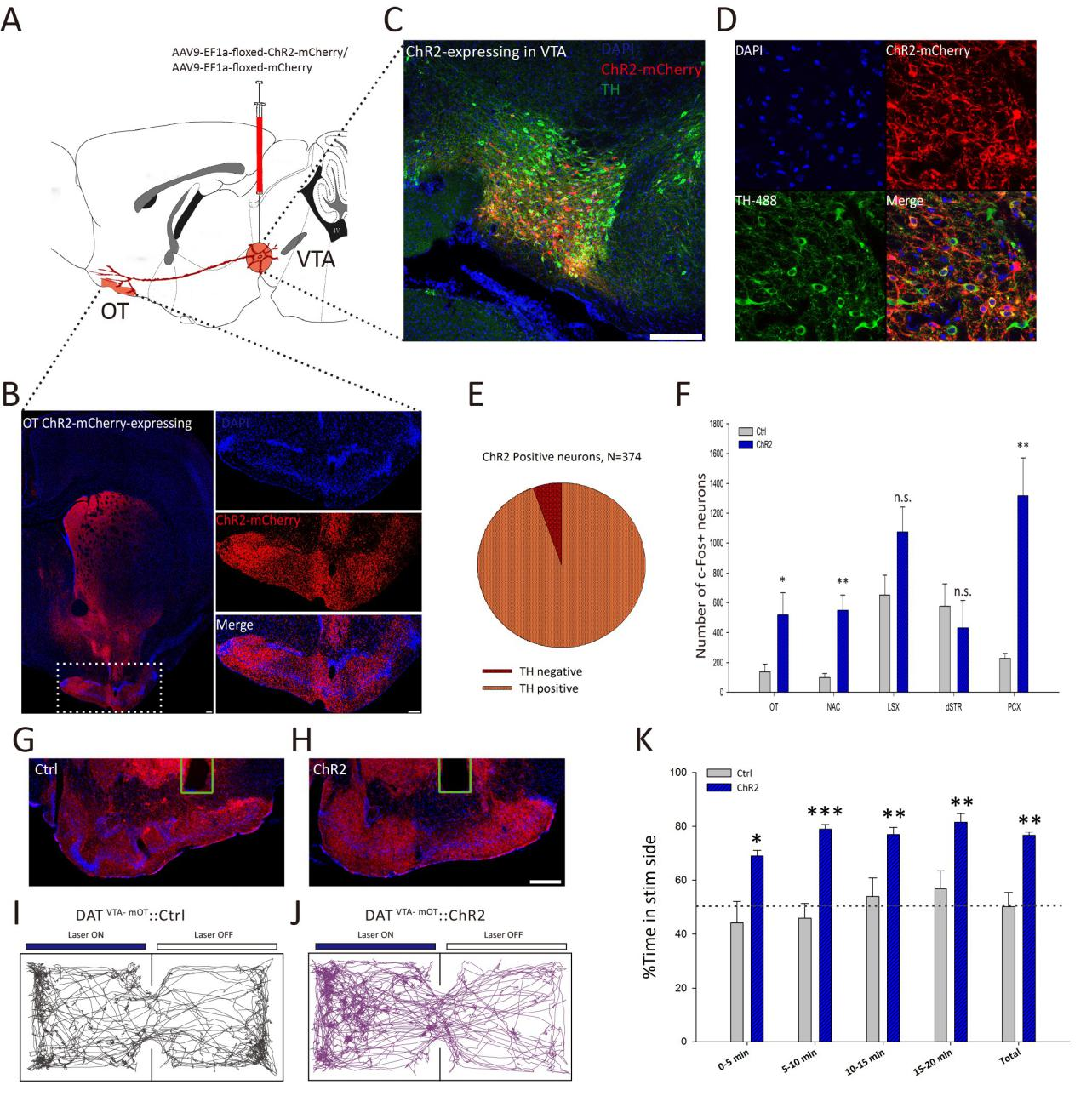
2017年12月,《eLife》杂志在线发表了武汉物理与数学研究所徐富强教授的研究成果,该工作运用光遗传学技术,研究从腹侧被盖区(VTA)到内侧嗅结节(mOT)的多巴胺能神经元投射通路以及其激活与奖赏行为的关系。课题组用病毒载体AAV9-EF1a-floxed-ChR2-mCherry / AAV9-EF1a-floxed-mCherry分别感染DAT-Cre小鼠和对照小鼠的VTA脑区,结果显示在VTA区表达mCherry的多巴胺能神经元占比94.39%,在mOT区也观察到大量表达mCherry的多巴胺能神经元。他们继续用蓝光刺激VTA到mOT的多巴胺能神经元投射,发现在嗅结节(OT)、伏隔核(NAc)和梨状皮层(PCX)中c-fos表达增加,位置偏好选择实验发现DAT-Cre小鼠在“light on”区域的停留时间明显高于对照小鼠。实验利用光遗传学很好地揭示了VTA到mOT的多巴胺能神经元的激活会导致动物的奖赏行为。(如图5)
图5. VTA到mOT的多巴胺能神经元的激活会导致动物的奖赏行为(Fuqiang Xu, et al.,eLife, 2017)
二、化学遗传学
化学遗传学(Chemical genetics)又称药物遗传学,是通过调查筛选化学小分子库,而对蛋白质功能以及细胞内信号转导通路进行研究的一门学科。该技术是对一些生物大分子实行改造,使其能和先前无法识别的小分子进行相互作用的过程,从而达到控制生物大分子活性的作用。
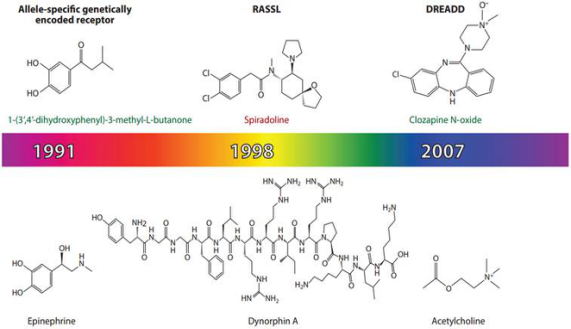
随着生物和化学交融的更加紧密,通过对生物体原有的配体与受体进行改造,得到了大量的具有外源物质激活、调节细胞通路的人工改造受体。目前改造的受体包括蛋白激酶、核酸杂交、各种代谢酶和G蛋白偶联受体,基于G蛋白偶联受体改造的化学遗传学受体有很多,从1991年构建的等位基因特异激活的基因编码受体(Allele-specific activation of genetically encoded receptors),到1998年构建的只能被合成配体激活的受体(Receptorsactivated solely by synthetic ligands, RASSLs)和基因工程改造的受体(Engineered receptors),再到2007年构建的只由特定药物激活的受体(Designer receptors exclusively activated by designer drugs, DREADDs)(如图6)。现在DREADDs已成为应用最广泛的化学遗传学技术。
图6.化学遗传学改造天然受体得到的人工受体(Bryan L.Roth. Annu.Rev.Neurosci. 2014)
1. DREADDs技术
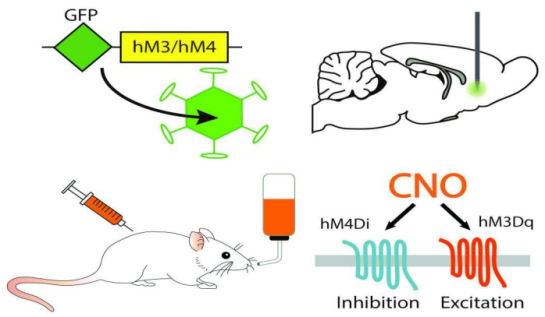
DREADDs技术是指只由特定药物叠氮平-N-氧化物(Clozapine-N-oxide,CNO)激活或抑制DREADDs受体,这些激活或抑制后的受体会选择性地作用于不同的GPCR级联反应来调节细胞信号转导,包括激活Gq、Gi、Gs、Golf和β-arrestin,其中应用最广泛的是Gq-DREADD和Gi-DREADD。
1.1 Gq-DREADD(hM3Dq)
hM3Dq是从人毒蕈碱乙酰胆碱受体M3上改造的仅对CNO(clozapine-N-oxide)有反应的人工受体(DREADD),不再受乙酰胆碱激活。在一些神经元里,CNO结合hM3D后,激活Gq蛋白偶联的磷酸酶PLCβ,引起PIP2被降解,从而使得被PIP2关闭的KCNQ外向钾离子通道被打开,以至于细胞膜去极化,形成动作电位。在KCNQ或是Gq不表达的神经元里,hM3D的功能可能会有所不同。
1.2 Gi-DREADD(hM4Di)
hM4Di是从人毒蕈碱乙酰胆碱受体M4上改造的仅对CNO(clozapine-N-oxide)有反应的人工受体(DREADD),不再受乙酰胆碱激活。在一些神经元里,CNO结合hM4D后,激活Gi蛋白偶联的内向钾离子通道GIRK,使得细胞膜超极化,抑制神经元细胞动作电位发放。 在不表达GIRK或是Gi的细胞中,hM4D的功能会有所不同。
2. 实施方法
激活或抑制神经元是通过激活或抑制DREADDs受体,而要想达到激活或抑制DREADDs受体的目的,就要选择相应的DREADDs受体。DREADDs的操作步骤如下(如图7):
①选择符合实验目的的DREADDs受体;
②将DREADDs受体基因和特异性启动子导入病毒载体并感染动物机体,使在靶细胞中表达DREADDs受体;
③在合适的时间点给予(立体定位、腹腔注射或喂水)实验动物CNO,激活或抑制DREADDs受体;
④通过行为学或电生理记录神经元活性改变带来的变化。
图7.化学遗传学的实验步骤
3. 应用案例
化学遗传学技术也被广泛用于神经科学领域,下面介绍几例运用该技术的研究案例:
2017年3月,暨南大学任超然实验室在《Nature Communication》发表研究论文,该项工作是借助化学遗传、钙离子成像及神经示踪揭示了视网膜缝投射通路,及视网膜缝神经元对防御行为的调控(如图8)。
图8.视网膜缝神经元对防御行为的调控(Chaoran Ren, et al.,Nature Communication, 2017)
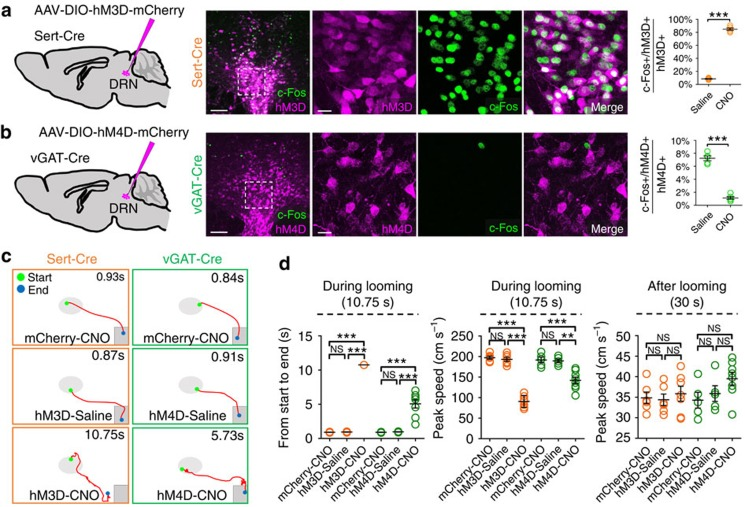
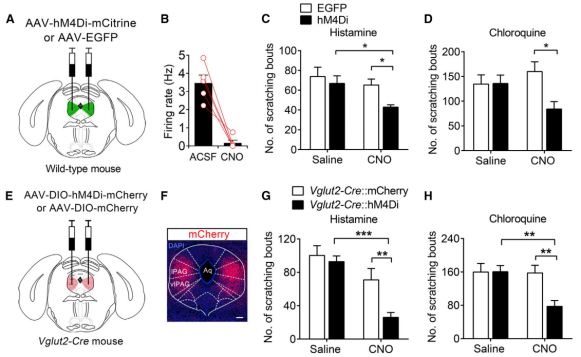
此外,《Neuron》在2019年1月发表了国科学院上海生命科学研究院孙衍刚的工作,该工作借助了化学遗传学来研究外侧/腹外侧中脑导水管周围灰质(l/vlPAG)谷氨酸能神经元在瘙痒中的功能作用。作者通过抑制l/vlPAG谷氨酸能神经元后,观察到组胺或氯喹诱导的瘙痒抓挠行为明显减弱。(如图9)
图9. l/vlPAG谷氨酸能神经元在瘙痒中的功能作用(Yangang Wang, et al., Neuron, 2019)
参考文献
1.Fenno L1,Yizhar O,Deisseroth K. The development and application of optogenetics.Annu Rev Neurosci.2011;34:389-412.
2.Yizhar O,Fenno LE,Davidson TJ,Mogri M,Deisseroth K. Optogenetics in Neural Systems.Neuron.2011;71(1):9-34.
3.Buchen L. Neuroscience: Illuminating the brain.Nature.2010;465(7294):26-8.
4.Knowland D,Lilascharoen V,Pacia CP,Shin S,Wang EH,Lim BK.Distinct Ventral Pallidal Neural Populations Mediate Separate Symptoms of Depression.Cell.2017;170(2):284-297.
5.Zhang Z,Liu Q,Wen P,Zhang J,Rao X,Zhou Z,Zhang H,He X,Li J,Zhou Z,Xu X,Zhang X,Luo R,Lv G,Li H,Cao P,Wang L,Xu F.Activation of the dopaminergic pathway from VTA to the medial olfactory tubercle generatesodor-preference and reward.Elife.2017;6. pii: e25423.
6.Sternson SM,Roth BL. Chemogenetic tools to interrogate brain functions.Annu Rev Neurosci.2014;37:387-407.
7.Huang L,Yuan T,Tan M,Xi Y,Hu Y,Tao Q,Zhao Z,Zheng J,Han Y,Xu F,Luo M,Sollars PJ,Pu M,Pickard GE,So KF,Ren C.A retinoraphe projection regulates serotonergic activity and looming-evoked defensive behaviour.Nat Commun.2017;8:14908.
8.Ren S,Wang Y,Yue F,Cheng X,Dang R,Qiao Q,Sun X,Li X,Jiang Q,Yao J,Qin H,Wang G,Liao X,Gao D,Xia J,Zhang J,Hu B,Yan J,Wang Y,Xu M,Han Y,Tang X,Chen X,He C,Hu Z.The paraventricular thalamus is a critical thalamic area for wakefulness.Science.2018;362(6413):429-434.
9.Gao ZR,Chen WZ,Liu MZ,Chen XJ,Wan L,Zhang XY,Yuan L,Lin JK,Wang M,Zhou L,Xu XH,Sun YG. Tac1-Expressing Neurons in the Periaqueductal Gray Facilitate the Itch-Scratching Cycle viaDescending Regulation.Neuron. 2019;101(1):45-59.e9.

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK