2024-09-18 阅读量:1442
脓毒症是由宿主对感染的反应失调引起的危及生命的器官功能障碍。在严重脓毒症患者中,肺是最易受损伤的器官。大约50%的严重脓毒症重症患者可能会发展为急性呼吸窘迫综合征(ARDS),其死亡率高达30-40%。迄今为止,还没有发现特定的治疗方法对脓毒症诱导的ARDS有效。面对这个紧迫的临床问题,进一步探索脓毒症相关肺损伤的发病机制将为脓毒症提供新的治疗策略,从而降低重症监护病房的死亡率。
ARDS的一个关键病理特征是肺内皮屏障功能的破坏。内皮细胞在循环血液与组织之间提供了一个半透性屏障。在ARDS中,由于炎症刺激,内皮屏障被破坏,导致富含蛋白的炎性水肿液积聚、透明膜形成和中性粒细胞在肺部浸润,从而引起肺顺应性差、弥漫性肺泡损伤、严重低氧血症甚至急性呼吸衰竭。因此,保持血管内皮的完整性可能有助于为脓毒症诱导的ARDS开发潜在的新治疗方法。
最近,许多遗传和表观遗传变化已被证明参与了内皮功能的维持。越来越多的证据表明,与脓毒症相关的肺微血管渗漏和器官损伤/功能障碍与表观遗传和基因表达的变化有关。RNA分子的化学修饰,即表观转录组,在基因表达的转录后调控中起着至关重要的作用。研究表明,N6-甲基腺苷(m6A)影响众多生理和病理过程。m6A修饰是真核细胞中mRNA和长链非编码RNA(lncRNA)甲基化最丰富的形式。大量研究证明,m6A修饰参与调控RNA剪接、定位、稳定性和翻译,并由甲基转移酶(如甲基转移酶样蛋白3—METTL3、METTL14等)催化,并由去甲基化酶(FTO、ALKBH5等)去除,以调节mRNA的合成和降解。据报道,异常的m6A mRNA甲基化与人类疾病的发生和发展密切相关。然而,m6A修饰在脓毒症诱导的ARDS中的作用在很大程度上仍然未知。因此,有必要阐明其潜在机制,以揭示m6A修饰在脓毒症诱导的肺内皮损伤中的确切生物学过程和影响。
近期,上海交通大学医学院附属仁济医院俞卫锋教授/焦英甫副研究员团队在Frontiers in Immunology杂志上发表题为“METTL3-Mediated N6-Methyladenosine Modification of Trim59 mRNA Protects Against Sepsis-Induced Acute Respiratory Distress Syndrome”的研究论文,本文中,作者表明脓毒症中m6A修饰的减少与METTL3表达的下调有关。METTL3是m6A RNA修饰缺失的主要调节因子。敲低METTL3加速了内皮细胞屏障功能障碍和炎症反应。此外,含三重基序蛋白59(Trim59)被鉴定为关键的m6A效应因子,其缺陷加剧肺损伤。从机制上讲,m6A阅读器YTHDF1(含YT521-B同源(YTH)结构域的蛋白(YTHDF)家族一员)识别并稳定m6A修饰的Trim59 mRNA,以保护血管内皮免受屏障功能障碍和炎症反应的影响。这些数据揭示了通过m6A修饰在脓毒症诱导的ARDS中的表观转录机制的新见解,在脓毒症相关肺损伤的诊断、预后和分子靶向治疗中具有重要的应用价值。

1.脓毒症诱导的急性呼吸窘迫综合征中m6A修饰失调
为阐明m6A修饰在脓毒症诱导的ARDS中的功能作用,研究者首先评估了正常和脓毒症小鼠(盲肠结扎穿孔术即CLP造摸后24 h)肺中的m6A RNA水平。通过比色酶联免疫吸附测定(ELISA)发现,脓毒症肺中总RNA的m6A水平显著降低。m6A修饰主要由m6A“写入器”和“擦除器”调节,因此,研究人员推测脓毒症肺中m6A RNA水平的降低是由这些基因的失调引起的。然后,作者比较了肺组织和肺微血管内皮细胞(PMVECs)中m6A“写入器”(METTL3、METTL8、METTL14和WTAP)和“擦除器”(ALKBH5和FTO)的mRNA水平。结果显示,在脓毒症肺和脂多糖(LPS,1 μg/mL,分别处理0 h、6 h、12 h、24 h)刺激的PMVECs中,甲基转移酶METTL3和METTL14表达显著下调,而其他基因的表达没有显著差异。通过蛋白质印迹确定,脓毒症肺组织中METTL3的蛋白表达也显著低于正常肺组织。此外,在LPS处理的PMVECs中,METTL3的蛋白水平显著降低。免疫组织化学结果进一步证实,与正常肺组织相比,脓毒症肺组织中METTL3的表达显著降低。综上所述,这些结果表明,在脓毒症诱导的ARDS中,m6A修饰减少、METTL3表达水平降低,并且脓毒症的发生可能与m6A甲基转移酶METTL3的失调有关。
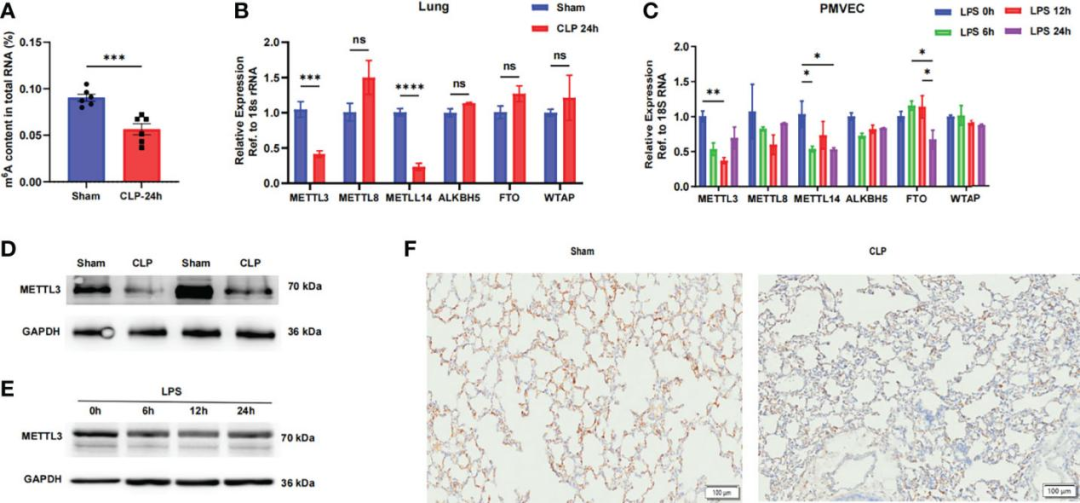
图1. METTL3-m6A通路在脓毒症诱导的ARDS中下调
2.METTL3与脓毒症诱导的ARDS中异常的m6A修饰相关
为确定METTL3在脓毒症诱导的ARDS中的作用,研究人员通过鼻内给药方式递送METTL3小干扰RNA(siRNA)或阴性对照(NC)siRNA,在小鼠中构建了METTL3敲低模型,并在mRNA和蛋白水平上验证了METTL3的敲低效率。C57BL/6小鼠进行盲肠结扎和穿刺(CLP),并在损伤前24 h预先鼻内给药METTL3 siRNA或NC siRNA。随后,作者研究了METTL3对脓毒症诱导的肺损伤的影响。假手术组(Sham组)小鼠的组织学检查(H&E染色)显示正常的肺,其特征是肺泡壁薄,偶见肺泡巨噬细胞,中性粒细胞很少。然而,与siNC-CLP组相比,siMETTL3-CLP组的小鼠表现出中性粒细胞浸润显著增加、出血、透明膜形成以及肺泡壁增厚。这些观察结果通过肺损伤评分评估肺损伤程度得到了证实,表明METTL3缺陷显著加剧了脓毒症诱导的肺损伤。此外,支气管肺泡灌洗液(BALF)中蛋白浓度和细胞数量的增加代表了内皮通透性的增强。即相比于siNC-CLP组,siMETTL3-CLP组BALF中的细胞数量、蛋白浓度显著增加。此外,研究者还检测了髓过氧化物酶(MPO)活性以评估中性粒细胞在肺组织中的积聚。结果显示敲低METTL3显著提高了脓毒症小鼠的MPO活性。通过伊文思蓝组织扩散评估实验,表明METTL3敲低的CLP小鼠表现出血管渗漏增加。此外,作者利用小鼠炎症定量抗体芯片检测了循环血液中的一组炎症标志物以评估肺损伤后的全身炎症反应。在测试的40种炎症标志物中,有12种标志物至少增加了2倍(与Sham组比较)。值得注意的是,siMETTL3处理导致CLP诱导的动物死亡显著增加(CLP后观察7 d内小鼠存活情况);具体而言,小鼠在CLP后72 h无法存活。总体而言,这些数据表明敲低METTL3加重脓毒症对内皮屏障完整性的破坏和其诱导的炎症反应。
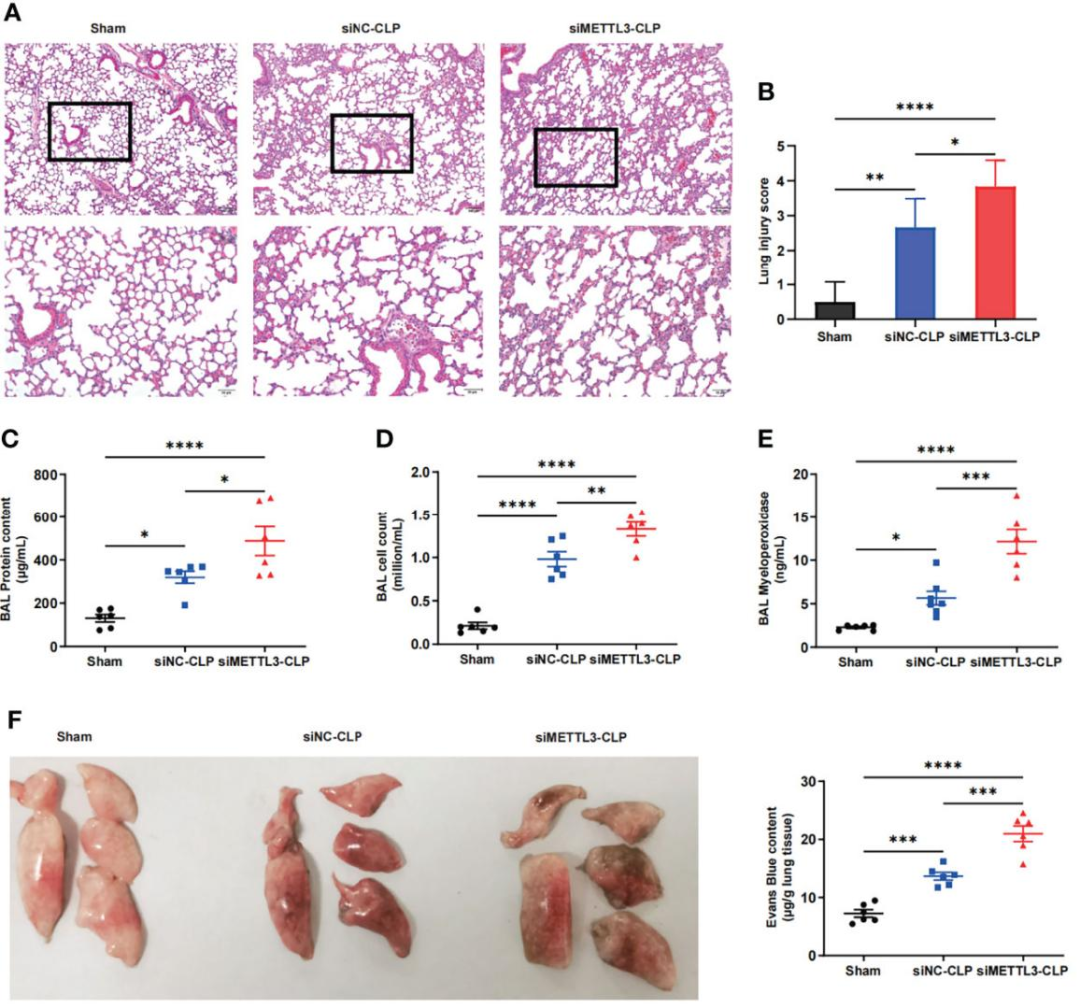
图2. METTL3缺失加剧了CLP模型中的肺内皮损伤
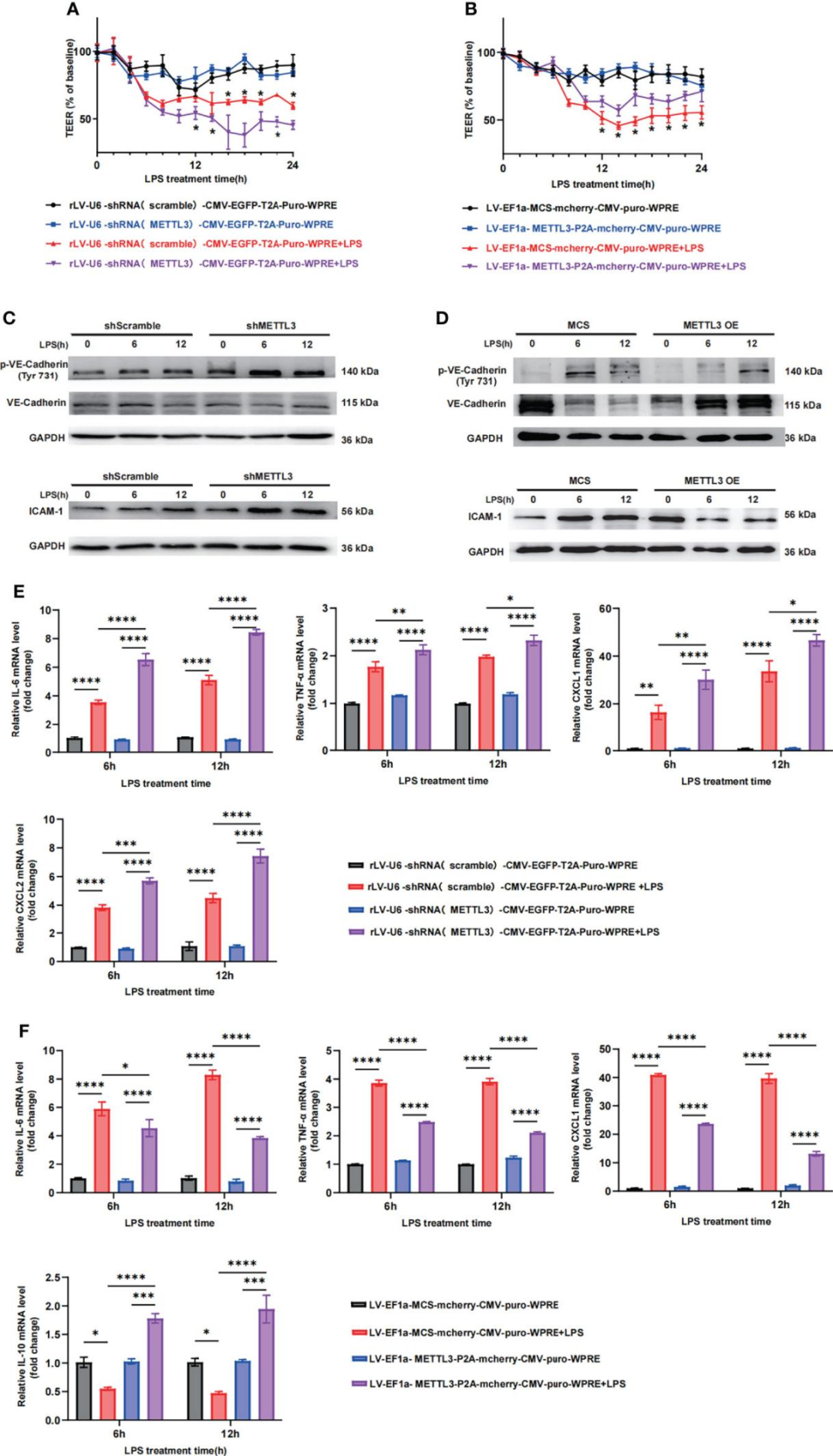
3.METTL3调节血管内皮屏障功能
由于METTL3在脓毒症肺中的表达显著下调,研究人员进一步研究了它在维持内皮屏障中的关键作用。METTL3的表达在不同细胞中可能有所不同,因此选择人肺血管内皮细胞系HULEC-5a(人肺微血管内皮细胞)建立类似肺损伤的细胞模型。为研究METTL3在维持内皮屏障中的关键作用,作者建立了METTL3稳定敲低的HULEC-5a细胞(慢病毒由枢密提供),用LPS刺激细胞不同时间,测量跨内皮电阻(TEER)以评估屏障功能。结果显示,METTL3的下调在LPS处理6 h时即引起单层电阻的显著降低,并且这种降低至少持续到LPS处理24 h,这表明METTL3敲低显著增加了HULEC-5a细胞的通透性。与这些观察结果一致,当HULEC-5a细胞用shMETTL3处理时,研究者也观察到血管内皮钙黏蛋白(VE-Cadherin)连接的丧失和细胞间黏附分子-1(ICAM-1)的积累(LPS处理6 h,与shScramble组比较,shMETTL3组VE-Cadherin表达显著下调、ICAM-1表达显著上调),这表明METTL3的抑制破坏了内皮通透性并加重了内皮屏障功能障碍。此外,METTL3的下调导致比shScramble组诱导更高水平的炎症细胞因子表达(LPS处理6 h、12 h)。随后,作者建立了METTL3稳定过表达的HULEC-5a细胞(慢病毒由枢密提供)。通过RT-qPCR和蛋白质印迹验证了METTL3的过表达。正如预期的那样,METTL3过表达显著改善了内皮单层电阻并提高了VE-Cadherin连接的表达(同时ICAM-1表达下调)。此外,炎症反应被有效抑制。综上所述,体外实验结果表明METTL3在脓毒症诱导的肺损伤中对血管内皮屏障功能的调节起着关键作用。
图3. METTL3调节血管内皮屏障功能
4.METTL3通过靶向Trim59调节内皮功能
为确定METTL3调节内皮屏障功能的分子机制,研究人员分别在稳定敲低METTL3及对照的HULEC-5a细胞中进行了RNA-seq和MeRIP-seq(甲基化RNA免疫共沉淀测序),结合数据分析、文献检索与实验验证,作者得出结论:METTL3介导的m6A修饰通过YTHDF1依赖的Trim59 mRNA稳定性维持Trim59的表达。
为进一步确定METTL3是否通过靶向Trim59调节内皮功能,作者在METTL3稳定过表达的HULEC-5a细胞中转染Trim59 siRNA,并利用RT-qPCR及蛋白质印迹从mRNA与蛋白水平验证敲低效果。TEER结果表明,在METTL3过表达的细胞中敲低Trim59部分逆转了METTL3对LPS诱导的内皮损伤的保护作用。此外,研究人员发现当Trim59表达下调时,METTL3过表达介导的内皮屏障恢复受到显著抑制(VE-Cadherin表达显著下调)。此外,敲低Trim59加剧了内皮炎症反应。综上所述,这些数据表明METTL3通过部分调节Trim59表达改善LPS诱导的血管内皮损伤。
图4. METTL3通过靶向Trim59调节内皮功能
结论
总体而言,本研究提供了证据表明METTL3缺失介导的m6A修饰减少影响脓毒症诱导的ARDS中的内皮屏障功能,最终增加内皮通透性并加重炎症反应,从而增加脓毒症相关的死亡率。这些发现揭示了这种修饰在脓毒症相关肺损伤的诊断、预后和分子靶向治疗中的应用价值。
本研究得到了国家自然科学基金(项目批准号:81701940、32030043)、国家重点研发计划(项目批准号:2018YFA0108204)等项目支持。
通讯作者介绍:
俞卫锋,医学博士、主任医师、教授、博士研究生导师。现任上海交通大学医学院附属仁济医院麻醉危重症疼痛中心主任,上海交通大学医学院麻醉与危重病医学系主任。教育部麻醉医学重点实验室主任,上海市围术期器官保护与功能支持工程技术中心主任。主持9项并指导科室国家自然科学基金79项,获国家自然科学基金生命科学部重点课题和科技部重大研发计划各一项。主编专著13部。共发表论文300余篇,SCI收录140篇,总IF>800分。有多篇发表在JCI、Anesthesiology、Advanced Science、BJA、Pain、Stroke、Science Translational Medicine、Nature Communications、Cancer Communications、ACS-NANO等著名杂志上。获国家和军队科技进步二等奖各一项,教育部科技进步奖一等奖一项。另获总后勤部“科技新星”、上海市卫生系统“银蛇奖”、军队院校“育才奖”银奖、“上海市优秀学科带头人”、“世界华人医师霍英东奖”等各种奖励。
焦英甫,上海交通大学医学院博士,副研究员,麻醉医学教育部重点实验室(上海交通大学)副主任,上海围术期器官支持与功能保护工程技术研究中心副主任,仁济医院麻醉科基础研究亚专业组长。主要研究方向:1、疼痛的发生及调控神经机制;2、全麻机制;3、围术期神经与外周脏器功能互作机制。主持国自然基金2项,参与基金数10项,主要研究工作成果发表在Journal of Clinical Investigation,Frontiers in immunology,Pain等国际期刊。

本文使用的病毒产品均来自枢密科技,列表如下:


了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK