2024-09-09 阅读量:1156
肝脂肪变性是最常见的慢性肝病之一,在过去几十年里,全球肝脂肪变性的患病率和发病率一直在上升。肝脂肪变性的发病机制复杂且尚不完全清楚,但胰岛素抵抗(IR)被认为是其发展的主要致病因素。在生理状态下,胰岛素抑制肝脏葡萄糖异生,促进脂肪从头合成(DNL)以储存热量。在IR期间,胰岛素不能抑制肝脏葡萄糖的产生,肝脏DNL仍无限制地增加,胰岛素水平与肝脏脂质沉积之间也存在正相关关系,进而造成肝脂肪变性增加。但肝脂肪变性通过何种机制增加仍未完全明确。
近日,山东省立医院赵家军、薄涛、高聆共同通讯在Nature Metabolism发表了题为“Upregulation of WDR6 Drives Hepatic de novo Lipogenesis in Insulin Resistance in Mice”的研究论文,作者发现WD重复域6(WD repeats domain 6,WDR6)促进IR期间肝脏DNL。人WDR6蛋白是含有WD40重复(WDR)的蛋白,由40-60个氨基酸残基组成的WD40重复是保守的蛋白结构域,其基本功能是协调多种蛋白复合物的组装。本文中,研究人员发现WDR6在高脂饮食(HFD)诱导的IR期间表达上调,随后通过上调脂肪酸(FA)合酶(FASN,参与肝脏DNL的关键代谢酶)表达促进肝脏DNL。此外,还鉴定出一个能抑制WDR6与PPP1CB(丝氨酸/苏氨酸蛋白磷酸酶1的β型催化亚基,PP1)相互作用的小分子天然化合物XLIX,从而能够减少IR期间的肝脂肪变性。综上所述,这些结果表明WDR6可作为治疗肝脂肪变性的潜在靶点。
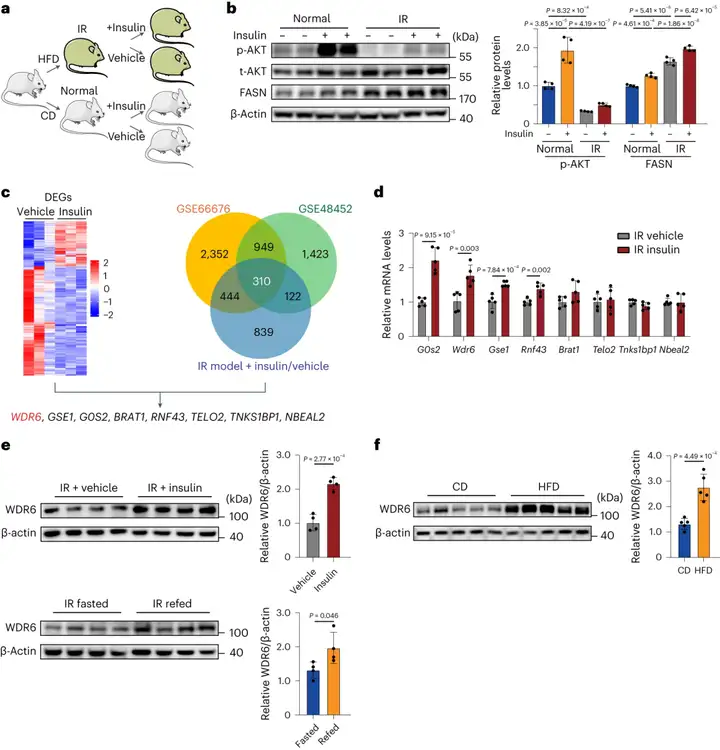
1.胰岛素抵抗期间,WDR6表达上调以响应胰岛素
研究人员通过HFD喂养6周来构建IR小鼠模型,随后腹腔注射胰岛素(每天每kg体重注射0.75单位)。AKT的磷酸化水平(Ser473位点)是胰岛素信号通路的关键指标(胰岛素作用的“经典”下游分子),结果显示对胰岛素的反应降低(p-AKT水平较低),表明胰岛素抵抗形成。然而,FASN在HFD小鼠中继续显示出对胰岛素的相同反应(IR+insulin组小鼠肝脏FASN表达进一步增加)。结果表明,胰岛素仍然可驱动IR期间这种脂肪生成基因的表达。
为鉴定在IR状态下仍对胰岛素有反应的基因,研究人员对注射胰岛素及对照vehicle(BSA,牛血清白蛋白)的IR小鼠肝脏进行转录组分析,总共鉴定出263个差异表达基因(DEGs)。接下来利用公共基因表达谱数据库进一步筛选感兴趣的候选基因,发现310个基因在三个数据库中相交,并与FASN水平呈正相关。然后关注那些IR期间对胰岛素有反应的基因,从而选择了8个候选基因。最终,通过RT-qPCR实验及文献检索,确定WDR6作为进一步研究的靶点。作者进一步实验发现IR后注射胰岛素或HFD重新喂养6小时,WDR6水平升高。此外,还发现NAFLD(非酒精性脂肪肝病)小鼠(HFD喂养28周)肝脏WDR6表达增加,这支持了WDR6参与肝脏脂质代谢的假设。
图1. WDR6在IR状态下对胰岛素的反应为表达上调
2.敲低肝脏Wdr6减少胰岛素抵抗状态下的肝脂肪变性
为测试WDR6是否促进IR诱导的肝脏代谢紊乱,研究人员将选择性敲低肝脏Wdr6的腺相关病毒及对照AAV尾静脉注射到小鼠体内,注射4周后,小鼠HFD喂养8周。结果显示,AAV主要表达在肝脏,shWDR6小鼠肝脏Wdr6表达显著降低。有趣的是,在HFD喂养后,shWDR6小鼠免受代谢异常的影响,包括血清甘油三酯(TAG)和空腹血糖(FPG)水平轻度增加(HFD喂养的shNC小鼠TAG及FPG指标上调更多),胰岛素敏感性也得到改善。根据对肝脏的超声分析、油红O(ORO)染色、透射电子显微镜(TEM)观察和TAG含量测定,发现与shNC组小鼠相比,雄性shWDR6小鼠的肝脏脂质沉积有所改善。这些数据表明WDR6参与肝脏脂质代谢。
为明确靶向肝脏WDR6是否可改善HFD的不利影响,研究人员开发了治疗模型(TM):HFD喂养2周后10周龄小鼠注射AAV-shWDR6(TM-shWDR6组),以模拟靶向WDR6的治疗效果。对照组小鼠(2周HFD+注射AAV-shNC)被细分为两个亚组:一组在注射AAV-shNC后继续接受HFD喂养(TM-shNC组),而另一组则在AAV注射后改为正常饮食(CD)喂养(HFD withdrawal组)。结果显示与TM-shNC组相比,TM-shWDR6组HFD诱导的IR和肝脏脂质沉积减轻。此外,作者也利用CRISPR-Cas9技术构建了肝脏特异性Wdr6敲除(WDR6-LKO)小鼠,对照组为野生型(WT)同窝对照(LC)小鼠。研究人员将8周龄WDR6-LKO和LC小鼠给予HFD喂养16周,结果显示相比于LC小鼠,雄性WDR6-LKO小鼠的血清TAG和FPG水平降低,胰岛素敏感性也有所提高;WDR6-LKO组小鼠肝脏中TAG沉积减少,脂肪肝程度较低。这些结果表明,靶向肝脏Wdr6可减少HFD相关的肝脏脂质沉积。综上所述,肝脏特异性抑制Wdr6改善或逆转IR期间的代谢紊乱,尤其是肝脏脂质沉积。
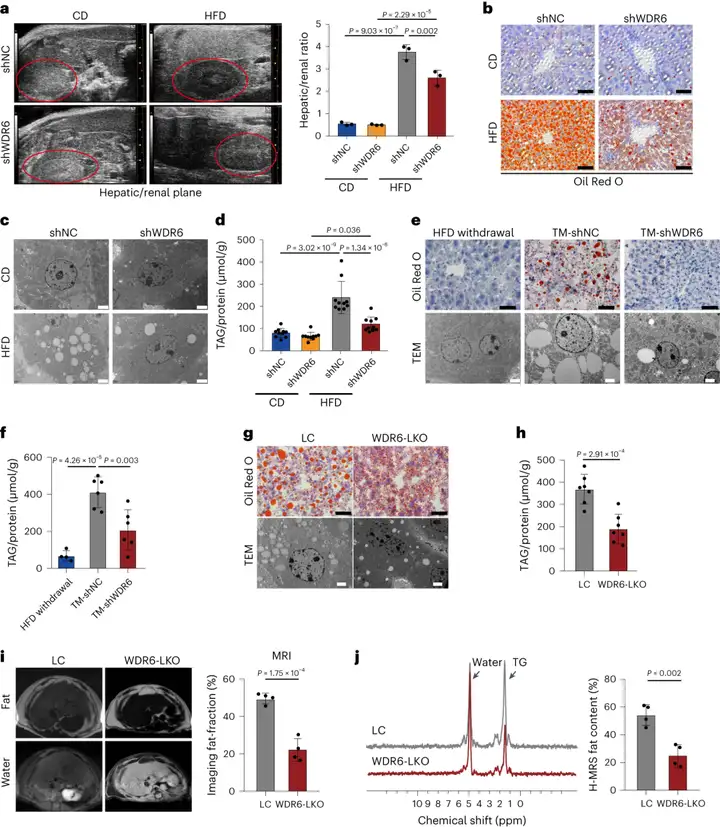
图2. Wdr6的肝脏特异性干预有效防止了HFD诱导的IR期间肝脏TAG过度沉积
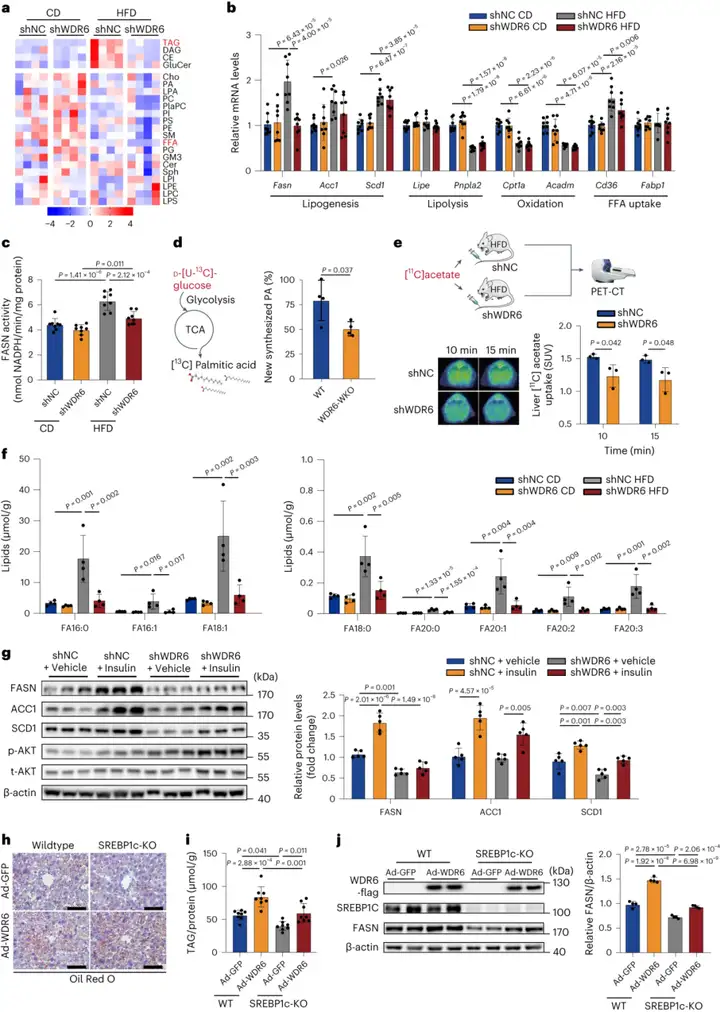
3.肝脏WDR6通过调节脂肪从头合成影响肝脏甘油三酯沉积
接下来,作者对CD和HFD分别喂养8周的shWDR6和shNC小鼠肝脏(即shNC CD组、shWDR6 CD组、shNC HFD组、shWDR6 HFD组)进行了脂质组学分析,以深入了解可能受WDR6影响的脂质代谢途径。结果如图所示,HFD喂养组之间差异最大的代谢物是TAG。因此,研究人员评估了shWDR6和shNC小鼠参与肝脏TAG代谢主要途径(包括DNL、脂肪分解、游离脂肪酸氧化和摄取,以及葡萄糖代谢)的各种代表性基因的表达模式,结果表明HFD组中shWDR6小鼠的DNL相关基因Fasn在mRNA和蛋白水平上表达都低于shNC小鼠。此外,在HFD组中,与对照小鼠相比,Wdr6敲低后FASN酶活也更低。
为进一步证实这些发现,作者利用碳同位素标记分析对原代肝细胞(肝细胞来自Wdr6全身敲除小鼠(WDR6-WKO)和野生型(WT)对照小鼠)中新合成的棕榈酸(棕榈酸是FASN的产物)含量进行了估算,结果显示与对照组小鼠比较,WDR6-WKO小鼠肝细胞中13C标记棕榈酸含量明显更低。进一步借助碳-11乙酸盐正电子发射断层成像(PET)估算肝脏DNL速率,结果显示由于肝脏Wdr6的敲低,肝脏DNL速率降低。此外,由于TAG的侧链由各种FAs组成,根据所涉及的不同生物合成酶,研究人员发现差异最明显的FAs是饱和脂肪酸(FA16:0,FA18:0)和单不饱和脂肪酸(FA16:1,FA18:1),而它们分别是FASN或硬脂酰辅酶A去饱和酶1(SCD1)的产物。综上所述,这些结果表明,IR状态下WDR6促进肝脏DNL,Fasn是参与这一过程的关键靶点。
接下来,作者测试了WDR6是否可介导IR期间调控FASN的胰岛素过程,因此,HFD-shWDR6小鼠注射胰岛素并在6小时后实施安乐/死。结果显示,与HFD-shNC小鼠不同,Wdr6的敲低显著减弱了胰岛素增加FASN水平的能力,但对乙酰辅酶A羧化酶1(ACC1)或SCD1的影响很小,这表明在IR期间,WDR6的上调可作为胰岛素增加FASN水平和DNL的替代手段。
为验证WDR6与肝脏DNL的关系,作者构建了高果糖饮食(HFrD)小鼠的AAV-shWDR6模型,由于果糖是肝脏DNL的强底物,HFrD在肝脏DNL研究中更常用。结果表明与HFrD-shNC组比较,HFrD-shWDR6组显示胰岛素敏感性有所增加,而血清TAG/FPG水平没有明显变化;肝脏饱和FAs(即DNL的产物)丰度更低;肝脏FASN水平降低。总的来说,这些数据证实WDR6在调节肝脏DNL中起着至关重要的作用。
随后,作者想知道WDR6是否介导了Fasn依赖于胆固醇调节元件结合蛋白1c(SREBP1c,DNL的关键转录因子)的表达调控。于是,研究人员在12周龄SREBP1c-KO C57BL/6小鼠通过尾静脉注射腺病毒过表达Wdr6(间隔5天共注射3次),15 d后小鼠予以安乐/死。结果显示,虽然SREBP1c敲除可减少肝脏TAG沉积,但过表达Wdr6仍然可提高SREBP1c-KO小鼠肝脏TAG和FASN蛋白水平。这些结果表明,SREBP1c于WDR6介导的对Fasn表达和肝脏TAG沉积的调节作用而言很重要,但不是必需的(删除SREBP1c只能部分阻断WDR6介导的调节作用)。
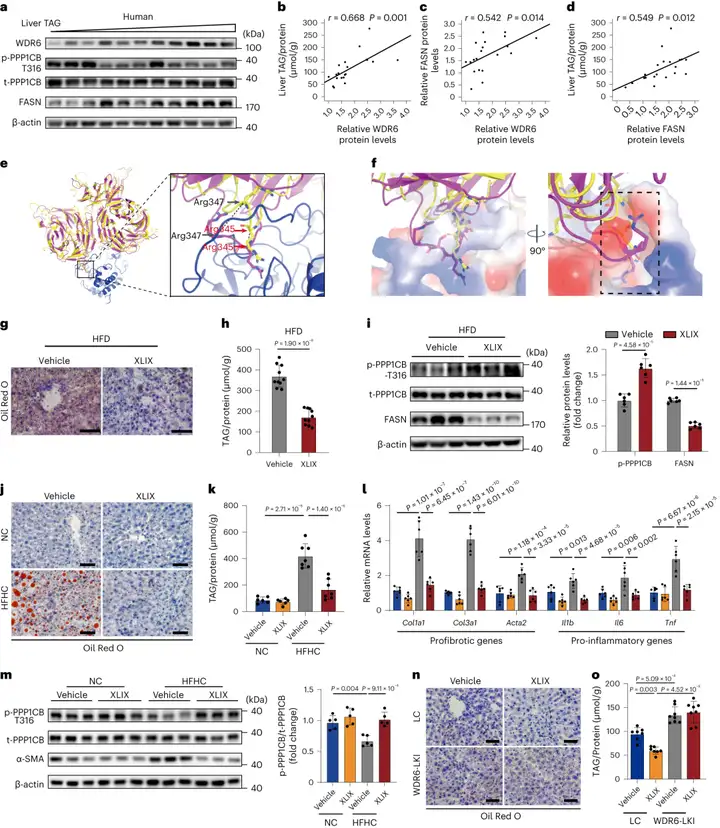
4.XLIX抑制WDR6-PPP1CB相互作用并减少肝脂肪变性
作者接下来继续探索WDR6调节FASN表达的机制。研究人员发现WDR6与PPP1CB相互作用,并在其Thr316处使之去磷酸化。进一步研究发现PPP1CB-Thr316介导WDR6对Fasn转录的调节;WDR6通过FKSRSR基序与PPP1CB相互作用;WDR6通过与PPP1CB的相互作用促进PPP1CB在Thr316位点的去磷酸化,进而使WDR6介导的肝脏DNL调节发生。
在WDR6的结构域中,最大的结合口袋位于结构域b(氨基酸330-687),其中包含推测的PP1结合基序FKSRSR。研究人员通过分子对接筛选了来自绞股蓝的11种单体与WDR6口袋的结合能力,发现XLIX与WDR6的结合能力最强。分子动力学(MD)模拟表明,XLIX通过与多个氨基酸残基形成的多个氢键与WDR6相互作用良好,其接近FKSRSR基序,可能对WDR6和PPP1CB的相互作用产生空间位阻效应。为进一步研究结合模式,作者借助计算机进行了蛋白-蛋白对接以构建WDR6-PPP1CB复合物,然后对其MD模拟。结果表明,WDR6中推测的PP1结合基序FKSRSR(残基342-347)形成一个可插入PPP1CB口袋的环。在WDR6-XLIX复合物中,FKSRSR环的构象在与XLIX结合后发生了显著变化。因此,作者推测XLIX引起的变构效应可能破坏FKSRSR环与PPP1CB的相互作用。这种干扰促使研究者探索XLIX对体内肝脏脂质沉积的影响,首先,8周龄C57BL/6J小鼠腹腔注射XLIX(每天每kg体重注射40 mg,持续4周;腹腔注射后1h即可到达肝脏)后通过评估肾功能和肝功能判断药物安全性,结果显示,XLIX对小鼠肝肾功能均没影响。肝肾切片的H&E染色结果进一步证实。
接下来,研究人员测试了XLIX是否可改善肝脏脂质沉积。考虑到NASH(非酒精性脂肪性肝炎)是临床需求最未被满足的病理状态,作者选择在HFD诱导的NAFLD模型及高脂高胆固醇(HFHC)饮食诱导的NASH模型中分别给予XLIX处理。于是,作者将小鼠予以HFD喂养3周(2周的HFD已足以诱导高水平肝脏脂质沉积)后腹腔注射XLIX 4周,结果显示,与对照组(注射DMSO)相比,XLIX处理组胰岛素敏感性提高。此外,肝脏脂质沉积和TAG含量降低,p-PPP1CB表达增加,FASN蛋白水平降低。对于NASH模型,8周龄C57BL/6J小鼠以HFHC饮食(HFHC组)或标准对照饮食(NC组)分别喂养2w、4w、8w、16w,结果显示,HFHC组小鼠肝脏WDR6表达显著增加(4w、8w、16w),并伴随NASH的病理进展(由肝脏切片的H&E、油红O和天狼星红-Picrosirius red染色结果揭示),p-PPP1CB表达明显下调(8w、16w)。在HFHC饮食喂养16周后腹腔注射XLIX 4周,结果表明XLIX的处理使得HFHC组小鼠IR程度更低(胰岛素敏感性提高)。更重要的是,该组小鼠肝脏脂质沉积和TAG含量也减少;p-PPP1CB表达增加。此外,多个标记基因的表达也降低了,如促炎相关基因IL1b、IL6和Tnf以及促纤维化基因Col1a1、Col3a1和编码蛋白α-SMA的Acta2。这些数据表明,XLIX能减缓肝脏炎症和纤维化的进展。综上所述,这些结果表明,XLIX很可能以增强PPP1CB在Thr316位点的磷酸化的方式改善NAFLD和NASH的进展。
结论
在这项研究中,作者发现了以前未被报道的肝脏DNL关键调节因子WDR6。在IR期间,肝脏WDR6表达上调并通过诱导PPP1CB的去磷酸化来促进肝脏DNL,从而导致Fasn表达增加。WDR6的进一步遗传或药理学靶向可有效减少与IR相关的肝脏TAG沉积。
这项工作得到了国家自然科学基金项目(项目批准号:91957209、81770788、82130025、82200879)、泰山学者项目等经费支持。
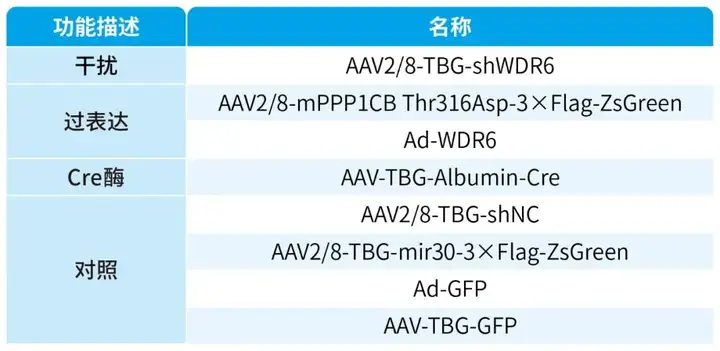
本文使用的病毒产品列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK