2024-09-09 阅读量:1283
进食行为是由身体的能量需求和愉悦感共同调节的复杂生理过程。先前研究表明,下丘脑是调控机体能量和营养需求平衡的最重要的脑区,其连接的环路监测外周信号,如胰岛素、瘦素和胃饥饿素,并调节饱腹感和饥饿状态。近年来研究表明,伏隔核(NAc)作为大脑基底前脑中的一个重要区域,不仅在奖赏、成瘾和强化学习等活动中发挥关键调控作用,同时也参与进食行为的调控。激活投射到外侧下丘脑(LH)或腹侧被盖区(VTA)的伏隔核的壳区(NAcSh)表达多巴胺1型受体(D1)的神经元可抑制正在进行的摄食行为[1]。
然而,大量的解剖学和功能学研究揭示NAc细胞构成具有异质性及与其他大脑区域功能连接的复杂性。这种异质性导致同一亚区的神经元在进食行为中产生不同的调控结果。因此,NAc中调节进食行为的具体神经元亚型以及其在整个环路协同作用过程中的机制仍然不是很清楚。为了更加全面地了解NAc细胞的异质性,张毅教授课题组前期构建了兼具基因表达和空间分布信息的伏隔核细胞图谱[2],这使得针对NAcSh不同细胞亚类在进食行为中功能的精细研究成为可能。
近日,哈佛医学院-波士顿儿童医院张毅教授实验室在Nature Metabolism杂志发表了题为“A subset of dopamine receptor-expressing neurons in the nucleus accumbens controls feeding and energy homeostasis”的研究,系统阐述了伏隔核壳区细胞异质性,并发现其中一类对进食相关行为有重要调节作用的神经元的生理功能和环路机制。

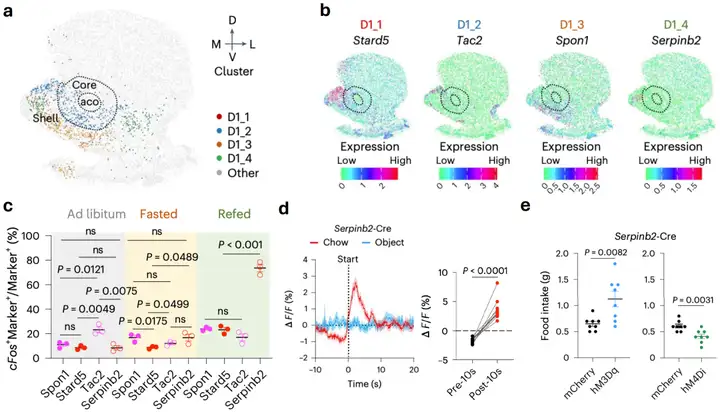
首先,研究者解析了位于NAcSh背中央区域的神经元构成,鉴定出表达D1的4种神经元亚类,分别由Stard5、Tac2、Spon1和Serpinb2标记。通过饥饿进食实验及荧光原位杂交技术,发现其中Serpinb2所标记的神经元亚类可以强烈响应饥饿后的进食行为。与之相符,在体光纤钙成像结果显示,小鼠自由探索进食后Serpinb2神经元兴奋性明显升高,在停止进食时迅速降低。然而,同区域的整体的D1神经元兴奋性在靠近食物时升高,进食时活性降低,在结束进食行为后活性升高。另一种由Tac2标记的神经元亚类则无明显改变。为了进一步解析神经元亚类在进食过程中的功能,研究者利用化学遗传学手段操纵这些神经元,结果表明激活或抑制Serpinb2神经元可以分别增加或者降低进食量及进食动机(图1)。值得注意的是,这一发现与之前报道的抑制整体D1神经元可以促进进食相反[3]。与此同时,通过三箱社交、高架十字迷宫、糖水偏好和条件位置偏好等NAc参与的行为范式筛选发现,Serpinb2神经元并不参与编码社交、焦虑、快感缺失和药物寻求行为。综上,研究者揭示Serpinb2神经元可以特异地编码进食行为。
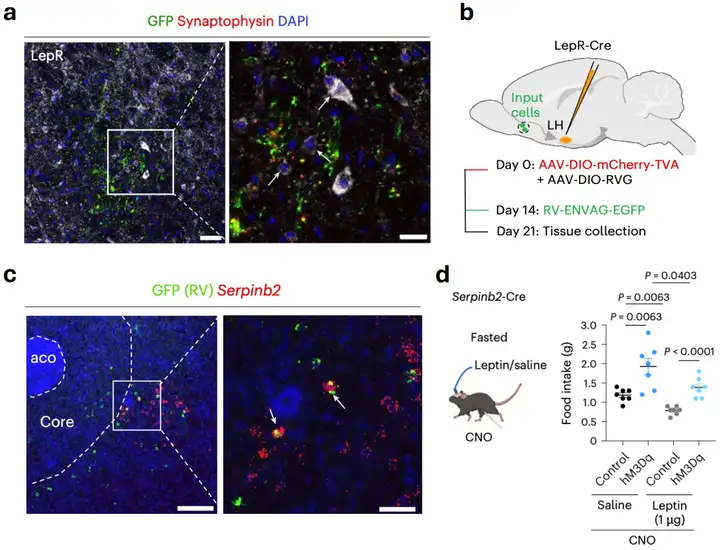
随后,为进一步探索Serpinb2神经元支配的下游神经网络,研究者通过病毒示踪技术发现,Serpinb2神经元可以特异投射到外侧下丘脑(Lateral hypothalamus,LH)中表达瘦素受体(LepR)的神经元,并不投射到腹侧苍白球、腹侧被盖区、杏仁核。抑制GABA能的Serpinb2神经元可以增加LH的c-Fos阳性细胞数,验证了NAcSh Serpinb2→LH环路的功能联系。先前研究揭示瘦素会显著抑制进食[4],然而有趣的是,研究者发现腹腔注射一定量瘦素后,激活Serpinb2神经元的小鼠依然增加了进食量(图2)。这表明,Serpinb2神经元可以抵抗由瘦素引起的进食抑制作用,为治疗神经性厌食症提供了新的可能。
图2. Serpinb2神经元连接LH LepR神经元抵抗瘦素效应
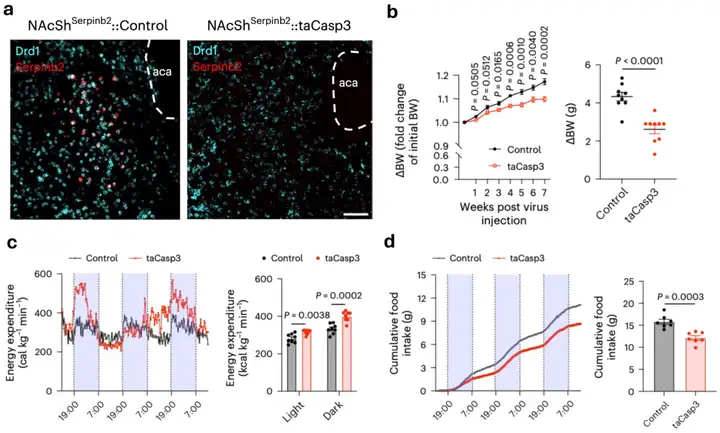
最后,研究者通过病毒介导的细胞凋亡技术特异地清除了Serpinb2神经元,发现这些神经元被清除的小鼠体重与对照组小鼠相比下降了约10%。进一步的代谢笼实验结果显示,清除Serpinb2神经元后,小鼠的耗氧量及能量消耗增加,而进食量明显减少(图3)。这一发现为暴饮暴食及肥胖的治疗带来潜在新策略。
文章结论与启发
综上,研究者系统解析了伏隔核壳区的细胞异质性,发现了一群能特异调控进食和能量消耗的神经元。这项工作实现了分子-细胞-结构-功能关系框架的建立,为进一步探索伏隔核的功能多样性提供了可能。同时,Serpinb2神经元的功能研究为进食障碍的治疗提供新思路。
该项研究由哈佛医学院-波士顿儿童医院张毅教授实验室完成。刘一穹博士为该研究的第一作者,王颖、赵政东、谢国光、张超和陈任超博士对本研究也做出了重要贡献。张毅教授为本文的通讯作者。
参考文献:
1. Maldonado-Irizarry, C.S., C.J. Swanson, and A.E. Kelley, Glutamate receptors in the nucleus accumbens shell control feeding behavior via the lateral hypothalamus. J Neurosci, 1995. 15(10): p. 6779-88.
2. Chen, R., et al., Decoding molecular and cellular heterogeneity of mouse nucleus accumbens. Nat Neurosci, 2021. 24(12): p. 1757-1771.
3. O'Connor, E.C., et al., Accumbal D1R Neurons Projecting to Lateral Hypothalamus Authorize Feeding. Neuron, 2015. 88(3): p. 553-64.
4. Leinninger, G.M., et al., Leptin acts via leptin receptor-expressing lateral hypothalamic neurons to modulate the mesolimbic dopamine system and suppress feeding. Cell Metab, 2009. 10(2): p. 89-98.
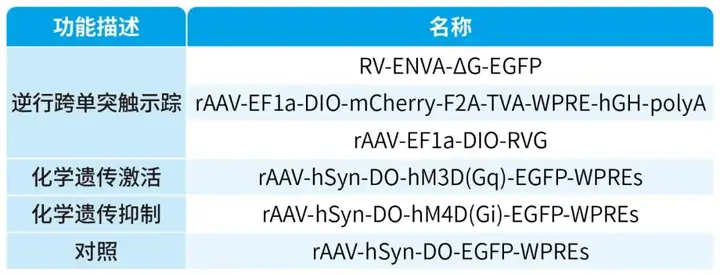
本文使用的来自枢密科技的病毒,列表如下:

了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK