2024-07-08 阅读量:1295
肾素-血管紧张素系统的激活作为高血压和慢性肾脏疾病(CKD)的标志,是促进肾小管间质纤维化进展的关键病理生理因素。血管紧张素II(Ang II)作为一种关键的活性分子,在肾小球硬化与肾小管间质纤维化中发挥关键作用。然而,Ang II诱导的肾纤维化的确切机制在很大程度上尚不清楚。
尽管人们长期以来一直猜测肾小管是肾损伤的受累部位,然而,越来越多的证据表明,肾小管其实是肾脏疾病进展的关键驱动部位。近端小管上皮细胞富含线粒体并依赖于氧化磷酸化,特别容易遭受缺氧、阻塞和代谢损伤。近端小管介导的细胞外基质(ECM)沉积被认为是导致终末期肾病的最终常见途径。前人研究显示近端小管在肾纤维化中具备重要作用,即通过发挥促炎作用和通过产生各种生物活性分子的成纤维细胞驱动间质炎症和纤维化。然而,损伤的近端小管通过何种确切的分子信号促进Ang II诱导的肾小管间质纤维化进展,目前了解的还不多。
LIM和衰老细胞抗原样结构域蛋白1(LIMS1)由五个LIM结构域和串联核定位信号组成,参与介导蛋白-蛋白相互作用,以普遍存在的方式在成人肾组织中表达。证据表明,LIMS1主要定位于肾细胞的局灶性粘附位点,与其它局灶性粘附蛋白重叠,通过与其它蛋白形成复合物在控制细胞行为方面发挥重要作用。有趣的是,有报道称LIMS1促进纤维化肾脏中肾小管上皮细胞向间充质细胞的转变。此外,研究还发现LIMS1通过与整合素连接激酶/小细胞蛋白α相互作用促进肾小球系膜基质沉积;细胞ECM粘附组分半胱氨酸-组氨酸富裕蛋白(PINCH-1,也称LIMS1)是纤维化和肿瘤生长的重要调节因子。尽管LIMS1在维护体内稳态方面发挥关键作用,但对其在Ang II诱导的肾小管间质纤维化中的确切作用还知之甚少。
2024年5月3日,东南大学附属中大医院肾内科王彬副主任医师、刘必成教授联合南京医科大学第二附属医院儿内科甘卫华主任医师团队合作在British Journal of Pharmacology期刊在线发表题为HIF-1α and adaptor protein LIM and senescent cell antigen-like domains protein 1 axis promotes tubulointerstitial fibrosis by interacting with vimentin in angiotensin II-induced hypertension研究论文。本文旨在阐明LIMS1在Ang II诱导的肾小管间质纤维化中的作用和调控。研究人员发现高血压肾病患者、Ang II诱导的高血压和肾小管间质纤维化小鼠中肾小管LIMS1的表达显著增加。肾小管LIMS1受缺氧诱导因子-1α(HIF-1α)的转录调控,并通过与波形蛋白(vimentin)相互作用在功能上参与促进肾小管间质纤维化。总的来说,这些研究结果为Ang II诱导的肾小管间质纤维化的机制提供了新的见解,并为CKD治疗提供了一个新的靶点。
1.Ang II诱导的肾小管间质纤维化中LIMS1表达增加
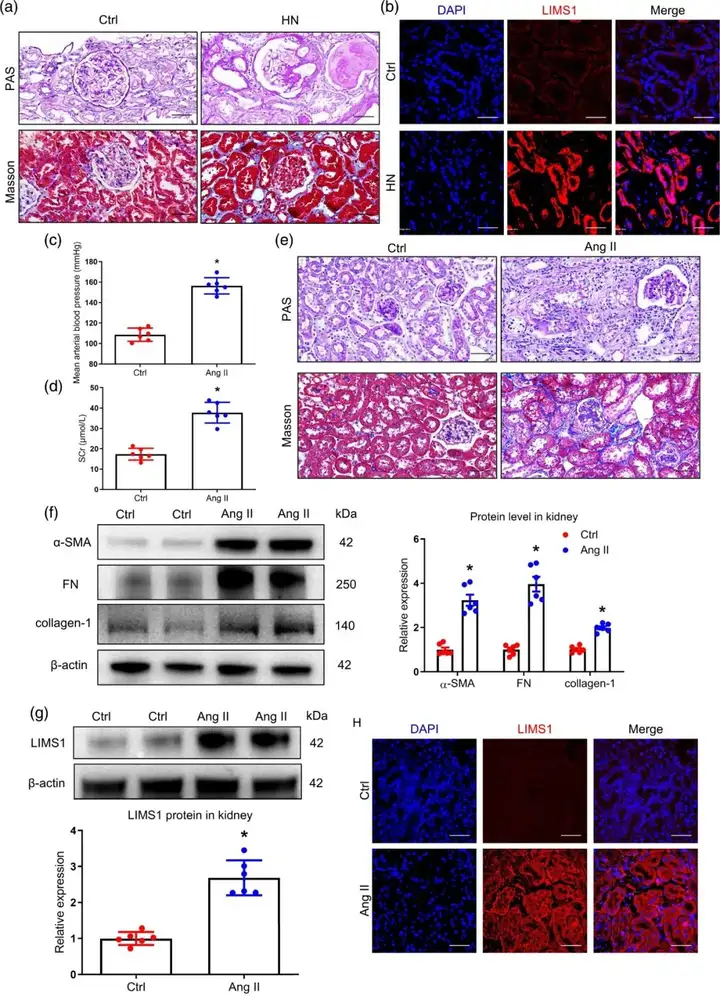
首先,作者观察了高血压肾病患者肾脏的组织病理学变化,结果显示小动脉玻璃样变、肾小管损伤和肾小管间质纤维化,并伴随LIMS1表达显著增加,且LIMS1主要定位于肾小管细胞。为探究LIMS1的表达模式,研究人员构建Ang II诱导的小鼠高血压和肾小管间质纤维化模型,发现皮下注射(皮下植入微型渗透泵)Ang II导致平均动脉压(MAP)显著升高,血清肌酐(Scr)水平也明显上升。组织病理学变化表明,Ang II诱导的肾小管间质纤维化模型成功建立。同时,发现ECM蛋白(α-SMA、FN、collagen-1)表达增加,证明形成了严重的肾小管间质纤维化。有趣的是,注射Ang II后,肾脏中LIMS1的表达显著增加。此外,还发现LIMS1表达在肾小管。综上所述,这些结果证明了LIMS1表达的增加与Ang II诱导的肾小管间质纤维化有关。
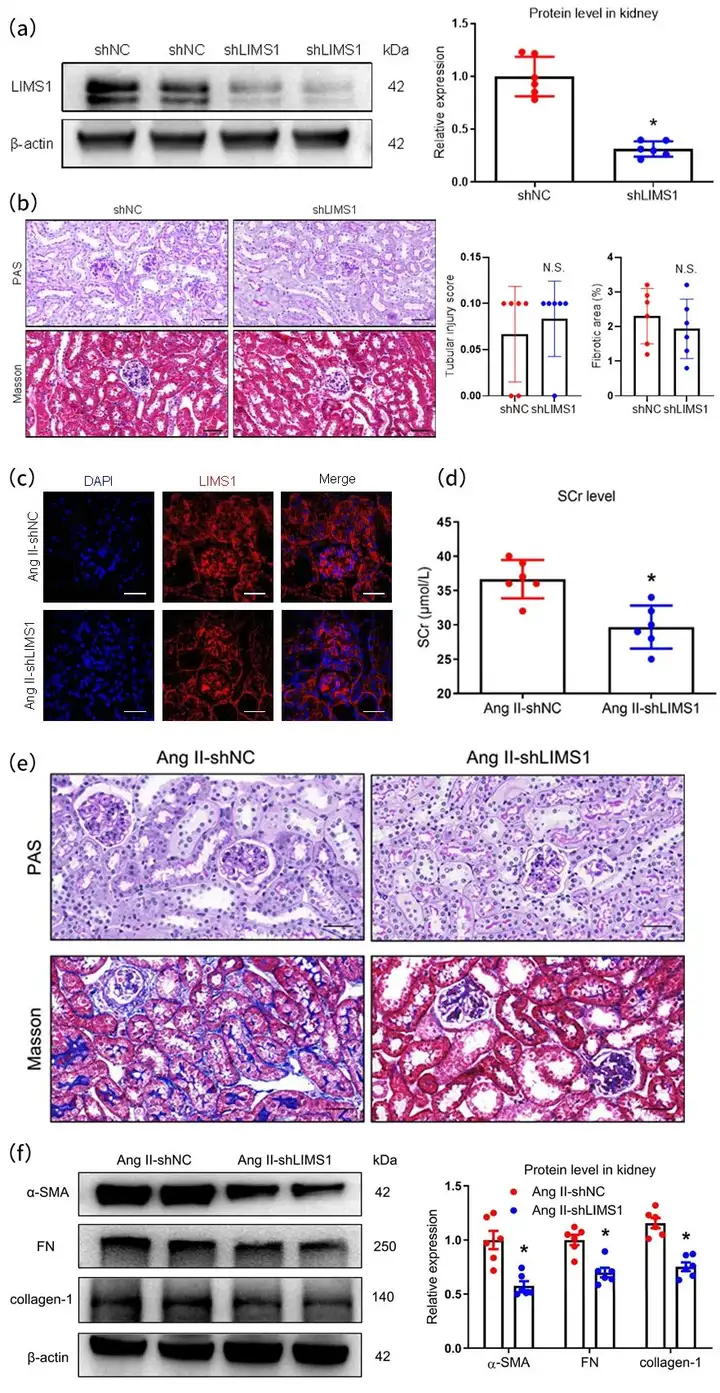
图1. LIMS1在Ang II诱导的高血压和肾小管间质纤维化中上调表达
2.LIMS1介导Ang II诱导的肾小管纤维化形成
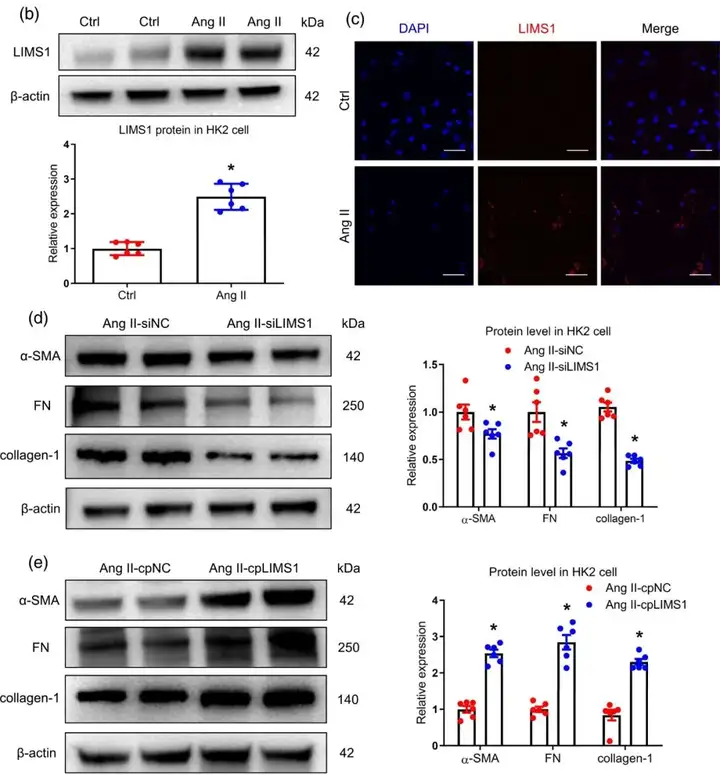
研究人员利用人肾皮质近曲小管上皮细胞系(HK-2细胞)探讨LIMS1在肾小管中的潜在作用。HK-2细胞加入Ang II(1 μmol•L-1)处理24h后,细胞外基质蛋白表达增加,表明Ang II诱导的肾小管纤维化成功形成。此外,结果显示HK-2细胞中LIMS1表达显著增加。接下来,作者通过siRNA敲低LIMS1或质粒过表达LIMS1,以探索LIMS1在纤维化形成中的作用。有趣的是,LIMS1敲低显著减少了肾小管细胞纤维化形成,而LIMS1过表达增加纤维化形成。总之,这些数据表明LIMS1在介导Ang II诱导的肾小管纤维化中起着关键作用。
3.肾小管LIMS1敲低延缓Ang II诱导的肾小管间质纤维化进展
研究人员为探讨LIMS1在体内对Ang II诱导的肾小管间质纤维化进展的影响,利用重组腺相关病毒rAAV进行肾小管特异性LIMS1敲低。首先,验证LIMS1的敲低效率,并证明肾小管特异性LIMS1敲低本身不会诱导正常小鼠的肾功能障碍和病理变化。接下来,作者在单肾切除tubular Cre+小鼠皮下植入Ang II微型渗透泵前1天,尾静脉注射敲低LIMS1的rAAV(1E+11vg/只)以实现肾小管特异性LIMS1敲低。结果显示,Ang II-shLIMS1组小鼠Scr水平急剧下降;组织病理学染色显示肾小管损伤和肾小管间质纤维化显著改善。综合来看,这些数据表明LIMS1是导致Ang II诱导的肾小管间质纤维化的关键致病因子。
4.LIMS1受HIF-1α转录调控
作者进一步探讨LIMS1表达的调控机制。研究人员发现高血压肾病患者肾组织中LIMS1 mRNA表达水平显著增加,与Ang II处理小鼠和HK-2细胞中其表达一致。随后作者进行了生物信息学分析,以帮助理解LIMS1转录的调控机制。通过分析CKD患者的染色质免疫沉淀(ChIP)数据及基因芯片数据,发现HIF-1α可转录调控LIMS1,且CKD患者肾组织中其表达显著增加。更有趣的是,LIMS1的表达与HIF-1α呈正相关。此外,实验还发现高血压肾病患者肾组织以及Ang II处理小鼠肾组织中HIF-1α表达显著增加,蛋白免疫印迹证实了相同的结果(Ang II处理小鼠肾组织及Ang II处理HK-2细胞中)。总的来说,这些数据表明LIMS1转录表达与HIF-1α有关。接下来,作者探讨了HIF-1α在调控LIMS1表达中的作用。发现在HIF-1α过表达的HK-2细胞(Ang II处理)中LIMS1 mRNA的表达明显增加,并通过免疫荧光和蛋白免疫印迹进一步证实。此外,利用软件预测,得知LIMS1启动子区存在1个HIF-1α的结合位点。表明LIMS1可被HIF-1α转录调控。ChIP实验结果显示,通过Ang II刺激HK-2细胞后,HIF-1α的结合富集在LIMS1启动子区。同样地,Ang II处理小鼠肾脏中也得到了类似的结果。最后,基于荧光素酶报告基因实验,结果显示HIF-1α显著诱导了LIMS1活性,表明HIF-1α和LIMS1之间存在直接相互作用,以响应Ang II。
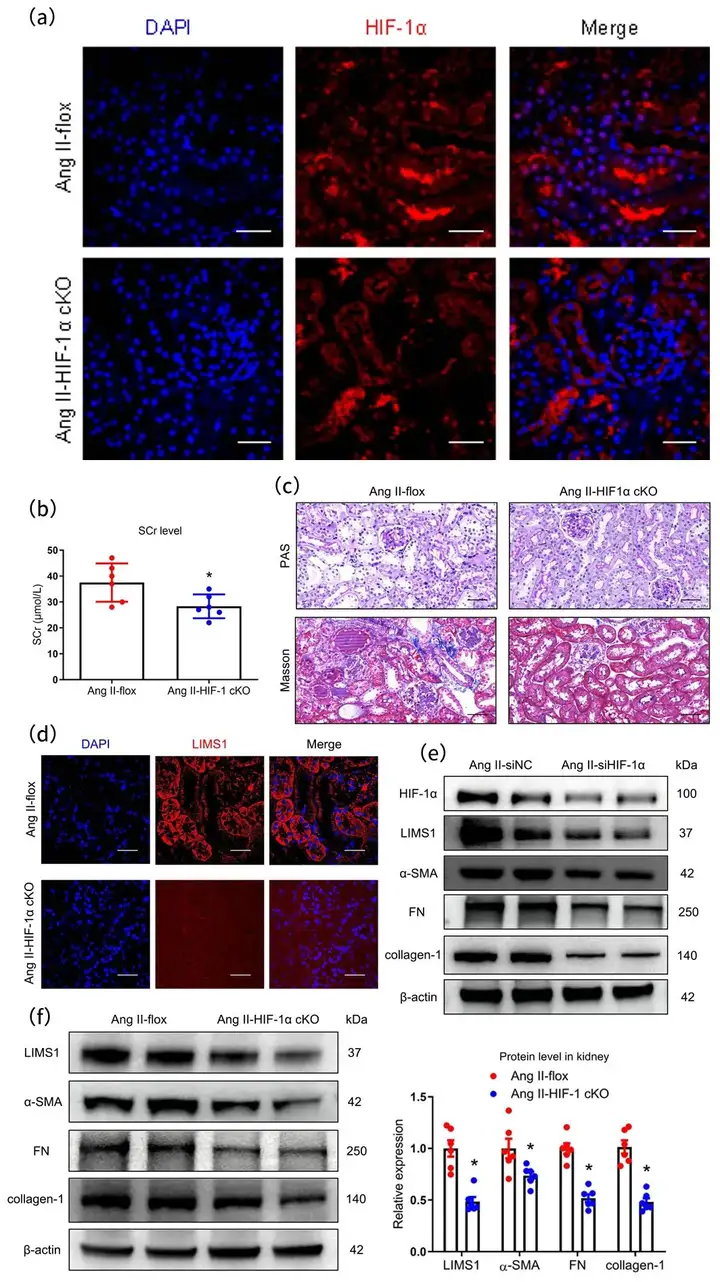
5.肾小管HIF-1α敲除(KO)通过调控LIMS1减轻Ang II诱导的肾小管间质纤维化
为探索肾小管HIF-1α在Ang II诱导的肾小管间质纤维化中的作用,作者构建了肾小管特异性HIF-1α KO小鼠( ???−1α????/???? 小鼠与cdh16-Cre小鼠杂交获得),并通过免疫荧光证实肾小管HIF-1α被成功敲除。相比于flox小鼠,肾小管特异性HIF-1α KO小鼠Scr水平显著降低,并伴随肾小管损伤减少、肾小管间质纤维化减轻以及LIMS1的表达降低。此外,在siRNA介导的HIF-1α敲低的HK-2细胞中(Ang II处理),肾小管LIMS1和ECM的表达明显减少。综上所述,这些数据表明HIF-1α通过调控LIMS1的表达在Ang II诱导的肾小管间质纤维化中起着关键作用。
图4. 肾小管HIF-1α KO改善Ang II诱导的肾小管间质纤维化(modified)
6.LIMS1通过与波形蛋白相互作用介导Ang II诱导的肾小管间质纤维化
接下来,研究人员探讨了LIMS1介导Ang II诱导的肾小管间质纤维化的分子机制。通过免疫沉淀-质谱(IP-MS)分析,作者发现LIMS1与波形蛋白(vimentin)结合。利用IP验证肾脏中LIMS1是否与波形蛋白形成复合物,结果显示,当用抗LIMS1抗体免疫沉淀肾组织裂解物时,检测到波形蛋白。此外,当用抗波形蛋白抗体免疫沉淀肾组织裂解物时,也检测到LIMS1。使用HK-2细胞裂解物在体外证实了类似的结果,表明LIMS1可在肾小管细胞中与波形蛋白形成二元复合物。最后,在高血压肾病患者的肾组织和Ang II处理后小鼠肾组织中进一步证实了LIMS1和波形蛋白的共定位。总之,这些结果有力地证明了LIMS1在Ang II诱导的肾小管间质纤维化条件下与波形蛋白相互作用。
结论
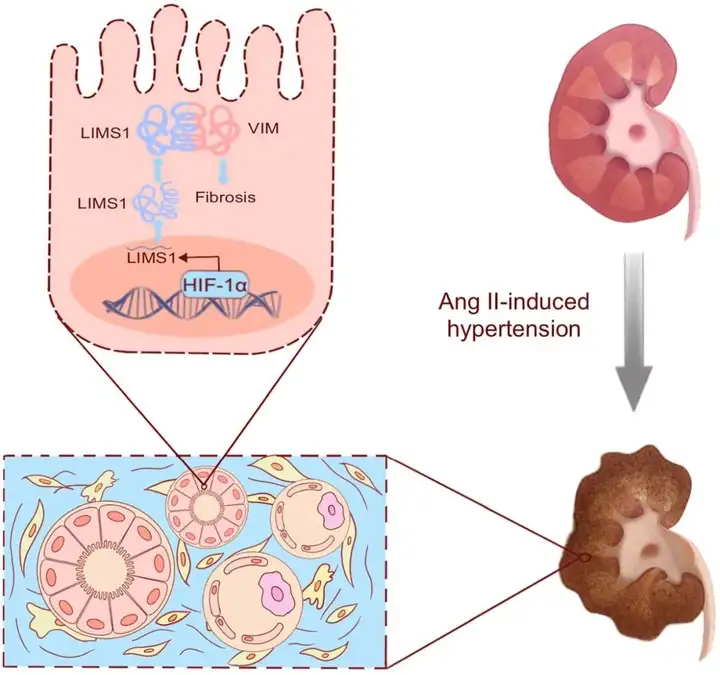
本研究首次发现,在Ang II诱导的肾小管间质纤维化中,失调的LIMS1(与波形蛋白相互作用的接头蛋白)被HIF-1α转录调节。本文证明了Ang II诱导的肾小管间质纤维化的一种新机制。即肾小管HIF-1α-LIMS1轴通过与波形蛋白相互作用促进肾小管间质纤维化。这些发现也为肾脏高血压损伤和肾小管间质纤维化的机制提供了独特的见解。阻断LIMS1信号级联反应是治疗Ang II诱导的肾小管间质纤维化颇具前景的靶点。
示意图:HIF-1α介导的LIMS1加重Ang II诱导的肾小管间质纤维化
东南大学附属中大医院肾内科倪维杰、李作林为论文共同第一作者,东南大学附属中大医院肾内科王彬副主任医师、刘必成教授、及南京医科大学第二附属医院儿内科甘卫华主任医师为论文共同通讯作者。该项工作获得国家自然科学基金项目(82000648,82070735,82241047)、国家自然科学基金重点项目(82030024,82230022)等的支持。
通讯作者介绍:
王彬,博士,副主任医师。擅长常见急慢性肾脏病的临床诊治,尤其在难治性肾病、遗传性肾脏病(如:多囊肾、法布里)等疾病的精准诊疗方面有丰富经验,担任江苏省Fabry病诊疗专家。目前主持国家自然科学基金面上项目/青年项目、江苏省自然科学基金面上项目等十余项科研项目,获科研资助经费约200万元。近年来,以第一或通讯作者身份在Sci Adv、JASN、Mol Ther、Theranostics、JACC Basic Transl Sci、Hum Gene Ther等TOP杂志发表SCI论文30余篇。
刘必成,教授,主任医师,医学博士,博士生导师,ISN fellow,Vebleo Fellow。国家重点研发计划首席科学家。现任东南大学医学院院长,肾脏病研究所所长,东南大学首批首席教授。从事肾脏病临床医教科研工作36年。主要研究慢性肾脏病发病机制及其临床诊治。擅长肾病综合征、狼疮性肾炎、糖尿病肾病、急慢性肾功能不全等各种疑难肾脏病诊治。主持国家重点研发计划、国家自然科学基金重点、重大国际合作项目等课题多项。在Science Advances、JASN、KI、Cell Death Diff、NEJM、Lancet等本领域期刊发表中英文论文、综述530多篇,其中SCI收录220多篇,主编(译)著作8部,副主编、参编著作48部。入选全球顶/级科学家,Elsevier全球高被引科学家。先后获得国家科技进步二等奖、教育部自然科学一等奖、教育部科技进步二等奖等多项成果奖励,申请发明专利11项,授权5项。荣获国家卫健委突出贡献中青年专家、江苏省突出医学成就奖和江苏省优秀科技工作者等称号,享受国务院特殊津贴。
甘卫华,主任医师(二级)、教授、小儿肾脏病专业博士、博士生导师,儿内科主任、小儿肾脏病专科主任及儿内科学系主任。江苏省333工程培养对象。江苏省六大高峰人才(A类)。擅长诊治小儿各类肾脏疾病,尤其对小儿难治性肾病、IgA肾病、紫癜性肾炎、小儿血尿的临床治疗有独到之处。
本文使用的病毒均来自枢密科技,列表如下:


了解产品及服务
请扫码添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK