2024-07-17 阅读量:2611
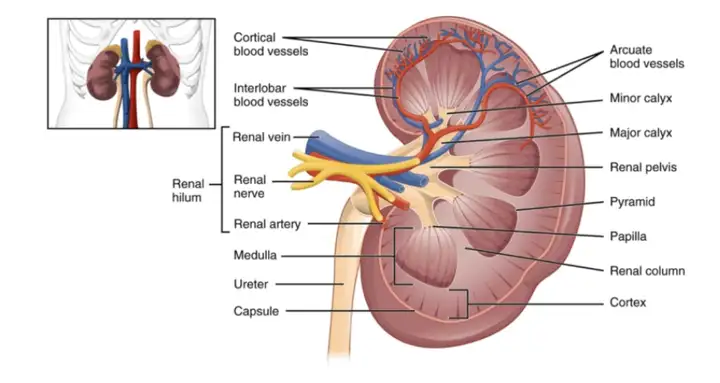
肾脏为成对的扁豆状器官,红褐色,位于腹膜后脊柱两旁浅窝中。肾脏一侧有一凹陷,叫做肾门,它是肾静脉、肾动脉出入肾脏以及输尿管与肾脏连接的部位,是肾盂、血管、神经、淋巴管出入的门户。这些出入肾门的结构,被结缔组织包裹,合称肾蒂。由肾门凹向肾内,有一个较大的腔,称肾窦。肾窦由肾实质围成,窦内含有肾动脉、肾静脉、淋巴管、肾小盏、肾大盏、肾盂和脂肪组织等。每个肾脏由100多万个肾单位组成。每个肾单位包括肾小球、肾小囊和肾小管三个部分,肾小球和肾小囊组成肾小体。
肾脏研究方向及方法
1)肾脏功能
肾单位是组成肾脏的结构和功能的基本单位,是肾脏部位物质交换和能量传输的重要系统,包括肾小球滤过血液形成原尿和肾小管、集合管重吸收营养物质及其毛细血管物质交换过程。肾脏的肾小球、肾小囊和肾小管等组成单位紧密协调、相互配合,保障了肾脏功能及泌尿系统的正常运转,通过复杂而精密的运行机制,维护着人体各项生命活动的正常运行。肾脏功能主要有以下几点:
排泄废物:肾脏排出毒素、尿素和过量的盐。尿素是细胞代谢的氮基废物,在肝脏中产生,并通过血液运输到肾脏。
维持水平衡:通过尿的生成,维持水的平衡。血液流经肾脏,通过滤过膜形成原尿,并通过肾小管、集合管重吸收等形成终尿,汇入肾盂,排出体外。
维持体液、电解质平衡:肾脏可通过集合管远端小管对体内的各种离子(电解质)如钠离子、磷离子、钙离子、镁离子的吸收和排泄来维持人体的体液和电解质平衡。
调节血压:肾脏能分泌肾素、前列腺素、激肽,并通过肾素一血管紧张素一醛固酮系统和激肽一缓激肽一前列腺素系统来调节人体的血压。
调节红细胞:肾脏分泌促红细胞生成素(EPO,糖蛋白激素),当身体没有足够的氧气时会刺激骨髓产生更多的红细胞。
维持体内酸碱平衡:肾脏能把代谢过程中产生的酸性物质通过尿液排出体外,并能控制酸性和碱性物质排出的比例,从而维持体液酸碱平衡。
2)肾脏相关疾病
一位健康成年人的肾脏每天都要过滤和清洁约200升的血液,进而把机体多余的水分排出体外,清除体内的代谢废物,维持内环境的稳定。如果肾脏出现了异常情况,对人体有害的物质或代谢产物的排泄会受到阻碍,在体内积聚引起各种病症。肾脏疾病的核心是器官无法清除血液中的毒素。最常见的肾脏疾病是慢性肾脏疾病(CKD),各种原因均可引起CKD,主要包括原发性/继发性肾小球肾炎、高血压肾小动脉硬化、糖尿病肾病、肾小管间质病变(慢性肾盂肾炎、慢性尿酸性肾病、梗阻性肾病、药物性肾病)、缺血性肾病、遗传性肾病(多囊肾、遗传性肾炎)等。肾病的可怕之处在于,它不像心脑血管疾病和心脏疾病,会有胸闷、感觉或运动障碍等表现,慢性肾病初发时,无明显不适,往往容易被忽视。看似健康却患有CKD的人死于心脑血管病的风险是正常人的10倍以上,如发展到尿毒症甚至会危及生命。
3)肾脏感染给药途径
静脉注射途径,因给药容易,允许载体随着血液的流动而分布全身,是大多数分子治疗的首要选择。但因肾脏结构肾小球的选择性滤过特性,将阻止大多数大小在50kDa以上的大分子颗粒从血液进入肾脏。为了提高病毒载体在肾脏中的转导效率,除了静脉注射全身给药方式外,还有以下几种肾脏局部感染给药途径。
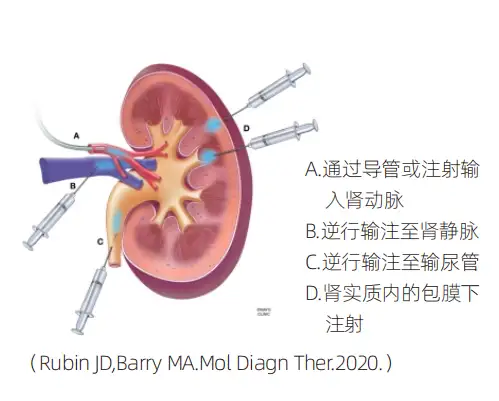
4)工具病毒在肾脏中的应用
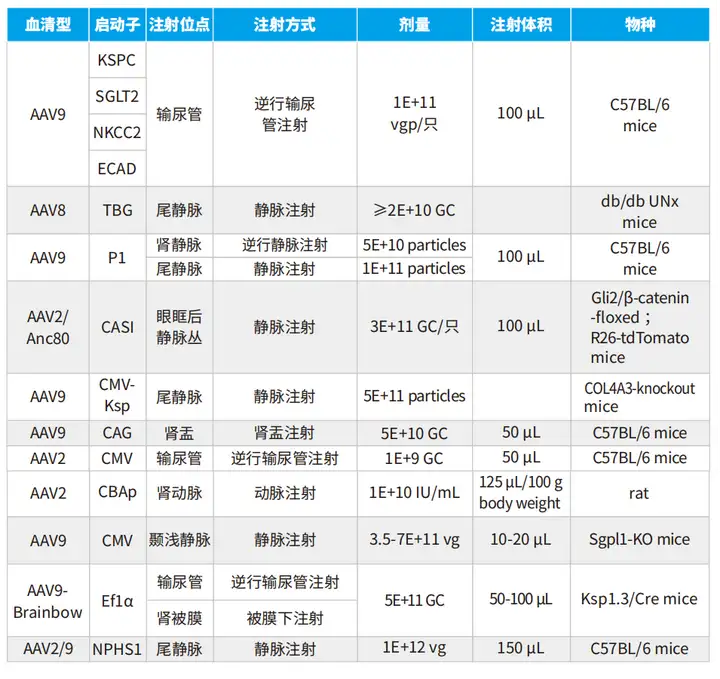
案例一:AAV感染肾脏适用的血清型
参考文献:Combined Paracrine and Endocrine AAV9-mediated Expression of Hepatocyte Growth Factor for the Treatment of Renal Fibrosis.Mol Ther.2010.
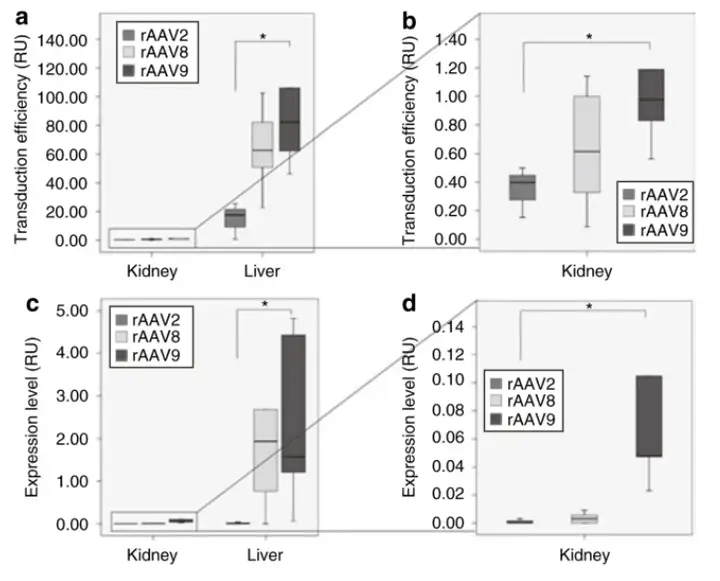
6周龄雄性COL4A3基因敲除小鼠经尾静脉注射自互补病毒载体rAAV2-CMV-GFP、rAAV8-CMV-GFP、rAAV9-CMV-GFP,注射量为5×10^11病毒颗粒/只,发现rAAV8和rAAV9的肾脏转导效率和转录活性优于rAAV2,rAAV9更优。
案例二:通过特异性启动子确定AAV感染肾脏的分布
参考文献:Nephron segment-specific gene expression using AAV vectors. Biochem Biophys Res Commun.2018.
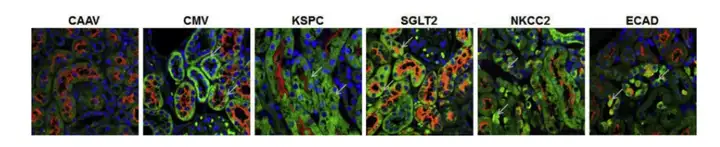
8周龄C57BL/6小鼠通过输尿管逆行输注AAV9-eGFP病毒(10^11 vgp/viral genome particles/病毒基因组颗粒/只,100 μL)到肾脏,研究人员使用肾单位的特定节段中优先表达的基因的启动子:肾脏特异性钙粘着蛋白(KSPC)基因启动子检测eGFP在整个肾单位中的表达;Na*/葡萄糖共转运蛋白(SGLT2)基因启动子检测eGFP在近端小管(PT)S1和S2段的表达;Na-K-2Cl共同转运蛋白(NKCC2)基因启动子检测eGFP在Henle环厚上升肢(TALH)中的表达;钙黏蛋白E(ECAD)基因启动子检测eGFP在集合管(CD)中的表达;CMV启动子作为对照。使用抗eGFP和生物素化LTA的抗体免疫双荧光染色证明不同启动子调控下AAV介导的基因表达的区域。结果显示,KSPC启动子在LTA阳性的PT细胞、LTA阴性细胞以及LTA轻度阳性的CD夹层细胞中提供GFP表达。ECAD启动子仅在LTA轻度阳性的CD夹层细胞中提供GFP表达,但在肾单位的任何其他节段中不提供GFP表达。SGLT2启动子仅在LTA阳性肾PT细胞中表达。NKCC2启动子提供肾单位TALH上皮细胞中eGFP的表达。
案例三:逆行肾静脉注射AAV9高效靶向肾脏组织
参考文献:rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery:conclusion of a comparative study. Gene Ther.2014.
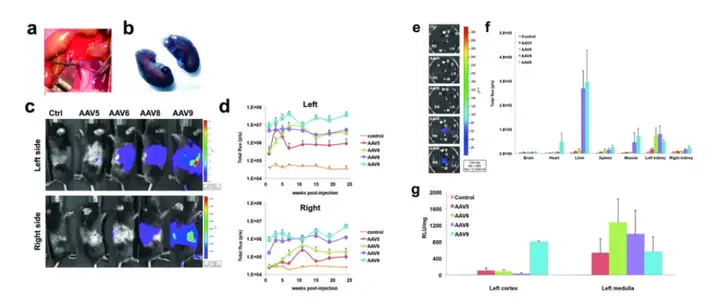
8-10周龄C57BL/6小鼠左肾逆行肾静脉注射rAAV5、6、8或9-CMV-luc(5E+10病毒颗粒,100 μL)而后检测荧光素酶表达,结果显示注射rAAV5后最多3周,在肾脏内特异性检测到荧光素酶表达,随后信号下降。rAAV6可介导荧光素酶在注射的肾脏中高、稳定和特异性表达。rAAV8在左肾内能获得同rAAV6类似的荧光素酶表达。然而,在右肾和其他组织中也检测到发光。rAAV9在左肾和其他组织中的转基因表达最强。注射后6个月,取大脑、心脏、肝脏、脾脏、肌肉、左肾和右肾,并进行IVIS分析。结果证实了研究人员在活体小鼠中观察到的数据。只有rAAV5和6在注射的肾脏中特异性检测到荧光素酶表达,但rAAV6的效率更高。rAAV8和rAAV9在左肾中观察到高水平的发光,但在其他器官中也发现了信号。
有效的肾脏基因传递意味着同时转导皮质和髓质。因此,利用荧光素酶实验研究左肾髓质和皮质中荧光素酶表达。结果提示,除rAAV9外,大多数rAAV血清型对髓质的靶向性都优于皮质。尤其是rAAV6,由于它高效和特异的肾脏转导,似乎是最佳的,对髓质的转导效率最高,但对皮质的转导较差。rAAV8也得到了类似的结果。相反,rAAV9在髓质和皮质中荧光素酶的表达都很强。
案例四:经肾实质肾盂注射AAV感染肾脏
参考文献:Transparenchymal Renal Pelvis Injection of Recombinant Adeno-Associated Virus Serotype 9 Vectors Is a Practical Approach for Gene Delivery in theKidney. Hum Gene Ther Methods.2018.
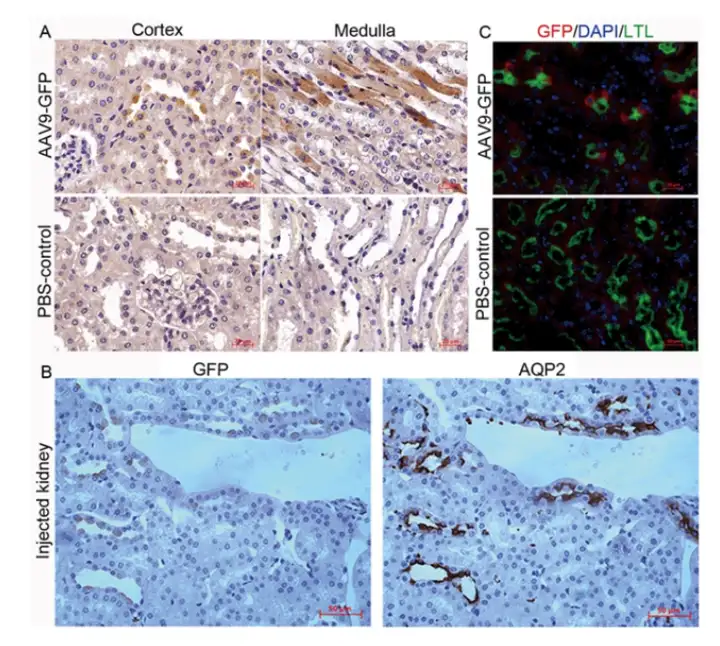
在4-6周龄,体重15-20g的C57BL/6小鼠中经肾实质肾盂注射AAV9-GFP(5E+10Gc,50 μL),3个月后在注射肾脏中免疫组织化学检测病毒分布,结果发现在皮质和髓质小管均可见GFP*细胞(图4A);进一步的节段研究表明GFP主要表达于水通道蛋白2(AQP2)-阳性小管,提示集合管(CD)细胞的转导(图4B),值得注意的是,并非所有AQP2阳性小管都被转导。此外,观察到GFP-表达细胞稀疏定位于莲四叶凝集素(Lotus tetragonolobus lectin, LTL)阳性小管(少量GFP表达),表明近端小管细胞的转导(图4C)。
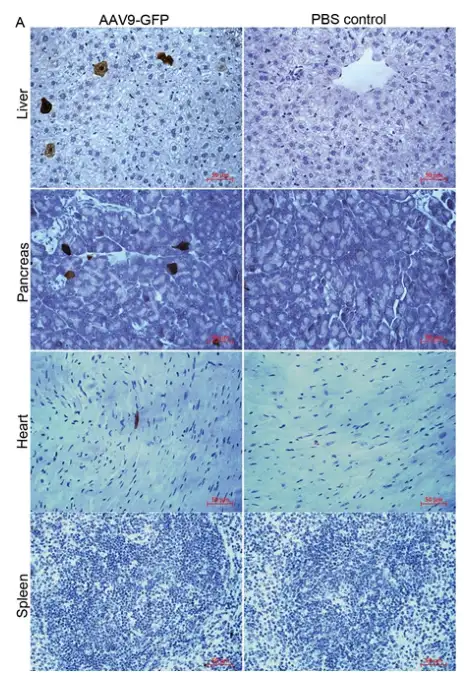
虽然经肾实质肾盂注射可以提高AAV在肾脏中的转导效率,这种注射方式也确实可被视为局部注射方法,但病毒载体系统转导的潜在风险应被考虑。肝脏是与不良反应相关的关键器官,经肾实质肾盂注射AAV-GFP载体后3个月,GFP表达呈现分散分布;胰腺中GFP表达表现出与肝脏转导相似的模式(推测病毒载体可能通过注射途径进入血液循环);而在心脏中检测到极少的GFP阳性细胞;有趣的是,也没有在脾脏中观察到GFP表达。
5)AAV载体在肾脏疾病中的应用
案例一:利用AAV介导糖尿病肾病(Diabetic kidney disease, DKD)模型
参考文献:Therapeutic effects of lisinopril and empagliflozin in a mouse model of hypertension-accelerated diabetic kidney disease. Am J Physiol Renal Physiol.2021.
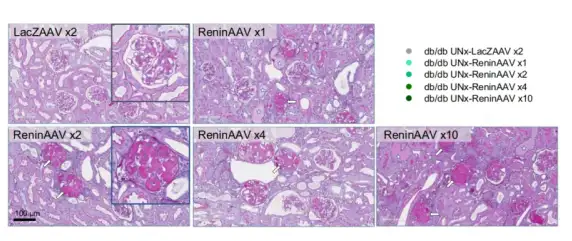
高血压是糖尿病肾病(DKD)进展的关键共病。为了促进开发具有控制疾病进展潜力的新型治疗干预措施,有必要建立可转化的动物模型,预测人类DKD的治疗效果。本研究利用腺相关病毒(AAV)介导的肾素在单侧肾切除(UNx)db/db小鼠(在BKS小鼠上敲除Lepr基因模拟Ⅱ型糖尿病)的过度表达,描述晚期DKD模型中肾脏疾病特征。
第5周注射AAV8-TBG(LacZAAV×2,2E+10 genome copies(GC);ReninAAV×1,1E+10GC;ReninAAV×2,2E+10GC;ReninAAV×4,4E+10GC;ReninAAV×10,10E+10 GC),第4周进行UNx,db/db UNx-Renin小鼠出现进行性DKD的特征,表现为严重蛋白尿、晚期肾小球硬化和肾小球肥大。如图所示,尽管LacZAAV对照组和ReninAAV组小鼠(1E+10GC)都表现出轻度系膜增生性肾小球肾炎,但更高的ReninAAV剂量(≥2E+10GC)促进节段性和球性肾小球硬化。ReninAAV对db/db-UNx小鼠的生理指标和肾小球硬化具有剂量依赖性影响。总的来说,db/db UNx-Renin小鼠在进展性DKD的生理和组织学特征方面表现出良好的临床可转化性。
案例二:利用AAV-Cre病毒转导肾脏间质细胞来治疗肾纤维化
参考文献:Efficient gene transfer to kidney mesenchymal cells using a synthetic adeno-associated viral vector. J Am Soc Nephrol.2018.
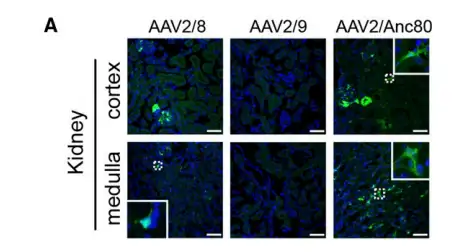
图7.AAV-Anc80可有效地转导肾间质细胞(1E+11GC/只,Anc80对肾脏的转导比8型高3-5倍)
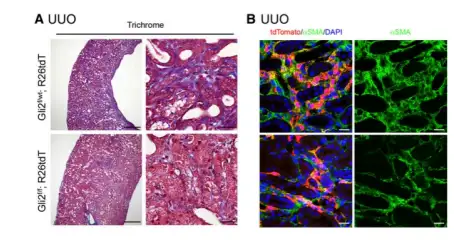
肾周细胞和血管周围成纤维细胞是肾纤维化过程中肾间质中肌成纤维细胞的主要祖细胞群,也是减缓纤维化肾脏疾病进展的重要治疗靶点。在本研究中使用AAV-Anc80血清型和CASI启动子(由截短的CMV增强子、鸡β-肌动蛋白启动子和UBC增强子以及剪接供体和剪接受体序列组成)通过静脉注射,结果发现AAV-Anc80可有效地转导肾间质细胞,包括周细胞、成纤维细胞和肾小球膜细胞。然后研究人员构建R26-tdTomato报告基因小鼠,且为Gli2tlow/low纯合子或Gli2toxt杂合子,在flox小鼠单侧输尿管结扎(UUO)手术前3周通过眼眶后静脉丛注射AAV-Anc80-CASl-Cre(3E+11GC/只,100μL),结果显示60%的皮质周细胞和血管周纤维细胞的转导效率(以tdTomato作对照),且在对侧未受损肾脏中未观察到明显的组织学异常。从肾间质细胞中敲除Gli2后,相比于Gli2ftoxmt杂合子,Gli2flow/hox纯合子具有更少的纤维化。
案例三:利用AAV载体治疗急性肾损伤(AKI)
参考文献:PSTPIP2 inhibits cisplatin-induced acute kidney injury by suppressing apoptosis of renal tubular epithelial cells. Cell Death &Disease.2020.
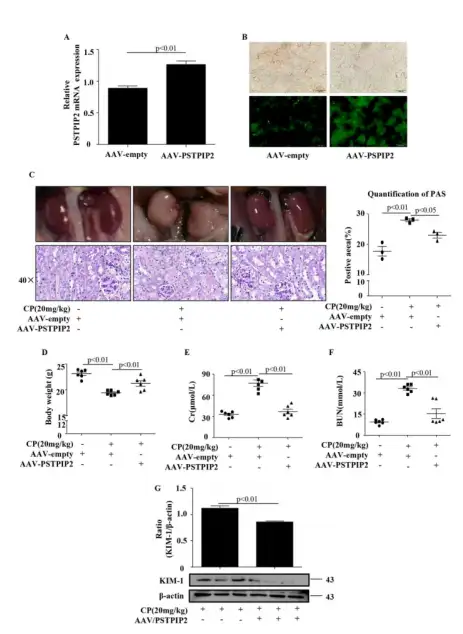
肾小管上皮细胞的凋亡和肾脏炎症已被证明是顺铂(CP)诱导的AKI的突出性特征。本研究发现脯氨酸-丝氨酸-苏氨酸磷酸酶相互作用蛋白2(proline-serine-threonine phosphatase-interacting protein 2,PSTPIP2)在顺铂诱导的AKI中有着重要作用,通过尾静脉注射AAV9-PSTPIP2可抑制CP诱导的肾功能障碍,并减少肾小管上皮细胞的凋亡。所图所示,rAAV9-PSTPIP2可以显著改善肾功能。与此一致的是,rAAV9-PSTPIP2组显著减少了Cr(血清肌酐)、BUN(血尿素氮)水平的增加。高碘.酸-希夫(PAS)染色的组织学分析显示rAAV9-PSTPIP2组与CP组相比,组织损伤显著减少。相比于CP组,rAAV9-PSTPIP2组的体重略有增加,但接近正常组的体重。蛋白质印迹分析也表明KIM-1(肾损伤分子-1)蛋白表达在CP处理组显著上调,而rAAV9-PSTPIP2可以降低KIM-1蛋白的表达。这些结果表明,PSTPIP2对CP诱导的AKI具有保护作用。
AAV感染肾脏的血清型有AAV2、AAV6、AAV8、AAV9和AAV-Anc80,较常用的是AAV9。可通过尾静脉注射、肾静脉注射、逆行输尿管注射和肾实质肾盂注射等感染肾脏,而由于系统注射容易在肝脏富集,通常在肾脏特异性启动子的操纵下促进AAV在肾脏的高效转导。注射病毒量一般为1~5E+10~11GC/vg,体积一般为50-150μL。
db/db小鼠品系背景一般为C57BLKS/J小鼠,瘦素受体(Lepr)基因点突变,导致脂肪细胞来源的瘦素信号转导障碍。出现严重的病态肥胖、血糖明显且持续升高、胰岛损伤且萎缩、重度胰岛素抵抗,早期就表现出肾小球肥厚伴内皮细胞增生。随着年龄增加,随后出现中等程度的蛋白尿和肾小球肥厚。但肾小管间质改变较轻,是研究早期DKD病变的常用模型。BTBR ob/ob小鼠:BTBR品系小鼠具有天然的胰岛素抵抗特性;ob/ob品系小鼠存在瘦素(Lep)突变基因,可导致小鼠饱腹感缺失。将2种品系的小鼠结合,建立了BTBR ob/ob小鼠2型糖尿病模型。BTBR ob/ob小鼠首先出现胰岛素抵抗伴血胰岛素水平增高,6周龄后出现显著的高血糖。早在8周龄就可以检测到蛋白尿和足细胞丢失,且足细胞的丢失持续于整个疾病过程。18周龄时该小鼠能够表现出糖尿病肾病晚期的典型特征,如广泛的肾小球基质扩张、局灶性结节性肾小球硬化、轻度肾小球基底膜增厚和间质纤维化、小动脉透明变性等。但是,该小鼠繁殖力差且价格昂贵。
高血压与高血糖存在协同作用促进啮齿类肾病。eNOS−/− 小鼠:eNOS−/−小鼠的品系背景一般为C57BL/6或者db/db小鼠,该模型存在血管内皮一氧化氮合酶(NOS)缺陷。在db/db小鼠的基础上,NOS缺陷引起的血管内皮功能障碍和高血压都会加速肾损伤。该模型早期病变主要为高血糖、高血压、蛋白尿、足细胞丢失等,随后也能表现出晚期糖尿病肾病特点(肾小球损伤:系膜溶解和肾小球硬化;广泛的血管基质扩张、血管溶解、基底膜增厚,以及肾小管纤维化)。该模型能形成DKD晚期功能及形态学结构改变,但饲养困难。肾素过表达鼠:在糖尿病模型背景下,创建肾素过表达转基因模型,实现肾素依赖性高血压和糖尿病的双重叠加效应,可加速糖尿病肾病的发展。

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK