2023-12-18 阅读量:4545
人脑是复杂的多尺度结构。在过去的几十年里,神经科学的研究主要集中在微观水平的分子、基因和细胞,或者是宏观水平基于磁共振成像的结构/功能网络和行为。然而,人脑包含约1000亿个神经元,这些神经元通过约1000万亿个突触进行连接,在中尺度水平上形成几乎无限数量的神经环路。这些环路是协调和执行各种基本和高级脑功能的结构基础(神经环路为功能网络提供解剖学基础)。因此,阐明神经环路是理解脑功能原理和神经系统疾病发病机制的重要前提。
在过去的几十年里,科学家从嗜神经病毒的天然毒株,如伪狂犬病毒(PRV)、单纯疱疹病毒(HSV)、狂犬病毒(RV)、水疱性口炎病毒(VSV)等改造而来诸多病毒工具(即重组嗜神经病毒)。与非病毒示踪剂相比,重组嗜神经病毒具有许多优点:它们能以细胞类型特异性、环路选择性的方式顺行、逆行和跨突触传递。本综述中,作者总结了用于神经环路示踪的病毒工具的研究进展,讨论了在神经科学研究中使用病毒工具的关键原则,并强调了开发和优化病毒工具的创新,进而用于跨不同物种(包括非人灵长类动物)的神经环路追踪。
一、重组腺相关病毒(rAAV)
rAAV载体是生物医学研究中最常用的病毒工具。rAAV是从细小病毒科依赖病毒属的野生型AAV发展而来的基因转移载体。它是迄今为止发现的最简单的复制缺陷型病毒,需依赖于腺病毒、单纯疱疹病毒或其他辅助病毒进行复制产生子代病毒。AAV基因组是长约4.7 kb的单链DNA分子。AAV复制酶蛋白(Rep)和衣壳蛋白(Cap)基因两侧是末端反向重复(ITR)序列。AAV病毒颗粒无包膜,为直径约20 nm的二十面体结构。rAAV基因组仅保留了AAV两端的ITRs,ITRs之间的所有病毒DNA被感兴趣的外源基因(GOI)所取代。AAV的ITRs充当顺式作用元件,反式补偿AAV的Rep、Cap及辅助病毒基因,从而确保AAV的复制和包装。因此,rAAV不仅具有良好的安全性,而且继承了野生型AAV的许多优点,如低免疫原性、多种血清型、宿主细胞范围广以及能介导外源基因在体内的长期稳定表达。迄今为止,已从宿主中鉴定出13种AAV血清型(AAV1-13)和超过100种变体。不同血清型的病毒衣壳结构不同,并具有不同的转导效率、组织和细胞趋向性以及免疫学特征。
研究表明AAVs的顺行、逆行和双向转运特性是血清型和浓度依赖性的。一般情况下,大多数AAV血清型更倾向于进入注射位点的神经元胞体,这种特性可能有助于标记神经元投射和操纵投射靶点。研究显示AAV1和AAV9可顺行跨突触扩散。高滴度AAV1-Cre可感染突触前神经元并特异性驱动突触后神经元中Cre依赖的基因表达,从而允许示踪和操纵直接相连的突触后神经元(下游神经元)。近期,有研究结果证明禽AAV(A3V)能以顺行方向跨多突触扩散,并不会产生突触外渗漏。一些经过工程改造的AAV变体(rAAV2-retro:主要靶向皮质区域和rAAV9-retro)可优先被注射位点的轴突末梢摄取,然后从轴突逆行转运到胞体,因此,适用于标记投射神经元。一些AAV血清型如AAV9能跨血脑屏障(BBB)转导脑细胞,但效率有限。研究者们利用AAV衣壳蛋白工程改造策略开发一系列AAV变体(如AAV-PHP.B、AAV-PHP.eB、AAV-PHP.S、AAV-F和AAV.Cap-B10),而这些变体具有增强的BBB穿透能力和更广泛的宿主趋向性,是静脉注射后转导全脑神经细胞的理想病毒工具。此外,rAAVs还可作为辅助病毒与其他跨突触传递病毒结合,以可视化神经环路的结构。
二、伪狂犬病毒(PRV)
PRV是α-疱疹病毒亚家族的成员,直径200-250 nm,基因组长度约150 kb。它是具有包膜的球形双链DNA病毒,经过分子修饰后可插入大片段外源基因。前人研究发现PRV主要感染猪和啮齿动物,不感染灵长类动物。但近些年来有研究报道有几种PRV自然变异株可感染人中枢神经系统并诱发脑炎。因此,在病毒改造和应用过程中应注意个人防护。
目前使用的PRV包括Becker株和Bartha株。Becker株由于其显著的毒性和无方向特异性传播而很少用于神经环路的研究。而Bartha株毒性较低,严格逆行传播,尤其是Bartha株通过突触能从外周迅速传递到中枢神经系统。然而,PRV感染后荧光信号微弱,需要通过免疫组化放大信号。为解决这个问题,研究人员开发PRV531和PRV724,分别具有强大EGFP(绿色荧光)和mRuby3(红色荧光)表达,并可用作有效的逆行跨多突触示踪剂。但由于PRV感染许多不同类型的神经元,造成初始感染神经元缺乏特异性,从而限制了PRV对神经环路的精确剖析。因此,科研人员开发从特定神经元逆行传递的PRV,如,Ba2001是Cre依赖的逆行跨多突触示踪剂,其编码GFP和对病毒复制至关重要的胸苷激酶(TK)。Ba2001只在表达Cre重组酶的神经元、与初始感染细胞有突触连接的神经元中复制。而Ba2017是源自PRV减毒Bartha株的新型重组PRV,其遗传稳定性提高,荧光蛋白表达增强。它已成功应用于识别和表征与胰岛β细胞多突触连接的下丘脑室旁核中催产素神经元亚群。此外,研究者开发表达位点特异性Cre重组酶的PRV(PRV-hSyn-Cre),能激活脑中逆行投射神元中Cre依赖性载体中转基因表达,促进神经环路的功能解剖。
三、狂犬病毒(RV)
RV是有包膜的负义单链RNA病毒,其直径约为75 nm,长度为180 nm,呈子弹状,基因组约12 kb并具有高度嗜神经性。由自身编码的RNA聚合酶复合物来完成RV的复制。野生型RV(WT RV)是迄今为止最常见的狂犬病病原体,主要通过受感染狗的咬伤进行传播。RV感染咬伤部位的周围神经末梢,并通过中枢神经系统严格从突触后神经元逆行传递到突触前神经元。对野生型RV进行改造,删除包膜糖蛋白基因(RV-ΔG)以提高安全性,RV-ΔG通过感染轴突末梢逆行标记投射神经元,或经进一步修饰逆行跨单突触标记直接输入神经元。重组的RV-ΔG能在短时间内高丰度表达外源基因,并可用于描绘投射到注射位点的神经元的精细结构、监测特定输入环路的Ca2+活性。EnvA(禽肉瘤和白细胞病病毒A蛋白)伪型的RV-ΔG(RV-ENVA-ΔG)不能感染哺乳动物神经元,仅可感染表达EnvA受体-TVA(禽细胞表面分子肿瘤病毒A)的细胞。这种受体-配体匹配(TVA-EnvA)允许靶神经元的特异性感染。由于RV-ΔG是复制缺陷的,需辅助病毒补偿G,才可从初始感染神经元逆行传递到直接相连的突触前神经元。基于RV的SAD-B19株的逆行跨单突触系统已被广泛应用于剖析特定类型神经元的输入网络。然而,由于跨突触效率低,SAD-B19株的逆行跨单突触系统标记到的输入神经元数量较少。此外,该系统神经元毒性高,难以携带监测和调控神经元活动的功能基因。经过不懈努力,研究者们发现与SAD-B19株相比,经过修饰的CVS-N2c株的逆行跨突触能力显著增强,对初始感染神经元的毒性明显降低(能在功能环路解剖研究中携带Ca2+探针、光遗传学功能基因),但存在生产困难,滴度低的劣势。密码子优化的嵌合糖蛋白(oG)可极大地提高SAD-B19-ΔG的跨突触效率,补偿oG的方法已被应用于输入网络分析。无毒基因G/L(大蛋白)删除的RV(RV-ΔGL)表达效率低,因而只能通过使用Cre或Flp重组酶与功能探针相结合的方式来监测和操纵神经活动。RV同时靶向皮质和皮质下区域,N2cG包被RV的逆行标记效率比B19G包被RV高10倍。
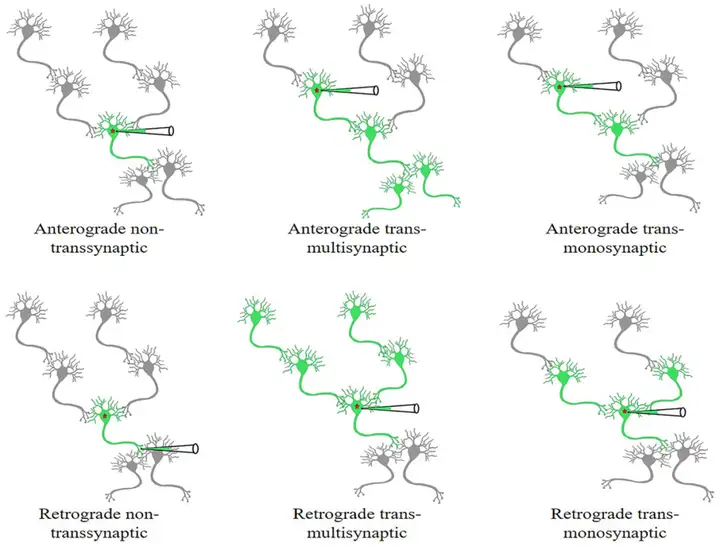
图1. 非跨突触和跨突触(跨多突触或单突触)病毒工具顺行或逆行传递示意图
HSV 1型H129株最初分离自患有急性单纯疱疹病毒感染脑炎患者的大脑,由于其顺行跨突触传递的特性被广泛用作输出环路示踪剂。然而,由于被轴突末端摄取的天然特性,神经环路示踪中H129存在标记亮度低和非特异性逆行标记的缺点。据报道,H129能通过轴突末梢吸收逆行感染投射神经元,并表现出时间延迟的逆行跨神经元扩散。作为广泛使用的顺行跨多突触示踪剂,H129经颅内感染后动物3-5天内死亡。
VSV是弹状病毒科,呈子弹状,有包膜的负链RNA病毒,其基因组长约11 kb,包含编码核衣壳蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)和大聚合酶(L)的基因。G蛋白使VSV能够感染大多数哺乳动物的细胞类型,N蛋白紧密缠绕RNA基因组,形成核酸酶抗性的核衣壳。VSV以其快速复制和组装、高效的感染和外源基因表达而闻名,并在神经元间顺行传递。这些特性使VSV有效适用于顺行跨多突触追踪输出网络。VSV结合其他病毒的糖蛋白形成的VSV伪型可实现不同的标记特征和顺行或逆行跨突触传递。然而,VSV在实验动物中的高神经毒性和快速致死性阻碍了其在神经环路结构和功能长期研究中的应用。为克服这些缺点,研究人员开发携带复制相关N蛋白第7个氨基酸突变的重组VSV(VSV-NR7A),细胞毒性减弱,且具有更高效的顺行跨突触能力。通过提供包被VSV糖蛋白的复制无能慢病毒,缺失糖蛋白G基因的VSV(VSV-∆G)能实现顺行跨单突触传递。因而,可用于以Cre依赖的方式标记初始感染神经元的直接投射靶点。
六、慢病毒(LV)
LV是逆转录病毒科的成员,是球形的有包膜病毒,直径约80-100 nm。LV的基因组是单链RNA,具有gag、pol和env基因,分别编码衣壳多聚蛋白组分、酶(逆转录酶、蛋白酶、整合酶)和包膜糖蛋白。LV的RNA基因组被逆转录成DNA以整合到宿主基因组中。基于人类免疫缺陷病毒1型(HIV-1)的LV载体是神经科学研究中应用最广泛的载体。LV载体介导稳定高效的在体基因转移到分化神经元中,并感染分裂和非分裂细胞,包括成年哺乳动物脑中神经元和胶质细胞。LV载体的嗜性在很大程度上取决于病毒包膜糖蛋白,而包膜糖蛋白对载体转导至关重要。伪型LV载体的糖蛋白通常来自VSV和RV的包膜糖蛋白(VSV-G;RV-G)。用VSV-G包装的慢病毒载体可转导神经元,顺行传递外源表达基因,逆行基因转移效率较低。而RV-G伪型的LV载体表现出逆行轴突运输增多。此外,融合包膜糖蛋白B型(FuG-B)伪型的LV载体显示出高效逆行运输(HiRet);融合糖蛋白C型(FuG-C)伪型的LV载体表现出神经元特异性逆行基因转移(NeuRet)。这些病毒载体已被应用于靶向支配注射位点的神经元集群,因此可用作特异性投射通路结构解剖和功能分析的逆行示踪剂。
七、用于非人灵长类动物神经环路追踪的病毒载体
重组病毒在不同脑区中表现出跨不同动物物种或神经元类型的不同感染倾向,病毒载体可携带多种元件或探针来满足特定的研究需求。用于猴脑标记的病毒工具包括RV、HSV1、AAV、LV,AAV、LV是最常用的用于顺行或逆行靶向的病毒载体。AAV和LV在脑中的转导、特异性和扩散方面存在差异。AAV转导注射位点周围更大的区域,而LV通常只转导注射位点。AAV直径约20 nm,而LV颗粒尺寸更大,约100 nm,进而限制了LV通过细胞外空间的扩散。研究表明rAAV9能标记猕猴全脑的皮层轴突纤维的长程投射。利用SAD-B19株G缺失并表达GFP的RV载体,可描绘恒河猴初级视觉皮层特异性投射神经元的形态。应用RV的CVS-11株,可剖析猕猴靶向脑区的跨多突触输入。
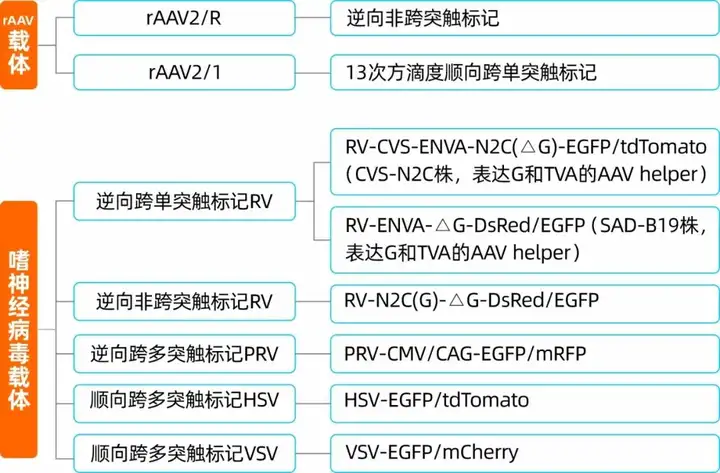
表1. 神经环路研究中常用的病毒载体分类
结构是功能的基础,功能是结构的体现。目前的神经环路追踪工具为我们揭示结构、阐明功能和机制提供了基本手段。在解剖神经环路时,病毒工具的选择很复杂,并取决于解决特定研究问题所需的实验设计。值得注意的是,在自由活动动物上进行的许多功能研究都长达数周甚至数月,因此病毒载体不干扰神经活动是必需的。目前,复制缺陷病毒,如AAV载体,由于对神经细胞毒性较小,主要用于神经环路的功能分析。可通过跨多突触传播追踪神经环路的病毒工具在修饰后毒性较小,但它们仍然不适用于功能研究。幸运的是,通过神经环路顺行或逆行跨单突触传播的病毒载体对神经细胞和动物的毒性小得多,而基于这些病毒的功能解剖工具也正在开发中。此外,神经环路的复杂性对开发技术和工具提出了新的挑战。病毒工具需要在许多方面进一步改进,包括减弱毒性、增加特异性、增强灵敏度,尤其是在结构和功能的综合研究中、与其他方法(如组学技术)兼容的工具。基础研究中的中国脑计划专注于理解非人灵长类动物认知过程的环路机制。新策略和新技术的开发,以及神经科学研究对新工具的无尽需求,将推动该领域的快速发展。
我司可提供用于神经环路示踪的诸多病毒工具,详情如下:

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK