2023-11-09 阅读量:2440
对于门诊和住院病人来说,疼痛是一种常见的痛苦来源。尽管疼痛发病率很高,但临床治疗疼痛仍然困难,尤其是慢性疼痛。慢性疼痛的病理机制比较复杂,涉及到多方面病理生理过程,其中中枢敏化包含上行和下行疼痛通路多个节点的可塑性。药物开发的重点是破坏这种与疼痛相关的可塑性。然而,近来有研究表明经典疼痛通路之外存在许多核团显著调节疼痛过程。解析这些环路可为有效治疗慢性疼痛提供潜在的治疗靶点。
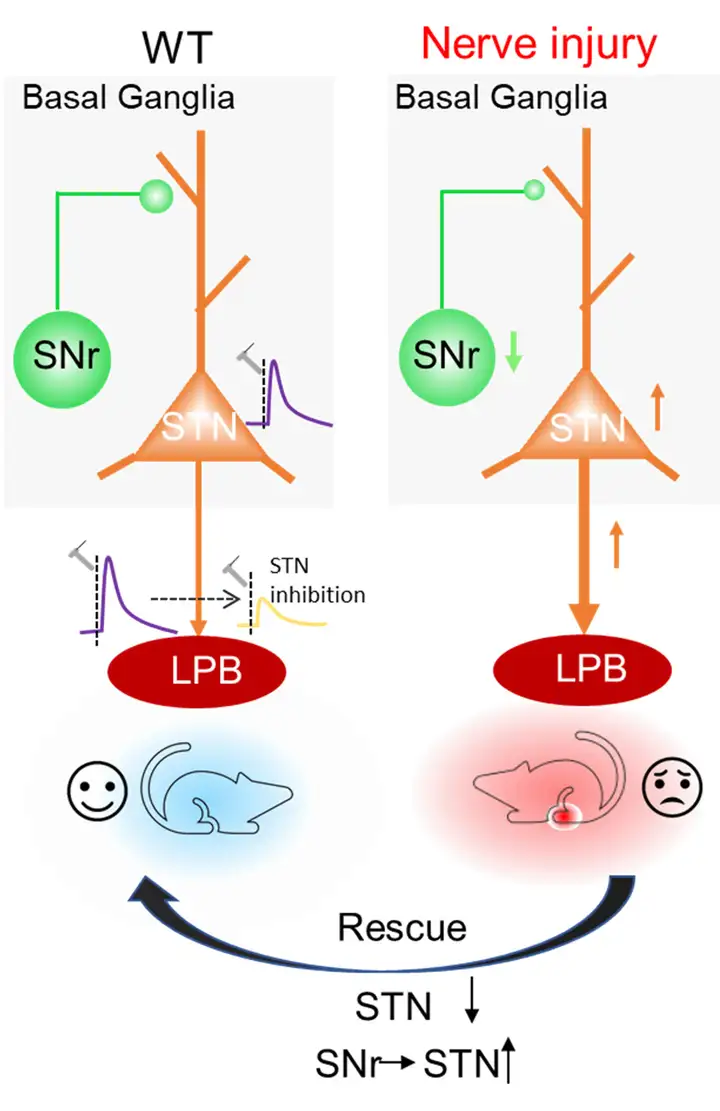
丘脑底核(STN)是位于基底神经节的纯谷氨酸能核团。对人类和啮齿类动物的研究表明STN可能在疼痛感知和调节中发挥重要作用。作者既往研究表明光遗传学激活STN神经元降低小鼠的疼痛阈值,而光遗传抑制过度活跃的STN神经元可改善帕金森病小鼠的痛觉过敏和中枢敏化。STN向基底神经节和非基底神经节结构发送谷氨酸能投射。然而,过度活跃的STN神经元是否存在一种联系导致慢性疼痛潜在的疼痛通路敏化目前尚在研究。鉴于外侧臂旁核(LPB)是疼痛信号通路的主要组成部分,并且是光遗传刺激STN后激活的核团之一。于是,作者推测STN神经元可能调节LPB的活性,从而调控疼痛过程。STN接受来自多个皮层和皮层下区域的兴奋性和抑制性输入。作者前期研究发现激活从黑质网状部(SNr)到STN的GABA能输入减少了炎症和神经病理性疼痛状态下的疼痛样超敏反应。表明STN中GABA能输入在调节疼痛信号中的重要作用。然而,在神经病理性疼痛条件下STN神经元的抑制性输入是否发生改变,从而影响STN神经元活动和神经病理性疼痛信号处理目前尚不清楚。
2022年12月15日,徐州医科大学麻醉学院/江苏省麻醉学重点实验室周春艺/肖诚/曹君利教授团队在Nature Communications期刊上发表题为“A nigro-subthalamo-parabrachial pathway modulates pain-like behaviors”的研究论文,揭示了介导疼痛样行为的神经环路机制。本文中,作者证实了一条神经通路,由SNr中的GABA能神经元、STN和LPB中谷氨酸能神经元组成(即SNrGABA-STNGlu-LPBGlu)。该通路调节小鼠的急性和慢性疼痛状态。在急性和慢性疼痛状态下,STN神经元的活性增强。而这种增强伴随着SNrGABA神经元活动减弱和STN-LPB谷氨酸能投射增强。激活SNrGABA-STNGlu-LPBGlu通路降低LPBGlu神经元的活性并减轻疼痛样行为。综上所述,SNrGABA-STNGlu-LPBGlu通路调节病理性疼痛,是疼痛治疗的潜在靶点。

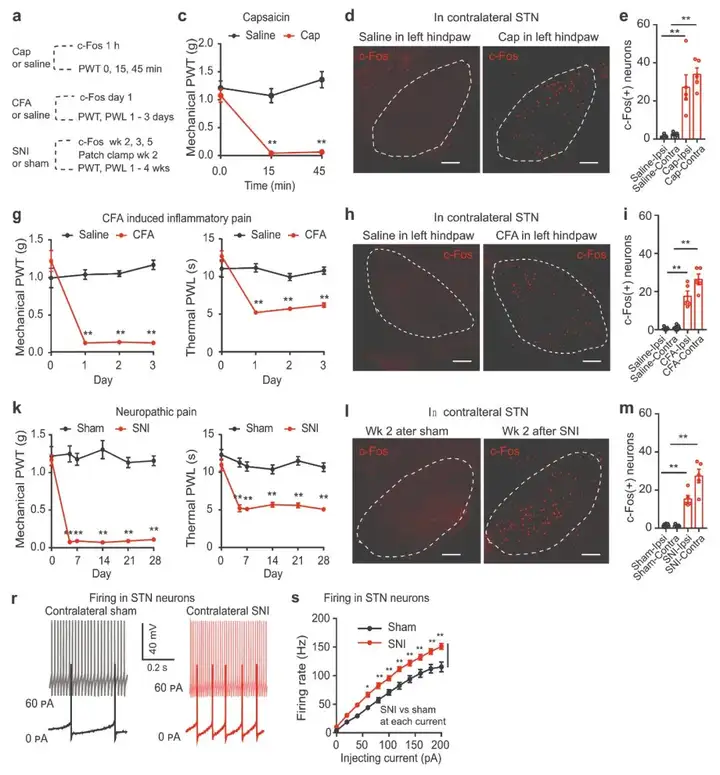
1.STN神经元在急性和慢性疼痛状态下被激活
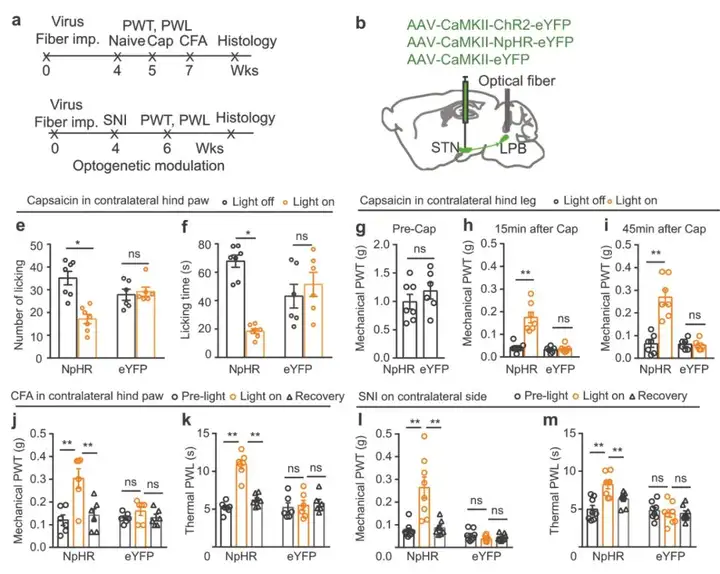
为揭示STN神经元在急性和慢性疼痛状态中的作用,作者在小鼠单侧后爪注射完全弗氏佐剂(CFA)或进行选择性神经损伤(SNI)构建慢性疼痛模型,单侧后腿下部注射辣椒素(Cap)构建急性疼痛模型,并检测STN中c-Fos的表达情况。上述模型中检测到机械刺激缩爪阈值(PWT)降低和热刺激缩爪潜伏期(PWL)缩短,证实疼痛模型成功建立。结果显示,单侧注射辣椒素后1 h,单侧注射CFA后1 d,SNI后2 w,小鼠双侧STN中c-fos阳性神经元的数量均显著增加。此外,SNI手术后3 w和5 w,STN中c-Fos表达也增加,这表明疼痛样行为伴随着STN神经元活动的变化。SNI手术后2 w,SNI小鼠脑片中STN神经元诱发放电率明显高于假手术组。这些结果进一步证实了STN神经元在急性和慢性疼痛状态下过度活跃。
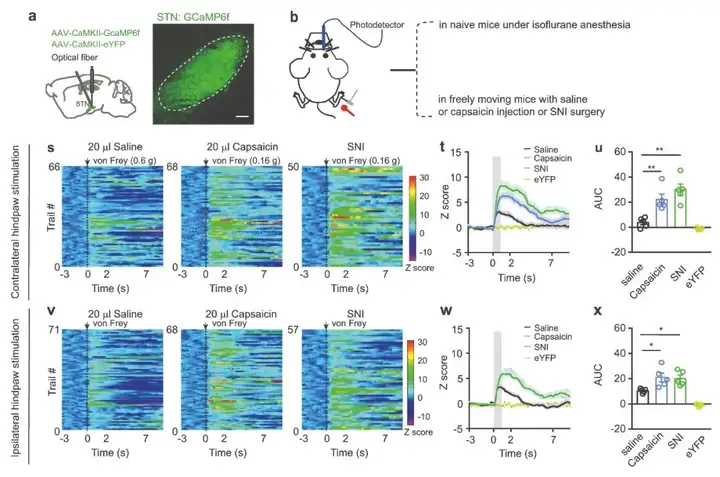
为进一步研究与疼痛样超敏反应相关的STN神经元活动变化,作者将AAV-CaMKII-GCaMP6f注射到STN,并记录小鼠STN神经元的GCaMP6f信号。结果显示小鼠任一后爪在强机械刺激(4 g von Frey纤维丝)或热刺激(48℃)后,STN神经元的GCaMP6f信号瞬间增加。为确定在炎症性和神经病理性疼痛状态下STN神经元对外部刺激的反应,研究人员在构建小鼠急性和慢性疼痛模型(分别为注射辣椒素与SNI)后,利用von Frey纤维丝刺激对应的PWT(对照生理盐水组0.6 g,Cap及SNI组0.16 g)刺激小鼠的后爪,并记录STN神经元中的GCaMP6f信号。结果显示,注射辣椒素后30 min或SNI手术后2 w,阈值刺激引起小鼠STN神经元的GCaMP6f信号相似的增加。而注射生理盐水小鼠STN神经元的GCaMP6f信号增幅较小。由于CaMKII启动子驱动基因在STN谷氨酸能神经元(STNGlu)中表达,这些结果表明,STNGlu神经元的激活与疼痛状态下疼痛样超敏反应有关。
图2. 疼痛处理过程中STN GCaMP6信号的动态变化
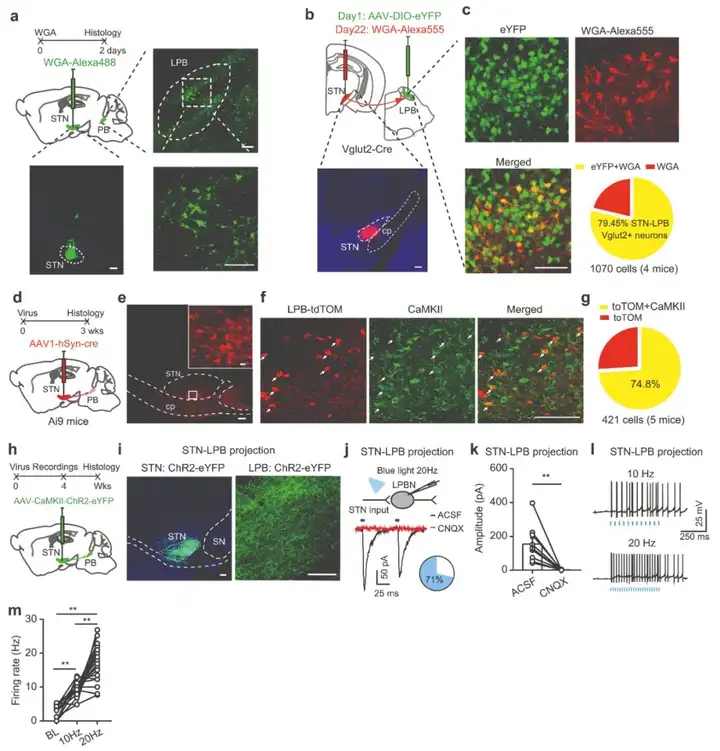
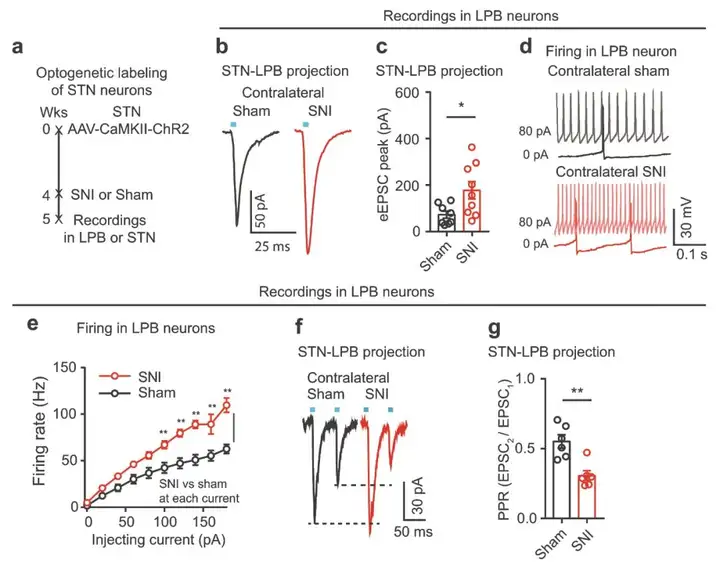
作者前期研究发现刺激STN神经元通过促进中枢敏化降低了机械刺激PWT和热刺激PWL。然而,这些神经元是否调节上行或下行疼痛通路尚不清楚。为解析STN参与疼痛样反应的潜在环路,作者探究STN的下游靶点。研究人员将WGA-Alexa 488(一种跨突触示踪剂,绿色荧光)注入STN,结果显示包括LPB在内的多个脑区均观察到荧光标记的神经元。因为LPB中的主要谷氨酸能神经元(LPBGlu)在疼痛过程起着重要作用,作者推测STN支配LPB的神经元类型是谷氨酸能神经元。为证实这一推测,作者在Vglut2-Cre小鼠的LPB中注射AAV-EF1α-DIO-eYFP来标记LPBGlu神经元,在STN中注射WGA-Alexa 555(红色荧光)来标记接受STN投射的LPB神经元。结果显示,在LPB中WGA-Alexa 555(+)神经元有将近80%表达eYFP。为进一步确认STN-LPBGlu投射,作者将顺行跨单突触示踪病毒载体scAAV1-hSyn-Cre注入Ai9小鼠(tdTomato报告基因小鼠)的STN中。结果显示,在LPB中观察到大量tdTomato(+)细胞,大约75%的这些细胞共表达CaMKII(谷氨酸能神经元标记物)。这表明STN投射到LPBGlu神经元。
接下来为探究STN-LPB投射的性质,作者将AAV-CaMKII-ChR2-eYFP注入STN,观察到蓝光刺激在71%被丰富的ChR2标记的神经末梢包围的LPB神经元中引发了CNQX(AMPA/kainate受体的强效竞争性拮抗剂)敏感的兴奋性突触后电流(photo-EPSCs被CNQX阻断)。在这些反应神经元中,LPB中STN末端的光刺激显著增加了LPB神经元放电速率。LPB逆行标记的量化显示,STN中约32.62%的神经元投射到LPB。总的来说,以上结果表明,STN支配的大多数LPB神经元是谷氨酸能神经元,STN–LPB投射是谷氨酸能投射,STNGlu–LPBGlu通路可能对LPB调节疼痛信号起着重要作用。
图3. STNGlu神经元直接支配LPBGlu神经元
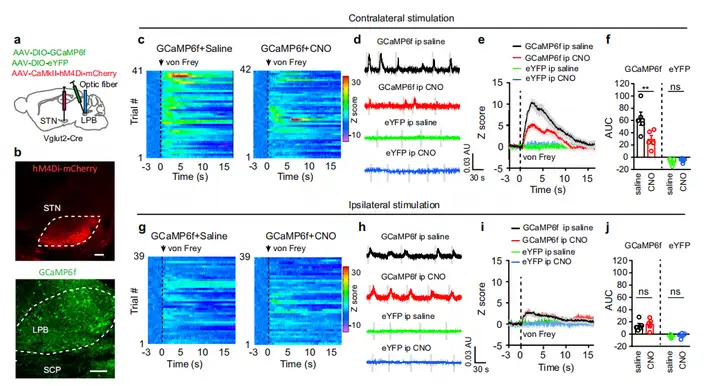
作者首先证实了LPB是STN-LPB神经元(投射LPB的STN神经元)的密集支配区。为测试STN-LPB谷氨酸能投射是否参与LPB神经元疼痛相关反应,作者将AAV-CaMKII-hM4Di-mCherry和Cre依赖的GCaMP6f(AAV-DIO-GCaMP6f)分别注射到Vglut2-Cre小鼠的STN和LPB。在体光纤记录显示,von Frey纤维丝刺激对侧后爪后,LPB中的GCaMP6f信号显著增加,而以相同强度刺激同侧后爪,GCaMP6f信号轻微增加。印证了相比对侧,LPB从同侧脊髓背角接受的感觉输入更少。利用CNO激活hM4Di持续沉默STNGlu神经元,结果发现对侧后爪刺激后GCaMP6f信号明显减弱。因此,这些结果表明,破坏STN的神经活动减弱了LPBGlu神经元在对侧后爪机械刺激后的反应。
此外,作者研究STN-LPB投射是否调节疼痛阈值。研究人员在WT小鼠STN中分别注射AAV-CaMKII-ChR2-eYFP、AAV-CaMKII-NpHR-eYFP或对照AAV-CaMKII-eYFP,并在LPB埋植光纤。结果显示,光遗传激活STN-LPB投射引起了对侧后爪的机械和热刺激疼痛超敏反应,然而,STN-LPB投射的光遗传抑制并没有改变任一后爪的机械和热痛阈值。这些结果表明,激活STN-LPB投射足以降低疼痛阈值。随后,作者进一步探究STN-LPB投射在炎症性和神经病理性疼痛条件下的作用。结果显示单侧光遗传沉默STN-LPB投射显著缓解辣椒素诱发的对侧后爪急性伤害性感受行为。类似地,光遗传沉默STN-LPB投射减轻对侧后爪辣椒素、CFA和SNI诱导的疼痛样超敏反应。上述结果说明STN-LPB投射调控疼痛样行为。
图5. STN-LPB投射调节疼痛样行为
图6. STNGlu-LPBGlu投射在神经病理性疼痛中增强
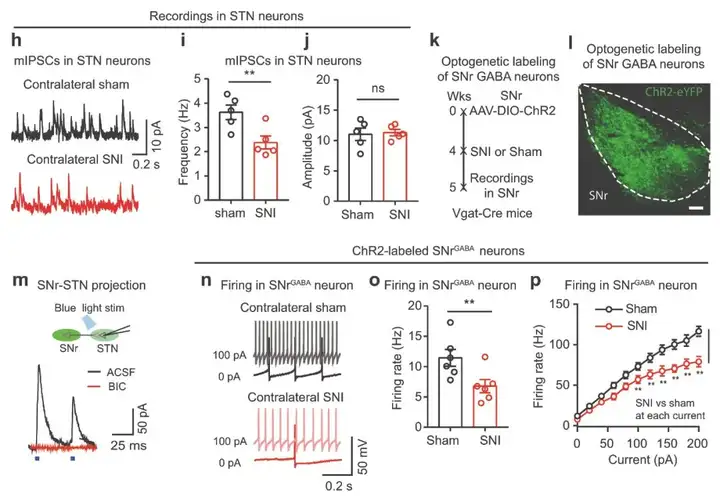
基于作者近期研究表明SNr-STN投射在多种疼痛情况下具有镇痛作用。于是,研究人员推测STN神经元的抑制性突触输入受损可能与各种疼痛状态下STN神经元的过度活跃有关。作者发现,与假手术对照小鼠相比,SNI小鼠STN神经元中微型抑制性突触后电流(mIPSCs)的频率降低。随后,作者结合光遗传学和脑片膜片钳记录来研究是否神经病理性疼痛状态下STN神经元GABA能输入减少导致STN神经元过度活跃。首先,作者将AAV-DIO-ChR2-eYFP注射到Vgat-Cre小鼠的SNr以标记局部GABA能神经元。结果显示光遗传激活STN中SNr GABA能末梢,在STN神经元脑片中诱发IPSCs(photo-IPSCs),而这些photo-IPSCs被GABAA受体拮抗剂荷包牡丹碱(Bicuculline,BIC)阻断。接下来,研究人员在SNrGABA能神经元中表达ChR2-eYFP,小鼠随后进行SNI,对照组进行假手术。结果发现,与假手术小鼠比较,SNI术后2 w,SNrGABA神经元的自发和诱发放电速率明显降低。这些数据表明SNI小鼠SNrGABA神经元活性降低导致STN神经元的抑制性输入减少。
图7. 神经病理性疼痛中SNrGABA神经元活性降低造成STN神经元的抑制性输入减少
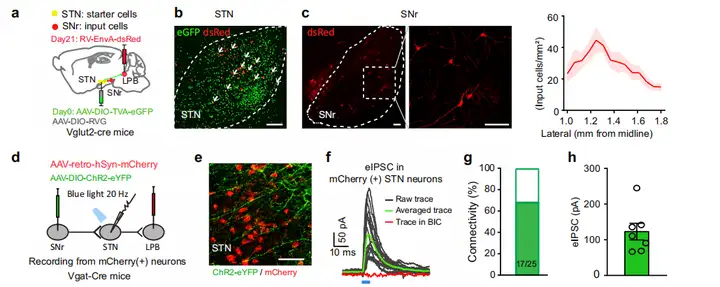
接下来,作者表征SNrGABA-STNGlu-LPBGlu通路的解剖和功能连接。首先,研究人员利用狂犬病毒(RV)介导Cre依赖的逆行跨单突触示踪系统。作者将Cre依赖的辅助病毒载体(AAV-EF1α-DIO-TVA-GFP和AAV-EF1α-DIO-RVG)注射到Vglut2-Cre小鼠的STN,三周后,将RV-EnvA-ΔG-DsRed注射到LPB,7天后研究人员在SNr中观察到DsRed标记的神经元。为进一步研究SNr-STN-LPB通路的功能性突触连接,作者将AAV-DIO-ChR2-eYFP注射到Vgat-Cre小鼠的SNr中标记SNrGABA神经元,并将AAV-retro-hSyn-mCherry注射到LPB中标记STN-LPB神经元。结果显示,在STN中观察到mCherry标记神经元和eYFP标记纤维。此外,STN脑片全细胞膜片钳记录显示短暂光刺激含有ChR2的SNrGABA末梢在68%mCherry标记的STN神经元中稳定诱发photo-IPSCs,photo-IPSCs被BIC阻断。综上所述,这些数据揭示了一个功能回路,即SNrGABA-STNGlu-LPBGlu通路,它将基底神经节与疼痛通路连接起来。
图8. SNrGABA-STNGlu-LPBGlu通路的连接
为确定SNrGABA-STNGlu-LPBGlu通路如何参与疼痛信号的调节,作者在SNr注射AAV-DIO-hM3Dq-mCherry或对照AAV-DIO-mCherry,STN注射逆行标记AAV-retro-hSyn-Cre-eGFP,以选择性激活SNr-STN神经元(投射STN的SNr神经元)。然后在这些小鼠LPB中注射AAV-CaMKII-GCaMP6f,并进行在体光纤记录。结果显示,对侧后爪刺激后,LPB中GCaMP6f信号增加,而注射CNO激活SNr-STN神经元导致上述增加明显减弱。
接下来,作者对SNr-STN-LPB通路是否调节疼痛阈值展开研究。通过在小鼠LPB中注射AAV-retro-CaMKII-Cre-mCherry、STN中注射AAV-FLEX-taCasp3-TEVP选择性消除该通路内的STN神经元(即STN-LPB神经元),并在同一小鼠SNr注射AAV-GAD67-ChR2-eGFP(AAV-GAD67-eYFP为对照),STN埋植光纤。结果显示,STN神经元数量大幅减少,但基线机械和热刺激疼痛阈值不受影响。随后上述小鼠注射辣椒素或进行SNI以分别构建急性炎性疼痛模型、神经病理性疼痛模型。在蓝光刺激激活SNrGABA-STN投射存在或不存在的情况下,检测小鼠疼痛阈值。结果显示,对侧辣椒素注射后15 min、45 min以及SNI后2 w,缺失STN神经元阻断了SNr-STN-LPB通路激活的止痛效果。此外,光遗传学刺激SNI小鼠的SNr-STN投射导致了对与蓝光照明配对的腔室的位置偏好,但SNI小鼠中利用taCasp3系统损伤STN-LPB神经元则不表现位置偏好。对照实验证实SNr表达eYFP和STN给光刺激不影响注射辣椒素或SNI小鼠的疼痛阈值,也不引发SNI小鼠条件性位置偏好(CPP)或厌恶。总的来说,这些数据表明,SNrGABA神经元通过STNGlu-LPBGlu通路调控疼痛样超敏反应。
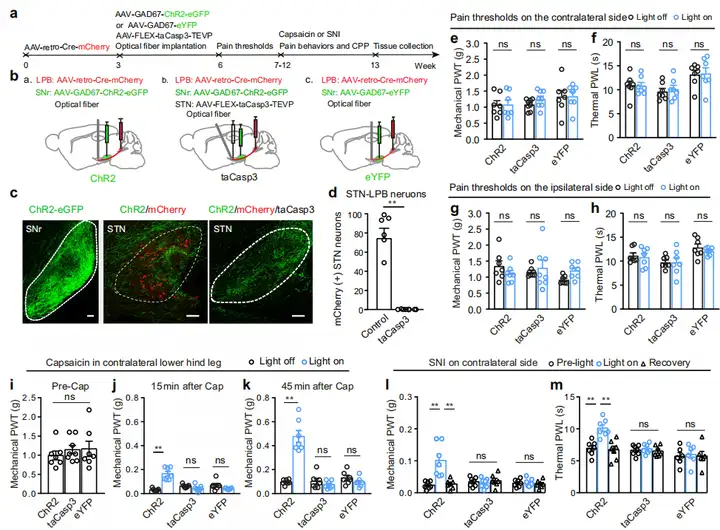
图9. 疼痛样行为中的SNrGABA-STNGlu-LPBGlu通路
本文研究人员结合病毒示踪、电生理学、光遗传学、化学遗传学、纤维光度法和疼痛样行为分析,证实了SNr-STN-LPB通路的功能连接,并探究该通路在调节急性和慢性疼痛状态中的作用。在慢性疼痛中,SNr-STN-LPB两级环路神经元兴奋性和突触联系发生了长期改变:SNr神经元兴奋性下降,STN神经元过度兴奋,STN-LPB谷氨酸能突触联系增强。用光遗传学技术逆转这些改变可缓解急慢性疼痛模型小鼠痛觉敏感症状。这项研究阐明了STN神经元调控疼痛反应和参与慢性疼痛的上下游机制,为基底神经节调控疼痛传导通路提供了直接突触水平证据。
图10. 神经损伤后SNrGABA-STNGlu-LPBGlu通路的神经可塑性

扫码下载原文
徐州医科大学麻醉学院周春艺教授为本文通讯作者,肖城教授、曹君利教授为本文共同通讯作者。论文的第一作者为博士生贾弢。这项工作得到国家重点研发计划-科技创新2030重大项目(2021ZD0203100)、国家自然科学基金(81971038、82171235、81870891、82071231、82271293、82293641、82130033)等资助。
通讯作者介绍
周春艺,博士,教授,博士生导师,江苏省特聘教授。目前的研究方向为探讨不同种类急慢性疼痛的分子、细胞和神经环路机制。研究内容主要包括基底神经节神经元、突触传递和突触可塑性的改变与疼痛中枢敏化的关系及其干预策略,为神经病理性疼痛和神经系统疾病疼痛症状的个性化治疗提供依据。
肖诚,博士,教授,博士生导师,江苏省特聘教授。目前主要研究深部脑区调控疼痛、运动、觉醒和情绪的神经环路和受体机制。
曹君利,博士,二级教授,博士生导师。现任徐州医科大学副校长、麻醉学院院长、江苏省麻醉学重点实验室主任、麻醉学国家重点实验室培育建设点负责人、江苏省“科教兴卫”工程麻醉学重点学科带头人、江苏省麻醉临床医学中心主任;教育部“长.江学者”特聘教授、国家百千万人才和国家有突出贡献中青年专家、国务院特殊津贴专家。主要从事慢性疼痛的脑机制及疼痛-抑郁共病的基础和临床研究。

本文使用的来自枢密科技的病毒产品,列表如下:

了解产品及服务
请扫码或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com 客服:18140661572(活动咨询、售后反馈等)
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK